プロテインキナーゼAシグナルがヒストンメチル化酵素G9aを介し細胞分化の“タイミング”を制御する
山水康平・山下 潤
(京都大学iPS細胞研究所 増殖分化機構研究部門)
email:山水康平
DOI: 10.7875/first.author.2012.084
Protein kinase a determines timing of early differentiation through epigenetic regulation with G9a.
Kohei Yamamizu, Mayako Fujihara, Makoto Tachibana, Shiori Katayama, Akiko Takahashi, Eiji Hara, Hiroshi Imai, Yoichi Shinkai, Jun K. Yamashita
Cell Stem Cell, 10, 759-770 (2012)
細胞分化は胚発生の過程においてさまざまなタンパク質により協調的かつ精密に制御されている.しかしながら,細胞分化の“タイミング”を制御する分子機構についてはまったくわかっていない.そこで,筆者らは,ES細胞の分化系を用いてその分子機構の解明に取り組んだ.マウスのES細胞において,細胞分化の開始と同時にプロテインキナーゼAを活性化すると,三胚葉それぞれの分化マーカーは約2倍も早く発現することを見い出した.さらに,その分子機構について,プロテインキナーゼAシグナルがヒストンメチル化酵素であるG9aの発現を促進し,未分化のマーカーであるOct3/4およびNanogをエピジェネティックに抑制することで,細胞分化のタイミングを制御していることを見い出した.さらに,G9aノックアウトマウスは早期に胎生致死となるが,このマウスではOct3/4およびNanogの発現が遅延しており,細胞分化が阻害されていることを明らかにした.これらの結果は,制御不能と思われた細胞分化のタイミングは恣意的に制御可能であるとともに,新しい分子機構により制御されていることを示した.さらに,昨今,期待されているES細胞あるいはiPS細胞を用いた再生医療を可能とするような技術開発にも貢献すると考えられた.
ES細胞(embryonic stem cell,胚性幹細胞)は初期胚(胚盤胞)に存在する未分化な細胞の集団である内部細胞塊より樹立された細胞株であり,多能性をもつことから細胞分化の研究にさかんに用いられている.iPS細胞(induced pluripotent stem cell,誘導多能性幹細胞)は成体の臓器から樹立の可能なES細胞様の幹細胞であり,すべての臓器への分化多能性をもつことから再生医療への応用が期待されている.近年,ES細胞およびiPS細胞を用いてさまざまな細胞を誘導する技術が開発されてきたが,現在のところ,細胞分化に要する時間は個々の細胞において内因性に決定されており,細胞分化のタイミングを恣意的に制御することはできないものと考えられている.
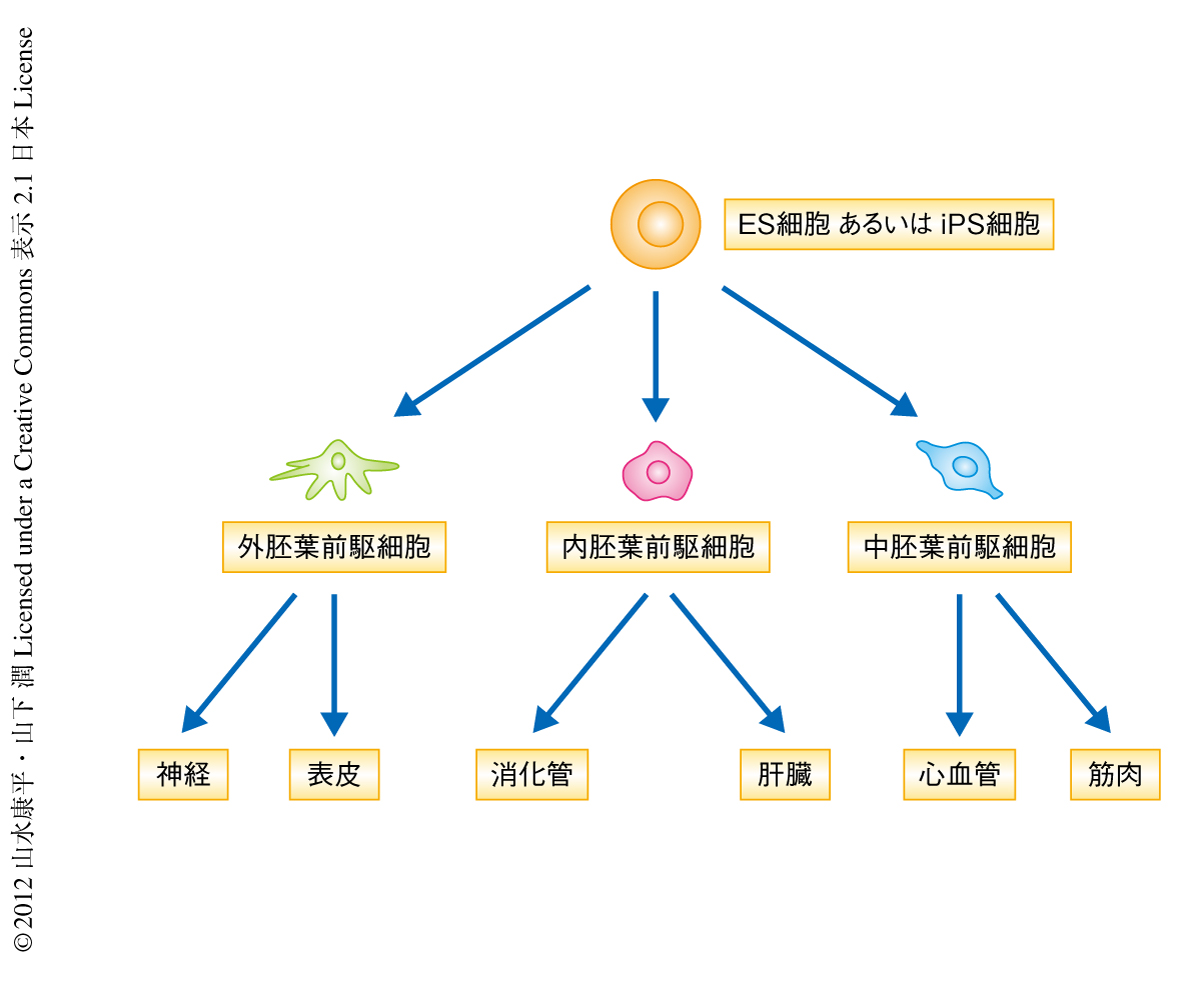
初期胚の細胞分化は,おもに外胚葉,内胚葉,中胚葉の3つの胚葉を誘導することからはじまる.外胚葉はおもに神経や表皮を,内胚葉はおもに消化管を,中胚葉はおもに心血管や筋肉をつくるとされるが(図1),この三胚葉を誘導する分子機構には不明な点が多い.その理由のひとつとして,体内における三胚葉の分化は胚の胎盤への着床とほぼ同時に起こり,非常に短期間のあいだにさまざまな生命現象がダイナミックに誘導されているからである.この段階の胚を採取し解析することは容易ではないため,ES細胞を用いた細胞分化の研究が有用であると考えられる.筆者らは,心血管系細胞の分化を系統的かつ経時的に解析できる新しいES細胞の分化系を構築し,その分化および再生の研究を行ってきた1).これまでに,cAMP-プロテインキナーゼAシグナルが血管前駆細胞の分化能を制御していることや2),動脈と静脈との細胞運命機構に関与していること3) を報告している.この研究では,ES細胞の分化系を用いて細胞分化のタイミングを制御する分子機構を探った.その結果,マウスのES細胞の分化初期において,プロテインキナーゼAを活性化することにより三胚葉の前駆細胞の分化を従来の約2倍も早く誘導できることを見い出した.これらの結果は,いままで内因性に規定されていると考えられていた細胞分化のタイミングは制御可能であることを示唆した.
cAMP-プロテインキナーゼAシグナルのES細胞の分化における役割を検討するため,まず,細胞分化の過程においてcAMPの細胞内濃度を測定した.その結果,細胞内cAMP濃度は三胚葉が誘導される以前の分化開始2.5日目において急激に上昇することを見い出し,このことから,cAMP-プロテインキナーゼAシグナルが三胚葉の細胞分化の開始に関与していることが示唆された.そこで,テトラサイクリンの投与により活性型のプロテインキナーゼAの発現を制御できるES細胞を作製し,三胚葉の分化の開始との関連を調べた.すると驚くべきことに,細胞分化と同時に活性型のプロテインキナーゼAを発現させることにより,中胚葉のマーカーであるFlk1,Brachyury,PDGFRαが通常の約2倍も早く発現することを見い出した.同様に,プロテインキナーゼAの活性化により内胚葉のマーカーであるFoxa2とSox17,および,外胚葉のマーカーであるNestinとFgf5の発現の開始時期も早くなった.また,プロテインキナーゼAの阻害剤であるPKIの添加により三胚葉それぞれの分化マーカーの発現が遅延することもわかった.一方,未分化のマーカーであるNanog,Oct3/4,Sox2の発現はプロテインキナーゼAの活性化により早く消失することも明らかになった.これらの結果より,プロテインキナーゼAシグナルが多能性をもつ状態から三胚葉への細胞分化のタイミングを制御していることが示された.
プロテインキナーゼAシグナルが初期胚の細胞分化を劇的に変化させることがわかったが,このシグナルはどのような分子機構を介し細胞分化を制御しているのだろうか? プロテインキナーゼAが広範囲にわたる遺伝子発現を変化させたことに着目し,遺伝子発現に深く関連するエピゲノムの変化に焦点をあてた.ウェスタンブロティング法による解析の結果,転写抑制を促すヒストンH3の9番目のリジン残基のメチル化を触媒する酵素であるG9aの発現がプロテインキナーゼAの活性化の直後に上昇し,それにともない,ヒストンH3の9番目のリジン残基のジメチル化が上昇していることを見い出した.さらに,未分化のマーカーであるOct3/4およびNanogの遺伝子プロモーター領域において,ヒストンH3の9番目のリジン残基のジメチル化が蓄積していることを確認した.また,これまでの報告によりG9aはDNAメチル化酵素Dnmtと結合しDNAのメチル化を促すことが示されている4).そこで,バイサルファイトシークエンス法によりDNAのメチル化について解析したところ,プロテインキナーゼAの活性化によりOct3/4およびNanogの遺伝子プロモーター領域においてDNAのメチル化が誘導されていることを見い出した.つまり,細胞分化の過程において,プロテインキナーゼAはヒストンメチル化酵素G9aを上昇させ,Oct3/4およびNanogの遺伝子プロモーター領域におけるヒストンH3の9番目のリジン残基のジメチル化,および,DNAのメチル化を誘導することで,Oct3/4およびNanogの発現をエピジェネティックに抑制していることが明らかになった.
これまで,プロテインキナーゼAシグナルがどのようにヒストンメチル化酵素G9aの発現を促進しているのかは不明であったが,最近の報告により,ユビキチンリガーゼAPC/CCdh1がG9aを標的としてその分解を促進していることが示され5),さらに,プロテインキナーゼAシグナルはAPC/CCdh1を抑制していることも報告された6).そこで,ES細胞の分化系においても同様な機構がはたらいているのかどうか検討した.その結果,プロテインキナーゼAシグナルはAPC/CCdh1を抑制することでG9aを蓄積させていることが明らかになった.これにより,シグナル伝達カスケード→エピジェネティックな制御→細胞分化,という一連の分化の制御機構が解明された.
これまで示した分化の制御機構がin vivoにおいても機能しているかどうかを探るため,初期胚培養法およびG9aノックアウトマウスを用いて検討を行った.まず,胚発生の過程におけるプロテインキナーゼAの発現を調べたところ,受精ののちの1細胞期の胚において高発現し,2細胞期から8細胞期では発現は急激に減少し,胚盤胞期の早期にまた急激に発現が上昇することを見い出した.このプロテインキナーゼAの発現レベルの変化は発生期におけるさまざまなエピゲノムの変化と類似する傾向にあり,プロテインキナーゼAが分化に重要な役割をはたしていることが示唆された.つぎに,胎生3.25日目にマウス母体より子宮還流により回収した胚盤胞期の胚に対し,プロテインキナーゼAの阻害剤H89,または,G9aの阻害剤であるBIX01294を添加した培地において1.5日間の培養を行い,プロテインキナーゼA-G9aシグナルが分化にあたえる影響を調べた.その結果,H89またはBIX01294の添加により未分化のマーカーであるNanogの発現が遅延し,原始内胚葉のマーカーであるGATA4の発現が抑制されていることを見い出した.すなわち,プロテインキナーゼAまたはG9aを抑制することにより胚の分化は遅延することが示された.
G9aノックアウトマウスは胎生8.5日から胎生12.5日のあいだに胎生致死となるが,興味深いことに,胎生8.5日よりまえに胚の成長遅延が起こる7).そこで,G9aの存在しないときには未分化の状態が維持され発生が阻害されるという仮説をたてた.G9aノックアウトマウスにおいてin situハイブリダイゼーション法により解析したところ,対照となるマウスでは胎生6.5日の胚においてOct3/4が発現し,胎生7.5日の胚においてその発現は急激に減少することを確認した一方,G9aノックアウトマウスの胎生7.5日の胚は未熟な形態を示し,Oct3/4が強く発現していることを明らかにした.また,G9aノックアウトマウスの胎生7.5日の胚において早期中胚葉のマーカーであるFlk1の発現は顕著に抑制されていることがわかった.したがって,G9aノックアウトマウスの胚ではG9aの欠損により未分化の状態が維持され,発生の遅延がひき起こされていると考えられた.
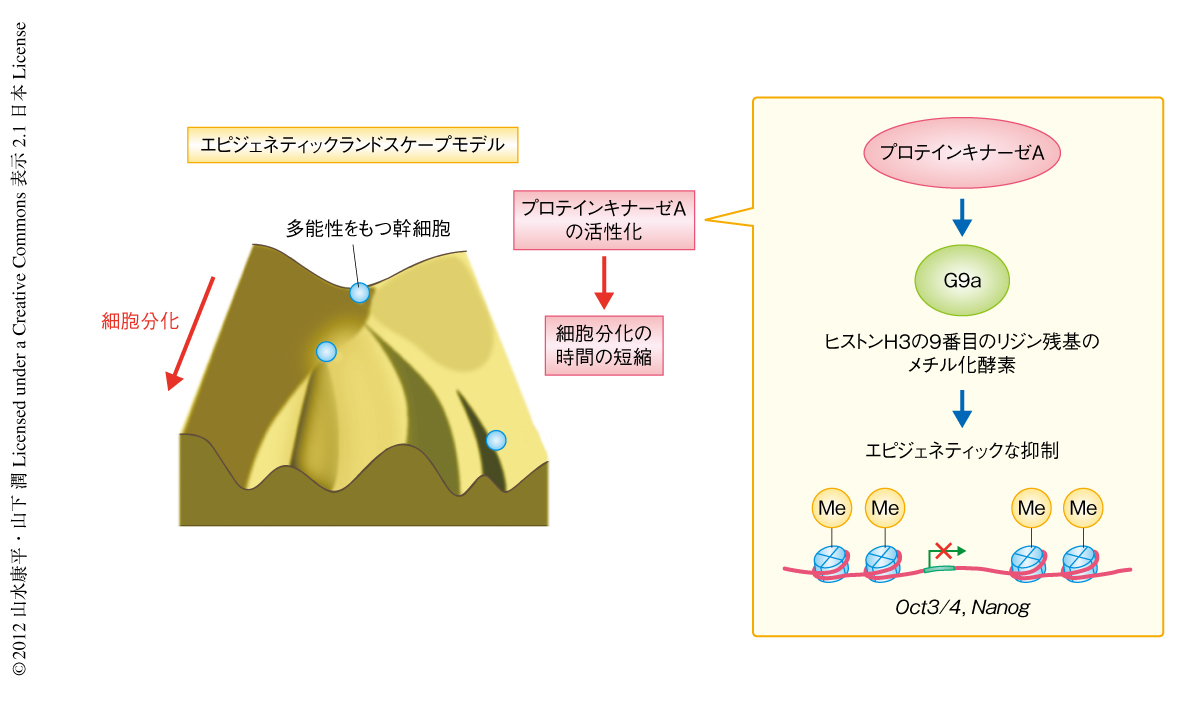
この研究により,筆者らは,これまで研究されてこなかった細胞分化の“タイミング”の機構を解明し,新たな発生の概念を示した.1950年代に発見されたcAMPとその下流タンパク質であるプロテインキナーゼAによるシグナル伝達系は,これまで生体におけるさまざま役割が示されてきたが,生命の根底である発生にも重要な役割をはたしていたことは非常に興味深い.さらに,cAMP-プロテインキナーゼAシグナル→エピジェネティクス制御タンパク質G9a→細胞分化,という新しい関連は発生生物学における新たな知識となる(図2).
ヒトES細胞あるいはiPS細胞を用いた再生医療の実現にむけた課題のひとつに,目的とする細胞への分化時間が長いことがある.たとえば,神経や心筋細胞などでは従来のES細胞あるいはiPS細胞からの誘導法では分化誘導に要する時間が長すぎて,病態が発症してから分化誘導するのではまにあわない.この研究により見い出された分化誘導を促進する技術を用いることにより細胞分化の時間を短縮することが可能となり,再生医療へむけた画期的な分化誘導法の開発に貢献できる可能性がある.
略歴:2010年 京都大学大学院医学研究科 修了,同年 京都大学iPS細胞研究所 研究員を経て,2012年より米国NIH National Institute on Aging博士研究員.
研究テーマ:ES細胞を用いた細胞分化の機構の解析と,in vitroでのES細胞の分化系を応用した胚発生の再現.
山下 潤(Jun K. Yamashita)
京都大学iPS細胞研究所 教授.
研究室URL:http://www.frontier.kyoto-u.ac.jp/es02/index.htm
© 2012 山水康平・山下 潤 Licensed under CC 表示 2.1 日本
(京都大学iPS細胞研究所 増殖分化機構研究部門)
email:山水康平
DOI: 10.7875/first.author.2012.084
Protein kinase a determines timing of early differentiation through epigenetic regulation with G9a.
Kohei Yamamizu, Mayako Fujihara, Makoto Tachibana, Shiori Katayama, Akiko Takahashi, Eiji Hara, Hiroshi Imai, Yoichi Shinkai, Jun K. Yamashita
Cell Stem Cell, 10, 759-770 (2012)
要 約
細胞分化は胚発生の過程においてさまざまなタンパク質により協調的かつ精密に制御されている.しかしながら,細胞分化の“タイミング”を制御する分子機構についてはまったくわかっていない.そこで,筆者らは,ES細胞の分化系を用いてその分子機構の解明に取り組んだ.マウスのES細胞において,細胞分化の開始と同時にプロテインキナーゼAを活性化すると,三胚葉それぞれの分化マーカーは約2倍も早く発現することを見い出した.さらに,その分子機構について,プロテインキナーゼAシグナルがヒストンメチル化酵素であるG9aの発現を促進し,未分化のマーカーであるOct3/4およびNanogをエピジェネティックに抑制することで,細胞分化のタイミングを制御していることを見い出した.さらに,G9aノックアウトマウスは早期に胎生致死となるが,このマウスではOct3/4およびNanogの発現が遅延しており,細胞分化が阻害されていることを明らかにした.これらの結果は,制御不能と思われた細胞分化のタイミングは恣意的に制御可能であるとともに,新しい分子機構により制御されていることを示した.さらに,昨今,期待されているES細胞あるいはiPS細胞を用いた再生医療を可能とするような技術開発にも貢献すると考えられた.
はじめに
ES細胞(embryonic stem cell,胚性幹細胞)は初期胚(胚盤胞)に存在する未分化な細胞の集団である内部細胞塊より樹立された細胞株であり,多能性をもつことから細胞分化の研究にさかんに用いられている.iPS細胞(induced pluripotent stem cell,誘導多能性幹細胞)は成体の臓器から樹立の可能なES細胞様の幹細胞であり,すべての臓器への分化多能性をもつことから再生医療への応用が期待されている.近年,ES細胞およびiPS細胞を用いてさまざまな細胞を誘導する技術が開発されてきたが,現在のところ,細胞分化に要する時間は個々の細胞において内因性に決定されており,細胞分化のタイミングを恣意的に制御することはできないものと考えられている.
初期胚の細胞分化は,おもに外胚葉,内胚葉,中胚葉の3つの胚葉を誘導することからはじまる.外胚葉はおもに神経や表皮を,内胚葉はおもに消化管を,中胚葉はおもに心血管や筋肉をつくるとされるが(図1),この三胚葉を誘導する分子機構には不明な点が多い.その理由のひとつとして,体内における三胚葉の分化は胚の胎盤への着床とほぼ同時に起こり,非常に短期間のあいだにさまざまな生命現象がダイナミックに誘導されているからである.この段階の胚を採取し解析することは容易ではないため,ES細胞を用いた細胞分化の研究が有用であると考えられる.筆者らは,心血管系細胞の分化を系統的かつ経時的に解析できる新しいES細胞の分化系を構築し,その分化および再生の研究を行ってきた1).これまでに,cAMP-プロテインキナーゼAシグナルが血管前駆細胞の分化能を制御していることや2),動脈と静脈との細胞運命機構に関与していること3) を報告している.この研究では,ES細胞の分化系を用いて細胞分化のタイミングを制御する分子機構を探った.その結果,マウスのES細胞の分化初期において,プロテインキナーゼAを活性化することにより三胚葉の前駆細胞の分化を従来の約2倍も早く誘導できることを見い出した.これらの結果は,いままで内因性に規定されていると考えられていた細胞分化のタイミングは制御可能であることを示唆した.
1.プロテインキナーゼAシグナルは三胚葉の誘導および多能性の消失のタイミングを制御する
cAMP-プロテインキナーゼAシグナルのES細胞の分化における役割を検討するため,まず,細胞分化の過程においてcAMPの細胞内濃度を測定した.その結果,細胞内cAMP濃度は三胚葉が誘導される以前の分化開始2.5日目において急激に上昇することを見い出し,このことから,cAMP-プロテインキナーゼAシグナルが三胚葉の細胞分化の開始に関与していることが示唆された.そこで,テトラサイクリンの投与により活性型のプロテインキナーゼAの発現を制御できるES細胞を作製し,三胚葉の分化の開始との関連を調べた.すると驚くべきことに,細胞分化と同時に活性型のプロテインキナーゼAを発現させることにより,中胚葉のマーカーであるFlk1,Brachyury,PDGFRαが通常の約2倍も早く発現することを見い出した.同様に,プロテインキナーゼAの活性化により内胚葉のマーカーであるFoxa2とSox17,および,外胚葉のマーカーであるNestinとFgf5の発現の開始時期も早くなった.また,プロテインキナーゼAの阻害剤であるPKIの添加により三胚葉それぞれの分化マーカーの発現が遅延することもわかった.一方,未分化のマーカーであるNanog,Oct3/4,Sox2の発現はプロテインキナーゼAの活性化により早く消失することも明らかになった.これらの結果より,プロテインキナーゼAシグナルが多能性をもつ状態から三胚葉への細胞分化のタイミングを制御していることが示された.
2.プロテインキナーゼAシグナルに依存して蓄積したヒストンメチル化酵素G9aはOct3/4およびNanogの発現を抑制する
プロテインキナーゼAシグナルが初期胚の細胞分化を劇的に変化させることがわかったが,このシグナルはどのような分子機構を介し細胞分化を制御しているのだろうか? プロテインキナーゼAが広範囲にわたる遺伝子発現を変化させたことに着目し,遺伝子発現に深く関連するエピゲノムの変化に焦点をあてた.ウェスタンブロティング法による解析の結果,転写抑制を促すヒストンH3の9番目のリジン残基のメチル化を触媒する酵素であるG9aの発現がプロテインキナーゼAの活性化の直後に上昇し,それにともない,ヒストンH3の9番目のリジン残基のジメチル化が上昇していることを見い出した.さらに,未分化のマーカーであるOct3/4およびNanogの遺伝子プロモーター領域において,ヒストンH3の9番目のリジン残基のジメチル化が蓄積していることを確認した.また,これまでの報告によりG9aはDNAメチル化酵素Dnmtと結合しDNAのメチル化を促すことが示されている4).そこで,バイサルファイトシークエンス法によりDNAのメチル化について解析したところ,プロテインキナーゼAの活性化によりOct3/4およびNanogの遺伝子プロモーター領域においてDNAのメチル化が誘導されていることを見い出した.つまり,細胞分化の過程において,プロテインキナーゼAはヒストンメチル化酵素G9aを上昇させ,Oct3/4およびNanogの遺伝子プロモーター領域におけるヒストンH3の9番目のリジン残基のジメチル化,および,DNAのメチル化を誘導することで,Oct3/4およびNanogの発現をエピジェネティックに抑制していることが明らかになった.
これまで,プロテインキナーゼAシグナルがどのようにヒストンメチル化酵素G9aの発現を促進しているのかは不明であったが,最近の報告により,ユビキチンリガーゼAPC/CCdh1がG9aを標的としてその分解を促進していることが示され5),さらに,プロテインキナーゼAシグナルはAPC/CCdh1を抑制していることも報告された6).そこで,ES細胞の分化系においても同様な機構がはたらいているのかどうか検討した.その結果,プロテインキナーゼAシグナルはAPC/CCdh1を抑制することでG9aを蓄積させていることが明らかになった.これにより,シグナル伝達カスケード→エピジェネティックな制御→細胞分化,という一連の分化の制御機構が解明された.
3.in vivoでの発生の過程においてプロテインキナーゼAおよびG9aの阻害は分化を遅延させる
これまで示した分化の制御機構がin vivoにおいても機能しているかどうかを探るため,初期胚培養法およびG9aノックアウトマウスを用いて検討を行った.まず,胚発生の過程におけるプロテインキナーゼAの発現を調べたところ,受精ののちの1細胞期の胚において高発現し,2細胞期から8細胞期では発現は急激に減少し,胚盤胞期の早期にまた急激に発現が上昇することを見い出した.このプロテインキナーゼAの発現レベルの変化は発生期におけるさまざまなエピゲノムの変化と類似する傾向にあり,プロテインキナーゼAが分化に重要な役割をはたしていることが示唆された.つぎに,胎生3.25日目にマウス母体より子宮還流により回収した胚盤胞期の胚に対し,プロテインキナーゼAの阻害剤H89,または,G9aの阻害剤であるBIX01294を添加した培地において1.5日間の培養を行い,プロテインキナーゼA-G9aシグナルが分化にあたえる影響を調べた.その結果,H89またはBIX01294の添加により未分化のマーカーであるNanogの発現が遅延し,原始内胚葉のマーカーであるGATA4の発現が抑制されていることを見い出した.すなわち,プロテインキナーゼAまたはG9aを抑制することにより胚の分化は遅延することが示された.
G9aノックアウトマウスは胎生8.5日から胎生12.5日のあいだに胎生致死となるが,興味深いことに,胎生8.5日よりまえに胚の成長遅延が起こる7).そこで,G9aの存在しないときには未分化の状態が維持され発生が阻害されるという仮説をたてた.G9aノックアウトマウスにおいてin situハイブリダイゼーション法により解析したところ,対照となるマウスでは胎生6.5日の胚においてOct3/4が発現し,胎生7.5日の胚においてその発現は急激に減少することを確認した一方,G9aノックアウトマウスの胎生7.5日の胚は未熟な形態を示し,Oct3/4が強く発現していることを明らかにした.また,G9aノックアウトマウスの胎生7.5日の胚において早期中胚葉のマーカーであるFlk1の発現は顕著に抑制されていることがわかった.したがって,G9aノックアウトマウスの胚ではG9aの欠損により未分化の状態が維持され,発生の遅延がひき起こされていると考えられた.
おわりに
この研究により,筆者らは,これまで研究されてこなかった細胞分化の“タイミング”の機構を解明し,新たな発生の概念を示した.1950年代に発見されたcAMPとその下流タンパク質であるプロテインキナーゼAによるシグナル伝達系は,これまで生体におけるさまざま役割が示されてきたが,生命の根底である発生にも重要な役割をはたしていたことは非常に興味深い.さらに,cAMP-プロテインキナーゼAシグナル→エピジェネティクス制御タンパク質G9a→細胞分化,という新しい関連は発生生物学における新たな知識となる(図2).
ヒトES細胞あるいはiPS細胞を用いた再生医療の実現にむけた課題のひとつに,目的とする細胞への分化時間が長いことがある.たとえば,神経や心筋細胞などでは従来のES細胞あるいはiPS細胞からの誘導法では分化誘導に要する時間が長すぎて,病態が発症してから分化誘導するのではまにあわない.この研究により見い出された分化誘導を促進する技術を用いることにより細胞分化の時間を短縮することが可能となり,再生医療へむけた画期的な分化誘導法の開発に貢献できる可能性がある.
文 献
- Yamashita, J., Itoh, H., Hirashima, M. et al.: Flk1-positive cells derived from embryonic stem cells serve as vascular progenitors. Nature, 408, 92-96 (2000)[PubMed]
- Yamamizu, K., Kawasaki, K., Katayama, S. et al.: Enhancement of vascular progenitor potential by protein kinase A through dual induction of Flk-1 and Neuropilin-1. Blood, 114, 3707-3716 (2009)[PubMed]
- Yamamizu, K., Matsunaga, T., Uosaki, H. et al.: Convergence of Notch and β-catenin signaling induces arterial fate in vascular progenitors. J. Cell Biol., 189, 325-338 (2010)[PubMed]
- Epsztejn-Litman, S., Feldman, N., Abu-Remaileh, M. et al.: De novo DNA methylation promoted by G9a prevents reprogramming of embryonically silenced genes. Nat. Struct. Mol. Biol., 15, 1176-1183 (2008)[PubMed]
- Takahashi, A., Imai, Y., Yamakoshi, K. et al.: DNA damage signaling triggers degradation of histone methyltransferases through APC/CCdh1 in senescent cells. Mol. Cell, 45, 123-131 (2012)[PubMed] [新着論文レビュー]
- Yamashita, Y. M., Nakaseko, Y., Samejima, I. et al.: 20S cyclosome complex formation and proteolytic activity inhibited by the cAMP/PKA pathway. Nature, 384, 276-279 (1996)[PubMed]
- Tachibana, M., Sugimoto, K., Nozaki, M. et al.: G9a histone methyltransferase plays a dominant role in euchromatic histone H3 lysine 9 methylation and is essential for early embryogenesis. Genes Dev., 16, 1779-1791 (2002)[PubMed]
著者プロフィール
略歴:2010年 京都大学大学院医学研究科 修了,同年 京都大学iPS細胞研究所 研究員を経て,2012年より米国NIH National Institute on Aging博士研究員.
研究テーマ:ES細胞を用いた細胞分化の機構の解析と,in vitroでのES細胞の分化系を応用した胚発生の再現.
山下 潤(Jun K. Yamashita)
京都大学iPS細胞研究所 教授.
研究室URL:http://www.frontier.kyoto-u.ac.jp/es02/index.htm
© 2012 山水康平・山下 潤 Licensed under CC 表示 2.1 日本