大脳皮質の発生過程における未分化なピラミダルニューロンの移動は転写因子FoxG1のダイナミックな減少および増加により制御されている
三好 悟一
(米国New York大学School of Medicine,Neuroscience Institute)
email:三好悟一
DOI: 10.7875/first.author.2012.085
Dynamic FoxG1 expression coordinates the integration of multipolar pyramidal neuron precursors into the cortical plate.
Goichi Miyoshi, Gord Fishell
Neuron, 74, 1045-1058 (2012)
大脳皮質のピラミダルニューロンが発生するその過程においては,未分化なニューロンは増殖層で生まれたのち皮質板へと長距離の移動を行う.そのとき,移動しているニューロンは増殖層と皮質板とのあいだの中間帯において,細長い形から星形の形状である多極性形態へと一過性にその形態を変えることが知られている.この多極性形態期には,ニューロンは大脳皮質の層に対して上下以外にも左右にも遊走することや,ニューロンが情報を伝達するうえで欠かせない軸索の伸張が起こることも知られている.筆者らは,この多極性形態をとるニューロンの移動の過程においては転写因子FoxG1の量がダイナミックに変化しており,初期には減少する一方,途中からは増加することをみつけた.そして,移動している未分化なニューロンにおけるFoxG1の減少と増加が大脳皮質の形成において必須であることを明らかにした.近年,FoxG1遺伝子の欠損あるいは発現過剰がヒトのさまざまな精神疾患において確認されていることから,これらの精神疾患の症状が発生期における多極性形態期の異常によりひき起こされている可能性が示唆された.
近年のヒトの遺伝子解析による知見から,異型Rett症候群の患者では転写因子をコードするFoxG1遺伝子が欠損していることが確認されている1).また,それとは異なる症状を示す,てんかん,知能の発育不全,言語障害をもつ患者では,Rett症候群とは逆にFoxG1遺伝子の重複する症例がみつかっている2).これらのことから,FoxG1遺伝子の発現が低下しても上昇しても,ヒトの大脳は正常に機能発達できないものと考えられている.
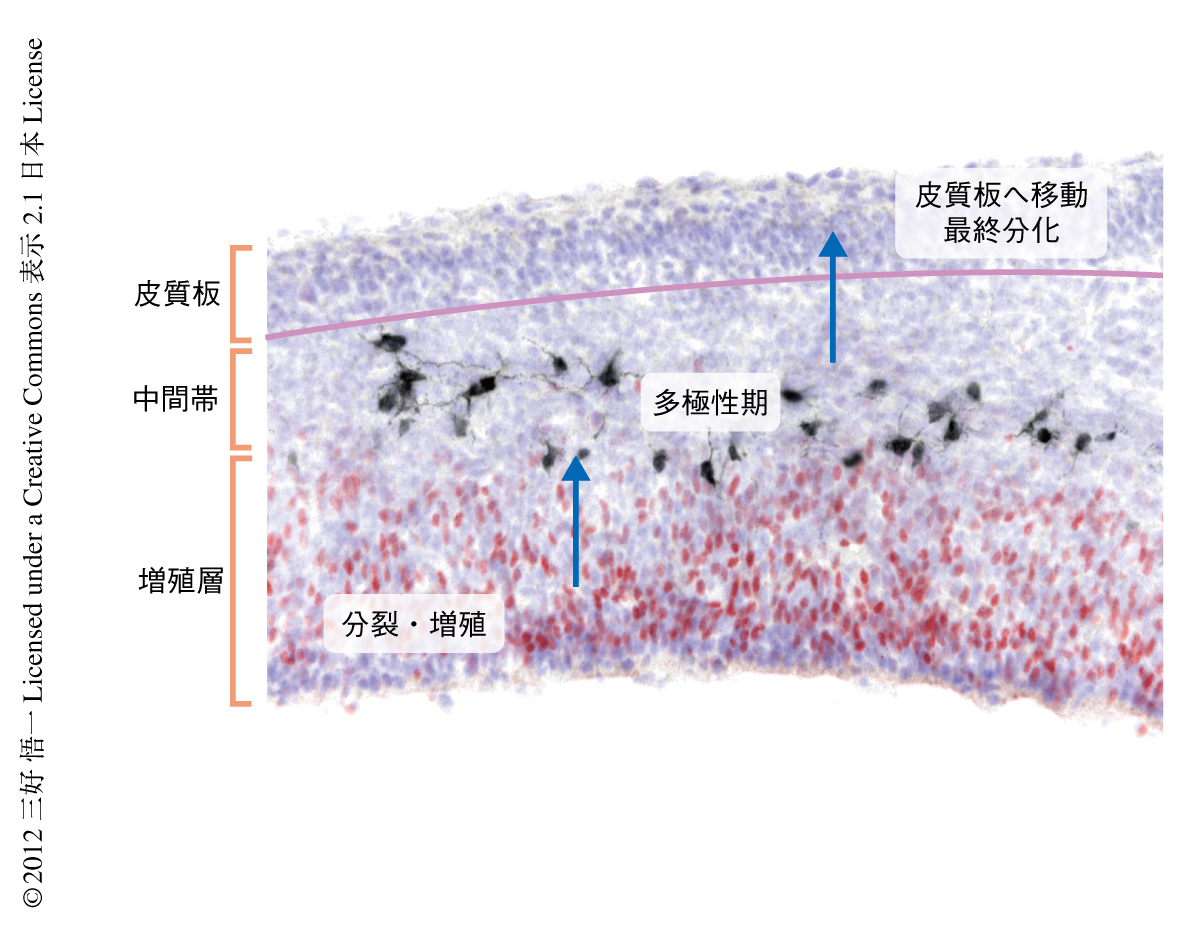
発生期に大脳皮質がつくられる過程においては,増殖層で生まれた未分化なピラミダルニューロンが大脳の皮質板へと順に移動する必要がある.その際,移動しているニューロンは増殖層と皮質板のあいだに位置する中間層において,細長い形から星形の形状である多極性形態(図1)へと一過的にその形態を変えることが知られている3,4).この多極性形態期では,移動しているニューロンが大脳皮質の層に対して上下以外に左右にも遊走することや,ニューロンが情報を伝達するうえで欠かせない構造である軸索の伸張が起こっていることが知られている.しかしながら,この多極性形態期がどのように制御され,また,大脳の構築においてどれほど重要であるのかはいまだ多く明らかにされていない5).
ノックアウトマウスなどを用いた解析から,転写因子FoxG1 6) は大脳のかたちづくられる初期において脳のそれぞれの領域の性質を決めることが知られている.FoxG1ノックアウトマウスでは海馬および大脳皮質の形成される背側の領域が拡張する一方,線条体や扁桃核のできる腹側の領域が完全に消失する.さらには,増殖している細胞の細胞周期の制御にもFoxG1は大きな役割をもつことが知られている.ところが,このように発生の初期段階で生じる表現型がとてもシビアであるため,増殖をおえたあとの未分化なニューロン,とくに,移動しているニューロンにおけるFoxG1の役割はまったく知られていない.筆者らは,移動している未分化なニューロンが多極性形態をとる時期において,FoxG1の発現がダイナミックに低下および上昇することを発見した.FoxG1遺伝子の欠損あるいは発現過剰がともにヒトの精神疾患において確認されていることから,多極性形態期におけるFoxG1の減少および増加にも大きな役割があるのではないかと考え解析を行った.
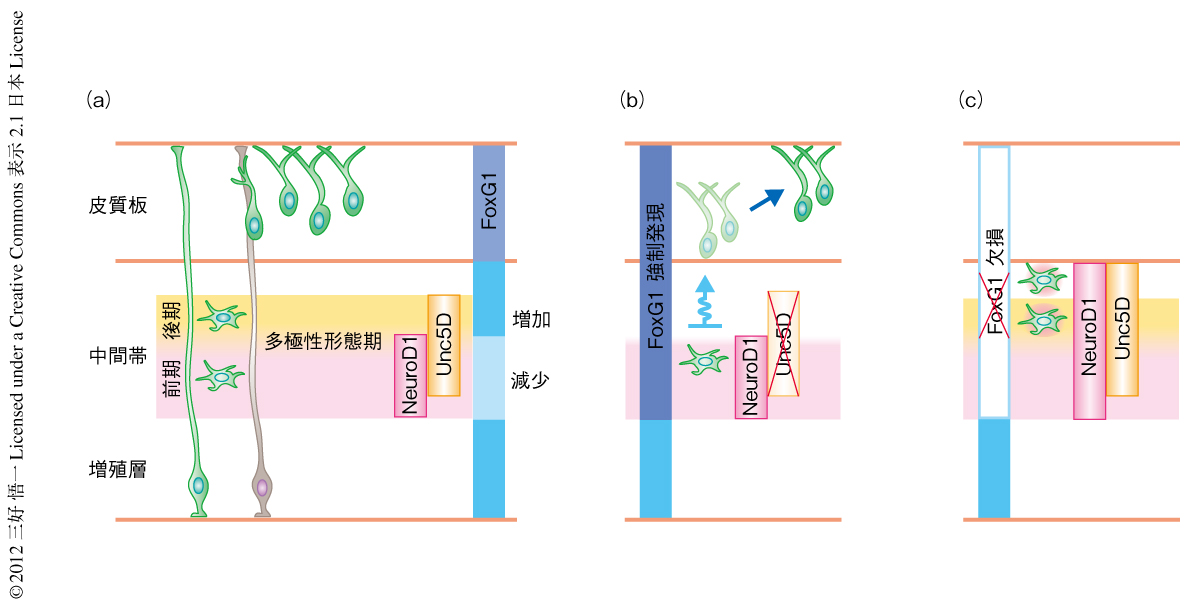
FoxG1を認識する抗体を用いた免疫染色法により,増殖層と皮質板のあいだに位置する中間帯に存在するニューロンにおけるFoxG1の発現パターンを調べた.この中間帯では,移動している未分化なニューロンは多極性形態をとることが知られていたので,まずは,遺伝学的な手法を用いて多極性形態をとるニューロンを標識した(図1).その結果,多極性形態期の前半においてはFoxG1の発現は抑制されており,逆に,後半においては,FoxG1の発現がふたたび上昇することを発見した(図2a).
in vivoにおいてFoxG1の量を人為的に増減させる実験を行った.まず,エレクトロポレーション法によりFoxG1を強制発現することで,本来は多極性形態期の前半に起こるFoxG1の発現抑制を打ち消した.その結果,3日後には,対照となるニューロンはすでに皮質板に移動しているにもかかわらず,FoxG1を強制発現したニューロンは中間帯にとどまったままであった.ところが,さらに日数をおいてみると,中間帯にとどまっていたFoxG1を強制発現したニューロンは徐々に皮質板へと移動しはじめた(図2b).そして,生後7日目には,対照のニューロンの多くは第4層のピラミダルニューロンに分化していたのに対し,FoxG1を強制発現したニューロンの多くは第2層あるいは第3層に存在していた.さらに,位置だけでなく遺伝子発現プロファイルについても,本来は第4層のニューロンにみられる遺伝子は発現しておらず,通常は第2層あるいは第3層のニューロンにみられる遺伝子が発現していた.これらの結果から,多極性形態期の前半においてFoxG1の発現抑制が正常に起こらないと皮質板への移動が遅れてしまい,その結果,本来とは異なる性質をもつニューロンに分化してしまうことがわかった.
多極性形態期の前半でのFoxG1の発現抑制が,どのような分子機構により未分化なニューロンの皮質板への移動を制御しているのか調べた.まず,多極性形態期の前半において特異的にNeuroD1が発現していること,また,NeuroD1が発現したしばらくあとにUnc5Dが発現することがわかった(図2a).Unc5Dは多極性形態期に特異的に発現する受容体として知られている7).FoxG1を強制発現したニューロンは皮質板への移動が中間帯において遅れることをすでに示したが,これらのニューロンはNeuroD1の発現を異所的に維持し,さらに驚くべきことに,Unc5Dを発現しないことがわかった(図2b).このことから,FoxG1を発現抑制できなかったニューロンでは多極性形態期の前半から後半への移行がうまく起こらなかったものと推察された(図2b).さらには,Unc5Dを発現しなかったことが多極性形態期の前半から後半への移行が阻害された直接の原因である可能性が示唆された.その場合,FoxG1を強制発現した際にみられる移動の遅れとそれによるピラミダルニューロンの変質は,Unc5Dを補うことによりレスキューされるはずである.
そこで,FoxG1の強制発現と同時に,Unc5Dも強制発現したところ,3日後にはすでに皮質板へと移動するニューロンが確認された.さらに,生後7日目にその最終的な位置を調べたところ,FoxG1のみを強制発現したニューロンと比較して,Unc5Dをも強制発現したニューロンではより多くが第4層に確認された.また,層に特異的なマーカーについても,Unc5Dの強制発現により第4層のニューロンのマーカーをもつものが多く確認された.つまり,Unc5Dの発現をもとにもどすことにより,FoxG1の強制発現により生じる異常はレスキューされた.以上から,多極性形態期の前半においてFoxG1が発現抑制されることによりUnc5Dの発現の誘導が起こることで,多極性形態期の後半への移行が促進され,これが最終的にはニューロンの皮質板へのスムースな移動に不可欠であることが明らかになった.さらには,単独では中間帯においてニューロンの移動を遅らせてしまう受容体Dccの機能をモジュレートするような役割をUnc5Dははたしており、このUnc5DとDccとの正常なバランスが多極性形態期における移行に重要であることも明らかにした.
多極性形態期の後半においてFoxG1が増加する理由を知るため,FoxG1のコンディショナルノックアウトマウスを作製した.コンディショナルノックアウトマウスは一般にはCreリコンビナーゼにより標的となる遺伝子が切り出されるようデザインされるが,ここでは,遺伝子が切り出されたあと,さらにリコンビナーゼであるFlpeが発現するようなしくみをくわえた.このコンディショナルノックアウトマウスをFlpeレポーターマウス8) と組み合わせることで,FoxG1の発現のなくなったニューロンのみを選択的に標識し追跡することを可能にした9).
多極性形態期の後半においてFoxG1をノックアウトすることでFoxG1の増加を阻害すると,ニューロンはいつまでたっても皮質板へと移動せずその直下にとどまりつづけることが明らかになった(図2c).興味深いことに,FoxG1の増加しない未分化なニューロンは,正常な場合と同じくいったん多極形態期に特異的なNeuroD1とUnc5Dの発現を消失したが,しばらくするとこれらの再発現が認められた.このことから,FoxG1の増加しないニューロンでは多極形態期の前半への退行が起こるものと考えられた.この表現型のさらなる検証のため,多極性形態の後期においてFoxG1をノックアウトしたニューロンおよび対照ニューロンにおける遺伝子発現をマイクロアレイ法により網羅的に比較した.その結果,ニューロンの移動を制御するような既知の遺伝子の多くに発現の変化がみられなかった.つまり,ニューロンが移動能を失ったことにより未分化なニューロンが皮質板の直下にとどまったわけではなく,多極性形態の前半へと退行したことが皮質板へと移動できなくなった直接の原因であることが示唆された.その一方,移動を終了しすでに皮質板のなかにあるニューロンではFoxG1をノックアウトしても多極性形態期への退行は起こらなかった.つまり,FoxG1が多極性形態期において未分化なニューロンを制御する機能は,ニューロンが移動しているときにのみ特異的であることがわかった.
この研究では,未分化なニューロンが移動の過程にとる多極形態期は大脳の層構造が形成される過程においてたいへん重要な意味をもつことを明らかにした.そして,この多極形態期の前半におけるFoxG1の減少と後半における増加は,ともに重要な役割をもつことを明らかにした.これらの研究成果より,FoxG1遺伝子の異常によりひき起こされる未分化なニューロンの変質や移動の異常が,ヒトのさまざまな精神疾患の原因のひとつとなっている可能性が強く示唆された.
略歴:2004年 京都大学大学院生命科学研究科 修了,同年より米国New York大学School of Medicineポスドク研究員.
研究テーマ:大脳皮質におけるニューロンネットワーク構築の分子機構.
関心事:大学院に在学時には,中脳におけるGABA産生ニューロンの分化決定因子を同定した.そののち,遺伝学的な手法を用いて,多様なサブタイプからなる大脳皮質のGABA産生介在ニューロンが生産され層構造に組み込まれていく時空間系列を解明してきた.今後は,ピラミダルニューロンと介在ニューロンとが相互に関与しながらニューロンネットワークを構築していく分子機構をおっていきたい.
© 2012 三好 悟一 Licensed under CC 表示 2.1 日本
(米国New York大学School of Medicine,Neuroscience Institute)
email:三好悟一
DOI: 10.7875/first.author.2012.085
Dynamic FoxG1 expression coordinates the integration of multipolar pyramidal neuron precursors into the cortical plate.
Goichi Miyoshi, Gord Fishell
Neuron, 74, 1045-1058 (2012)
要 約
大脳皮質のピラミダルニューロンが発生するその過程においては,未分化なニューロンは増殖層で生まれたのち皮質板へと長距離の移動を行う.そのとき,移動しているニューロンは増殖層と皮質板とのあいだの中間帯において,細長い形から星形の形状である多極性形態へと一過性にその形態を変えることが知られている.この多極性形態期には,ニューロンは大脳皮質の層に対して上下以外にも左右にも遊走することや,ニューロンが情報を伝達するうえで欠かせない軸索の伸張が起こることも知られている.筆者らは,この多極性形態をとるニューロンの移動の過程においては転写因子FoxG1の量がダイナミックに変化しており,初期には減少する一方,途中からは増加することをみつけた.そして,移動している未分化なニューロンにおけるFoxG1の減少と増加が大脳皮質の形成において必須であることを明らかにした.近年,FoxG1遺伝子の欠損あるいは発現過剰がヒトのさまざまな精神疾患において確認されていることから,これらの精神疾患の症状が発生期における多極性形態期の異常によりひき起こされている可能性が示唆された.
はじめに
近年のヒトの遺伝子解析による知見から,異型Rett症候群の患者では転写因子をコードするFoxG1遺伝子が欠損していることが確認されている1).また,それとは異なる症状を示す,てんかん,知能の発育不全,言語障害をもつ患者では,Rett症候群とは逆にFoxG1遺伝子の重複する症例がみつかっている2).これらのことから,FoxG1遺伝子の発現が低下しても上昇しても,ヒトの大脳は正常に機能発達できないものと考えられている.
発生期に大脳皮質がつくられる過程においては,増殖層で生まれた未分化なピラミダルニューロンが大脳の皮質板へと順に移動する必要がある.その際,移動しているニューロンは増殖層と皮質板のあいだに位置する中間層において,細長い形から星形の形状である多極性形態(図1)へと一過的にその形態を変えることが知られている3,4).この多極性形態期では,移動しているニューロンが大脳皮質の層に対して上下以外に左右にも遊走することや,ニューロンが情報を伝達するうえで欠かせない構造である軸索の伸張が起こっていることが知られている.しかしながら,この多極性形態期がどのように制御され,また,大脳の構築においてどれほど重要であるのかはいまだ多く明らかにされていない5).
ノックアウトマウスなどを用いた解析から,転写因子FoxG1 6) は大脳のかたちづくられる初期において脳のそれぞれの領域の性質を決めることが知られている.FoxG1ノックアウトマウスでは海馬および大脳皮質の形成される背側の領域が拡張する一方,線条体や扁桃核のできる腹側の領域が完全に消失する.さらには,増殖している細胞の細胞周期の制御にもFoxG1は大きな役割をもつことが知られている.ところが,このように発生の初期段階で生じる表現型がとてもシビアであるため,増殖をおえたあとの未分化なニューロン,とくに,移動しているニューロンにおけるFoxG1の役割はまったく知られていない.筆者らは,移動している未分化なニューロンが多極性形態をとる時期において,FoxG1の発現がダイナミックに低下および上昇することを発見した.FoxG1遺伝子の欠損あるいは発現過剰がともにヒトの精神疾患において確認されていることから,多極性形態期におけるFoxG1の減少および増加にも大きな役割があるのではないかと考え解析を行った.
1.移動している未分化なニューロンが多極性形態をとる時期において転写因子FoxG1はダイナミックな発現パターンを示す
FoxG1を認識する抗体を用いた免疫染色法により,増殖層と皮質板のあいだに位置する中間帯に存在するニューロンにおけるFoxG1の発現パターンを調べた.この中間帯では,移動している未分化なニューロンは多極性形態をとることが知られていたので,まずは,遺伝学的な手法を用いて多極性形態をとるニューロンを標識した(図1).その結果,多極性形態期の前半においてはFoxG1の発現は抑制されており,逆に,後半においては,FoxG1の発現がふたたび上昇することを発見した(図2a).
2.多極性形態期の前半にFoxG1の発現抑制が起こらないと未分化なニューロンの移動が遅れその性質に変化が生じる
in vivoにおいてFoxG1の量を人為的に増減させる実験を行った.まず,エレクトロポレーション法によりFoxG1を強制発現することで,本来は多極性形態期の前半に起こるFoxG1の発現抑制を打ち消した.その結果,3日後には,対照となるニューロンはすでに皮質板に移動しているにもかかわらず,FoxG1を強制発現したニューロンは中間帯にとどまったままであった.ところが,さらに日数をおいてみると,中間帯にとどまっていたFoxG1を強制発現したニューロンは徐々に皮質板へと移動しはじめた(図2b).そして,生後7日目には,対照のニューロンの多くは第4層のピラミダルニューロンに分化していたのに対し,FoxG1を強制発現したニューロンの多くは第2層あるいは第3層に存在していた.さらに,位置だけでなく遺伝子発現プロファイルについても,本来は第4層のニューロンにみられる遺伝子は発現しておらず,通常は第2層あるいは第3層のニューロンにみられる遺伝子が発現していた.これらの結果から,多極性形態期の前半においてFoxG1の発現抑制が正常に起こらないと皮質板への移動が遅れてしまい,その結果,本来とは異なる性質をもつニューロンに分化してしまうことがわかった.
3.FoxG1の発現抑制により多極性形態期の前半から後半への移行をつかさどるUnc5Dの発現が誘導される
多極性形態期の前半でのFoxG1の発現抑制が,どのような分子機構により未分化なニューロンの皮質板への移動を制御しているのか調べた.まず,多極性形態期の前半において特異的にNeuroD1が発現していること,また,NeuroD1が発現したしばらくあとにUnc5Dが発現することがわかった(図2a).Unc5Dは多極性形態期に特異的に発現する受容体として知られている7).FoxG1を強制発現したニューロンは皮質板への移動が中間帯において遅れることをすでに示したが,これらのニューロンはNeuroD1の発現を異所的に維持し,さらに驚くべきことに,Unc5Dを発現しないことがわかった(図2b).このことから,FoxG1を発現抑制できなかったニューロンでは多極性形態期の前半から後半への移行がうまく起こらなかったものと推察された(図2b).さらには,Unc5Dを発現しなかったことが多極性形態期の前半から後半への移行が阻害された直接の原因である可能性が示唆された.その場合,FoxG1を強制発現した際にみられる移動の遅れとそれによるピラミダルニューロンの変質は,Unc5Dを補うことによりレスキューされるはずである.
そこで,FoxG1の強制発現と同時に,Unc5Dも強制発現したところ,3日後にはすでに皮質板へと移動するニューロンが確認された.さらに,生後7日目にその最終的な位置を調べたところ,FoxG1のみを強制発現したニューロンと比較して,Unc5Dをも強制発現したニューロンではより多くが第4層に確認された.また,層に特異的なマーカーについても,Unc5Dの強制発現により第4層のニューロンのマーカーをもつものが多く確認された.つまり,Unc5Dの発現をもとにもどすことにより,FoxG1の強制発現により生じる異常はレスキューされた.以上から,多極性形態期の前半においてFoxG1が発現抑制されることによりUnc5Dの発現の誘導が起こることで,多極性形態期の後半への移行が促進され,これが最終的にはニューロンの皮質板へのスムースな移動に不可欠であることが明らかになった.さらには,単独では中間帯においてニューロンの移動を遅らせてしまう受容体Dccの機能をモジュレートするような役割をUnc5Dははたしており、このUnc5DとDccとの正常なバランスが多極性形態期における移行に重要であることも明らかにした.
4.多極性形態期の後半におけるFoxG1の発現上昇が未分化なニューロンの皮質板への移動に必須である
多極性形態期の後半においてFoxG1が増加する理由を知るため,FoxG1のコンディショナルノックアウトマウスを作製した.コンディショナルノックアウトマウスは一般にはCreリコンビナーゼにより標的となる遺伝子が切り出されるようデザインされるが,ここでは,遺伝子が切り出されたあと,さらにリコンビナーゼであるFlpeが発現するようなしくみをくわえた.このコンディショナルノックアウトマウスをFlpeレポーターマウス8) と組み合わせることで,FoxG1の発現のなくなったニューロンのみを選択的に標識し追跡することを可能にした9).
多極性形態期の後半においてFoxG1をノックアウトすることでFoxG1の増加を阻害すると,ニューロンはいつまでたっても皮質板へと移動せずその直下にとどまりつづけることが明らかになった(図2c).興味深いことに,FoxG1の増加しない未分化なニューロンは,正常な場合と同じくいったん多極形態期に特異的なNeuroD1とUnc5Dの発現を消失したが,しばらくするとこれらの再発現が認められた.このことから,FoxG1の増加しないニューロンでは多極形態期の前半への退行が起こるものと考えられた.この表現型のさらなる検証のため,多極性形態の後期においてFoxG1をノックアウトしたニューロンおよび対照ニューロンにおける遺伝子発現をマイクロアレイ法により網羅的に比較した.その結果,ニューロンの移動を制御するような既知の遺伝子の多くに発現の変化がみられなかった.つまり,ニューロンが移動能を失ったことにより未分化なニューロンが皮質板の直下にとどまったわけではなく,多極性形態の前半へと退行したことが皮質板へと移動できなくなった直接の原因であることが示唆された.その一方,移動を終了しすでに皮質板のなかにあるニューロンではFoxG1をノックアウトしても多極性形態期への退行は起こらなかった.つまり,FoxG1が多極性形態期において未分化なニューロンを制御する機能は,ニューロンが移動しているときにのみ特異的であることがわかった.
おわりに
この研究では,未分化なニューロンが移動の過程にとる多極形態期は大脳の層構造が形成される過程においてたいへん重要な意味をもつことを明らかにした.そして,この多極形態期の前半におけるFoxG1の減少と後半における増加は,ともに重要な役割をもつことを明らかにした.これらの研究成果より,FoxG1遺伝子の異常によりひき起こされる未分化なニューロンの変質や移動の異常が,ヒトのさまざまな精神疾患の原因のひとつとなっている可能性が強く示唆された.
文 献
- Ariani, F., Hayek, G., Rondinella, D. et al.: FOXG1 is responsible for the congenital variant of Rett syndrome. Am. J. Hum. Genet., 83, 89-93 (2008)[PubMed]
- Brunetti-Pierri, N., Paciorkowski, A. R., Ciccone, R. et al.: Duplications of FOXG1 in 14q12 are associated with developmental epilepsy, mental retardation, and severe speech impairment. Eur. J. Hum. Genet., 19, 102-107 (2011)[PubMed]
- Noctor, S. C., Martinez-Cerdeno, V., Ivic, L. et al.: Cortical neurons arise in symmetric and asymmetric division zones and migrate through specific phases. Nat. Neurosci., 7, 136-144 (2004)[PubMed]
- Tabata, H. & Nakajima, K.: Multipolar migration: the third mode of radial neuronal migration in the developing cerebral cortex. J. Neurosci., 23, 9996-10001 (2003)[PubMed]
- LoTurco, J. J. & Bai, J.: The multipolar stage and disruptions in neuronal migration. Trends Neurosci., 29, 407-413 (2006)[PubMed]
- Hanashima, C., Li, S. C., Shen, L. et al.: Foxg1 suppresses early cortical cell fate. Science, 303, 56-59 (2004)[PubMed]
- Sasaki, S., Tabata, H., Tachikawa, K. et al.: The cortical subventricular zone-specific molecule Svet1 is part of the nuclear RNA coded by the putative netrin receptor gene Unc5d and is expressed in multipolar migrating cells. Mol. Cell. Neurosci., 38, 474-483 (2008)[PubMed]
- Miyoshi, G., Hjerling-Leffler, J., Karayannis, T. et al.: Genetic fate mapping reveals that the caudal ganglionic eminence produces a large and diverse population of superficial cortical interneurons. J. Neurosci., 30, 1582-1594 (2010)[PubMed]
- Miyoshi, G. & Fishell, G.: Directing neuron-specific transgene expression in the mouse CNS. Curr. Opin. Neurobiol., 16, 577-584 (2006)[PubMed]
著者プロフィール
略歴:2004年 京都大学大学院生命科学研究科 修了,同年より米国New York大学School of Medicineポスドク研究員.
研究テーマ:大脳皮質におけるニューロンネットワーク構築の分子機構.
関心事:大学院に在学時には,中脳におけるGABA産生ニューロンの分化決定因子を同定した.そののち,遺伝学的な手法を用いて,多様なサブタイプからなる大脳皮質のGABA産生介在ニューロンが生産され層構造に組み込まれていく時空間系列を解明してきた.今後は,ピラミダルニューロンと介在ニューロンとが相互に関与しながらニューロンネットワークを構築していく分子機構をおっていきたい.
© 2012 三好 悟一 Licensed under CC 表示 2.1 日本