腸管のM細胞の分化にはEtsファミリー転写因子Spi-Bが必須である
金谷高史・大野博司
(理化学研究所免疫・アレルギー科学総合研究センター 免疫系構築研究チーム)
email:金谷高史,大野博司
DOI: 10.7875/first.author.2012.082
The Ets transcription factor Spi-B is essential for the differentiation of intestinal microfold cells.
Takashi Kanaya, Koji Hase, Daisuke Takahashi, Shinji Fukuda, Katsuaki Hoshino, Izumi Sasaki, Hiroaki Hemmi, Kathryn A Knoop, Nachiket Kumar, Mayuko Sato, Tatsuro Katsuno, Osamu Yokosuka, Kiminori Toyooka, Kumiko Nakai, Ayako Sakamoto, Yuuki Kitahara, Toshi Jinnohara, Stephen J McSorley, Tsuneyasu Kaisho, Ifor R Williams, Hiroshi Ohno
Nature Immunology, 13, 729-736 (2012)
腸管の粘膜にはM細胞とよばれる腸管上皮細胞が点在し,腸管の内部に侵入してきた抗原をさかんに取り込むことで免疫応答を発動させている.しかしながら,M細胞は生体において絶対数の少ないことが障害となり,その分化の機構はほとんど明らかにされていなかった.この研究では,RANKLとよばれるサイトカインがM細胞の分化を誘導するという現象を活用し,M細胞が分化する際にEtsファミリー転写因子のひとつであるSpi-Bの発現が誘導されることを見い出した.Spi-Bを欠損するマウスではM細胞の形成が完全に消失し,それにともない,腸管において抗原に特異的な免疫応答が阻害されることが明らかになった.この結果は,Spi-BがM細胞の分化に決定的な役割をはたすことを示した.
腸管は栄養および水分の吸収の場であり,腸管の粘膜は絨毛とよばれる突起構造を形成することで広大な表面積をもち吸収効率を高めている.腸管の粘膜には食物とともに生体にとり有害な抗原が侵入してくるため,多くの感染症における初期の感染経路ともなっている.これらの抗原から広大な表面積をもつ腸管の粘膜を守るため,腸管には全身の末梢リンパ球のうち60~70%が集中し,体内で最大の免疫組織である腸管免疫組織が発達している.パイエル板に代表される腸管免疫組織は,粘膜面を介し腸管の内腔にある抗原を直接的に取り込むことで免疫応答を発動させている.腸管免疫組織をおおう粘膜の上皮細胞層は濾胞関連上皮(follicle-associated epithelium:FAE)とよばれ,ここには腸管にある抗原をさかんに取り込むM細胞(M:microfold)が分布している.M細胞により取り込まれた抗原はその直下にある樹状細胞などの免疫細胞に受け渡され,抗原に対する特異的な免疫応答が誘導される.このように,M細胞は腸管免疫応答において重要な役割をはたしているものと考えられるが,抗原の取り込みのしくみやM細胞そのものの分化に関してはほとんど明らかにされていない.近年のトランスクリプトーム解析により,M細胞に発現する複数の遺伝子が同定され,これらの機能解析がM細胞の機能の分子レベルでの解明につながるものと期待されている.実際に筆者らは,そのうちGP2(glycoprotein-2)が細菌の取り込みの受容体として機能することを明らかにしている1).しかしながら,M細胞の分化を制御するタンパク質は明らかにされていなかった.この研究では,M細胞の分化を制御する転写因子の同定を目的とした.
細胞の分化を制御する転写因子を同定するためには,標的とする細胞の分化の過程を経時的に観察することが必須である.しかしながら,M細胞は生体における絶対数が少なく,単離して培養系にもち込むことが困難であったため,その分化に関する研究はほとんど進んでいなかった.最近,破骨細胞の分化促進タンパク質として知られるRANKL(receptor activator of NF-κB ligand)がM細胞の分布する濾胞関連上皮の直下に発現することが見い出された2).さらに,マウスへのRANKLの投与により,通常はM細胞の存在しない絨毛の上皮細胞層においてM細胞の異所性の分化の誘導されることが報告された3).この研究では,このRANKLによるM細胞の異所性の誘導を活用し,M細胞の分化の過程の経時的な観察を試みた.
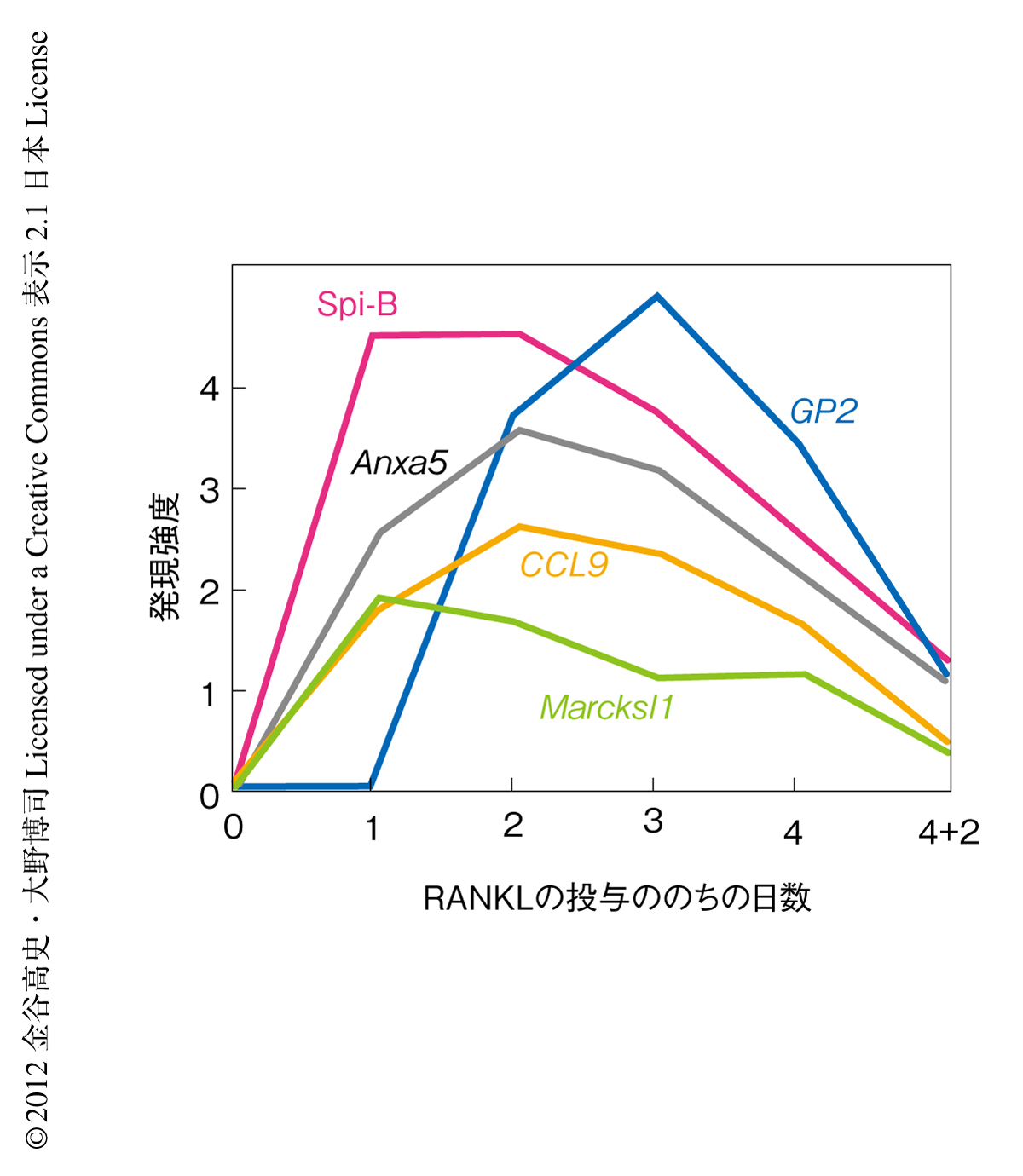
RANKLをマウスに3~4日間にわたり連続投与することによりM細胞は絨毛の上皮細胞層に誘導される.そこで,RANKLの投与から1日後,2日後,3日後,4日後のマウスの小腸より絨毛の上皮細胞を採取し,M細胞のマーカー遺伝子の発現動態を解析した.その結果,Marcksl1遺伝子はRANKLの投与の1日後,CCL9遺伝子は2日後,そして,GP2遺伝子は3日後に発現のピークをむかえることが観察されたことから,マーカー遺伝子により異なる発現動態を示すことが明らかになった(図1).この発現動態はM細胞の分化の遷移段階そのものを現わすものであり,RANKLの投与ののちの経時的な遺伝子発現の解析はM細胞の分化の過程の追跡を可能にすることが示された.
M細胞の分化の過程において発現する転写因子を探索するため,RANKLの投与ののちの遺伝子の発現変動を網羅的に解析した.RANKLの投与ののち発現の変動する転写因子に着目したところ,RANKLの投与から1日後にEtsファミリー転写因子のひとつであるSpi-Bの発現が強く誘導されることがわかった(図1).これまでに,Spi-BはB細胞など免疫細胞における発現が報告されているが4),そのほかの細胞種における発現は報告されていない.腸管免疫組織のうちパイエル板におけるSpi-Bの発現を解析したところ,M細胞の分布する濾胞関連上皮において高い発現が観察された.M細胞のマーカーであるGP2との共染色を行った結果,濾胞関連上皮に分布するM細胞はSpi-Bを高発現していることが確認された.孤立リンパ小節や大腸の免疫組織など,パイエル板以外の腸管免疫組織の濾胞関連上皮におけるSpi-Bの発現を解析したところ,パイエル板と同様,M細胞において強い発現が観察された.また,ヒトのパイエル板のM細胞においてもSpi-Bの発現することが確認されたことから,Spi-BのM細胞における発現はマウスとヒトのあいだで保存されていることが明らかになった.
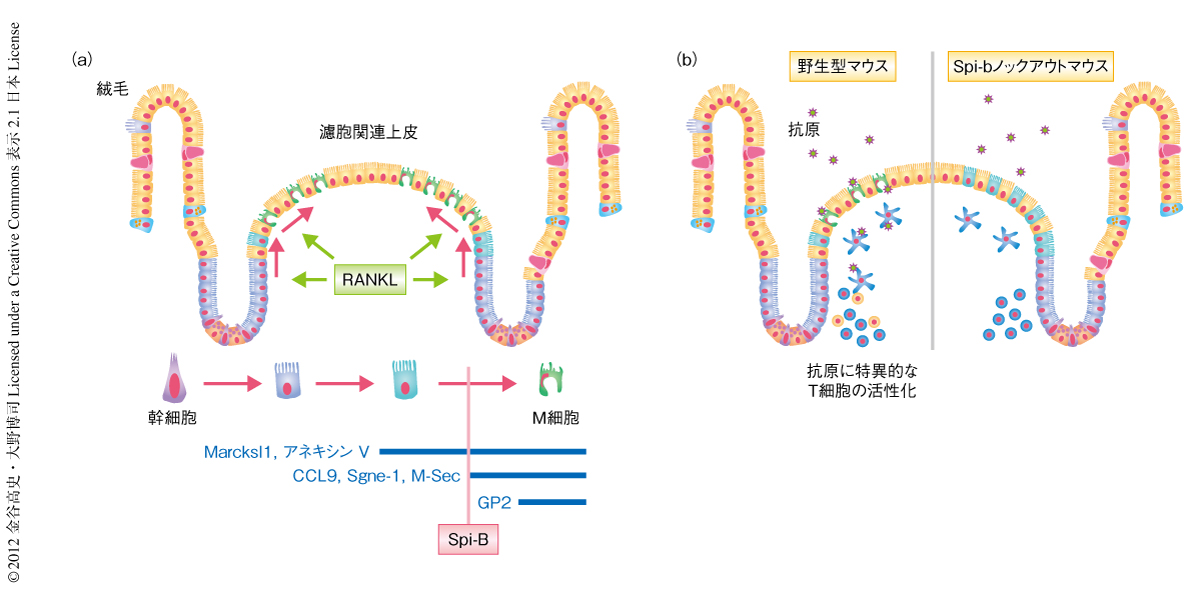
M細胞における転写因子Spi-Bの高い発現は,M細胞の分化へのSpi-Bの関与を強く示唆した.そこで,Spi-BノックアウトマウスにおけるM細胞の形成を解析した.ホールマウント免疫染色法によりM細胞のマーカータンパク質であるGP2の発現を観察したところ,Spi-BノックアウトマウスにおいてGP2陽性のM細胞は完全に欠失していることが明らかになった.RANKLにより誘導されるM細胞の分化を経時的に観察することでM細胞のマーカー遺伝子は異なった発現動態を示すことを発見していたので,GP2遺伝子のほか,CCL9遺伝子,Marcksl1遺伝子,Anxa5遺伝子,M-Sec遺伝子,Sgne-1遺伝子といったM細胞のマーカー遺伝子の発現を解析した5,6).その結果,CCL9,M-Sec,Sgne-1の発現はSpi-Bノックアウトマウスの濾胞関連上皮において完全に消失するが,Marcksl1およびアネキシンVの発現は維持されていることがわかった.
つぎに,Spi-Bノックアウトマウスに存在するMarcksl1陽性およびアネキシンV陽性の濾胞関連上皮の細胞の性状を解析するため,電子顕微鏡によりSpi-Bノックアウトマウスのパイエル板の濾胞関連上皮を観察した.野生型マウスのM細胞はマイクロフォールド(microfold)とよばれるふぞろいでまばらな微絨毛の構造を細胞の表面に形成することが知られるが,Spi-Bノックアウトマウスの濾胞関連上皮ではマイクロフォールドを形成する細胞は観察されなかった.さらに,M細胞の最大の特徴である抗原の取り込みおよび輸送能を評価するため,Spi-Bノックアウトマウスに蛍光標識ビーズ,あるいは,M細胞から取り込まれることの知られている細菌Salmonella enterica serovar Typhimurium(S. Typhimurium)やYersinia enterocoliticaを経口的に投与した.投与ののちパイエル板に取り込まれた数を測定したところ,いずれの取り込みもSpi-Bノックアウトマウスにおいて著しく減少していた.これらのことから,Spi-Bノックアウトマウスでは形態学的および機能的にM細胞と判断される細胞は完全に欠失することが明らかになった(図2a).
M細胞の欠失が腸管免疫応答に及ぼす影響を評価するため,経口的に投与した細菌S. Typhimuriumに対する免疫応答を解析した.S. Typhimuriumを認識するT細胞受容体SM1のトランスジェニックマウスから,野生型マウスおよびSpi-BノックアウトマウスにSM1をもつCD4陽性T細胞を移入し,感染ののちこのT細胞の活性化マーカーの発現を測定することでS. Typhimuriumに特異的な免疫応答を評価した7,8).野生型マウスに移入したSM1をもつCD4陽性T細胞はS. Typhimuriumの感染により活性化したが,Spi-Bノックアウトマウスに移入したSM1をもつCD4陽性T細胞はS. Typhimuriumを感染させてもほとんど活性化しないことが明らかになった.Spi-BはM細胞以外にB細胞などの免疫細胞においても発現していることから,これらの細胞におけるSpi-Bの欠失が活性化に影響をあたえていることも否定できなかった.そこで,野生型マウスの骨髄細胞をSpi-Bノックアウトマウスに移植した骨髄キメラマウスを作製し同様の実験を行った.S. Typhimuriumの感染ののちSpi-Bノックアウト骨髄キメラマウスではSM1をもつCD4陽性T細胞の活性化ののちの増殖が阻害されたことから,Spi-Bの欠損によりひき起こされるM細胞の欠失が腸管におけるS. Typhimuriumに特異的な免疫応答を阻害することが示された(図2b).
今後,Spi-Bノックアウトマウスを用いることで生体におけるM細胞の重要性を的確に評価することが可能となる.とくに,M細胞を標的とした経口ワクチンの開発において,ワクチンの有効性を評価するうえで非常に強力なツールとなることが期待される.一方で,M細胞はある種の病原体の感染口となることが報告されているため,これら病原体の感染機構の解明への貢献も期待できる.
略歴:2009年 東北大学大学院農学研究科博士課程後期 修了,同年より理化学研究所 免疫・アレルギー科学総合研究センター 研究員.
研究テーマ:M細胞の分化機構と生体における存在意義.
抱負:自分の研究成果により,M細胞をよりメジャーな存在にしたい.
大野 博司(Hiroshi Ohno)
理化学研究所免疫・アレルギー科学総合研究センター チームリーダー,横浜市立大学大学院生命ナノシステム科学研究科 客員教授.
研究室URL:http://leib.rcai.riken.jp/riken/index.html
© 2012 金谷高史・大野博司 Licensed under CC 表示 2.1 日本
(理化学研究所免疫・アレルギー科学総合研究センター 免疫系構築研究チーム)
email:金谷高史,大野博司
DOI: 10.7875/first.author.2012.082
The Ets transcription factor Spi-B is essential for the differentiation of intestinal microfold cells.
Takashi Kanaya, Koji Hase, Daisuke Takahashi, Shinji Fukuda, Katsuaki Hoshino, Izumi Sasaki, Hiroaki Hemmi, Kathryn A Knoop, Nachiket Kumar, Mayuko Sato, Tatsuro Katsuno, Osamu Yokosuka, Kiminori Toyooka, Kumiko Nakai, Ayako Sakamoto, Yuuki Kitahara, Toshi Jinnohara, Stephen J McSorley, Tsuneyasu Kaisho, Ifor R Williams, Hiroshi Ohno
Nature Immunology, 13, 729-736 (2012)
要 約
腸管の粘膜にはM細胞とよばれる腸管上皮細胞が点在し,腸管の内部に侵入してきた抗原をさかんに取り込むことで免疫応答を発動させている.しかしながら,M細胞は生体において絶対数の少ないことが障害となり,その分化の機構はほとんど明らかにされていなかった.この研究では,RANKLとよばれるサイトカインがM細胞の分化を誘導するという現象を活用し,M細胞が分化する際にEtsファミリー転写因子のひとつであるSpi-Bの発現が誘導されることを見い出した.Spi-Bを欠損するマウスではM細胞の形成が完全に消失し,それにともない,腸管において抗原に特異的な免疫応答が阻害されることが明らかになった.この結果は,Spi-BがM細胞の分化に決定的な役割をはたすことを示した.
はじめに
腸管は栄養および水分の吸収の場であり,腸管の粘膜は絨毛とよばれる突起構造を形成することで広大な表面積をもち吸収効率を高めている.腸管の粘膜には食物とともに生体にとり有害な抗原が侵入してくるため,多くの感染症における初期の感染経路ともなっている.これらの抗原から広大な表面積をもつ腸管の粘膜を守るため,腸管には全身の末梢リンパ球のうち60~70%が集中し,体内で最大の免疫組織である腸管免疫組織が発達している.パイエル板に代表される腸管免疫組織は,粘膜面を介し腸管の内腔にある抗原を直接的に取り込むことで免疫応答を発動させている.腸管免疫組織をおおう粘膜の上皮細胞層は濾胞関連上皮(follicle-associated epithelium:FAE)とよばれ,ここには腸管にある抗原をさかんに取り込むM細胞(M:microfold)が分布している.M細胞により取り込まれた抗原はその直下にある樹状細胞などの免疫細胞に受け渡され,抗原に対する特異的な免疫応答が誘導される.このように,M細胞は腸管免疫応答において重要な役割をはたしているものと考えられるが,抗原の取り込みのしくみやM細胞そのものの分化に関してはほとんど明らかにされていない.近年のトランスクリプトーム解析により,M細胞に発現する複数の遺伝子が同定され,これらの機能解析がM細胞の機能の分子レベルでの解明につながるものと期待されている.実際に筆者らは,そのうちGP2(glycoprotein-2)が細菌の取り込みの受容体として機能することを明らかにしている1).しかしながら,M細胞の分化を制御するタンパク質は明らかにされていなかった.この研究では,M細胞の分化を制御する転写因子の同定を目的とした.
1.RANKLによるM細胞の分化の過程の経時的な観察
細胞の分化を制御する転写因子を同定するためには,標的とする細胞の分化の過程を経時的に観察することが必須である.しかしながら,M細胞は生体における絶対数が少なく,単離して培養系にもち込むことが困難であったため,その分化に関する研究はほとんど進んでいなかった.最近,破骨細胞の分化促進タンパク質として知られるRANKL(receptor activator of NF-κB ligand)がM細胞の分布する濾胞関連上皮の直下に発現することが見い出された2).さらに,マウスへのRANKLの投与により,通常はM細胞の存在しない絨毛の上皮細胞層においてM細胞の異所性の分化の誘導されることが報告された3).この研究では,このRANKLによるM細胞の異所性の誘導を活用し,M細胞の分化の過程の経時的な観察を試みた.
RANKLをマウスに3~4日間にわたり連続投与することによりM細胞は絨毛の上皮細胞層に誘導される.そこで,RANKLの投与から1日後,2日後,3日後,4日後のマウスの小腸より絨毛の上皮細胞を採取し,M細胞のマーカー遺伝子の発現動態を解析した.その結果,Marcksl1遺伝子はRANKLの投与の1日後,CCL9遺伝子は2日後,そして,GP2遺伝子は3日後に発現のピークをむかえることが観察されたことから,マーカー遺伝子により異なる発現動態を示すことが明らかになった(図1).この発現動態はM細胞の分化の遷移段階そのものを現わすものであり,RANKLの投与ののちの経時的な遺伝子発現の解析はM細胞の分化の過程の追跡を可能にすることが示された.
2.転写因子Spi-BはM細胞に高発現する
M細胞の分化の過程において発現する転写因子を探索するため,RANKLの投与ののちの遺伝子の発現変動を網羅的に解析した.RANKLの投与ののち発現の変動する転写因子に着目したところ,RANKLの投与から1日後にEtsファミリー転写因子のひとつであるSpi-Bの発現が強く誘導されることがわかった(図1).これまでに,Spi-BはB細胞など免疫細胞における発現が報告されているが4),そのほかの細胞種における発現は報告されていない.腸管免疫組織のうちパイエル板におけるSpi-Bの発現を解析したところ,M細胞の分布する濾胞関連上皮において高い発現が観察された.M細胞のマーカーであるGP2との共染色を行った結果,濾胞関連上皮に分布するM細胞はSpi-Bを高発現していることが確認された.孤立リンパ小節や大腸の免疫組織など,パイエル板以外の腸管免疫組織の濾胞関連上皮におけるSpi-Bの発現を解析したところ,パイエル板と同様,M細胞において強い発現が観察された.また,ヒトのパイエル板のM細胞においてもSpi-Bの発現することが確認されたことから,Spi-BのM細胞における発現はマウスとヒトのあいだで保存されていることが明らかになった.
3.Spi-BノックアウトマウスにおけるM細胞の欠失
M細胞における転写因子Spi-Bの高い発現は,M細胞の分化へのSpi-Bの関与を強く示唆した.そこで,Spi-BノックアウトマウスにおけるM細胞の形成を解析した.ホールマウント免疫染色法によりM細胞のマーカータンパク質であるGP2の発現を観察したところ,Spi-BノックアウトマウスにおいてGP2陽性のM細胞は完全に欠失していることが明らかになった.RANKLにより誘導されるM細胞の分化を経時的に観察することでM細胞のマーカー遺伝子は異なった発現動態を示すことを発見していたので,GP2遺伝子のほか,CCL9遺伝子,Marcksl1遺伝子,Anxa5遺伝子,M-Sec遺伝子,Sgne-1遺伝子といったM細胞のマーカー遺伝子の発現を解析した5,6).その結果,CCL9,M-Sec,Sgne-1の発現はSpi-Bノックアウトマウスの濾胞関連上皮において完全に消失するが,Marcksl1およびアネキシンVの発現は維持されていることがわかった.
つぎに,Spi-Bノックアウトマウスに存在するMarcksl1陽性およびアネキシンV陽性の濾胞関連上皮の細胞の性状を解析するため,電子顕微鏡によりSpi-Bノックアウトマウスのパイエル板の濾胞関連上皮を観察した.野生型マウスのM細胞はマイクロフォールド(microfold)とよばれるふぞろいでまばらな微絨毛の構造を細胞の表面に形成することが知られるが,Spi-Bノックアウトマウスの濾胞関連上皮ではマイクロフォールドを形成する細胞は観察されなかった.さらに,M細胞の最大の特徴である抗原の取り込みおよび輸送能を評価するため,Spi-Bノックアウトマウスに蛍光標識ビーズ,あるいは,M細胞から取り込まれることの知られている細菌Salmonella enterica serovar Typhimurium(S. Typhimurium)やYersinia enterocoliticaを経口的に投与した.投与ののちパイエル板に取り込まれた数を測定したところ,いずれの取り込みもSpi-Bノックアウトマウスにおいて著しく減少していた.これらのことから,Spi-Bノックアウトマウスでは形態学的および機能的にM細胞と判断される細胞は完全に欠失することが明らかになった(図2a).
4.Spi-Bノックアウトマウスにおいて抗原に特異的な腸管免疫応答は阻害される
M細胞の欠失が腸管免疫応答に及ぼす影響を評価するため,経口的に投与した細菌S. Typhimuriumに対する免疫応答を解析した.S. Typhimuriumを認識するT細胞受容体SM1のトランスジェニックマウスから,野生型マウスおよびSpi-BノックアウトマウスにSM1をもつCD4陽性T細胞を移入し,感染ののちこのT細胞の活性化マーカーの発現を測定することでS. Typhimuriumに特異的な免疫応答を評価した7,8).野生型マウスに移入したSM1をもつCD4陽性T細胞はS. Typhimuriumの感染により活性化したが,Spi-Bノックアウトマウスに移入したSM1をもつCD4陽性T細胞はS. Typhimuriumを感染させてもほとんど活性化しないことが明らかになった.Spi-BはM細胞以外にB細胞などの免疫細胞においても発現していることから,これらの細胞におけるSpi-Bの欠失が活性化に影響をあたえていることも否定できなかった.そこで,野生型マウスの骨髄細胞をSpi-Bノックアウトマウスに移植した骨髄キメラマウスを作製し同様の実験を行った.S. Typhimuriumの感染ののちSpi-Bノックアウト骨髄キメラマウスではSM1をもつCD4陽性T細胞の活性化ののちの増殖が阻害されたことから,Spi-Bの欠損によりひき起こされるM細胞の欠失が腸管におけるS. Typhimuriumに特異的な免疫応答を阻害することが示された(図2b).
おわりに
今後,Spi-Bノックアウトマウスを用いることで生体におけるM細胞の重要性を的確に評価することが可能となる.とくに,M細胞を標的とした経口ワクチンの開発において,ワクチンの有効性を評価するうえで非常に強力なツールとなることが期待される.一方で,M細胞はある種の病原体の感染口となることが報告されているため,これら病原体の感染機構の解明への貢献も期待できる.
文 献
- Hase, K., Kawano, K., Nochi, T. et al.: Uptake through glycoprotein 2 of FimH+ bacteria by M cells initiates mucosal immune response. Nature, 462, 226-230 (2009)[PubMed]
- Taylor, R. T., Patel, S. R., Lin, E. et al.: Lymphotoxin-independent expression of TNF-related activation-induced cytokine by stromal cells in cryptopatches, isolated lymphoid follicles, and Peyer's patches. J. Immunol., 178, 5659-5667 (2007)[PubMed]
- Knoop, K. A., Kumar, N., Butler, B. R. et al.: RANKL is necessary and sufficient to initiate development of antigen-sampling M cells in the intestinal epithelium. J. Immunol., 183, 5738-5747 (2009)[PubMed]
- Su, G. H., Chen, H. M., Muthusamy, N. et al.: Defective B cell receptor-mediated responses in mice lacking the Ets protein, Spi-B. EMBO J., 16, 7118-7129 (1997)[PubMed]
- Terahara, K., Toshida, M., Igarashi, O. et al.: Comprehensive gene expression profiling of Peyer's patch M cells, villous M-like cells, and intestinal epithelial cells. J. Immunol., 180, 7840-7846 (2008)[PubMed]
- Hase, K., Kimura, S., Takatsu, H. et al.: M-Sec promotes membrane nanotube formation by interacting with Ral and the exocyst complex. Nat. Cell Biol., 11, 1427-1432 (2009)[PubMed]
- McSorley, S. J., Asch, S., Costalonga, M. et al.: Tracking salmonella-specific CD4 T cells in vivo reveals a local mucosal response to a disseminated infection. Immunity, 16, 365-377 (2002)[PubMed]
- Salazar-Gonzalez, R. M., Niess, J. H., Zammit, D. J. et al.: CCR6-mediated dendritic cell activation of pathogen-specific T cells in Peyer's patches. Immunity, 24, 623-632 (2006)[PubMed]
著者プロフィール
略歴:2009年 東北大学大学院農学研究科博士課程後期 修了,同年より理化学研究所 免疫・アレルギー科学総合研究センター 研究員.
研究テーマ:M細胞の分化機構と生体における存在意義.
抱負:自分の研究成果により,M細胞をよりメジャーな存在にしたい.
大野 博司(Hiroshi Ohno)
理化学研究所免疫・アレルギー科学総合研究センター チームリーダー,横浜市立大学大学院生命ナノシステム科学研究科 客員教授.
研究室URL:http://leib.rcai.riken.jp/riken/index.html
© 2012 金谷高史・大野博司 Licensed under CC 表示 2.1 日本