MPS1/Mph1は動原体タンパク質KNL1/Spc7をリン酸化することにより紡錘体形成チェックポイントタンパク質の動原体への局在を促進する
山岸有哉・渡邊嘉典
(東京大学分子細胞生物学研究所 染色体動態研究分野)
email:山岸有哉
DOI: 10.7875/first.author.2012.078
MPS1/Mph1 phosphorylates the kinetochore protein KNL1/Spc7 to recruit SAC components.
Yuya Yamagishi, Ching-Hui Yang, Yuji Tanno, Yoshinori Watanabe
Nature Cell Biology, 14, 746-752 (2012)
染色体を正確に娘細胞に分配することはゲノムの恒常性を維持するうえで必須である.そのため,生物は正確な染色体の分配を行うための巧妙な機構をもつ.そのうちのひとつである紡錘体形成チェックポイントは,分裂期において紡錘体微小管に結合していない動原体を感知し分裂後期への移行を阻害する機構である.この紡錘体形成チェックポイントがはたらくことにより,分裂後期に移行するまえにすべての動原体は紡錘体微小管により捉えられていることが保証される.MPS1は酵母からヒトまで真核生物に広く保存されたキナーゼであり,その活性は紡錘体形成チェックポイントの活性化,および,染色体が反対の方向から延びた微小管により捉えられる二方向性結合の確立の両方に必要であることが知られている.しかし,その主要な基質は不明であった.今回,筆者らは,分裂酵母を用いた解析から,MPS1のホモログMph1は動原体タンパク質KNL1のホモログSpc7をリン酸化し,そのリン酸化は紡錘体形成チェックポイントの活性化,および,染色体の二方向性結合の確立の両方に必要であることを示した.また,ヒト培養細胞を用いた解析から,この機構が進化的に保存されたものであることも明らかにした.
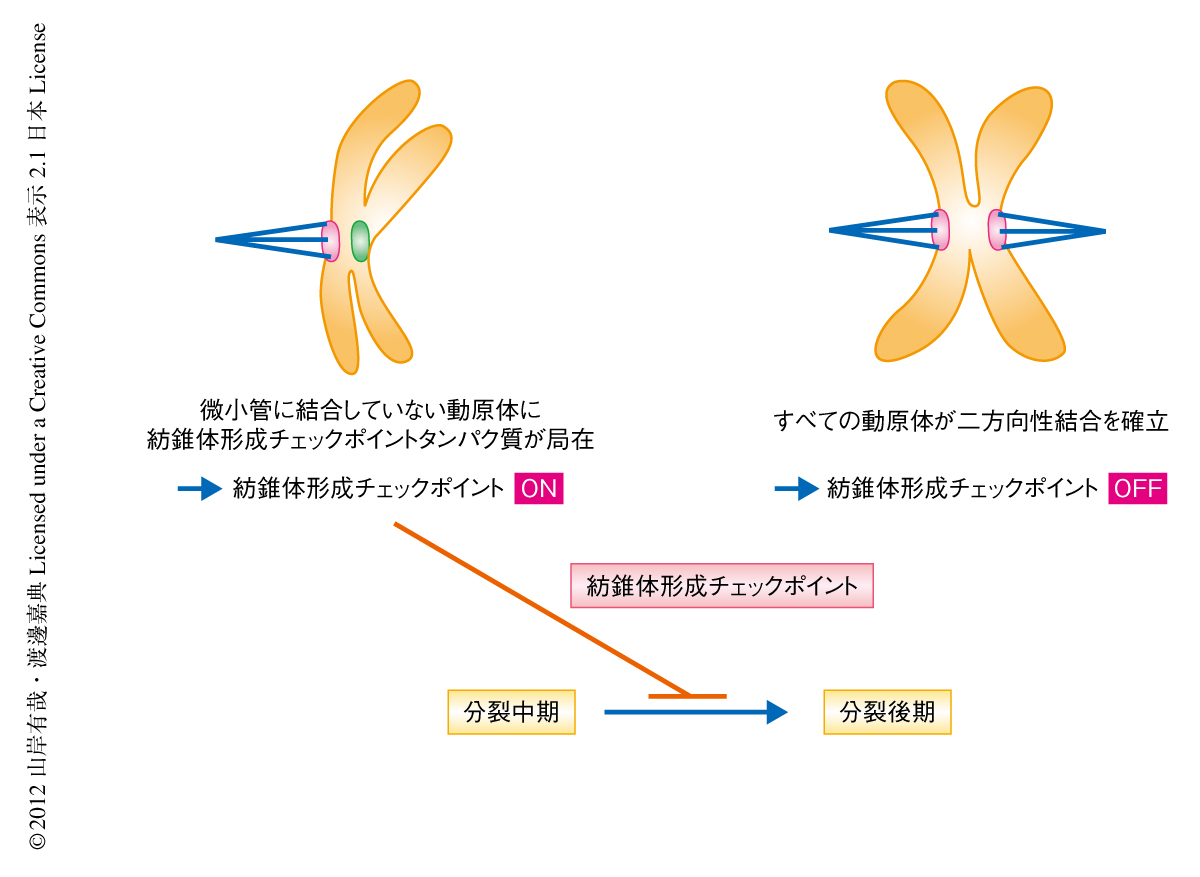
生物が増殖しさらに子孫を残すためには染色体を正確に分配することが必須である.S期に複製された染色体(姉妹染色分体)はコヒーシンとよばれる糊のようなはたらきをするタンパク質複合体により接着される.分裂期にはいると,それぞれの姉妹染色分体は両極から延びる紡錘体微小管により捉えられ二方向性結合を確立する.最終的にすべての動原体が二方向性結合を確立すると,コヒーシンは切断され姉妹染色分体は両極へと分配される.紡錘体形成チェックポイント(spindle assembly checkpoint:SAC)は微小管に結合していない動原体を感知し分裂後期への移行を阻害する機構である.すべての動原体が微小管により捉えられたときのみ紡錘体形成チェックポイントは不活性化され,細胞は分裂後期へと移行することができる1)(図1).
紡錘体形成チェックポイントの活性化にはたらく進化的に保存されたタンパク質Bub1,Bub3,Mad1,Mad2,Mad3/BubR1,MPS1/Mph1は,微小管に結合していない動原体に局在することが知られている.これらタンパク質の動原体への局在は紡錘体形成チェックポイントの活性化に必須であると考えられているが,その局在がどのようにして起こるのかについては不明な点が多い.なかでもMPS1/Mph1については,そのキナーゼ活性が知られているほかの紡錘体形成チェックポイントタンパク質すべての動原体への局在に必要であり2),紡錘体形成チェックポイントの活性化の最上流に位置するタンパク質と考えられている.しかし,MPS1/Mph1が紡錘体形成チェックポイントの活性化にはたらくという最初の報告3) から15年以上のあいだ,その主要なリン酸化の基質は同定されていなかった.また,同じく進化的に保存されたキナーゼであるBub1は,細胞周期をつうじBub3と複合体を形成し,分裂期には微小管と結合していない動原体へと局在化する.Bub1はMad1およびMad2の動原体への局在に必要であることが示されており,紡錘体形成チェックポイントの活性化においてMPS1/Mph1についで上流で機能していると考えられる4).さらに,Bub1はMPS1/Mph1と同様に,紡錘体形成チェックポイントの活性化のみならず染色体の二方向性結合の確立にも寄与していることが知られている.しかし,Bub1-Bub3複合体がどのようにして動原体に局在するのか,その分子機構は不明であった.
今回の研究において,筆者らは,MPS1/Mph1が動原体タンパク質であるKNL1/Spc7をリン酸化し,Bub1-Bub3複合体とKNL1/Spc7との結合を促進することでBub1-Bub3を動原体へと局在化させることを発見した.このKNL1/Spc7のリン酸化は,紡錘体形成チェックポイントの活性化,および,染色体の二方向性結合の確立の両方に必要であった.これらのことから,いままで不明であったMPS1/Mph1の進化的に保存された主要な基質はKNL1/Spc7であることが明らかになった.
筆者らはこれまで,おもにBub1とその下流において染色体の分配を制御するShugoshinの機能解析を行ってきた5).そこで,Bub1が動原体に局在する分子機構に興味をもち,遺伝学的な手法の行いやすい分裂酵母を用いて解析を行うことにした.Bub1の動原体への局在化の機構に関しては,ヒト培養細胞などを用いた解析から3つの保存されたタンパク質の必要であることがわかっていた.ひとつはBub1と複合体を形成するBub3,もうひとつは紡錘体形成チェックポイントタンパク質であるMPS1/Mph1,そして最後に動原体タンパク質であるKNL1/Spc7(ヒトではBlinkinともよばれる)である6-8).これまでの報告により,KNL1がBub1のもつTPR(tetratrichopeptide repeat)とよばれるに配列に直接に結合することでBub1を動原体へと局在化させるというモデルが提唱されていたが8,9),最近,このTPR配列はBub1の動原体への局在に必要ないという結果も報告され,混沌とした状態になっていた10).
そこで,分裂酵母においてもBub3,Mph1のホモログであるMPS1,KNL1のホモログであるSpc7が分裂期におけるBub1の動原体への局在に必要であるかどうかを検討したところ,これらの3つのタンパク質は分裂酵母においても必要であることが明らかになった.また,bub1破壊株においてはMph1の動原体への局在は正常であったことから,Mph1はBub1の上流に位置することがわかった.
つぎに,Bub1の動原体への局在に必要なMph1の基質は何かということだが,その候補となるのはBub1,Bub3,Spc7である.Mph1によるin vitroリン酸化アッセイを行ったところ,これらのうちSpc7のみが効率よくリン酸化されることがわかった.in vitroにおけるSpc7のリン酸化部位を決定したところ,少なくとも4箇所がリン酸化部位として同定され,そのうちの3箇所はKNL1/Spc7ファミリーに保存されているMELTリピート(Met-Glu/Asp-Leu/Ile-Ser/Thr)配列11) に位置していた.Spc7のMELTリピート配列およびそれに類似した配列に11箇所あったセリン残基およびスレオニン残基をすべてアラニン残基に置換し,それ以外のリン酸化部位Thr77のアラニン残基への置換とあわせ,12残基を置換した非リン酸化型Spc7変異体を作製した.
この非リン酸化型Spc7変異体はin vitroにおいてMph1によるリン酸化をまったくうけなかった.また,MELTリピート配列にあるリン酸化部位Thr257に対するリン酸化に特異的な抗体を作製しin vivoにおけるリン酸化について調べたところ,この残基は分裂期に特異的にリン酸化されていることがわかった.これらの結果から,Mph1はSpc7のMELTリピート配列をリン酸化することがわかった.また,ヒトMPS1もヒトKNL1のMELTリピート配列およびそれに類似した配列をin vitroにおいてリン酸化し,さらに,そのうちThr875についてはHeLa細胞において分裂期に特異的にMPS1に依存してリン酸化されることもあわせて示された.したがって,KNL1/Spc7は進化的に保存されたMPS1/Mph1の基質であることが明らかになった.
Mph1によるSpc7のリン酸化がBub1の動原体への局在にあたえる影響を調べるため,非リン酸化型Spc7変異体,および,それと同じ12残基をグルタミン酸残基へと置換したリン酸化模倣型Spc7変異体を発現する細胞を作製し,Bub1の動原体への局在を観察した.その結果,非リン酸化型Spc7変異体の発現細胞ではmph1破壊株と同様に,分裂期におけるBub1の動原体への局在は完全に失われていた.一方,リン酸化模倣型Spc7変異体の発現細胞では分裂期のみならず間期の細胞においてもBub1の動原体への局在が観察された.しかも,このリン酸化模倣型Spc7変異体の発現細胞におけるBub1の動原体への局在はMph1にまったく依存しないこともわかった.しかし,この局在はBub1のパートナーであるBub3に依存していた.また,これらの細胞においてBub3の動原体への局在を観察したところ,Bub1と同様に非リン酸化型Spc7変異体の発現細胞では動原体への局在が失われ,リン酸化模倣型Spc7変異体の発現細胞ではつねに動原体に局在していた.そして,この動原体への局在はMph1には依存せずBub1に依存するものであった.これらの結果から,Mph1によるSpc7のリン酸化がBub1-Bub3複合体の動原体への局在を促進するという機構が明らかになった.
この機構がヒトにおいても保存されているかどうかを検討するため,HeLa細胞を用いて実験を行った.内在性のKNL1をsiRNAによりノックダウンすると同時に,Spc7と同様に8残基を置換した非リン酸化型KNL1変異体あるいはリン酸化模倣型KNL1変異体を発現させ,分裂期におけるBub1の動原体への局在を観察した.その結果,非リン酸化型KNL1変異体の発現細胞ではBub1の動原体への局在は失われたのに対し,リン酸化模倣型KNL1変異体の発現細胞では野生型KNL1を発現した細胞と同様にBub1の動原体への局在が観察された.これらの結果から,ヒトにおいてもMPS1によるKNL1のリン酸化がBub1の動原体への局在に必要であることがわかった.
一方,以前にBub1とKNL1との相互作用に必要と報告されていたKNL1のKIモチーフ9) について,このモチーフを欠損したKNL1変異体は正常に動原体に局在した.したがって,Bub1のTPR配列は動原体への局在に必要ないという報告10) ともあわせ,以前に提唱されていたBub1のTPR配列とKNL1のKIモチーフとの相互作用はBub1の動原体への局在に必要なく,KNL1はMPS1によりリン酸化されることで,KIモチーフとは異なる領域を介してBub1-Bub3複合体と相互作用することが可能になり,この相互作用によりBub1-Bub3複合体の動原体への局在は促進されると考えられた.
MPS1/Mph1によるKNL1/Spc7のリン酸化はどのような機構によりBub1-Bub3複合体の動原体への局在を促進するのであろうか.ひとつの可能性は,このリン酸化がKNL1/Spc7とBub1-Bub3複合体との結合を促進するというものである.この可能性を検討するため,in vitro翻訳系によりBub1,Bub3,非リン酸化型Spc7変異体,リン酸化模倣型Spc7変異体を作製しプルダウンアッセイを行った.その結果,Bub1とBub3は互いに共存するときにのみリン酸化模倣型Spc7変異体と特異的に相互作用した.この相互作用は非リン酸化型Spc7変異体とのあいだにはみられなかった.このことから,Bub1とBub3は複合体として,Mph1によりリン酸化されたSpc7に直接に結合するという分子機構が明らかになった.この結果は,さきに述べたin vivoにおいて局在の制御の関係を調べた結果と一致した.
さらに,ヒトにおいても,HeLa細胞の抽出液を用いた免疫沈降実験によりBub1とKNL1との相互作用が示され,また,細胞培養液にMPS1の阻害剤であるReversineを添加するとBub1の動原体への局在は消失しKNL1との相互作用は失われることがわかった.これらの結果から,Bub1-Bub3複合体がMPS1/Mph11によりリン酸化されたKNL1/Spc7に特異的に結合することで動原体へと局在化する,という進化的に保存されたBub1の動原体への局在化の機構が明らかになった.
Mph1によるSpc7のリン酸化が紡錘体形成チェックポイントの活性化および染色体の二方向性結合の確立にはたす役割を解析した.αチューブリン変異株を用いて細胞において微小管を形成できない状態にすると,野生型Spc7を発現する細胞は紡錘体形成チェックポイントを活性化し分裂期において停止した.ところが,非リン酸化型Spc7変異体の発現細胞は分裂期において停止できなかった.一方,リン酸化模倣型Spc7変異体の発現細胞は大部分が分裂期において停止した.さらに重要なことに,非リン酸化型Spc7変異体の発現細胞においてBub1を強制的に動原体に局在化させると紡錘体形成チェックポイント活性化の表現型が抑圧された.また,紡錘体形成チェックポイントの活性化に必須なタンパク質であるMad1の動原体への局在について観察したところ,非リン酸化型Spc7変異体の発現細胞ではmph1破壊株やbub1破壊株と同様に,Mad1の動原体への局在は失われていた.これらのことから,Mph1によるSpc7のリン酸化およびそれに依存して起こるBub1の動原体への局在化は,紡錘体形成チェックポイントの活性化に必須であることが明らかになった.
染色体の二方向性結合について解析するため,分裂酵母の第2染色体をGFPで標識してその分配様式を調べた.その結果,非リン酸化型Spc7変異体の発現細胞ではmph1破壊株やbub1破壊株と同様に,姉妹染色体が同一の娘細胞に分配されてしまう染色体の不分離が高頻度で観察された.このことは,非リン酸化型Spc7変異体の発現細胞には染色体の二方向性結合の過程に欠損のあることを示していた.このような染色体の不分離はリン酸化模倣型Spc7変異体の発現細胞ではほとんどみられなかった.以上の結果から,Mph1によるSpc7のリン酸化に依存して起こるBub1-Bub3複合体の動原体への局在化は,紡錘体形成チェックポイントの活性化および染色体の二方向性結合の過程の両方に必要であることが明らかになった.
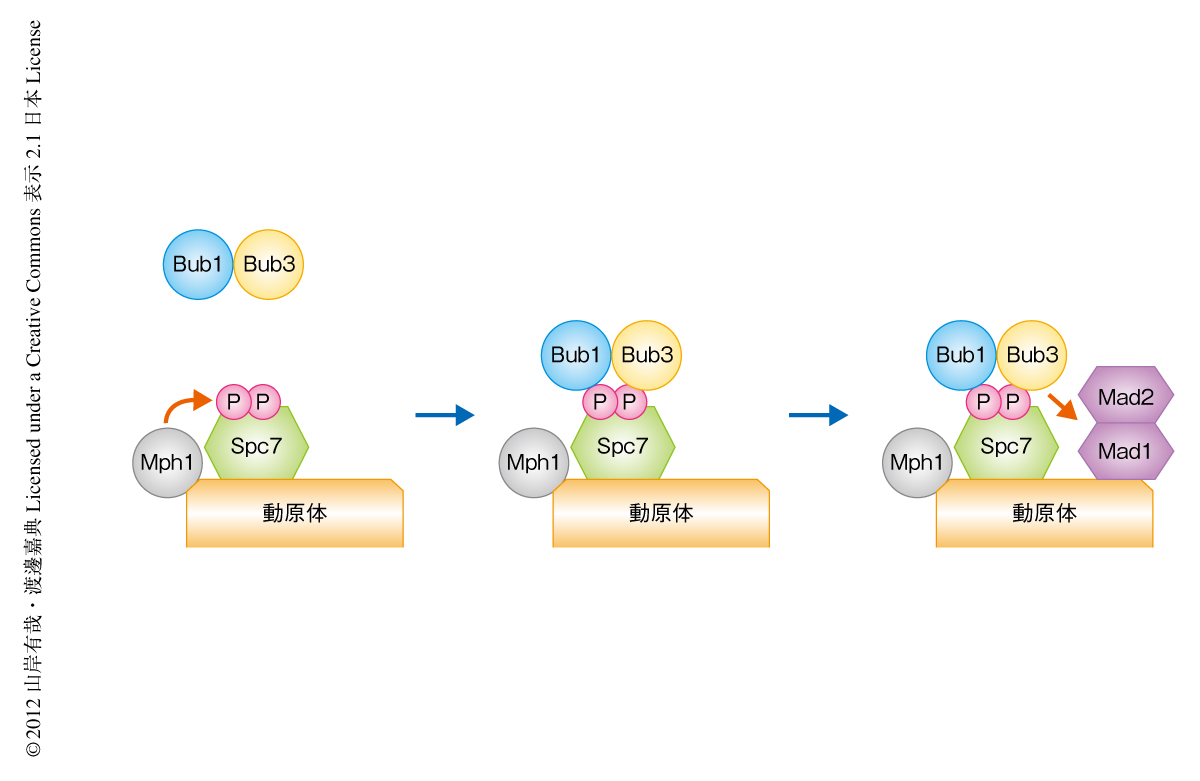
紡錘体形成チェックポイントは染色体数の恒常性を維持するうえで,とくに高等動物にとりきわめて重要な機構である.しかし,かかわるタンパク質が多く,それらタンパク質の動原体への局在化の機構ひとつをとってみても非常に複雑に考えられがちであった.今回の研究により,紡錘体形成チェックポイントタンパク質の動原体への局在化のヒエラルキーについて,少なくとも,分裂酵母においてはその大部分が明らかになった(図2).最上流にMph1が位置し,その下流にBub1-Bub3複合体,さらに下流にMad1-Mad2複合体が存在する.このことをふまえると,今後,明らかにすべきもっとも重要な課題は,最上流に位置するMph1がいかにして微小管に結合していない動原体を認識しそこに局在するのか,ということになるだろう.紡錘体形成チェックポイントにかぎらず,正確な染色体の分配を保証する機構は真核生物に広く保存されていることが多い.したがって,分裂酵母のような遺伝学的な手法の力を存分に利用できるモデル生物を研究に用いるメリットは大きい.その結果が,ヒトを含むより高等な動物の用いている機構を理解するうえで本質的な貢献をすることはまちがいないものと考えられる.
略歴:2011年 東京大学理学系研究科博士課程 修了,同年より東京大学分子細胞生物学研究所 助教.
研究テーマ:セントロメアに局在するタンパク質の機能および局在化の機構.
抱負:2013年から研究分野を神経科学に移す予定.それまでに,紡錘体形成チェックポイントが微小管に結合していない動原体を感知するしくみを解明したい.
渡邊 嘉典(Yoshinori Watanabe)
東京大学分子細胞生物学研究所 教授.
研究室URL:http://www.iam.u-tokyo.ac.jp/watanabe-lab/
© 2012 山岸有哉・渡邊嘉典 Licensed under CC 表示 2.1 日本
(東京大学分子細胞生物学研究所 染色体動態研究分野)
email:山岸有哉
DOI: 10.7875/first.author.2012.078
MPS1/Mph1 phosphorylates the kinetochore protein KNL1/Spc7 to recruit SAC components.
Yuya Yamagishi, Ching-Hui Yang, Yuji Tanno, Yoshinori Watanabe
Nature Cell Biology, 14, 746-752 (2012)
要 約
染色体を正確に娘細胞に分配することはゲノムの恒常性を維持するうえで必須である.そのため,生物は正確な染色体の分配を行うための巧妙な機構をもつ.そのうちのひとつである紡錘体形成チェックポイントは,分裂期において紡錘体微小管に結合していない動原体を感知し分裂後期への移行を阻害する機構である.この紡錘体形成チェックポイントがはたらくことにより,分裂後期に移行するまえにすべての動原体は紡錘体微小管により捉えられていることが保証される.MPS1は酵母からヒトまで真核生物に広く保存されたキナーゼであり,その活性は紡錘体形成チェックポイントの活性化,および,染色体が反対の方向から延びた微小管により捉えられる二方向性結合の確立の両方に必要であることが知られている.しかし,その主要な基質は不明であった.今回,筆者らは,分裂酵母を用いた解析から,MPS1のホモログMph1は動原体タンパク質KNL1のホモログSpc7をリン酸化し,そのリン酸化は紡錘体形成チェックポイントの活性化,および,染色体の二方向性結合の確立の両方に必要であることを示した.また,ヒト培養細胞を用いた解析から,この機構が進化的に保存されたものであることも明らかにした.
はじめに
生物が増殖しさらに子孫を残すためには染色体を正確に分配することが必須である.S期に複製された染色体(姉妹染色分体)はコヒーシンとよばれる糊のようなはたらきをするタンパク質複合体により接着される.分裂期にはいると,それぞれの姉妹染色分体は両極から延びる紡錘体微小管により捉えられ二方向性結合を確立する.最終的にすべての動原体が二方向性結合を確立すると,コヒーシンは切断され姉妹染色分体は両極へと分配される.紡錘体形成チェックポイント(spindle assembly checkpoint:SAC)は微小管に結合していない動原体を感知し分裂後期への移行を阻害する機構である.すべての動原体が微小管により捉えられたときのみ紡錘体形成チェックポイントは不活性化され,細胞は分裂後期へと移行することができる1)(図1).
紡錘体形成チェックポイントの活性化にはたらく進化的に保存されたタンパク質Bub1,Bub3,Mad1,Mad2,Mad3/BubR1,MPS1/Mph1は,微小管に結合していない動原体に局在することが知られている.これらタンパク質の動原体への局在は紡錘体形成チェックポイントの活性化に必須であると考えられているが,その局在がどのようにして起こるのかについては不明な点が多い.なかでもMPS1/Mph1については,そのキナーゼ活性が知られているほかの紡錘体形成チェックポイントタンパク質すべての動原体への局在に必要であり2),紡錘体形成チェックポイントの活性化の最上流に位置するタンパク質と考えられている.しかし,MPS1/Mph1が紡錘体形成チェックポイントの活性化にはたらくという最初の報告3) から15年以上のあいだ,その主要なリン酸化の基質は同定されていなかった.また,同じく進化的に保存されたキナーゼであるBub1は,細胞周期をつうじBub3と複合体を形成し,分裂期には微小管と結合していない動原体へと局在化する.Bub1はMad1およびMad2の動原体への局在に必要であることが示されており,紡錘体形成チェックポイントの活性化においてMPS1/Mph1についで上流で機能していると考えられる4).さらに,Bub1はMPS1/Mph1と同様に,紡錘体形成チェックポイントの活性化のみならず染色体の二方向性結合の確立にも寄与していることが知られている.しかし,Bub1-Bub3複合体がどのようにして動原体に局在するのか,その分子機構は不明であった.
今回の研究において,筆者らは,MPS1/Mph1が動原体タンパク質であるKNL1/Spc7をリン酸化し,Bub1-Bub3複合体とKNL1/Spc7との結合を促進することでBub1-Bub3を動原体へと局在化させることを発見した.このKNL1/Spc7のリン酸化は,紡錘体形成チェックポイントの活性化,および,染色体の二方向性結合の確立の両方に必要であった.これらのことから,いままで不明であったMPS1/Mph1の進化的に保存された主要な基質はKNL1/Spc7であることが明らかになった.
1.Bub1の動原体への局在に必要な進化的に保存された3つのタンパク質
筆者らはこれまで,おもにBub1とその下流において染色体の分配を制御するShugoshinの機能解析を行ってきた5).そこで,Bub1が動原体に局在する分子機構に興味をもち,遺伝学的な手法の行いやすい分裂酵母を用いて解析を行うことにした.Bub1の動原体への局在化の機構に関しては,ヒト培養細胞などを用いた解析から3つの保存されたタンパク質の必要であることがわかっていた.ひとつはBub1と複合体を形成するBub3,もうひとつは紡錘体形成チェックポイントタンパク質であるMPS1/Mph1,そして最後に動原体タンパク質であるKNL1/Spc7(ヒトではBlinkinともよばれる)である6-8).これまでの報告により,KNL1がBub1のもつTPR(tetratrichopeptide repeat)とよばれるに配列に直接に結合することでBub1を動原体へと局在化させるというモデルが提唱されていたが8,9),最近,このTPR配列はBub1の動原体への局在に必要ないという結果も報告され,混沌とした状態になっていた10).
そこで,分裂酵母においてもBub3,Mph1のホモログであるMPS1,KNL1のホモログであるSpc7が分裂期におけるBub1の動原体への局在に必要であるかどうかを検討したところ,これらの3つのタンパク質は分裂酵母においても必要であることが明らかになった.また,bub1破壊株においてはMph1の動原体への局在は正常であったことから,Mph1はBub1の上流に位置することがわかった.
2.MPS1/Mph1はKNL1/Spc7のMELTリピート配列をリン酸化する
つぎに,Bub1の動原体への局在に必要なMph1の基質は何かということだが,その候補となるのはBub1,Bub3,Spc7である.Mph1によるin vitroリン酸化アッセイを行ったところ,これらのうちSpc7のみが効率よくリン酸化されることがわかった.in vitroにおけるSpc7のリン酸化部位を決定したところ,少なくとも4箇所がリン酸化部位として同定され,そのうちの3箇所はKNL1/Spc7ファミリーに保存されているMELTリピート(Met-Glu/Asp-Leu/Ile-Ser/Thr)配列11) に位置していた.Spc7のMELTリピート配列およびそれに類似した配列に11箇所あったセリン残基およびスレオニン残基をすべてアラニン残基に置換し,それ以外のリン酸化部位Thr77のアラニン残基への置換とあわせ,12残基を置換した非リン酸化型Spc7変異体を作製した.
この非リン酸化型Spc7変異体はin vitroにおいてMph1によるリン酸化をまったくうけなかった.また,MELTリピート配列にあるリン酸化部位Thr257に対するリン酸化に特異的な抗体を作製しin vivoにおけるリン酸化について調べたところ,この残基は分裂期に特異的にリン酸化されていることがわかった.これらの結果から,Mph1はSpc7のMELTリピート配列をリン酸化することがわかった.また,ヒトMPS1もヒトKNL1のMELTリピート配列およびそれに類似した配列をin vitroにおいてリン酸化し,さらに,そのうちThr875についてはHeLa細胞において分裂期に特異的にMPS1に依存してリン酸化されることもあわせて示された.したがって,KNL1/Spc7は進化的に保存されたMPS1/Mph1の基質であることが明らかになった.
3.MPS1/Mph1はKNL1/Spc7をリン酸化することによりBub1-Bub3複合体を動原体へと局在化させる
Mph1によるSpc7のリン酸化がBub1の動原体への局在にあたえる影響を調べるため,非リン酸化型Spc7変異体,および,それと同じ12残基をグルタミン酸残基へと置換したリン酸化模倣型Spc7変異体を発現する細胞を作製し,Bub1の動原体への局在を観察した.その結果,非リン酸化型Spc7変異体の発現細胞ではmph1破壊株と同様に,分裂期におけるBub1の動原体への局在は完全に失われていた.一方,リン酸化模倣型Spc7変異体の発現細胞では分裂期のみならず間期の細胞においてもBub1の動原体への局在が観察された.しかも,このリン酸化模倣型Spc7変異体の発現細胞におけるBub1の動原体への局在はMph1にまったく依存しないこともわかった.しかし,この局在はBub1のパートナーであるBub3に依存していた.また,これらの細胞においてBub3の動原体への局在を観察したところ,Bub1と同様に非リン酸化型Spc7変異体の発現細胞では動原体への局在が失われ,リン酸化模倣型Spc7変異体の発現細胞ではつねに動原体に局在していた.そして,この動原体への局在はMph1には依存せずBub1に依存するものであった.これらの結果から,Mph1によるSpc7のリン酸化がBub1-Bub3複合体の動原体への局在を促進するという機構が明らかになった.
この機構がヒトにおいても保存されているかどうかを検討するため,HeLa細胞を用いて実験を行った.内在性のKNL1をsiRNAによりノックダウンすると同時に,Spc7と同様に8残基を置換した非リン酸化型KNL1変異体あるいはリン酸化模倣型KNL1変異体を発現させ,分裂期におけるBub1の動原体への局在を観察した.その結果,非リン酸化型KNL1変異体の発現細胞ではBub1の動原体への局在は失われたのに対し,リン酸化模倣型KNL1変異体の発現細胞では野生型KNL1を発現した細胞と同様にBub1の動原体への局在が観察された.これらの結果から,ヒトにおいてもMPS1によるKNL1のリン酸化がBub1の動原体への局在に必要であることがわかった.
一方,以前にBub1とKNL1との相互作用に必要と報告されていたKNL1のKIモチーフ9) について,このモチーフを欠損したKNL1変異体は正常に動原体に局在した.したがって,Bub1のTPR配列は動原体への局在に必要ないという報告10) ともあわせ,以前に提唱されていたBub1のTPR配列とKNL1のKIモチーフとの相互作用はBub1の動原体への局在に必要なく,KNL1はMPS1によりリン酸化されることで,KIモチーフとは異なる領域を介してBub1-Bub3複合体と相互作用することが可能になり,この相互作用によりBub1-Bub3複合体の動原体への局在は促進されると考えられた.
4.MPS1/Mph1によるKNL1/Spc7のリン酸化はBub1-Bub3複合体とSpc7との結合を促進する
MPS1/Mph1によるKNL1/Spc7のリン酸化はどのような機構によりBub1-Bub3複合体の動原体への局在を促進するのであろうか.ひとつの可能性は,このリン酸化がKNL1/Spc7とBub1-Bub3複合体との結合を促進するというものである.この可能性を検討するため,in vitro翻訳系によりBub1,Bub3,非リン酸化型Spc7変異体,リン酸化模倣型Spc7変異体を作製しプルダウンアッセイを行った.その結果,Bub1とBub3は互いに共存するときにのみリン酸化模倣型Spc7変異体と特異的に相互作用した.この相互作用は非リン酸化型Spc7変異体とのあいだにはみられなかった.このことから,Bub1とBub3は複合体として,Mph1によりリン酸化されたSpc7に直接に結合するという分子機構が明らかになった.この結果は,さきに述べたin vivoにおいて局在の制御の関係を調べた結果と一致した.
さらに,ヒトにおいても,HeLa細胞の抽出液を用いた免疫沈降実験によりBub1とKNL1との相互作用が示され,また,細胞培養液にMPS1の阻害剤であるReversineを添加するとBub1の動原体への局在は消失しKNL1との相互作用は失われることがわかった.これらの結果から,Bub1-Bub3複合体がMPS1/Mph11によりリン酸化されたKNL1/Spc7に特異的に結合することで動原体へと局在化する,という進化的に保存されたBub1の動原体への局在化の機構が明らかになった.
5.Mph1に依存的なBub1-Bub3複合体の動原体への局在は紡錘体形成チェックポイントの活性化および染色体の二方向性結合の確立に寄与する
Mph1によるSpc7のリン酸化が紡錘体形成チェックポイントの活性化および染色体の二方向性結合の確立にはたす役割を解析した.αチューブリン変異株を用いて細胞において微小管を形成できない状態にすると,野生型Spc7を発現する細胞は紡錘体形成チェックポイントを活性化し分裂期において停止した.ところが,非リン酸化型Spc7変異体の発現細胞は分裂期において停止できなかった.一方,リン酸化模倣型Spc7変異体の発現細胞は大部分が分裂期において停止した.さらに重要なことに,非リン酸化型Spc7変異体の発現細胞においてBub1を強制的に動原体に局在化させると紡錘体形成チェックポイント活性化の表現型が抑圧された.また,紡錘体形成チェックポイントの活性化に必須なタンパク質であるMad1の動原体への局在について観察したところ,非リン酸化型Spc7変異体の発現細胞ではmph1破壊株やbub1破壊株と同様に,Mad1の動原体への局在は失われていた.これらのことから,Mph1によるSpc7のリン酸化およびそれに依存して起こるBub1の動原体への局在化は,紡錘体形成チェックポイントの活性化に必須であることが明らかになった.
染色体の二方向性結合について解析するため,分裂酵母の第2染色体をGFPで標識してその分配様式を調べた.その結果,非リン酸化型Spc7変異体の発現細胞ではmph1破壊株やbub1破壊株と同様に,姉妹染色体が同一の娘細胞に分配されてしまう染色体の不分離が高頻度で観察された.このことは,非リン酸化型Spc7変異体の発現細胞には染色体の二方向性結合の過程に欠損のあることを示していた.このような染色体の不分離はリン酸化模倣型Spc7変異体の発現細胞ではほとんどみられなかった.以上の結果から,Mph1によるSpc7のリン酸化に依存して起こるBub1-Bub3複合体の動原体への局在化は,紡錘体形成チェックポイントの活性化および染色体の二方向性結合の過程の両方に必要であることが明らかになった.
おわりに
紡錘体形成チェックポイントは染色体数の恒常性を維持するうえで,とくに高等動物にとりきわめて重要な機構である.しかし,かかわるタンパク質が多く,それらタンパク質の動原体への局在化の機構ひとつをとってみても非常に複雑に考えられがちであった.今回の研究により,紡錘体形成チェックポイントタンパク質の動原体への局在化のヒエラルキーについて,少なくとも,分裂酵母においてはその大部分が明らかになった(図2).最上流にMph1が位置し,その下流にBub1-Bub3複合体,さらに下流にMad1-Mad2複合体が存在する.このことをふまえると,今後,明らかにすべきもっとも重要な課題は,最上流に位置するMph1がいかにして微小管に結合していない動原体を認識しそこに局在するのか,ということになるだろう.紡錘体形成チェックポイントにかぎらず,正確な染色体の分配を保証する機構は真核生物に広く保存されていることが多い.したがって,分裂酵母のような遺伝学的な手法の力を存分に利用できるモデル生物を研究に用いるメリットは大きい.その結果が,ヒトを含むより高等な動物の用いている機構を理解するうえで本質的な貢献をすることはまちがいないものと考えられる.
文 献
- Musacchio, A. & Salmon, E. D.: The spindle-assembly checkpoint in space and time. Nat. Rev. Mol. Cell Biol., 8, 379-393 (2007)[PubMed]
- Sliedrecht, T., Zhang, C., Shokat, K. M. et al.: Chemical genetic inhibition of Mps1 in stable human cell lines reveals novel aspects of Mps1 function in mitosis. PLoS One, 5, e10251 (2010)[PubMed]
- Weiss, E. & Winey, M.: The Saccharomyces cerevisiae spindle pole body duplication gene MPS1 is part of a mitotic checkpoint. J. Cell Biol., 132, 111-123 (1996)[PubMed]
- Sharp-Baker, H. & Chen, R. H.: Spindle checkpoint protein Bub1 is required for kinetochore localization of Mad1, Mad2, Bub3, and CENP-E, independently of its kinase activity. J. Cell Biol., 153, 1239-1250 (2001)[PubMed]
- Kawashima, S. A., Yamagishi, Y., Honda, T. et al.: Phosphorylation of H2A by Bub1 prevents chromosomal instability through localizing shugoshin. Science, 327, 172-177 (2010)[PubMed]
- Taylor, S. S., Ha, E. & McKeon, F.: The human homologue of Bub3 is required for kinetochore localization of Bub1 and a Mad3/Bub1-related protein kinase. J. Cell Biol., 142, 1-11 (1998)[PubMed]
- Maciejowski, J., George, K. A., Terret, M. E. et al.: Mps1 directs the assembly of Cdc20 inhibitory complexes during interphase and mitosis to control M phase timing and spindle checkpoint signaling. J. Cell Biol., 190, 89-100 (2010)[PubMed]
- Kiyomitsu, T., Obuse, C. & Yanagida, M.: Human Blinkin/AF15q14 is required for chromosome alignment and the mitotic checkpoint through direct interaction with Bub1 and BubR1. Dev. Cell, 13, 663-769 (2007)[PubMed]
- Kiyomitsu, T., Murakami, H. & Yanagida, M.: Protein interaction domain mapping of human kinetochore protein Blinkin reveals a consensus motif for binding of spindle assembly checkpoint proteins Bub1 and BubR1. Mol. Cell. Biol., 31, 998-1011 (2011)[PubMed]
- Krenn, V., Wehenkel, A., Li, X. et al.: Structural analysis reveals features of the spindle checkpoint kinase Bub1-kinetochore subunit Knl1 interaction. J. Cell Biol., 196, 451-467 (2012)[PubMed]
- Cheeseman, I. M., Niessen, S., Anderson, S. et al.: A conserved protein network controls assembly of the outer kinetochore and its ability to sustain tension. Genes Dev., 18, 2255-2268 (2004)[PubMed]
著者プロフィール
略歴:2011年 東京大学理学系研究科博士課程 修了,同年より東京大学分子細胞生物学研究所 助教.
研究テーマ:セントロメアに局在するタンパク質の機能および局在化の機構.
抱負:2013年から研究分野を神経科学に移す予定.それまでに,紡錘体形成チェックポイントが微小管に結合していない動原体を感知するしくみを解明したい.
渡邊 嘉典(Yoshinori Watanabe)
東京大学分子細胞生物学研究所 教授.
研究室URL:http://www.iam.u-tokyo.ac.jp/watanabe-lab/
© 2012 山岸有哉・渡邊嘉典 Licensed under CC 表示 2.1 日本