背側大動脈は交感神経および副腎髄質の前駆細胞の移動と分化を制御する司令塔としてはたらく
齋藤大介1・高橋淑子2
(1奈良先端科学技術大学院大学バイオサイエンス研究科 分子発生生物学研究室,2京都大学大学院理学研究科 生物科学専攻発生ゲノム科学研究室)
email:齋藤大介,高橋淑子
DOI: 10.7875/first.author.2012.077
The dorsal aorta initiates a molecular cascade that instructs sympatho-adrenal specification.
Daisuke Saito, Yuta Takase, Hidetaka Murai, Yoshiko Takahashi
Science, 336, 1578-1581 (2012)
自律神経系に属する交感神経と副腎髄質は神経堤細胞に由来する.筆者らは,ニワトリの胚における血管に特異的な遺伝子操作法とマウスにおける遺伝学的な手法とを駆使することで,発生においてどのようにして神経堤細胞から交感神経と副腎髄質の細胞系譜が生み出されるのかについて明らかにした.その内容は,胚において最初に形成される動脈である背側大動脈が,神経堤細胞の移動とそののちの細胞系譜の分岐を制御するシグナルセンターとして機能するというものであった.具体的には,背側大動脈から分泌されるBMPが周辺の間充織に対しSDF1とNrg1の発現を誘導し,この2つのタンパク質のもつ誘引タンパク質としての活性により神経堤細胞がガイドされる.つぎの段階では,BMPシグナルは交感神経と副腎髄質との細胞系譜の分岐に直接にかかわる.これらの知見は,昨今,注目されている神経と血管との相互作用の研究に新しい視点をもたらすものである.
自律神経系は体内における恒常性の維持やストレス防御を行ううえで非常に重要な役割をはたしており,その異常はさまざまな疾患をひき起こす.しかしながら,発生において自律神経系がどのように形成されるのかについてはほとんどわかっていなかった.
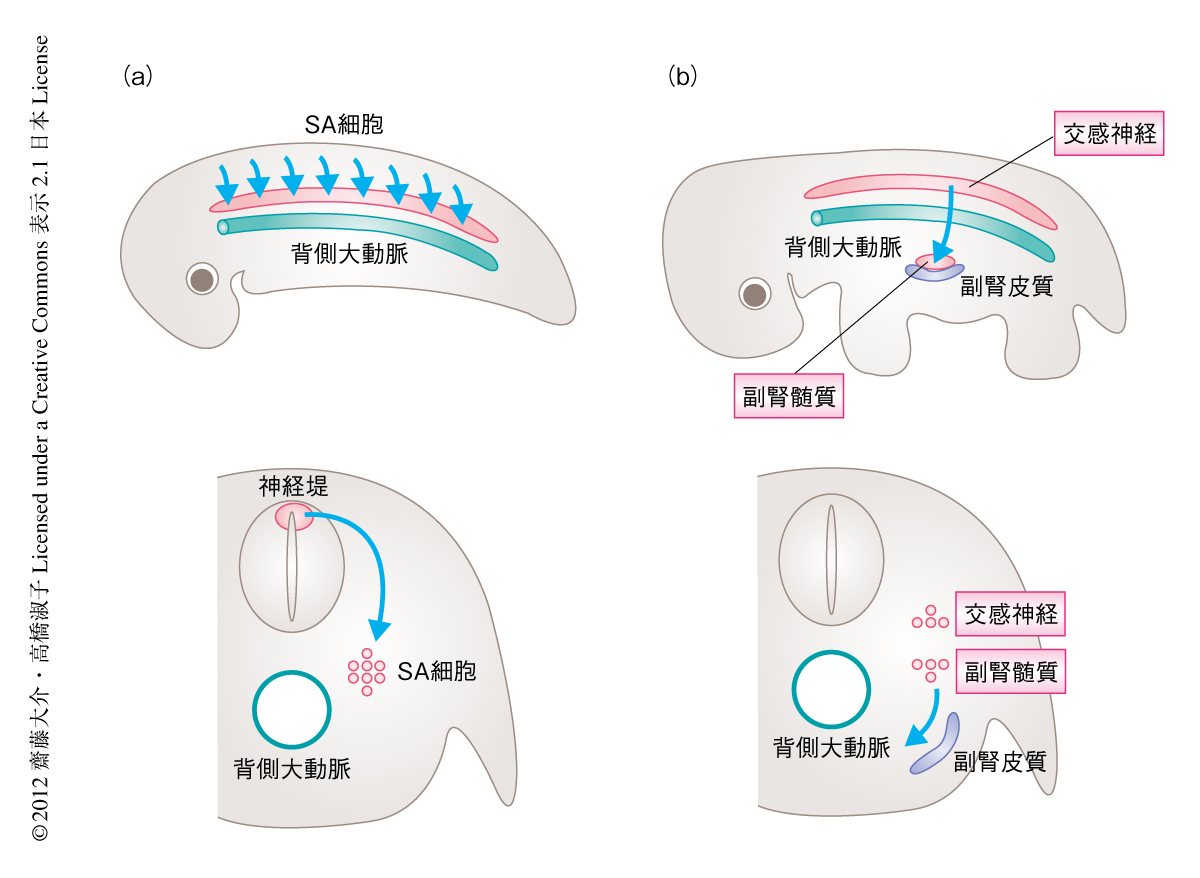
自律神経系は,交感神経,副交感神経,および,副腎から構成される.なかでも,交感神経と副腎を構成する副腎髄質は体幹部の神経堤細胞に由来する.神経堤細胞は発生の初期にのみみられる前駆細胞であり,神経管の背側に生まれたのち胚の内部を移動し,移動したさきで神経,神経の支持細胞,色素細胞などさまざまな細胞に分化する.過去の知見から,交感神経と副腎髄質は神経堤細胞の細胞系譜のなかでもとくに近い細胞種であり,その共通の祖先細胞は交感神経-副腎髄質前駆細胞(sympatho-adrenal progenitor cell)とよばれる.まず,交感神経-副腎髄質前駆細胞は神経管の背側から背側大動脈の付近まで集団として移動する.つぎに,一部の交感神経-副腎髄質前駆細胞は背側大動脈にそってさらに腹側に移動しのちに副腎髄質を形成する一方で,その場にとどまりつづけた交感神経-副腎髄質前駆細胞はのちに交感神経に分化する(図1).交感神経(前駆細胞)と副腎髄質(前駆細胞)の示すこのような挙動から,背側大動脈がこれら細胞の移動や細胞系譜の分岐になんらかの役割をはたしていることが予想されていたものの,その内容についてはほとんどわかっていなかった.ひとつの大きな理由として,同一の胚において背側大動脈と交感神経-副腎髄質前駆細胞の操作を同時に行うことがむずかしいという技術的な原因があげられる.筆者らは,革新的な技術を用いることにより,背側大動脈が交感神経-副腎髄質前駆細胞の移動およびそののちの交感神経と副腎髄質との分岐を主導する司令塔としてはたらくこと,さらには,BMP(bone morphogenetic protein)がこれらのイベントに中心的な役割をはたすことを明らかにした.
交感神経-副腎髄質前駆細胞の分化や移動には,分泌タンパク質であるBMP,SDF1(Stromal cell-derived factor-1),および,Nrg1(Neuregulin 1)のかかわることがそれぞれ別々に報告されていた1-3).しかしながら,これらのタンパク質と背側大動脈との関連性は不明であったので,はじめにこれらの発現解析と機能解析を行った.BMPのうちBMP4およびBMP7は背側大動脈において発現が認められた.また,BMPシグナルが活性化されている領域は背側大動脈から同心円状に広がっており,交感神経-副腎髄質前駆細胞の集団もそのなかに含まれていた.そこで,交感神経-副腎髄質前駆細胞が背側大動脈に移動するのにBMPシグナルは必要かどうかを調べるため,BMPのリガンドに対するアンタゴニストであるNogginをニワトリの胚の背側大動脈にトランスフェクション法により強制発現させることで,背側大動脈の周辺におけるBMPシグナルの阻害実験を行った.この阻害により交感神経-副腎髄質前駆細胞は背側大動脈までたどりつくことができなかったことから,この移動におけるBMPシグナルの必要性が示された.しかしながら,交感神経-副腎髄質前駆細胞の移動にこの細胞それ自体におけるBMPシグナルの活性化は必要でないことや,BMPのリガンドは交感神経-副腎髄質前駆細胞の誘引タンパク質ではないこともわかった.それでは,BMPは交感神経-副腎髄質前駆細胞の移動にどのように寄与しているのだろうか?
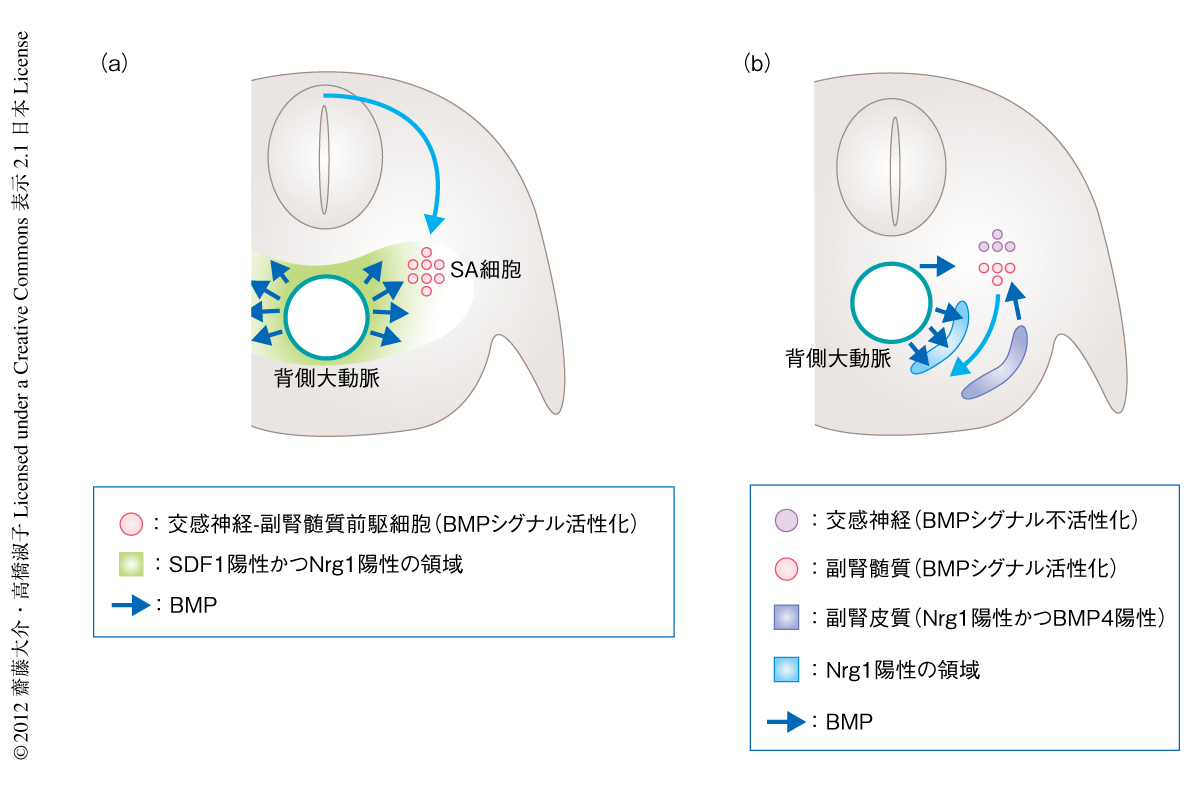
その答えは,SDF1とNrg1の役割を調べる過程で明らかになった.in vivoにおいてSDF1やNrg1を異所的に発現させる実験や,in vitroにおける細胞移動アッセイから,SDF1とNrg1が交感神経-副腎髄質前駆細胞の誘引タンパク質であることがわかったのである.SDF1とNrg1の発現はどちらも背側大動脈それ自体ではなく,その周辺の間充織においてみられた.Nogginにより背側大動脈の周辺のBMPシグナルを阻害することによりSDF1およびNrg1の発現は消失したことから,これら誘引タンパク質の発現は背側大動脈からのBMPにより担われていることが明らかになった.つまり,背側大動脈からのシグナル(BMPシグナルを含む)によりその周辺にSDF1とNrg1の発現が誘導され,この2つの誘引タンパク質により交感神経-副腎髄質前駆細胞がガイドされていると考えられた(図2a).
交感神経-副腎髄質前駆細胞から交感神経と副腎髄質の細胞系譜が分岐する分子機構について調べた.背側大動脈の付近までたどりついてまもない交感神経-副腎髄質前駆細胞ではBMPシグナルは活性化しているが,その12時間のちにすべての交感神経-副腎髄質前駆細胞においてBMPシグナルの活性化は認められなくなった.さらに12時間のちにBMPシグナルは再活性化されたが,このとき,副腎髄質となる細胞でのみこの再活性化は認められた.このBMPシグナルの再活性化の差が交感神経と副腎髄質との分岐をひき起こしているのかどうかを調べるため,交感神経-副腎髄質前駆細胞においてBMP受容体のドミナントネガティブ型変異体を発現させBMPシグナルを遮断したところ,この細胞は副腎髄質となる細胞の集団に参加できなくなった.このことから,BMPシグナルは交感神経と副腎髄質との分岐に必須であるといえた.
交感神経と副腎髄質との分岐の起こる時期に少しさきんじて,Nrg1は副腎髄質となる細胞を包み込むかのようにその左右および移動先において発現し,まさに副腎髄質となる細胞の通り道をつくっているかのようにみえた.このNrg1シグナルが副腎髄質の分岐に必要かどうかを検証するため,Nrg1の受容体であるErbBのドミナントネガティブ型変異体を交感神経-副腎髄質前駆細胞に発現させてその挙動を解析した.その結果,Nrg1シグナルを遮断された交感神経-副腎髄質前駆細胞は副腎髄質となる細胞の集団に参加できなかったことから,Nrg1シグナルも交感神経と副腎髄質との分岐に必要であることが示された.
しかしながら,副腎髄質の形成に関して,BMPとNrg1は異なる役割をはたしていることがわかった.つまり,BMPシグナルは,作用機序の詳細はまだわからないものの副腎髄質となる細胞において自律的にはたらき副腎髄質を分岐させる役割と,背側大動脈の周辺にはたらきかけてNrg1の発現を確立させる役割をもつ一方で,Nrg1は副腎髄質となる細胞の誘引タンパク質としての役割をはたしていた(図2b).
副腎髄質はのちに副腎皮質と会合して副腎を形成することから,副腎髄質と副腎皮質とのあいだにはなんらかの相互作用があるだろうと予想されていた4-6).たしかに,副腎皮質を欠失する転写因子Sf1のノックアウトマウスの胚では7),副腎の予定域に存在する副腎髄質の細胞の数が正常な胚と比べ約半数に減る8).それでは,副腎皮質は副腎髄質の形態形成に関してどのようにはたらいているのだろうか? また,なぜ半数の副腎髄質の細胞は副腎皮質がなくても存在できるのだろうか? これらの疑問に対するひとつの解釈が,Nrg1は副腎髄質の誘引タンパク質として機能するというさきに述べた知見と,以下のNrg1の発現解析から導きだされた.さきにNrg1は副腎髄質の左右に発現していると述べたが,その左右の組織の一方は背側大動脈の側の間充織,もう一方は,なんと副腎皮質であった.予想したとおり,Sf1ノックアウトマウスにおいては副腎皮質のあるべき領域でのNrg1の発現は消失するものの,背側大動脈の側の間充織での発現にまったく変化はなかった.この結果は,Sf1ノックアウトマウスでも副腎髄質が残存しているという事実を説明しうる.すなわち,副腎皮質のNrg1がなくても背側大動脈の側のNrg1が副腎髄質を誘引しているのである.正常な発生においては,背側大動脈の側と副腎皮質の側で発現するNrg1により副腎髄質は誘引されていると考えられた(図2b)
今回,筆者らは,交感神経系と副腎の形成にかかわる分子機構を細胞レベルおよび分子レベルにおいて明らかにした.そこでは,背側大動脈が主役となっており,交感神経-副腎髄質前駆細胞の背側大動脈までの移動,交感神経と副腎髄質の細胞系譜の分岐,および,副腎髄質の移動までも制御していた.背側大動脈に時空間的に制御されるかたちで複数のタンパク質がくり返し使われていることや,交感神経-副腎髄質前駆細胞の細胞系譜に属する細胞がさまざまなタンパク質に対する反応性を時々刻々と変化させていることがみえてきた.
この研究から,交感神経系が形成されるためにはBMPがきわめて中心的な役割をもつことが証明された.iPS細胞から交感神経や副腎をつくったという報告はまだない.今後の細胞工学や細胞治療,そして,自律神経失調症の治療にむけ,BMPは注目されるべきタンパク質となるだろう.また,自律神経にかかわる血管の作用も明らかになったことから,循環器系の治療と自律神経失調症とのかかわりについても大いに期待される.
略歴:2002年 東北大学大学院理学研究科 修了,同年 理化学研究所発生・再生総合科学研究センター 研究員を経て,2004年より奈良先端科学技術大学院大学バイオサイエンス研究科 助手(現 助教).
研究テーマ:動物の形態形成をささえる細胞移動の分子機構.
高橋 淑子(Yoshiko Takahashi)
京都大学大学院理学研究科 教授.
© 2012 齋藤大介・高橋淑子 Licensed under CC 表示 2.1 日本
(1奈良先端科学技術大学院大学バイオサイエンス研究科 分子発生生物学研究室,2京都大学大学院理学研究科 生物科学専攻発生ゲノム科学研究室)
email:齋藤大介,高橋淑子
DOI: 10.7875/first.author.2012.077
The dorsal aorta initiates a molecular cascade that instructs sympatho-adrenal specification.
Daisuke Saito, Yuta Takase, Hidetaka Murai, Yoshiko Takahashi
Science, 336, 1578-1581 (2012)
要 約
自律神経系に属する交感神経と副腎髄質は神経堤細胞に由来する.筆者らは,ニワトリの胚における血管に特異的な遺伝子操作法とマウスにおける遺伝学的な手法とを駆使することで,発生においてどのようにして神経堤細胞から交感神経と副腎髄質の細胞系譜が生み出されるのかについて明らかにした.その内容は,胚において最初に形成される動脈である背側大動脈が,神経堤細胞の移動とそののちの細胞系譜の分岐を制御するシグナルセンターとして機能するというものであった.具体的には,背側大動脈から分泌されるBMPが周辺の間充織に対しSDF1とNrg1の発現を誘導し,この2つのタンパク質のもつ誘引タンパク質としての活性により神経堤細胞がガイドされる.つぎの段階では,BMPシグナルは交感神経と副腎髄質との細胞系譜の分岐に直接にかかわる.これらの知見は,昨今,注目されている神経と血管との相互作用の研究に新しい視点をもたらすものである.
はじめに
自律神経系は体内における恒常性の維持やストレス防御を行ううえで非常に重要な役割をはたしており,その異常はさまざまな疾患をひき起こす.しかしながら,発生において自律神経系がどのように形成されるのかについてはほとんどわかっていなかった.
自律神経系は,交感神経,副交感神経,および,副腎から構成される.なかでも,交感神経と副腎を構成する副腎髄質は体幹部の神経堤細胞に由来する.神経堤細胞は発生の初期にのみみられる前駆細胞であり,神経管の背側に生まれたのち胚の内部を移動し,移動したさきで神経,神経の支持細胞,色素細胞などさまざまな細胞に分化する.過去の知見から,交感神経と副腎髄質は神経堤細胞の細胞系譜のなかでもとくに近い細胞種であり,その共通の祖先細胞は交感神経-副腎髄質前駆細胞(sympatho-adrenal progenitor cell)とよばれる.まず,交感神経-副腎髄質前駆細胞は神経管の背側から背側大動脈の付近まで集団として移動する.つぎに,一部の交感神経-副腎髄質前駆細胞は背側大動脈にそってさらに腹側に移動しのちに副腎髄質を形成する一方で,その場にとどまりつづけた交感神経-副腎髄質前駆細胞はのちに交感神経に分化する(図1).交感神経(前駆細胞)と副腎髄質(前駆細胞)の示すこのような挙動から,背側大動脈がこれら細胞の移動や細胞系譜の分岐になんらかの役割をはたしていることが予想されていたものの,その内容についてはほとんどわかっていなかった.ひとつの大きな理由として,同一の胚において背側大動脈と交感神経-副腎髄質前駆細胞の操作を同時に行うことがむずかしいという技術的な原因があげられる.筆者らは,革新的な技術を用いることにより,背側大動脈が交感神経-副腎髄質前駆細胞の移動およびそののちの交感神経と副腎髄質との分岐を主導する司令塔としてはたらくこと,さらには,BMP(bone morphogenetic protein)がこれらのイベントに中心的な役割をはたすことを明らかにした.
1.交感神経-副腎髄質前駆細胞の誘引タンパク質はSDF1とNrg1であり背側大動脈から分泌されるBMPはそれらの発現制御を担う
交感神経-副腎髄質前駆細胞の分化や移動には,分泌タンパク質であるBMP,SDF1(Stromal cell-derived factor-1),および,Nrg1(Neuregulin 1)のかかわることがそれぞれ別々に報告されていた1-3).しかしながら,これらのタンパク質と背側大動脈との関連性は不明であったので,はじめにこれらの発現解析と機能解析を行った.BMPのうちBMP4およびBMP7は背側大動脈において発現が認められた.また,BMPシグナルが活性化されている領域は背側大動脈から同心円状に広がっており,交感神経-副腎髄質前駆細胞の集団もそのなかに含まれていた.そこで,交感神経-副腎髄質前駆細胞が背側大動脈に移動するのにBMPシグナルは必要かどうかを調べるため,BMPのリガンドに対するアンタゴニストであるNogginをニワトリの胚の背側大動脈にトランスフェクション法により強制発現させることで,背側大動脈の周辺におけるBMPシグナルの阻害実験を行った.この阻害により交感神経-副腎髄質前駆細胞は背側大動脈までたどりつくことができなかったことから,この移動におけるBMPシグナルの必要性が示された.しかしながら,交感神経-副腎髄質前駆細胞の移動にこの細胞それ自体におけるBMPシグナルの活性化は必要でないことや,BMPのリガンドは交感神経-副腎髄質前駆細胞の誘引タンパク質ではないこともわかった.それでは,BMPは交感神経-副腎髄質前駆細胞の移動にどのように寄与しているのだろうか?
その答えは,SDF1とNrg1の役割を調べる過程で明らかになった.in vivoにおいてSDF1やNrg1を異所的に発現させる実験や,in vitroにおける細胞移動アッセイから,SDF1とNrg1が交感神経-副腎髄質前駆細胞の誘引タンパク質であることがわかったのである.SDF1とNrg1の発現はどちらも背側大動脈それ自体ではなく,その周辺の間充織においてみられた.Nogginにより背側大動脈の周辺のBMPシグナルを阻害することによりSDF1およびNrg1の発現は消失したことから,これら誘引タンパク質の発現は背側大動脈からのBMPにより担われていることが明らかになった.つまり,背側大動脈からのシグナル(BMPシグナルを含む)によりその周辺にSDF1とNrg1の発現が誘導され,この2つの誘引タンパク質により交感神経-副腎髄質前駆細胞がガイドされていると考えられた(図2a).
2.BMPとNeg1は交感神経と副腎髄質の細胞系譜の分岐にかかわる
交感神経-副腎髄質前駆細胞から交感神経と副腎髄質の細胞系譜が分岐する分子機構について調べた.背側大動脈の付近までたどりついてまもない交感神経-副腎髄質前駆細胞ではBMPシグナルは活性化しているが,その12時間のちにすべての交感神経-副腎髄質前駆細胞においてBMPシグナルの活性化は認められなくなった.さらに12時間のちにBMPシグナルは再活性化されたが,このとき,副腎髄質となる細胞でのみこの再活性化は認められた.このBMPシグナルの再活性化の差が交感神経と副腎髄質との分岐をひき起こしているのかどうかを調べるため,交感神経-副腎髄質前駆細胞においてBMP受容体のドミナントネガティブ型変異体を発現させBMPシグナルを遮断したところ,この細胞は副腎髄質となる細胞の集団に参加できなくなった.このことから,BMPシグナルは交感神経と副腎髄質との分岐に必須であるといえた.
交感神経と副腎髄質との分岐の起こる時期に少しさきんじて,Nrg1は副腎髄質となる細胞を包み込むかのようにその左右および移動先において発現し,まさに副腎髄質となる細胞の通り道をつくっているかのようにみえた.このNrg1シグナルが副腎髄質の分岐に必要かどうかを検証するため,Nrg1の受容体であるErbBのドミナントネガティブ型変異体を交感神経-副腎髄質前駆細胞に発現させてその挙動を解析した.その結果,Nrg1シグナルを遮断された交感神経-副腎髄質前駆細胞は副腎髄質となる細胞の集団に参加できなかったことから,Nrg1シグナルも交感神経と副腎髄質との分岐に必要であることが示された.
しかしながら,副腎髄質の形成に関して,BMPとNrg1は異なる役割をはたしていることがわかった.つまり,BMPシグナルは,作用機序の詳細はまだわからないものの副腎髄質となる細胞において自律的にはたらき副腎髄質を分岐させる役割と,背側大動脈の周辺にはたらきかけてNrg1の発現を確立させる役割をもつ一方で,Nrg1は副腎髄質となる細胞の誘引タンパク質としての役割をはたしていた(図2b).
3.副腎髄質となる細胞は由来の異なる2つのNrg1陽性の領域により誘引される
副腎髄質はのちに副腎皮質と会合して副腎を形成することから,副腎髄質と副腎皮質とのあいだにはなんらかの相互作用があるだろうと予想されていた4-6).たしかに,副腎皮質を欠失する転写因子Sf1のノックアウトマウスの胚では7),副腎の予定域に存在する副腎髄質の細胞の数が正常な胚と比べ約半数に減る8).それでは,副腎皮質は副腎髄質の形態形成に関してどのようにはたらいているのだろうか? また,なぜ半数の副腎髄質の細胞は副腎皮質がなくても存在できるのだろうか? これらの疑問に対するひとつの解釈が,Nrg1は副腎髄質の誘引タンパク質として機能するというさきに述べた知見と,以下のNrg1の発現解析から導きだされた.さきにNrg1は副腎髄質の左右に発現していると述べたが,その左右の組織の一方は背側大動脈の側の間充織,もう一方は,なんと副腎皮質であった.予想したとおり,Sf1ノックアウトマウスにおいては副腎皮質のあるべき領域でのNrg1の発現は消失するものの,背側大動脈の側の間充織での発現にまったく変化はなかった.この結果は,Sf1ノックアウトマウスでも副腎髄質が残存しているという事実を説明しうる.すなわち,副腎皮質のNrg1がなくても背側大動脈の側のNrg1が副腎髄質を誘引しているのである.正常な発生においては,背側大動脈の側と副腎皮質の側で発現するNrg1により副腎髄質は誘引されていると考えられた(図2b)
おわりに
今回,筆者らは,交感神経系と副腎の形成にかかわる分子機構を細胞レベルおよび分子レベルにおいて明らかにした.そこでは,背側大動脈が主役となっており,交感神経-副腎髄質前駆細胞の背側大動脈までの移動,交感神経と副腎髄質の細胞系譜の分岐,および,副腎髄質の移動までも制御していた.背側大動脈に時空間的に制御されるかたちで複数のタンパク質がくり返し使われていることや,交感神経-副腎髄質前駆細胞の細胞系譜に属する細胞がさまざまなタンパク質に対する反応性を時々刻々と変化させていることがみえてきた.
この研究から,交感神経系が形成されるためにはBMPがきわめて中心的な役割をもつことが証明された.iPS細胞から交感神経や副腎をつくったという報告はまだない.今後の細胞工学や細胞治療,そして,自律神経失調症の治療にむけ,BMPは注目されるべきタンパク質となるだろう.また,自律神経にかかわる血管の作用も明らかになったことから,循環器系の治療と自律神経失調症とのかかわりについても大いに期待される.
文 献
- Reissmann, E., Ernsberger, U., Francis-West, P. H. et al.: Involvement of bone morphogenetic protein-4 and bone morphogenetic protein-7 in the differentiation of the adrenergic phenotype in developing sympathetic neurons. Development, 122, 2079-2088 (1996)[PubMed]
- Kasemeier-Kulesa, J. C., McLennan, R., Romine, M. H. et al.: CXCR4 controls ventral migration of sympathetic precursor cells. J. Neurosci., 30, 13078-13088 (2010)[PubMed]
- Britsch, S., Li, L., Kirchhoff, S. et al.: The ErbB2 and ErbB3 receptors and their ligand, neuregulin-1, are essential for development of the sympathetic nervous system. Genes Dev., 12, 1825-1836 (1998)[PubMed]
- Anderson, D. J. & Axel, R.: A bipotential neuroendocrine precursor whose choice of cell fate is determined by NGF and glucocorticoids. Cell, 47, 1079-1090 (1986)[PubMed]
- Doupe, A. J., Landis, S. C. & Patterson, P. H.: Environmental influences in the development of neural crest derivatives: glucocorticoids, growth factors, and chromaffin cell plasticity. J. Neurosci., 5, 2119-2142 (1985)[PubMed]
- Unsicker, K., Krisch, B., Otten, U. et al.: Nerve growth factor-induced fiber outgrowth from isolated rat adrenal chromaffin cells: impairment by glucocorticoids. Proc. Natl. Acad. Sci. USA, 75, 3498-3502 (1978)[PubMed]
- Luo, X., Ikeda, Y. & Parker, K. L.: A cell-specific nuclear receptor is essential for adrenal and gonadal development and sexual differentiation. Cell, 77, 481-490 (1994)[PubMed]
- Gut, P., Huber, K., Lohr, J. et al.: Lack of an adrenal cortex in Sf1 mutant mice is compatible with the generation and differentiation of chromaffin cells. Development, 132, 4611-4619 (2005)[PubMed]
著者プロフィール
略歴:2002年 東北大学大学院理学研究科 修了,同年 理化学研究所発生・再生総合科学研究センター 研究員を経て,2004年より奈良先端科学技術大学院大学バイオサイエンス研究科 助手(現 助教).
研究テーマ:動物の形態形成をささえる細胞移動の分子機構.
高橋 淑子(Yoshiko Takahashi)
京都大学大学院理学研究科 教授.
© 2012 齋藤大介・高橋淑子 Licensed under CC 表示 2.1 日本