母性因子PGC7はヒストンH3の9番目のリジン残基のジメチル化との結合を介し受精卵における5-メチルシトシンから5-ヒドロキシルメチルシトシンへの変換を阻害する
中村肇伸・仲野 徹
(大阪大学大学院医学系研究科 幹細胞病理学)
email:中村肇伸,仲野 徹
DOI: 10.7875/first.author.2012.074
PGC7 binds histone H3K9me2 to protect against conversion of 5mC to 5hmC in early embryos.
Toshinobu Nakamura, Yu-Jung Liu, Hiroyuki Nakashima, Hiroki Umehara, Kimiko Inoue, Shogo Matoba, Makoto Tachibana, Atsuo Ogura, Yoichi Shinkai, Toru Nakano
Nature, 486, 415-419 (2012)
5-メチルシトシンによるDNA修飾はエピジェネティックな遺伝子の発現制御に重要な役割をはたしている.5-メチルシトシンはメチルシトシンデオキシナーゼTetにより5-ヒドロキシルメチルシトシンという別のDNA修飾へと変換されうる.また,ゲノムにおける5-ヒドロキシルメチルシトシンと5-メチルシトシンとのバランスは多能性や細胞系譜の運命決定と密接に関係している.母性因子であるPGC7は,初期発生において5-メチルシトシンから5-ヒドロキシルメチルシトシンへの変換から雌性ゲノムを保護することが報告されている.今回,筆者らは,PGC7がヒストンH3の9番目のリジン残基のジメチル化を介して雌性クロマチンと結合し,これをTet3による5-メチルシトシンから5-ヒドロキシルメチルシトシンへの変換から保護することを見い出した.さらに,成熟した精子において,ヒストンH3の9番目のリジン残基のジメチル化の存在するインプリント遺伝子の制御領域にある5-メチルシトシンも,PGC7との結合により保護されていた.このような制御機構は,初期胚と同様に体細胞においてもDNA修飾に関与していることが考えられた.
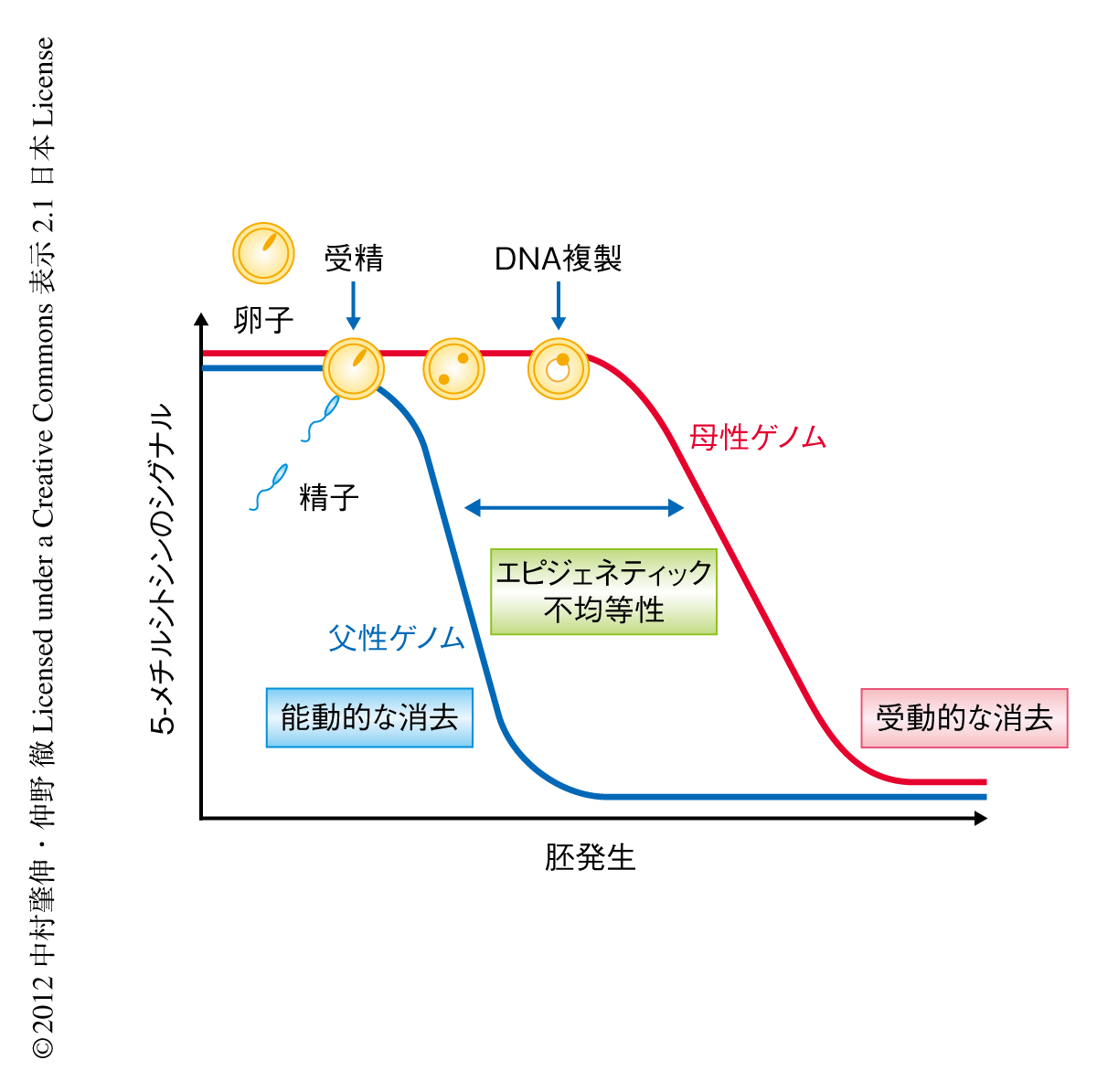
哺乳類では受精ののちゲノム全体の5-メチルシトシン(5mC)は消去されるが,精子に由来する雄性ゲノムと卵子に由来する雌性ゲノムでは5mCの消去のタイミングが異なる.雄性ゲノムのもつ5mCはDNA複製よりもまえに能動的に消去されるのに対し,雌性ゲノムの5mCはDNA複製にともない受動的に消去される.5mCが雌性ゲノムだけで能動的に消去されるため,受精卵においてゲノムの5mCの状態は不均等になる(図1).これは,初期発生における“エピジェネティック不均等性”とよばれ,正常な個体発生に重要であると考えられている1).筆者らは,これまで,初期胚,始原生殖細胞および卵細胞において特異的に発現する母性因子PGC7(Stella,Dppa3)が,雌性ゲノムに特異的に5mCから5hmCへの変換を阻害することを明らかにしてきた2).また,PGC7は初期発生において雌性ゲノムだけでなく,インプリント遺伝子の制御領域やレトロトランスポゾンの制御領域に存在する5mCを維持する機能ももつことも見い出している3).しかし,雌雄の両方の前核に存在するPGC7がどのようにして雌性ゲノムや特定のゲノム領域を識別して5mCを制御するのかについては不明であった.
受精卵の雌性クロマチンには5mCおよびヒストンH3の9番目のリジン残基のジメチル化(H3K9me2)が存在しているのに対し,雄性クロマチンではこれらの修飾はほとんど認められない.そこで,PGC7がこのH3K9me2を認識することにより雌性クロマチンと特異的に結合しているという仮説をたてた.まず,H3K9me2のほとんど存在しないG9aノックアウトES細胞を用いて,PGC7とクロマチンとの結合にH3K9me2は影響をあたえるかどうかを調べた.その結果,G9aノックアウトES細胞から精製したクロマチンは,野生型ES細胞から精製したクロマチンに比べPGC7との結合が有意に弱まることがわかった.つぎに,PGC7ノックアウトES細胞およびPGC7を発現させたPGC7ノックアウトES細胞を用いたクロマチン免疫沈降実験を行い,PGC7はH3K9me2を含むクロマチンと特異的に結合することを明らかにした.また,競合的ヒストンペプチド結合実験からPGC7はH3K9me2ともっとも強く結合することがわかった.このことから,PGC7はH3K9me2の存在するヒストンテールに直接に結合していることが示唆された.さらに,クロマチン免疫沈降実験から,野生型のES細胞においてPGC7はH3K9me2の存在するMagea2領域およびWfdc15a領域に結合するが,H3K9me2の存在しないOct3/4領域には結合しないことがわかった.一方,G9aノックアウトES細胞ではPGC7のMagea2領域およびWfdc15a領域への結合が認められなくなった.これらのことから,PGC7はin vivoにおいてH3K9me2の存在するクロマチンと特異的に結合していることが明らかになった.
PGC7とH3K9me2との結合が機能的であるかどうかを調べるため,クロマチンDNAを基質とする酵素であるミクロコッカルヌクレアーゼの活性に対しPGC7のあたえる影響を検討した.その結果,PGC7を発現させた野生型ES細胞においてミクロコッカルヌクレアーゼ活性は阻害されることがわかった.しかし,この阻害効果はG9aノックアウトES細胞ではまったく認められなかった.また,G9aノックアウトES細胞にG9aを発現させるとPGC7によるミクロコッカルヌクレアーゼ活性の阻害が回復した.これらのことから,PGC7はH3K9me2に依存的にクロマチンDNAを保護していることが示された.
通常の免疫染色法では,試料をパラホルムアルデヒドなどにより固定したのちTritonX-100などの界面活性剤による処理を行う.しかし,この方法では核に存在するタンパク質はクロマチンとの結合の有無に関係なく同じように染色されてしまう.そこで,試料をTritonX-100で前処理することによりクロマチンとの結合が弱いタンパク質を洗い流したのち,免疫染色を行った.その結果,通常の免疫染色では雌雄の両方の前核に検出されるPGC7が,TritonX-100により前処理を行った場合には雌性の前核にのみ検出されるようになった.すなわち,PGC7は雌性クロマチンと強く結合していた.つぎに,この結合がH3K9me2を介したものであるかどうかを検討するため,受精卵にH3K9me2(および,モノメチル化)に特異的な脱メチル化酵素であるJhdm2a(Kdm3a)を強制発現させた.その結果,Jhdm2aを発現させた場合にはH3K9me2が脱メチル化しPGC7と雌性クロマチンとの結合が解除された.さらに,Jhdm2aを発現させた受精卵において,雌性ゲノムの5mCは5hmCへと変換されることがわかった.これらのことから,PGC7はH3K9me2を認識して雌性クロマチンと結合することにより,5mCから5hmCへの変換から雌性ゲノムを特異的に保護していることが明らかになった.
Dlk1-Gtl2領域,H19領域およびRasgrf1領域などの父性インプリント遺伝子の制御領域に存在する5mCは,初期発生の過程において維持されることが知られている.筆者らは,PGC7ノックアウトマウスの卵子から得た受精卵において,H19領域およびRasgrf1領域にあるインプリント遺伝子の制御領域において5mCは維持されないことを見い出している.しかし,PGC7がどのようにしてH19領域およびRasgrf1領域に存在するインプリント遺伝子の制御領域にある5mCを特異的に維持するのかについては不明であった.
精子の形成過程においてヌクレオソームのヒストンはプロタミンへと置換されることが知られている.しかし最近,成熟した精子においてもインプリント遺伝子の制御領域などではヒストンが残存していることが報告された4,5).そこで,Dlk1-Gtl2領域,H19領域およびRasgrf1領域にある父性インプリント遺伝子の制御領域に存在するヒストンの修飾状態を調べた.その結果,H19領域およびRasgrf1領域にあるインプリント遺伝子の制御領域のクロマチンにはH3K9me2の存在することがわかった.一方,Dlk1-Gtl2領域にあるインプリント遺伝子の制御領域にはH3K9me2は存在していなかった.これらのことから,精子のクロマチンに存在するH3K9me2が受精卵へともち越されPGC7と結合することにより,H19領域およびRasgrf1領域に存在するインプリント遺伝子の制御領域にある5mCは維持されることが示唆された.
これまでの研究から,受精卵における5mCから5hmCへの変換にはメチルシトシンデオキシナーゼであるTet3が関与することが明らかにされていた2,6).そこで,ES細胞を用いてPGC7がTet3のクロマチンへの結合にあたえる影響を検討した.PGC7ノックアウトES細胞にTet3を単独で発現させたところ,Tet3はクロマチンと結合することがわかった.一方,PGC7ノックアウトES細胞にPGC7とTet3とを共発現させた場合には,PGC7はクロマチンに結合していたが,Tet3はクロマチンとは結合していなかった.このことから,PGC7はTet3とクロマチンとの結合を阻害することがわかった.つぎに,C末端を欠失させたPGC7変異体を用いて同様の実験を行ったところ,この変異体はクロマチンとは結合したが,Tet3のクロマチンへの結合は阻害しないことがわかった.さらに,C末端を欠失させたPGC7変異体は,全長のPGC7とは異なりミクロコッカルヌクレアーゼ活性を阻害しないことが示された.
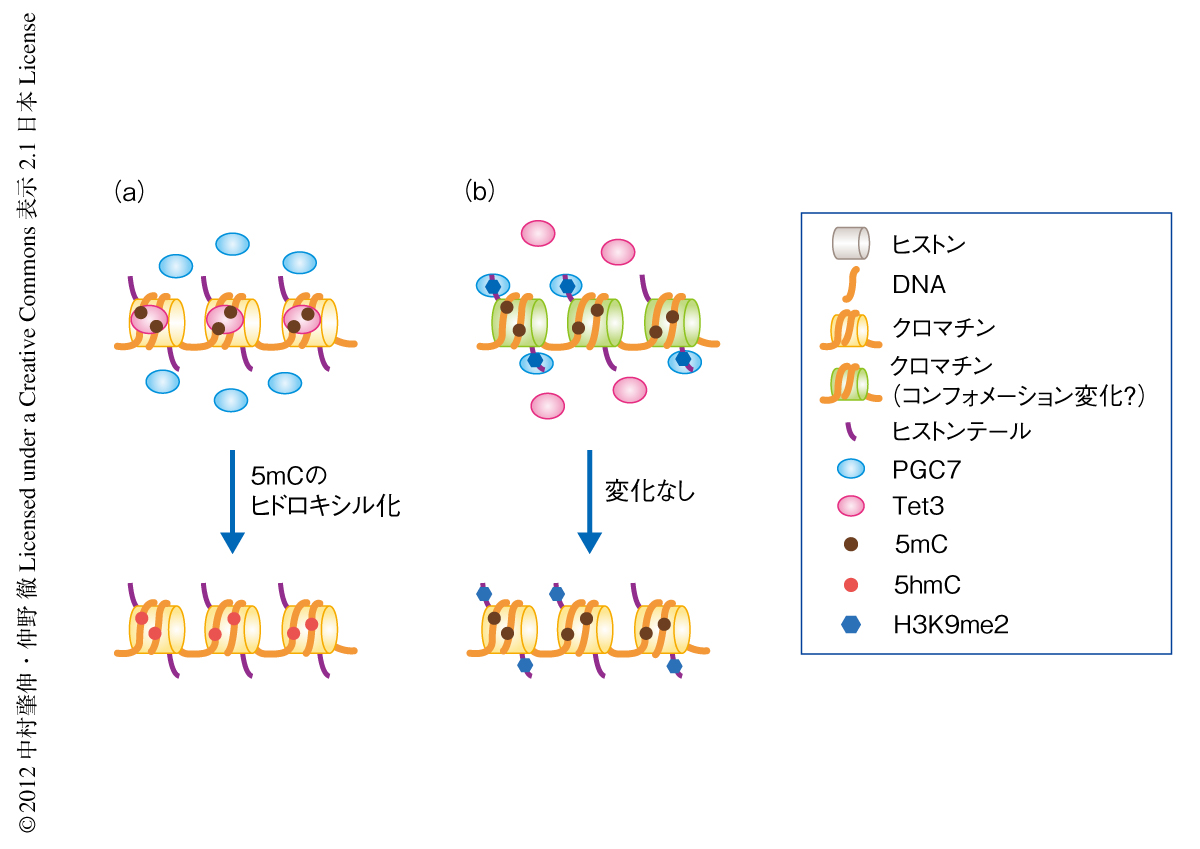
PGC7によるTet3の阻害の分子機構には,PGC7とTet3のクロマチンへの競合的な結合,PGC7による立体障害,PGC7によるクロマチンのコンフォメーション変化,の3つの可能性が考えられた.しかし,C末端を欠失させたPGC7変異体はクロマチンと結合するにもかかわらずTet3とクロマチンとの結合を阻害しなかったことから,PGC7がTet3と競合してクロマチンと結合している可能性は否定された.つぎに,PGC7(約17 kDa)はコアヒストン(約100 kDa)に対し小さいこと,PGC7はヒストンテールに結合するにもかかわらずヌクレオソームのリンカー部位を優先的に切断するミクロコッカルヌクレアーゼの活性を阻害することから,PGC7による立体障害の可能性も低いと考えられた.これらのことから,PGC7はそのN末端側でクロマチンと結合することによりクロマチンのコンフォメーション変化を誘起し,Tet3とクロマチンとの結合を阻害している可能性が高いと考えられた(図2).
今回の報告により,PGC7がH3K9me2を認識してクロマチンと結合することで,受精卵の雌性ゲノムに存在する5mCをTet3による5hmCへの変換から保護していることが明らかになった.また,インプリント遺伝子の制御領域に存在する5mCも同様の機構で維持されていることが示された.しかし最近,5hmCはTetによりさらに5-ホルミルシトシン,5-カルボキシルシトシンへと変換されうることが報告されている7,8).今後のさらなる解析により,これらの塩基の生理的な役割や生物学的な意義の解明されることが期待される.
略歴:2002年 大阪大学大学院薬学研究科 修了,大阪大学微生物病研究所 特任研究員,大阪大学大学院生命機能研究科 特任研究員,大阪大学大学院医学系研究科 助教を経て,2012年より長浜バイオ大学バイオサイエンス学部 講師.
研究テーマ:受精卵におけるエピジェネティックなリプログラミング機構の解明,体細胞の核におけるリプログラミング機構の解明.
関心事:基礎研究の再生医療への応用,世界自然遺産,シロクマ,ウミガメ.
仲野 徹(Toru Nakano)
大阪大学大学院医学系研究科および同 生命機能研究科 教授.
研究室URL:http://www.fbs.osaka-u.ac.jp/labs/nakano/
© 2012 中村肇伸・仲野 徹 Licensed under CC 表示 2.1 日本
(大阪大学大学院医学系研究科 幹細胞病理学)
email:中村肇伸,仲野 徹
DOI: 10.7875/first.author.2012.074
PGC7 binds histone H3K9me2 to protect against conversion of 5mC to 5hmC in early embryos.
Toshinobu Nakamura, Yu-Jung Liu, Hiroyuki Nakashima, Hiroki Umehara, Kimiko Inoue, Shogo Matoba, Makoto Tachibana, Atsuo Ogura, Yoichi Shinkai, Toru Nakano
Nature, 486, 415-419 (2012)
要 約
5-メチルシトシンによるDNA修飾はエピジェネティックな遺伝子の発現制御に重要な役割をはたしている.5-メチルシトシンはメチルシトシンデオキシナーゼTetにより5-ヒドロキシルメチルシトシンという別のDNA修飾へと変換されうる.また,ゲノムにおける5-ヒドロキシルメチルシトシンと5-メチルシトシンとのバランスは多能性や細胞系譜の運命決定と密接に関係している.母性因子であるPGC7は,初期発生において5-メチルシトシンから5-ヒドロキシルメチルシトシンへの変換から雌性ゲノムを保護することが報告されている.今回,筆者らは,PGC7がヒストンH3の9番目のリジン残基のジメチル化を介して雌性クロマチンと結合し,これをTet3による5-メチルシトシンから5-ヒドロキシルメチルシトシンへの変換から保護することを見い出した.さらに,成熟した精子において,ヒストンH3の9番目のリジン残基のジメチル化の存在するインプリント遺伝子の制御領域にある5-メチルシトシンも,PGC7との結合により保護されていた.このような制御機構は,初期胚と同様に体細胞においてもDNA修飾に関与していることが考えられた.
はじめに
哺乳類では受精ののちゲノム全体の5-メチルシトシン(5mC)は消去されるが,精子に由来する雄性ゲノムと卵子に由来する雌性ゲノムでは5mCの消去のタイミングが異なる.雄性ゲノムのもつ5mCはDNA複製よりもまえに能動的に消去されるのに対し,雌性ゲノムの5mCはDNA複製にともない受動的に消去される.5mCが雌性ゲノムだけで能動的に消去されるため,受精卵においてゲノムの5mCの状態は不均等になる(図1).これは,初期発生における“エピジェネティック不均等性”とよばれ,正常な個体発生に重要であると考えられている1).筆者らは,これまで,初期胚,始原生殖細胞および卵細胞において特異的に発現する母性因子PGC7(Stella,Dppa3)が,雌性ゲノムに特異的に5mCから5hmCへの変換を阻害することを明らかにしてきた2).また,PGC7は初期発生において雌性ゲノムだけでなく,インプリント遺伝子の制御領域やレトロトランスポゾンの制御領域に存在する5mCを維持する機能ももつことも見い出している3).しかし,雌雄の両方の前核に存在するPGC7がどのようにして雌性ゲノムや特定のゲノム領域を識別して5mCを制御するのかについては不明であった.
1.PGC7はヒストンH3の9番目のリジン残基のジメチル化を含むクロマチンと特異的に結合する
受精卵の雌性クロマチンには5mCおよびヒストンH3の9番目のリジン残基のジメチル化(H3K9me2)が存在しているのに対し,雄性クロマチンではこれらの修飾はほとんど認められない.そこで,PGC7がこのH3K9me2を認識することにより雌性クロマチンと特異的に結合しているという仮説をたてた.まず,H3K9me2のほとんど存在しないG9aノックアウトES細胞を用いて,PGC7とクロマチンとの結合にH3K9me2は影響をあたえるかどうかを調べた.その結果,G9aノックアウトES細胞から精製したクロマチンは,野生型ES細胞から精製したクロマチンに比べPGC7との結合が有意に弱まることがわかった.つぎに,PGC7ノックアウトES細胞およびPGC7を発現させたPGC7ノックアウトES細胞を用いたクロマチン免疫沈降実験を行い,PGC7はH3K9me2を含むクロマチンと特異的に結合することを明らかにした.また,競合的ヒストンペプチド結合実験からPGC7はH3K9me2ともっとも強く結合することがわかった.このことから,PGC7はH3K9me2の存在するヒストンテールに直接に結合していることが示唆された.さらに,クロマチン免疫沈降実験から,野生型のES細胞においてPGC7はH3K9me2の存在するMagea2領域およびWfdc15a領域に結合するが,H3K9me2の存在しないOct3/4領域には結合しないことがわかった.一方,G9aノックアウトES細胞ではPGC7のMagea2領域およびWfdc15a領域への結合が認められなくなった.これらのことから,PGC7はin vivoにおいてH3K9me2の存在するクロマチンと特異的に結合していることが明らかになった.
2.PGC7はヒストンH3の9番目のリジン残基のジメチル化に依存してクロマチンDNAを保護する
PGC7とH3K9me2との結合が機能的であるかどうかを調べるため,クロマチンDNAを基質とする酵素であるミクロコッカルヌクレアーゼの活性に対しPGC7のあたえる影響を検討した.その結果,PGC7を発現させた野生型ES細胞においてミクロコッカルヌクレアーゼ活性は阻害されることがわかった.しかし,この阻害効果はG9aノックアウトES細胞ではまったく認められなかった.また,G9aノックアウトES細胞にG9aを発現させるとPGC7によるミクロコッカルヌクレアーゼ活性の阻害が回復した.これらのことから,PGC7はH3K9me2に依存的にクロマチンDNAを保護していることが示された.
3.PGC7はヒストンH3の9番目のリジン残基のジメチル化との結合を介して雌性ゲノムの5-メチルシトシンを保護する
通常の免疫染色法では,試料をパラホルムアルデヒドなどにより固定したのちTritonX-100などの界面活性剤による処理を行う.しかし,この方法では核に存在するタンパク質はクロマチンとの結合の有無に関係なく同じように染色されてしまう.そこで,試料をTritonX-100で前処理することによりクロマチンとの結合が弱いタンパク質を洗い流したのち,免疫染色を行った.その結果,通常の免疫染色では雌雄の両方の前核に検出されるPGC7が,TritonX-100により前処理を行った場合には雌性の前核にのみ検出されるようになった.すなわち,PGC7は雌性クロマチンと強く結合していた.つぎに,この結合がH3K9me2を介したものであるかどうかを検討するため,受精卵にH3K9me2(および,モノメチル化)に特異的な脱メチル化酵素であるJhdm2a(Kdm3a)を強制発現させた.その結果,Jhdm2aを発現させた場合にはH3K9me2が脱メチル化しPGC7と雌性クロマチンとの結合が解除された.さらに,Jhdm2aを発現させた受精卵において,雌性ゲノムの5mCは5hmCへと変換されることがわかった.これらのことから,PGC7はH3K9me2を認識して雌性クロマチンと結合することにより,5mCから5hmCへの変換から雌性ゲノムを特異的に保護していることが明らかになった.
4.PGC7はヒストンH3の9番目のリジン残基のジメチル化との結合を介してインプリント遺伝子の制御領域の5-メチルシトシンを保護する
Dlk1-Gtl2領域,H19領域およびRasgrf1領域などの父性インプリント遺伝子の制御領域に存在する5mCは,初期発生の過程において維持されることが知られている.筆者らは,PGC7ノックアウトマウスの卵子から得た受精卵において,H19領域およびRasgrf1領域にあるインプリント遺伝子の制御領域において5mCは維持されないことを見い出している.しかし,PGC7がどのようにしてH19領域およびRasgrf1領域に存在するインプリント遺伝子の制御領域にある5mCを特異的に維持するのかについては不明であった.
精子の形成過程においてヌクレオソームのヒストンはプロタミンへと置換されることが知られている.しかし最近,成熟した精子においてもインプリント遺伝子の制御領域などではヒストンが残存していることが報告された4,5).そこで,Dlk1-Gtl2領域,H19領域およびRasgrf1領域にある父性インプリント遺伝子の制御領域に存在するヒストンの修飾状態を調べた.その結果,H19領域およびRasgrf1領域にあるインプリント遺伝子の制御領域のクロマチンにはH3K9me2の存在することがわかった.一方,Dlk1-Gtl2領域にあるインプリント遺伝子の制御領域にはH3K9me2は存在していなかった.これらのことから,精子のクロマチンに存在するH3K9me2が受精卵へともち越されPGC7と結合することにより,H19領域およびRasgrf1領域に存在するインプリント遺伝子の制御領域にある5mCは維持されることが示唆された.
5.PGC7による5-メチルシトシンから5-メチルヒドロキシシトシンへの変換阻害の分子機構
これまでの研究から,受精卵における5mCから5hmCへの変換にはメチルシトシンデオキシナーゼであるTet3が関与することが明らかにされていた2,6).そこで,ES細胞を用いてPGC7がTet3のクロマチンへの結合にあたえる影響を検討した.PGC7ノックアウトES細胞にTet3を単独で発現させたところ,Tet3はクロマチンと結合することがわかった.一方,PGC7ノックアウトES細胞にPGC7とTet3とを共発現させた場合には,PGC7はクロマチンに結合していたが,Tet3はクロマチンとは結合していなかった.このことから,PGC7はTet3とクロマチンとの結合を阻害することがわかった.つぎに,C末端を欠失させたPGC7変異体を用いて同様の実験を行ったところ,この変異体はクロマチンとは結合したが,Tet3のクロマチンへの結合は阻害しないことがわかった.さらに,C末端を欠失させたPGC7変異体は,全長のPGC7とは異なりミクロコッカルヌクレアーゼ活性を阻害しないことが示された.
PGC7によるTet3の阻害の分子機構には,PGC7とTet3のクロマチンへの競合的な結合,PGC7による立体障害,PGC7によるクロマチンのコンフォメーション変化,の3つの可能性が考えられた.しかし,C末端を欠失させたPGC7変異体はクロマチンと結合するにもかかわらずTet3とクロマチンとの結合を阻害しなかったことから,PGC7がTet3と競合してクロマチンと結合している可能性は否定された.つぎに,PGC7(約17 kDa)はコアヒストン(約100 kDa)に対し小さいこと,PGC7はヒストンテールに結合するにもかかわらずヌクレオソームのリンカー部位を優先的に切断するミクロコッカルヌクレアーゼの活性を阻害することから,PGC7による立体障害の可能性も低いと考えられた.これらのことから,PGC7はそのN末端側でクロマチンと結合することによりクロマチンのコンフォメーション変化を誘起し,Tet3とクロマチンとの結合を阻害している可能性が高いと考えられた(図2).
おわりに
今回の報告により,PGC7がH3K9me2を認識してクロマチンと結合することで,受精卵の雌性ゲノムに存在する5mCをTet3による5hmCへの変換から保護していることが明らかになった.また,インプリント遺伝子の制御領域に存在する5mCも同様の機構で維持されていることが示された.しかし最近,5hmCはTetによりさらに5-ホルミルシトシン,5-カルボキシルシトシンへと変換されうることが報告されている7,8).今後のさらなる解析により,これらの塩基の生理的な役割や生物学的な意義の解明されることが期待される.
文 献
- Feng, S., Jacobsen, S. E. & Reik, W.: Epigenetic reprogramming in plant and animal development. Science, 330, 622-627 (2010)[PubMed]
- Wossidlo, M., Nakamura, T., Lepikhov, K. et al.: 5-Hydroxymethylcytosine in the mammalian zygote is linked with epigenetic reprogramming. Nat. Commun., 2, 241 (2011)[PubMed]
- Nakamura, T., Arai, Y., Umehara, H. et al.: PGC7/Stella protects against DNA demethylation in early embryogenesis. Nat. Cell Biol., 9, 64-71 (2007)[PubMed]
- Hammoud, S. S., Nix, D. A., Zhang, H. et al.: Distinctive chromatin in human sperm packages genes for embryo development. Nature, 460, 473-478 (2009)[PubMed]
- Brykczynska, U., Hisano, M., Erkek, S. et al.: Repressive and active histone methylation mark distinct promoters in human and mouse spermatozoa. Nat. Struct. Mol. Biol., 17, 679-687(2010)[PubMed]
- Gu, T. P., Guo, F., Yang, H. et al.: The role of Tet3 DNA dioxygenase in epigenetic reprogramming by oocytes. Nature, 477, 606-610 (2011)[PubMed]
- Ito, S., Shen, L., Dai, Q. et al.: Tet proteins can convert 5-methylcytosine to 5-formylcytosine and 5-carboxylcytosine. Science, 333, 1300-1303 (2011)[PubMed]
- He, Y. L., Li, B. Z., Li, Z. et al.: Tet-mediated formation of 5-carboxylcytosine and its excision by TDG in mammalian DNA. Science, 333, 1303-1307 (2011)[PubMed]
著者プロフィール
略歴:2002年 大阪大学大学院薬学研究科 修了,大阪大学微生物病研究所 特任研究員,大阪大学大学院生命機能研究科 特任研究員,大阪大学大学院医学系研究科 助教を経て,2012年より長浜バイオ大学バイオサイエンス学部 講師.
研究テーマ:受精卵におけるエピジェネティックなリプログラミング機構の解明,体細胞の核におけるリプログラミング機構の解明.
関心事:基礎研究の再生医療への応用,世界自然遺産,シロクマ,ウミガメ.
仲野 徹(Toru Nakano)
大阪大学大学院医学系研究科および同 生命機能研究科 教授.
研究室URL:http://www.fbs.osaka-u.ac.jp/labs/nakano/
© 2012 中村肇伸・仲野 徹 Licensed under CC 表示 2.1 日本