インスリン-AKTシグナル伝達経路の情報多重化によるインスリンの作用の時間情報コード
久保田浩行・黒田真也
(東京大学大学院理学系研究科 生物化学専攻)
email:久保田浩行
DOI: 10.7875/first.author.2012.071
Temporal coding of insulin action through multiplexing of the AKT pathway.
Hiroyuki Kubota, Rei Noguchi, Yu Toyoshima, Yu-ichi Ozaki, Shinsuke Uda, Kanako Watanabe, Wataru Ogawa, Shinya Kuroda
Molecular Cell, 46, 820-832 (2012)
生体におけるインスリンの分泌には,食後に一過的に分泌される追加分泌や,空腹のときも微量に分泌される基礎分泌,約15分間の周期の波形をもつ分泌など,異なる時間波形をもつ複数の成分の存在が知られている.これらの時間波形はインスリンの生理作用において重要であることが古くから報告されているが,その分子機構は不明であった.近年,筆者らは,細胞は分子の時間変化(時間波形)に情報を埋め込んで通信・処理しているという時間情報コードの概念を世界にさきがけて提唱している.この研究では,この時間情報コードの概念から,血中のインスリンのもつ時間波形に制御情報がコードされ,標的となる臓器のシグナル伝達経路により選択的に通信されているのではないかと考えた.そこで,実験とシミュレーションによる解析を行い,インスリンのシグナル伝達経路において中心的なタンパク質であるAKTがインスリンの複数の時間波形を多重に通信し,下流の分子を選択的に制御できることを明らかにした.
生物は多様な外界の変化に対して適切な応答をしなければならない.しかし,細胞におけるシグナル伝達経路の数は限られている.つまり,シグナル伝達経路の本質のひとつは,多彩な入出力を限られた分子,または,そのネットワークを用いて通信・処理するシステムにある.そこで,細胞は限られたシグナル伝達経路を用いて多彩な応答を行うため,シグナル伝達経路の組合せにより情報を通信・処理するという方法を用いている(クロストーク).近年,筆者らは,このシグナル伝達経路の組合せ以外に,細胞は分子の時間変化(時間波形)に情報を埋め込んで通信・処理しているという時間情報コードの概念を世界にさきがけ提唱している.世界的にもこの時間情報コードの概念は注目されているが1),その生理的な役割は解析されていない.
生体におけるインスリンの分泌は,食後に一過的に分泌される追加分泌や,空腹のときも微量に分泌される基礎分泌2),約15分間の周期の波形をもつ分泌3) など,異なる時間波形をもつ複数の成分の存在が知られている.生体においてインスリンの約15分間の周期をもつ刺激は一定の刺激よりも肝臓からの糖の放出抑制を増強するなど,その時間波形の重要性が報告されているが,その分子機構は不明のままである.
筆者らは,時間情報コードの概念から,血中のインスリンのもつ時間波形にある種の制御情報がコードされ,標的となる臓器におけるシグナル伝達経路により選択的に通信されているのではないかと考えた.そこで,実験の結果を再現するようなシミュレーションモデルを作成して解析を行った.その結果,インスリンのシグナル伝達経路において中心的なタンパク質であるAKTがインスリンの複数の時間波形を多重に通信し,下流の分子は制御構造や酵素の性質の違いによりこれらを選択的に通信・処理できることを明らかにした.
血中に分泌されたインスリンの最初の標的となる臓器は肝臓である.つまり,インスリンの作用する臓器のなかで肝臓がもっともインスリンの時間波形の影響をうけていると考えられる.そこで,インスリンの時間波形がどのように処理されるのか,はじめに,ラットに由来する肝がん細胞であるFao細胞を用いて検討を行った.異なる濃度のインスリンにより一定の刺激をあたえ,インスリンのシグナル伝達経路において中心的な役割を担っているAKTタンパク質のリン酸化と,その下流の分子であるS6Kタンパク質のリン酸化,GSK3βタンパク質のリン酸化,G6Pase mRNAの時間波形(すなわち,時間変動のパターン)を測定した(この研究では,AKT,S6K,GSK3βのリン酸化についてはタンパク質レベルでの定量を,G6PaseについてはmRNAレベルでの定量を行っているが,以下ではとくに区別せずAKT,S6K,GSK3β,G6Paseと表記する).AKTには一過性の波形と持続性の波形とが観測されたが,下流の3つの分子の時間波形はそれぞれ異なっていた.阻害剤などを用いた実験からはほかのシグナル伝達経路とのクロストークは確認されず,少なくともFao細胞においては,AKTがこれらの分子を支配的に制御していることがわかった.つまり,これらの分子は同じ上流分子を共有するにもかかわらず時間波形が異なっていた.これらの結果は,AKTのもつ時間波形に多重に情報が埋め込まれ,下流の3つの分子はAKTにコードされた異なる情報を通信・処理していることを示唆していた.
これらの分子の挙動の特徴を明らかにするため,コンピューターシミュレーションを用いて,実験で得られた時間波形を再現するような単純な生化学反応モデルを,過去の知見にもとづいて作成した.作成されたモデルは,AKTとGSK3βの一過性の波形および持続性の波形と,G6Paseの持続性の波形を再現したが,過去の知見からではS6Kの一過性の波形を再現することができなかった.そこで,mTORからの負の制御機構を導入したところS6Kの時間波形を再現することができた(図1a).S6KからmTORへの負のフィードバックループの導入によってもS6Kの時間波形を再現できることを確認しており,その制御機構までは同定できていないが,そこにはインスリンに依存的で適当な時間的な遅れをもつ新規の負の制御が必要であることを見い出した.
これらの分子の波形の特徴を明らかにするため,インスリンによるランプ刺激を行った.ランプ刺激とは,刺激の濃度を徐々に増加することで刺激の時間変化率を変える方法である(図1b).この研究では,ランプ刺激において到達する最終濃度を固定し,その濃度に到達する時間を変えることにより刺激の時間変化率を変化させた.その結果,シミュレーションと検証実験のどちらにおいても,刺激の時間変化率が小さくなるにつれAKTとS6K,GSK3βの一過性の波形は減少した.つまり,これらの分子の一過性の波形にはインスリンの時間変化率の情報がコードされていると考えられた.その一方で,G6Paseにはもともと顕著な一過性の波形がないためその減少は観察されなかった.AKTがこれら3つの分子の上流分子であることを考えると,インスリンの時間変化率の情報はAKTの一過性の波形を介してS6KとGSK3βに通信されると考えられた.とくに,S6Kは刺激の速度にかかわらず一過性の波形のみを示したので,インスリンの時間変化率の情報はS6Kに対しもっとも強く通信されていると考えられた.
さらにこれらの分子の時間波形の特徴を明らかにするため,最終濃度の異なるパルス刺激を行った.パルス刺激とは,刺激をくわえある時間ののち刺激をなくす(減らす)ことで一過性の刺激をあたえる方法である(図1b).この研究では,パルス刺激をあたえることで刺激の時間変化率を固定し,そののち,異なる最終濃度にまでパルス刺激を減少させることで最終濃度に対する応答を検討した.その結果,シミュレーションと検証実験のどちらにおいても,刺激の最終濃度が低くなるにつれAKTとGSK3β,G6Paseの持続性の波形は減少した.つまり,これらの分子の持続性の波形にはインスリンの最終濃度の情報がコードされていると考えられた.その一方で,S6Kにはもともと持続性の波形がないためその減少は観察されなかった.AKTがこれら3つの分子の上流分子であることを考えると,インスリンの最終濃度の情報はAKTの持続性の波形を介してGSK3βとG6Paseに通信されると考えられた.とくに,G6Paseは最終濃度についてもっとも大きなダイナミックレンジを示したので,インスリンの最終濃度の情報はG6Paseに対しもっとも通信されていると考えられた.また,AKTとGSK3β,G6Paseはランプ刺激において刺激の時間変化率にかかわらず同じ値に到達した.この結果からも,インスリンの最終濃度の情報はAKTの持続性の波形を介してGSK3βとG6Paseに通信されることが示唆された.
このように,AKTに制御される3つの下流分子はAKTに多重にコードされたインスリンの時間変化率と最終濃度の情報を選択的に通信・処理していることが明らかになった.
それでは,AKTに制御される3つの下流分子は,AKTに多重にコードされた情報をどのように選択的に通信しているのだろうか? モデルの解析と検証実験の結果,以下の3つの理由により,AKTに多重にコードされた情報を下流の分子が個別に通信・処理していることが明らかになった(図1b).
S6Kの制御構造はインコヒーレントな(“矛盾した”)フィードフォワードループ(incoherent feed-forward loop:IFFL)とよばれる構造であり4),AKTの時間変化率に応答して一過性の波形を示した.その一方で,GSK3βとG6Paseの制御構造はフィードフォワード(feed-forward:FF)であり,AKTの時間波形に追随するだけであった.その結果,S6Kはインスリンの刺激によりAKTに時間変化のあるときだけ一過性の応答を示した.また,S6KからmTORへの負のフィードバックループの構造でも同様の性質を示すことも確認された.
つぎに,GSK3βとG6Paseの時定数を求めた.時定数とは下流分子が上流分子にどのくらい速く追随できるかを示す指標であり,この値が小さいと上流分子に追随できる(同じ時間波形になる).GSK3βの時定数は1.6分であり,G6Paseの時定数は18.4分であった.GSK3βの時定数は十分に小さかったためAKTの一過性の波形と持続性の波形に十分に追随できた.しかし,G6Paseの時定数はAKTの一過性の波形に追随できるほど大きくはなかった.そのため,GSK3βはAKTの時間波形に十分に追随できたことで一過性の波形と持続性の波形を示し,G6PaseはAKTの一過性の波形に追随できなかったため持続性の波形のみを示した.
最後に,GSK3βとG6Paseの定常状態におけるAKTに対する50%効果濃度(EC50)を求めた.50%効果濃度とは上流分子に対する下流分子の感受性の指標であり,この値が小さいほど感受性は高い(わずかな変化でも大きな応答を示す).GSK3βの50%効果濃度は0.33であり,G6Paseの50%効果濃度は0.06であった.G6Paseの50%効果濃度は非常に小さかったため,定常状態におけるAKTのわずかな変動に対しても大きな応答を示した.このため,G6Paseは強い持続性の波形を示した.また,GSK3βはAKTに対し直線に近い応答を示した.これにより,G6Paseとは違いAKTから十分な量の情報を受け取ることができた5).
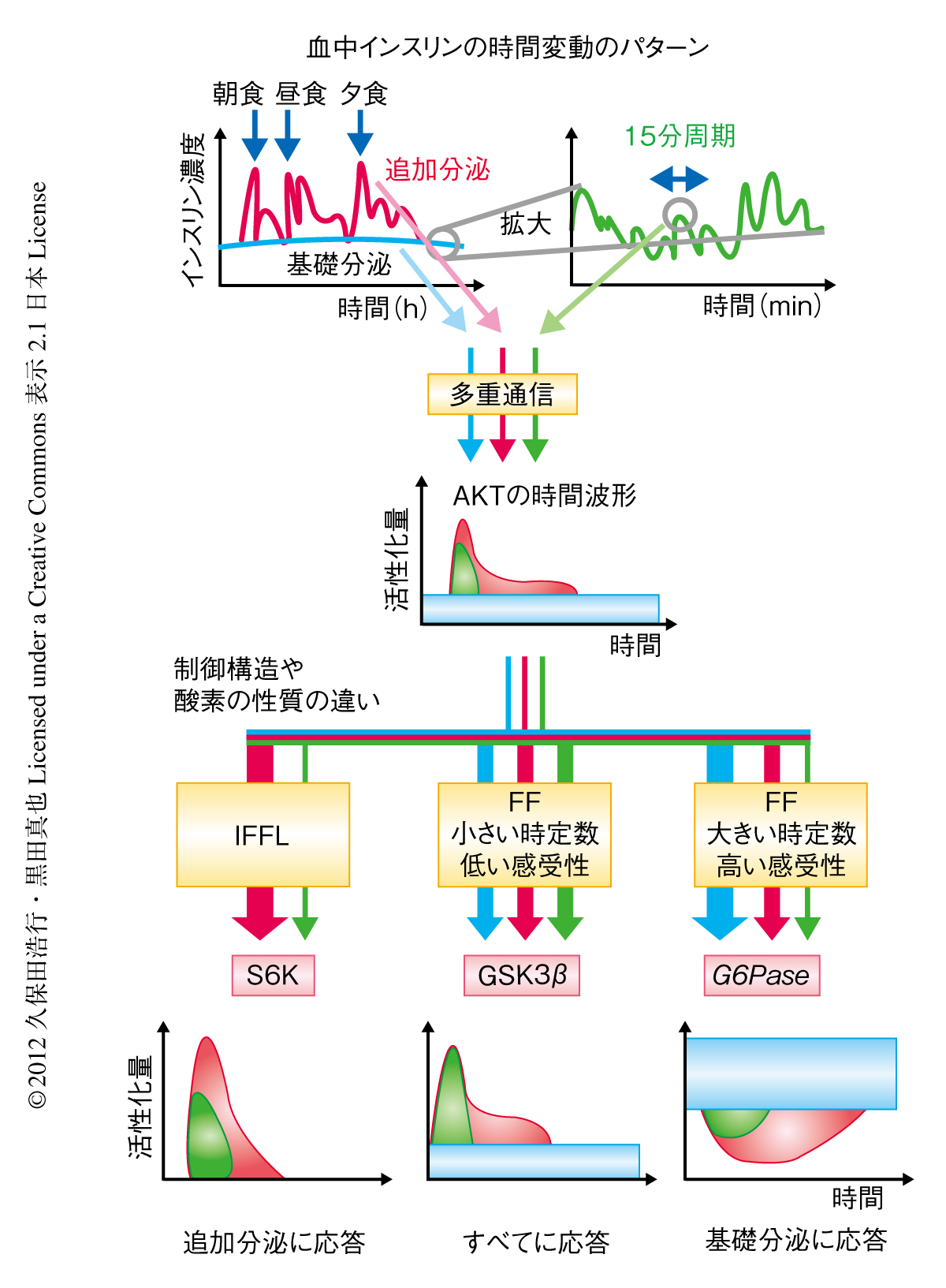
ここで示したような制御構造や酵素の性質の違いにより,AKTに制御される3つの下流分子はAKTに多重にコードされたインスリンの時間変化率と最終濃度の情報を選択的に通信・処理していることが明らかになった(図2).
このような特性をもつインスリン-AKTシグナル伝達経路の構成分子が血中のインスリンの時間波形をどのように通信・処理しているかについて検討した.さきにも述べたように,生体における血中のインスリンの時間波形には,追加分泌と基礎分泌,そして,約15分の周期をもつ波形の存在することが知られている.そこで,これらの時間波形を実験的に模倣した,120分のパルス刺激(追加分泌),濃度の変動のない定常状態の刺激(基礎分泌),そして,15分のパルス刺激(約15分の周期をもつ波形をあたえることは実験的にむずかしいため)について,シミュレーションと検証実験により検討した.その結果,S6Kは追加分泌や15分周期の波形には応答できるが基礎分泌には応答できない(時間変化率が小さいので応答できない)こと,GSK3βはすべての時間波形に応答できること(時定数が小さいためすべての時間波形に応答できる),さらに,G6Paseは追加分泌や基礎分泌には応答できるが(とくに,感受性が高いため基礎分泌を強調した),15分周期の波形には応答できない(時定数が大きいため速い変化に応答できない)ことが明らかになった(図2).これらの特性は,生体における応答をより反映していると考えられるラットの初代培養肝細胞においても確認された.
この研究により,インスリンの追加分泌や基礎分泌,15分周期の波形にコードされた時間変化率や濃度の情報がいったんAKTの時間波形に多重にコードされ,下流分子の制御構造や酵素の性質の違いにより個別に通信・処理されることで,選択的に下流分子を制御していることが明らかになった(図2).
この研究は,シグナル分子は制御情報をコードする媒体であり,シグナル伝達経路のうえを伝わる時間パターンが情報の実態であるという“時間情報コード”という概念を提示した.とくに,生体において実際に使われている時間波形を模した刺激を用いたことで,従来の研究のようにシグナル伝達経路の特徴を明らかにしただけでなく,生物がこのシステムを用いて実際に生体において時間波形をどのように処理しているかについても明らかにした.多くのホルモンの分泌は周期性を示すこと,制御構造の違いや酵素の性質の違いはシグナル伝達経路においてありふれたものであることから,この概念は,インスリンの作用にとどまらずさまざまな生物現象に適用できる共通の概念であるものと思われる.また,時間情報コードの概念は,なぜ15分周期の波形が効果的なのかなど,インスリン作用機構の解明や糖尿病の治療といった応用につながるものと期待される.
略歴:2001年 東京大学大学院理学系研究科博士課程 修了,2002年 日本学術振興会特別研究員,2005年 産学官連携研究員を経て,2007年より東京大学大学院理学系研究科 助教.
研究テーマ:インスリンの時間波形により制御される分子の解析.
抱負:時間情報コードの概念は生物における制御原理のひとつであることを明らかにしたい.
黒田 真也(Shinya Kuroda)
東京大学大学院理学系研究科 教授.
研究室URL:http://kurodalab.bi.s.u-tokyo.ac.jp/ja/index.html
© 2012 久保田浩行・黒田真也 Licensed under CC 表示 2.1 日本
(東京大学大学院理学系研究科 生物化学専攻)
email:久保田浩行
DOI: 10.7875/first.author.2012.071
Temporal coding of insulin action through multiplexing of the AKT pathway.
Hiroyuki Kubota, Rei Noguchi, Yu Toyoshima, Yu-ichi Ozaki, Shinsuke Uda, Kanako Watanabe, Wataru Ogawa, Shinya Kuroda
Molecular Cell, 46, 820-832 (2012)
この論文に出現する遺伝子・タンパク質のUniprot ID
要 約
生体におけるインスリンの分泌には,食後に一過的に分泌される追加分泌や,空腹のときも微量に分泌される基礎分泌,約15分間の周期の波形をもつ分泌など,異なる時間波形をもつ複数の成分の存在が知られている.これらの時間波形はインスリンの生理作用において重要であることが古くから報告されているが,その分子機構は不明であった.近年,筆者らは,細胞は分子の時間変化(時間波形)に情報を埋め込んで通信・処理しているという時間情報コードの概念を世界にさきがけて提唱している.この研究では,この時間情報コードの概念から,血中のインスリンのもつ時間波形に制御情報がコードされ,標的となる臓器のシグナル伝達経路により選択的に通信されているのではないかと考えた.そこで,実験とシミュレーションによる解析を行い,インスリンのシグナル伝達経路において中心的なタンパク質であるAKTがインスリンの複数の時間波形を多重に通信し,下流の分子を選択的に制御できることを明らかにした.
はじめに
生物は多様な外界の変化に対して適切な応答をしなければならない.しかし,細胞におけるシグナル伝達経路の数は限られている.つまり,シグナル伝達経路の本質のひとつは,多彩な入出力を限られた分子,または,そのネットワークを用いて通信・処理するシステムにある.そこで,細胞は限られたシグナル伝達経路を用いて多彩な応答を行うため,シグナル伝達経路の組合せにより情報を通信・処理するという方法を用いている(クロストーク).近年,筆者らは,このシグナル伝達経路の組合せ以外に,細胞は分子の時間変化(時間波形)に情報を埋め込んで通信・処理しているという時間情報コードの概念を世界にさきがけ提唱している.世界的にもこの時間情報コードの概念は注目されているが1),その生理的な役割は解析されていない.
生体におけるインスリンの分泌は,食後に一過的に分泌される追加分泌や,空腹のときも微量に分泌される基礎分泌2),約15分間の周期の波形をもつ分泌3) など,異なる時間波形をもつ複数の成分の存在が知られている.生体においてインスリンの約15分間の周期をもつ刺激は一定の刺激よりも肝臓からの糖の放出抑制を増強するなど,その時間波形の重要性が報告されているが,その分子機構は不明のままである.
筆者らは,時間情報コードの概念から,血中のインスリンのもつ時間波形にある種の制御情報がコードされ,標的となる臓器におけるシグナル伝達経路により選択的に通信されているのではないかと考えた.そこで,実験の結果を再現するようなシミュレーションモデルを作成して解析を行った.その結果,インスリンのシグナル伝達経路において中心的なタンパク質であるAKTがインスリンの複数の時間波形を多重に通信し,下流の分子は制御構造や酵素の性質の違いによりこれらを選択的に通信・処理できることを明らかにした.
1.インスリンの刺激によりシグナル伝達分子の示す時間波形は異なる
血中に分泌されたインスリンの最初の標的となる臓器は肝臓である.つまり,インスリンの作用する臓器のなかで肝臓がもっともインスリンの時間波形の影響をうけていると考えられる.そこで,インスリンの時間波形がどのように処理されるのか,はじめに,ラットに由来する肝がん細胞であるFao細胞を用いて検討を行った.異なる濃度のインスリンにより一定の刺激をあたえ,インスリンのシグナル伝達経路において中心的な役割を担っているAKTタンパク質のリン酸化と,その下流の分子であるS6Kタンパク質のリン酸化,GSK3βタンパク質のリン酸化,G6Pase mRNAの時間波形(すなわち,時間変動のパターン)を測定した(この研究では,AKT,S6K,GSK3βのリン酸化についてはタンパク質レベルでの定量を,G6PaseについてはmRNAレベルでの定量を行っているが,以下ではとくに区別せずAKT,S6K,GSK3β,G6Paseと表記する).AKTには一過性の波形と持続性の波形とが観測されたが,下流の3つの分子の時間波形はそれぞれ異なっていた.阻害剤などを用いた実験からはほかのシグナル伝達経路とのクロストークは確認されず,少なくともFao細胞においては,AKTがこれらの分子を支配的に制御していることがわかった.つまり,これらの分子は同じ上流分子を共有するにもかかわらず時間波形が異なっていた.これらの結果は,AKTのもつ時間波形に多重に情報が埋め込まれ,下流の3つの分子はAKTにコードされた異なる情報を通信・処理していることを示唆していた.
2.インスリンの刺激によりシグナル伝達分子の示す時間波形を再現するモデルの作成
これらの分子の挙動の特徴を明らかにするため,コンピューターシミュレーションを用いて,実験で得られた時間波形を再現するような単純な生化学反応モデルを,過去の知見にもとづいて作成した.作成されたモデルは,AKTとGSK3βの一過性の波形および持続性の波形と,G6Paseの持続性の波形を再現したが,過去の知見からではS6Kの一過性の波形を再現することができなかった.そこで,mTORからの負の制御機構を導入したところS6Kの時間波形を再現することができた(図1a).S6KからmTORへの負のフィードバックループの導入によってもS6Kの時間波形を再現できることを確認しており,その制御機構までは同定できていないが,そこにはインスリンに依存的で適当な時間的な遅れをもつ新規の負の制御が必要であることを見い出した.
3.シグナル伝達分子の示す一過性の波形はインスリン刺激の時間変化率,持続性の波形はインスリンの濃度に応答している
これらの分子の波形の特徴を明らかにするため,インスリンによるランプ刺激を行った.ランプ刺激とは,刺激の濃度を徐々に増加することで刺激の時間変化率を変える方法である(図1b).この研究では,ランプ刺激において到達する最終濃度を固定し,その濃度に到達する時間を変えることにより刺激の時間変化率を変化させた.その結果,シミュレーションと検証実験のどちらにおいても,刺激の時間変化率が小さくなるにつれAKTとS6K,GSK3βの一過性の波形は減少した.つまり,これらの分子の一過性の波形にはインスリンの時間変化率の情報がコードされていると考えられた.その一方で,G6Paseにはもともと顕著な一過性の波形がないためその減少は観察されなかった.AKTがこれら3つの分子の上流分子であることを考えると,インスリンの時間変化率の情報はAKTの一過性の波形を介してS6KとGSK3βに通信されると考えられた.とくに,S6Kは刺激の速度にかかわらず一過性の波形のみを示したので,インスリンの時間変化率の情報はS6Kに対しもっとも強く通信されていると考えられた.
さらにこれらの分子の時間波形の特徴を明らかにするため,最終濃度の異なるパルス刺激を行った.パルス刺激とは,刺激をくわえある時間ののち刺激をなくす(減らす)ことで一過性の刺激をあたえる方法である(図1b).この研究では,パルス刺激をあたえることで刺激の時間変化率を固定し,そののち,異なる最終濃度にまでパルス刺激を減少させることで最終濃度に対する応答を検討した.その結果,シミュレーションと検証実験のどちらにおいても,刺激の最終濃度が低くなるにつれAKTとGSK3β,G6Paseの持続性の波形は減少した.つまり,これらの分子の持続性の波形にはインスリンの最終濃度の情報がコードされていると考えられた.その一方で,S6Kにはもともと持続性の波形がないためその減少は観察されなかった.AKTがこれら3つの分子の上流分子であることを考えると,インスリンの最終濃度の情報はAKTの持続性の波形を介してGSK3βとG6Paseに通信されると考えられた.とくに,G6Paseは最終濃度についてもっとも大きなダイナミックレンジを示したので,インスリンの最終濃度の情報はG6Paseに対しもっとも通信されていると考えられた.また,AKTとGSK3β,G6Paseはランプ刺激において刺激の時間変化率にかかわらず同じ値に到達した.この結果からも,インスリンの最終濃度の情報はAKTの持続性の波形を介してGSK3βとG6Paseに通信されることが示唆された.
このように,AKTに制御される3つの下流分子はAKTに多重にコードされたインスリンの時間変化率と最終濃度の情報を選択的に通信・処理していることが明らかになった.
4.AKTの下流分子はAKTにコードされた情報を制御構造や酵素の性質の違いにより選択的に通信・処理している
それでは,AKTに制御される3つの下流分子は,AKTに多重にコードされた情報をどのように選択的に通信しているのだろうか? モデルの解析と検証実験の結果,以下の3つの理由により,AKTに多重にコードされた情報を下流の分子が個別に通信・処理していることが明らかになった(図1b).
S6Kの制御構造はインコヒーレントな(“矛盾した”)フィードフォワードループ(incoherent feed-forward loop:IFFL)とよばれる構造であり4),AKTの時間変化率に応答して一過性の波形を示した.その一方で,GSK3βとG6Paseの制御構造はフィードフォワード(feed-forward:FF)であり,AKTの時間波形に追随するだけであった.その結果,S6Kはインスリンの刺激によりAKTに時間変化のあるときだけ一過性の応答を示した.また,S6KからmTORへの負のフィードバックループの構造でも同様の性質を示すことも確認された.
つぎに,GSK3βとG6Paseの時定数を求めた.時定数とは下流分子が上流分子にどのくらい速く追随できるかを示す指標であり,この値が小さいと上流分子に追随できる(同じ時間波形になる).GSK3βの時定数は1.6分であり,G6Paseの時定数は18.4分であった.GSK3βの時定数は十分に小さかったためAKTの一過性の波形と持続性の波形に十分に追随できた.しかし,G6Paseの時定数はAKTの一過性の波形に追随できるほど大きくはなかった.そのため,GSK3βはAKTの時間波形に十分に追随できたことで一過性の波形と持続性の波形を示し,G6PaseはAKTの一過性の波形に追随できなかったため持続性の波形のみを示した.
最後に,GSK3βとG6Paseの定常状態におけるAKTに対する50%効果濃度(EC50)を求めた.50%効果濃度とは上流分子に対する下流分子の感受性の指標であり,この値が小さいほど感受性は高い(わずかな変化でも大きな応答を示す).GSK3βの50%効果濃度は0.33であり,G6Paseの50%効果濃度は0.06であった.G6Paseの50%効果濃度は非常に小さかったため,定常状態におけるAKTのわずかな変動に対しても大きな応答を示した.このため,G6Paseは強い持続性の波形を示した.また,GSK3βはAKTに対し直線に近い応答を示した.これにより,G6Paseとは違いAKTから十分な量の情報を受け取ることができた5).
ここで示したような制御構造や酵素の性質の違いにより,AKTに制御される3つの下流分子はAKTに多重にコードされたインスリンの時間変化率と最終濃度の情報を選択的に通信・処理していることが明らかになった(図2).
5.インスリンの複数の時間波形はAKTに多重にコードされ下流分子により選択的に通信・処理される
このような特性をもつインスリン-AKTシグナル伝達経路の構成分子が血中のインスリンの時間波形をどのように通信・処理しているかについて検討した.さきにも述べたように,生体における血中のインスリンの時間波形には,追加分泌と基礎分泌,そして,約15分の周期をもつ波形の存在することが知られている.そこで,これらの時間波形を実験的に模倣した,120分のパルス刺激(追加分泌),濃度の変動のない定常状態の刺激(基礎分泌),そして,15分のパルス刺激(約15分の周期をもつ波形をあたえることは実験的にむずかしいため)について,シミュレーションと検証実験により検討した.その結果,S6Kは追加分泌や15分周期の波形には応答できるが基礎分泌には応答できない(時間変化率が小さいので応答できない)こと,GSK3βはすべての時間波形に応答できること(時定数が小さいためすべての時間波形に応答できる),さらに,G6Paseは追加分泌や基礎分泌には応答できるが(とくに,感受性が高いため基礎分泌を強調した),15分周期の波形には応答できない(時定数が大きいため速い変化に応答できない)ことが明らかになった(図2).これらの特性は,生体における応答をより反映していると考えられるラットの初代培養肝細胞においても確認された.
この研究により,インスリンの追加分泌や基礎分泌,15分周期の波形にコードされた時間変化率や濃度の情報がいったんAKTの時間波形に多重にコードされ,下流分子の制御構造や酵素の性質の違いにより個別に通信・処理されることで,選択的に下流分子を制御していることが明らかになった(図2).
おわりに
この研究は,シグナル分子は制御情報をコードする媒体であり,シグナル伝達経路のうえを伝わる時間パターンが情報の実態であるという“時間情報コード”という概念を提示した.とくに,生体において実際に使われている時間波形を模した刺激を用いたことで,従来の研究のようにシグナル伝達経路の特徴を明らかにしただけでなく,生物がこのシステムを用いて実際に生体において時間波形をどのように処理しているかについても明らかにした.多くのホルモンの分泌は周期性を示すこと,制御構造の違いや酵素の性質の違いはシグナル伝達経路においてありふれたものであることから,この概念は,インスリンの作用にとどまらずさまざまな生物現象に適用できる共通の概念であるものと思われる.また,時間情報コードの概念は,なぜ15分周期の波形が効果的なのかなど,インスリン作用機構の解明や糖尿病の治療といった応用につながるものと期待される.
文 献
- Behar, M. & Hoffmann, A.: Understanding the temporal codes of intra-cellular signals. Curr. Opin. Genet. Dev., 20, 684-693 (2010)[PubMed]
- Polonsky, K. S.: Twenty-four-hour profiles and pulsatile patterns of insulin secretion in normal and obese subjects. J. Clin. Invest., 81, 442-448 (1988)[PubMed]
- O'Rahilly, S., Turner, R. G. & Matthews, D. R.: Impaired pulsatile secretion of insulin in relatives of patients with non-insulin-dependent diabetes. N. Engl. J. Med., 318, 1225-1230 (1988)[PubMed]
- Ma, W., Trusina, A., Tang, C. et al.: Defining network topologies that can achieve biochemical adaptation. Cell, 138, 760-773 (2009)[PubMed]
- Yu, R. C., Pesce, C. G., Brent, R. et al.: Negative feedback that improves information transmission in yeast signalling. Nature, 456, 755-761 (2008)[PubMed]
著者プロフィール
略歴:2001年 東京大学大学院理学系研究科博士課程 修了,2002年 日本学術振興会特別研究員,2005年 産学官連携研究員を経て,2007年より東京大学大学院理学系研究科 助教.
研究テーマ:インスリンの時間波形により制御される分子の解析.
抱負:時間情報コードの概念は生物における制御原理のひとつであることを明らかにしたい.
黒田 真也(Shinya Kuroda)
東京大学大学院理学系研究科 教授.
研究室URL:http://kurodalab.bi.s.u-tokyo.ac.jp/ja/index.html
© 2012 久保田浩行・黒田真也 Licensed under CC 表示 2.1 日本