膜貫通型セマフォリンとその受容体との複合体の形成による視神経の交差ガイダンスの制御
桑島孝明・Carol Mason
(米国Columbia大学Departments of Pathology and Cell Biology)
email:桑島孝明
DOI: 10.7875/first.author.2012.070
Optic chiasm presentation of Semaphorin6D in the context of Plexin-A1 and Nr-CAM promotes retinal axon midline crossing.
Takaaki Kuwajima, Yutaka Yoshida, Noriko Takegahara, Timothy J. Petros, Atsushi Kumanogoh, Thomas M. Jessell, Takeshi Sakurai, Carol Mason
Neuron, 74, 676-690 (2012)
哺乳類では両眼の網膜視神経芽細胞からの神経軸索は視交差を経由し,外側漆状体などの視中枢に視覚の情報を伝達する.マウスの網膜の腹側領域からの軸索は前脳の正中線に存在する視交差を介して同じ側の脳へと投射し(非交差),腹側領域以外からの軸索は反対側の脳へと投射する(交差).この視交差を介した視神経の交差と非交差のガイダンスは両眼による立体視の獲得に必須である.以前の研究より非交差ガイダンスの分子機構は解明されているが,交差ガイダンスにかかわるタンパク質また制御機構についてはほとんど明らかにされていない.この研究により,マウスの視交差において,ガイダンスタンパク質であるセマフォリン6Dと細胞接着因子Nr-CAMが放射状グリア細胞に,セマフォリン6Dの受容体であるプレキシンA1が正中線に存在するニューロンに発現していることがわかった.セマフォリン6Dはそれのみでは網膜交差領域における神経軸索の伸展を阻害するが,Nr-CAMとプレキシンA1が存在すると神経軸索の伸展を促進することが明らかになった.網膜交差領域の神経軸索には同じくプレキシンA1とNr-CAMが発現しており,視交差からのシグナルを伝達し,これらタンパク質の相互作用により網膜交差領域の視神経軸索を視交差から誘引して正中線を通過させることで,交差ガイダンスを制御していることが明らかになった.これらの知見は,いままで不明であった視神経の交差ガイダンスの分子機構の解明,さらに,哺乳類が獲得した立体視に関する分子機構の解明にもつながるものと考えられる.
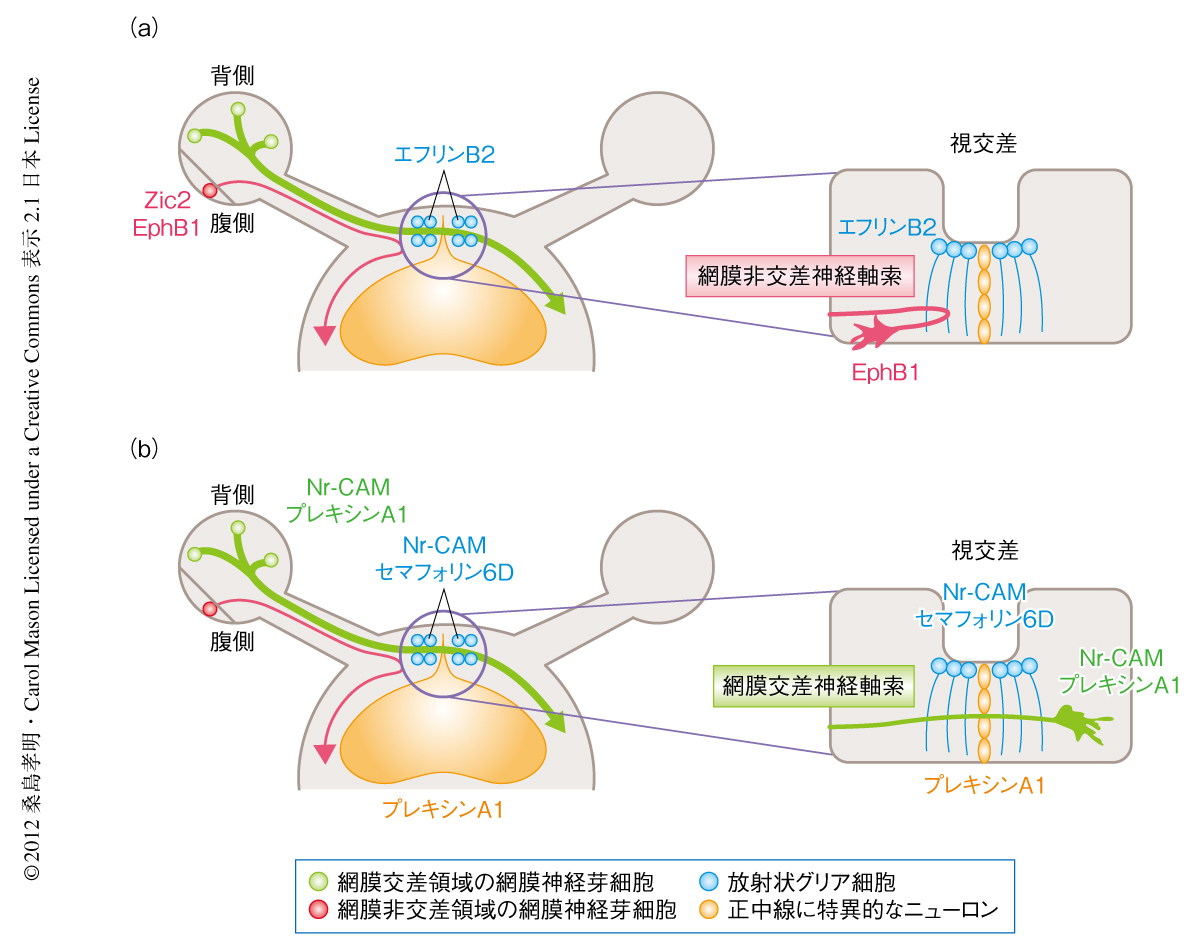
マウスでは網膜の腹側領域(非交差領域)からの軸索は視交差を介して同じ側の脳へと投射し,腹側領域以外(交差領域)からの軸索は反対側の脳へと投射しており,両眼からの神経軸索が交差あるいは非交差することで立体視を獲得している.視神経の交差ガイダンスは視神経軸索の伸展が活発に起こる胎生12日齢から生後0日齢のあいだに形成され,非交差ガイダンスは胎生14~17日齢にのみ形成される.以前の研究より非交差ガイダンスに関与する分子機構の一端が明らかにされており,そのひとつとして,チロシンキナーゼ受容体EphB1は胎生14~17日齢の網膜非交差領域において高発現し,そのリガンドであるエフリンB2が視交差の正中に発現してEphB1陽性の視細胞の神経突起を反発させることで,非交差領域の視神経を非交差に誘導している1).さらに,転写因子Zic2は胎生14~17日齢の網膜非交差領域において高発現し,EphB1の上流においてその発現を制御することにより同様に視神経を非交差に誘導している2,3)(図1a).しかし,両眼からの交差ガイダンスの分子機構については不明な点が多い.そこでこの研究では,マウスをモデル動物とし,発生期において確立される視神経の交差ガイダンスを制御するタンパク質を同定しその分子機構を解明することを目的とした.
以前の研究より,細胞接着因子Nr-CAMは胎生期の視交差の正中線の放射状グリア細胞に発現し,さらに,胎生12~18日齢の網膜交差領域(網膜の腹側領域以外),胎生17~18日齢では網膜の腹側領域(この時期には,網膜の腹側領域にも交差ガイダンスに関与する網膜視神経細胞が出現する)の網膜神経芽細胞にも発現し,交差ガイダンスの起こる領域において発現していることから,Nr-CAMは交差ガイダンスを制御するタンパク質である可能性が高いと考えられた.しかし,Nr-CAMノックアウトマウスにおいては胎生17~18日齢の網膜の腹側領域からの交差ガイダンスのみわずかな欠損がみられるだけで,胎生期における主要な交差ガイダンスを担う網膜交差領域(腹側以外の領域)からの交差ガイダンスの制御にはほかのタンパク質の存在が必須であると考えられた4).そこで,発生期の神経ガイダンスにおいて,Nr-CAMがガイダンスタンパク質であるセマフォリンと複合体を形成し神経ガイダンスを制御していることが報告されていたため5),視神経の交差ガイダンスも同様にセマフォリンとの協調により制御されているのではないかと推定した.分泌型セマフォリンであるセマフォリン3と膜貫通型セマフォリンであるセマフォリン6の発生期の視交差における発現パターンを調べたところ,セマフォリン6DがNr-CAMと同じ正中線の放射状グリア細胞において発現していることがわかった.セマフォリン6Dはその受容体であるプレキシンA1と結合することが報告されていたため6),プレキシンA1の発現パターンを調べたところ,視交差のもうひとつの細胞である正中線に特異的なニューロンにおいて発現していることが明らかになった(図1b).
視交差に発現しているセマフォリン6Dの視神経突起の伸展における機能を調べるため,受容体への結合を阻害するような抗セマフォリン6D抗体を作製した.胎生14.5日齢の網膜交差領域の移植片を視交差の分散細胞において共培養し,抗セマフォリン6D抗体を添加したところ,網膜交差領域における神経軸索の伸展は抗体のないときと比べ減少することがわかった.この結果から,視交差に発現するセマフォリン6Dは網膜交差領域における神経軸索の伸展に促進的にはたらくことがわかった.しかし,多くのセマフォリンは神経軸索の伸展に対し阻害的にはたらくことが知られている.セマフォリン6Dが網膜交差領域における神経軸索の伸展に促進的にはたらいていることをさらに確認するため,HEK細胞において全長のセマフォリン6Dを発現させ,このHEK細胞のうえで網膜交差領域の移植片を培養した.その結果,セマフォリン6Dの発現したHEK細胞では,発現していないHEK細胞に比べ神経軸索の伸展が顕著に減少することが明らかになった.
この2つの実験から,セマフォリン6Dは単独では網膜交差領域における神経軸索の伸展に対し阻害的にはたらくが,視交差に発現するほかのタンパク質がセマフォリン6Dの機能を変化させ,神経軸索の伸展を促進しているものと推定された.そこで,視交差の放射状グリア細胞にセマフォリン6Dと共発現しているNr-CAMと,視交差の正中線に存在するニューロンに発現しセマフォリン6Dの受容体であるプレキシンA1に注目した.視交差の放射状グリア細胞と同様にセマフォリン6DとNr-CAMとを共発現させたHEK細胞と,視交差の正中線に存在するニューロンと同様にプレキシンA1を発現させたHEK細胞を作製し,この2つのHEK細胞を混合したうえで網膜交差領域の移植片を培養した.その結果,セマフォリン6D,Nr-CAM,プレキシンA1の三者が発現したHEK細胞では網膜交差領域における神経軸索の伸展は促進されることがわかった.以上の結果から,セマフォリン6D単独では網膜交差領域における神経軸索の伸展に対し阻害的にはたらくが,Nr-CAMとプレキシンA1が存在するとセマフォリン6Dは神経軸索の伸展に対し促進的にはたらくことが明らかになった.
培養細胞を使用した実験から,視交差およびHEK細胞に発現させたセマフォリン6D,Nr-CAM,プレキシンA1は網膜交差領域における神経軸索の伸展に特異的な影響を及ぼしており,セマフォリン6Dのシグナルを伝達する受容体が網膜交差領域に発現しているものと推定された.そこで,胎生14.5日齢の網膜においてセマフォリン6Dの受容体であるプレキシンA1の発現を調べたところ網膜交差領域において特異的に発現していることがわかった.また,Nr-CAMも網膜交差領域においてプレキシンA1と共発現し,両者とも網膜非交差領域に発現している転写因子Zic2とは共発現していないことが明らかになった(図1b).
この結果から,網膜交差領域に発現するプレキシンA1およびNr-CAMがセマフォリン6Dのシグナルを伝達していると推定されたため,プレキシンA1ノックアウトマウス,Nr-CAMノックアウトマウス,および,プレキシンA1 Nr-CAMダブルノックアウトマウスに由来する網膜交差領域の移植片と野生型マウスに由来する視交差の分散細胞とを共培養し,そこでの神経軸索の伸展の変化について検討した.視交差の分散細胞のうえで培養したプレキシンA1ノックアウトマウスおよびNr-CAMノックアウトマウスに由来する網膜交差領域からの神経軸索は,野生型マウスに由来する網膜からの神経軸索に比べ顕著に短く,プレキシンA1 Nr-CAMダブルノックアウトマウスに由来する神経軸索は単独のノックアウトマウスに比べさらに減少していることが明らかになった.つぎに,これらの神経軸索の伸展の減少が視交差におけるセマフォリン6Dシグナルに依存した現象であるかどうかを検討するため,セマフォリン6D,Nr-CAM,プレキシンA1の三者が発現しているHEK細胞のうえで,プレキシンA1ノックアウトマウス,Nr-CAMノックアウトマウス,および,プレキシンA1 Nr-CAMダブルノックアウトマウスに由来する網膜交差領域の移植片を培養し,そこでの神経軸索の伸展の変化について検討した.視交差の分散細胞のうえでの結果と同様に,プレキシンA1ノックアウトマウスおよびNr-CAMノックアウトマウスに由来する神経軸索の伸展においては,野生型マウスに由来する神経軸索の伸展に比べ促進能が減少し,プレキシンA1 Nr-CAMダブルノックアウトマウスでは神経軸索の伸展はまったく促進されないことが明らかになった.
さらに,種々の結合実験から,Nr-CAMはセマフォリン6Dの新規の受容体であり,また,Nr-CAMはプレキシンA1と結合することでセマフォリン6Dの結合能を上昇させていることがわかった.これらの結果から,網膜交差領域に発現するプレキシンA1とNr-CAMが視交差からのセマフォリン6Dのシグナルを伝達し,網膜交差領域における神経軸索の伸展を制御しているものと考えられた.
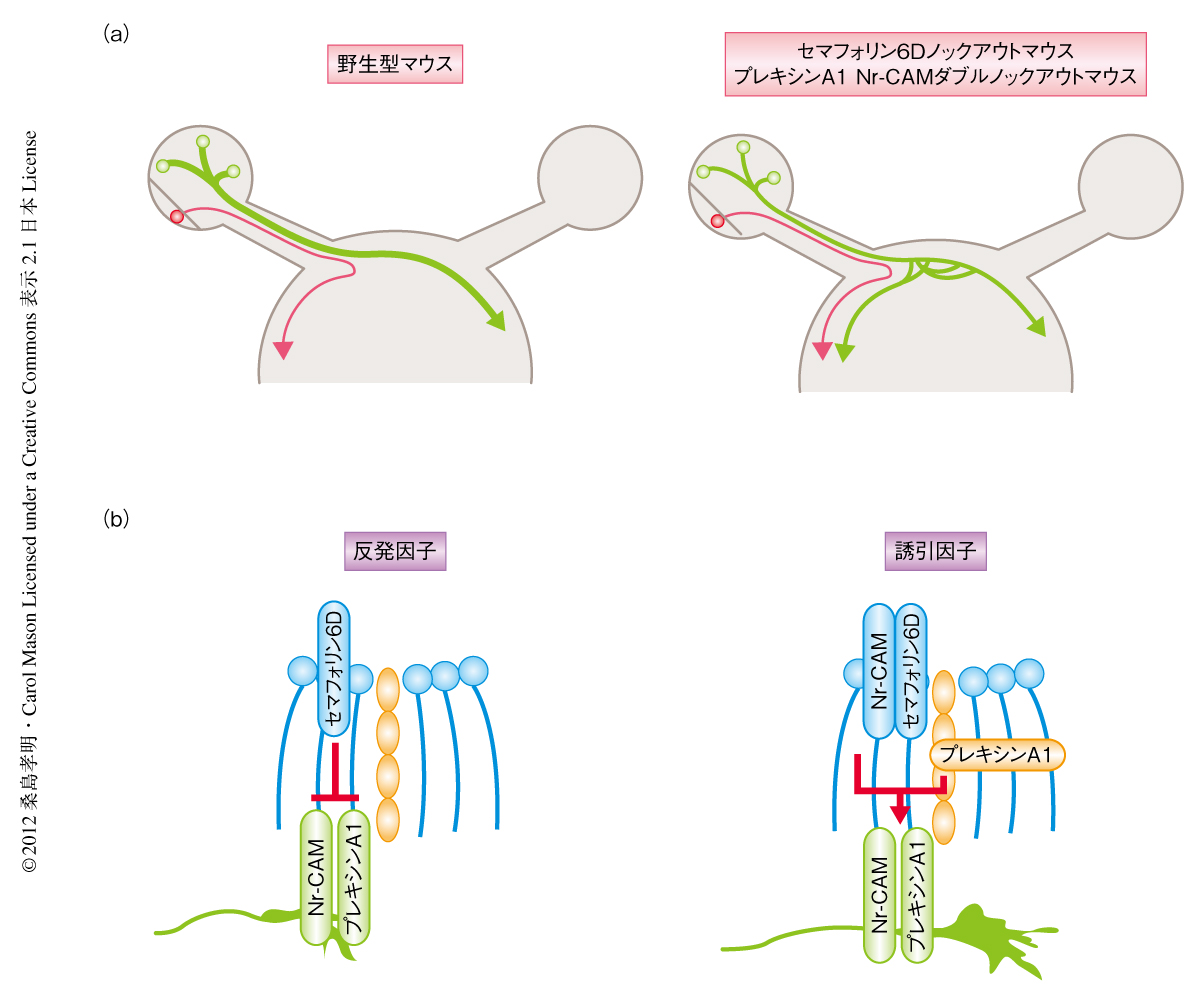
以上の培養実験の結果から,セマフォリン6D,Nr-CAM,プレキシンA1の三者が生体において網膜交差領域からの視神経の交差ガイダンスを制御しているものと推定された.そこで,胎生15日目のセマフォリン6Dノックアウトマウス,プレキシンA1ノックアウトマウス,Nr-CAMノックアウトマウス,および,プレキシンA1 Nr-CAMダブルノックアウトマウスの片眼にトレーサーを注入し,視交差における視神経の交差ガイダンスに変化がみられるかどうか検討した.これらのノックアウトマウスのうち,セマフォリン6DノックアウトマウスとプレキシンA1 Nr-CAMダブルノックアウトマウスにおいて,網膜交差領域からの視神経軸索の一部は交差できず視交差において同じ側の脳に投射することが明らかになった(図2a).胎生後期(胎生18~19日目)や生後においても,セマフォリン6DノックアウトマウスとプレキシンA1 Nr-CAMダブルノックアウトマウスには同様の表現型がみられた.これら個体レベルでの実験から,セマフォリン6D,Nr-CAM,プレキシンA1の三者が網膜交差領域からの視神経の交差ガイダンスを制御していることが明らかになった.
以上の結果から,ガイダンスタンパク質であるセマフォリン6Dが視交差に発現し,プレキシンA1とNr-CAMが網膜交差領域の神経軸索と視交差において別々の細胞に発現し,これらのタンパク質が巧妙に相互作用することでセマフォリン6Dの機能を反発因子から誘引因子へと変換し,網膜交差領域からの神経軸索を視交差において誘引することで視神経の交差ガイダンスを制御していることが明らかになった(図2b).しかし,セマフォリン6DノックアウトマウスやプレキシンA1 Nr-CAMダブルノックアウトマウスでは網膜交差領域からの視神経軸索のうち一部のみが同じ側の脳に投射することから,ほかのタンパク質も視神経の交差ガイダンスを制御していることが考えられる.そのひとつとして,最近,網膜交差領域にセマフォリンの別の受容体であるNeuropilin1が発現し,そのリガンドであるVEGFが視交差に発現し網膜交差領域の神経軸索を誘引することで視神経の交差ガイダンスを制御していることが報告された7).これらの知見は,いままで不明であった視神経の交差ガイダンスの分子機構の解明,さらに,哺乳類が獲得した立体視に関する分子機構の解明にもつながると考えられる.また,これらの神経ガイダンスタンパク質とその受容体による相互作用やそれにともなう機能に関する新たな分子機構は,視神経のガイダンスのみならず,脊髄や前脳における神経ガイダンスにも適用され広く認知されるものと考えられる.
略歴:2006年 大阪大学大学院理学研究科 修了.同年より米国Columbia大学Associate Research Scientist.
研究テーマ:視神経のガイダンスの制御機構の解明とその応用.
抱負:眼を“知る”ことから,将来,再生にむけ眼を“創る”ことに焦点をあてたい.
Carol Mason
米国Columbia大学Professor.
© 2012 桑島孝明・Carol Mason Licensed under CC 表示 2.1 日本
(米国Columbia大学Departments of Pathology and Cell Biology)
email:桑島孝明
DOI: 10.7875/first.author.2012.070
Optic chiasm presentation of Semaphorin6D in the context of Plexin-A1 and Nr-CAM promotes retinal axon midline crossing.
Takaaki Kuwajima, Yutaka Yoshida, Noriko Takegahara, Timothy J. Petros, Atsushi Kumanogoh, Thomas M. Jessell, Takeshi Sakurai, Carol Mason
Neuron, 74, 676-690 (2012)
要 約
哺乳類では両眼の網膜視神経芽細胞からの神経軸索は視交差を経由し,外側漆状体などの視中枢に視覚の情報を伝達する.マウスの網膜の腹側領域からの軸索は前脳の正中線に存在する視交差を介して同じ側の脳へと投射し(非交差),腹側領域以外からの軸索は反対側の脳へと投射する(交差).この視交差を介した視神経の交差と非交差のガイダンスは両眼による立体視の獲得に必須である.以前の研究より非交差ガイダンスの分子機構は解明されているが,交差ガイダンスにかかわるタンパク質また制御機構についてはほとんど明らかにされていない.この研究により,マウスの視交差において,ガイダンスタンパク質であるセマフォリン6Dと細胞接着因子Nr-CAMが放射状グリア細胞に,セマフォリン6Dの受容体であるプレキシンA1が正中線に存在するニューロンに発現していることがわかった.セマフォリン6Dはそれのみでは網膜交差領域における神経軸索の伸展を阻害するが,Nr-CAMとプレキシンA1が存在すると神経軸索の伸展を促進することが明らかになった.網膜交差領域の神経軸索には同じくプレキシンA1とNr-CAMが発現しており,視交差からのシグナルを伝達し,これらタンパク質の相互作用により網膜交差領域の視神経軸索を視交差から誘引して正中線を通過させることで,交差ガイダンスを制御していることが明らかになった.これらの知見は,いままで不明であった視神経の交差ガイダンスの分子機構の解明,さらに,哺乳類が獲得した立体視に関する分子機構の解明にもつながるものと考えられる.
はじめに
マウスでは網膜の腹側領域(非交差領域)からの軸索は視交差を介して同じ側の脳へと投射し,腹側領域以外(交差領域)からの軸索は反対側の脳へと投射しており,両眼からの神経軸索が交差あるいは非交差することで立体視を獲得している.視神経の交差ガイダンスは視神経軸索の伸展が活発に起こる胎生12日齢から生後0日齢のあいだに形成され,非交差ガイダンスは胎生14~17日齢にのみ形成される.以前の研究より非交差ガイダンスに関与する分子機構の一端が明らかにされており,そのひとつとして,チロシンキナーゼ受容体EphB1は胎生14~17日齢の網膜非交差領域において高発現し,そのリガンドであるエフリンB2が視交差の正中に発現してEphB1陽性の視細胞の神経突起を反発させることで,非交差領域の視神経を非交差に誘導している1).さらに,転写因子Zic2は胎生14~17日齢の網膜非交差領域において高発現し,EphB1の上流においてその発現を制御することにより同様に視神経を非交差に誘導している2,3)(図1a).しかし,両眼からの交差ガイダンスの分子機構については不明な点が多い.そこでこの研究では,マウスをモデル動物とし,発生期において確立される視神経の交差ガイダンスを制御するタンパク質を同定しその分子機構を解明することを目的とした.
1.発生期の視交差にはセマフォリン6D,Nr-CAM,プレキシンA1が発現している
以前の研究より,細胞接着因子Nr-CAMは胎生期の視交差の正中線の放射状グリア細胞に発現し,さらに,胎生12~18日齢の網膜交差領域(網膜の腹側領域以外),胎生17~18日齢では網膜の腹側領域(この時期には,網膜の腹側領域にも交差ガイダンスに関与する網膜視神経細胞が出現する)の網膜神経芽細胞にも発現し,交差ガイダンスの起こる領域において発現していることから,Nr-CAMは交差ガイダンスを制御するタンパク質である可能性が高いと考えられた.しかし,Nr-CAMノックアウトマウスにおいては胎生17~18日齢の網膜の腹側領域からの交差ガイダンスのみわずかな欠損がみられるだけで,胎生期における主要な交差ガイダンスを担う網膜交差領域(腹側以外の領域)からの交差ガイダンスの制御にはほかのタンパク質の存在が必須であると考えられた4).そこで,発生期の神経ガイダンスにおいて,Nr-CAMがガイダンスタンパク質であるセマフォリンと複合体を形成し神経ガイダンスを制御していることが報告されていたため5),視神経の交差ガイダンスも同様にセマフォリンとの協調により制御されているのではないかと推定した.分泌型セマフォリンであるセマフォリン3と膜貫通型セマフォリンであるセマフォリン6の発生期の視交差における発現パターンを調べたところ,セマフォリン6DがNr-CAMと同じ正中線の放射状グリア細胞において発現していることがわかった.セマフォリン6Dはその受容体であるプレキシンA1と結合することが報告されていたため6),プレキシンA1の発現パターンを調べたところ,視交差のもうひとつの細胞である正中線に特異的なニューロンにおいて発現していることが明らかになった(図1b).
2.セマフォリン6Dは網膜交差領域における神経軸索の伸長を阻害するがNr-CAMおよびプレキシンA1が存在すると神経軸索の伸長を促進する
視交差に発現しているセマフォリン6Dの視神経突起の伸展における機能を調べるため,受容体への結合を阻害するような抗セマフォリン6D抗体を作製した.胎生14.5日齢の網膜交差領域の移植片を視交差の分散細胞において共培養し,抗セマフォリン6D抗体を添加したところ,網膜交差領域における神経軸索の伸展は抗体のないときと比べ減少することがわかった.この結果から,視交差に発現するセマフォリン6Dは網膜交差領域における神経軸索の伸展に促進的にはたらくことがわかった.しかし,多くのセマフォリンは神経軸索の伸展に対し阻害的にはたらくことが知られている.セマフォリン6Dが網膜交差領域における神経軸索の伸展に促進的にはたらいていることをさらに確認するため,HEK細胞において全長のセマフォリン6Dを発現させ,このHEK細胞のうえで網膜交差領域の移植片を培養した.その結果,セマフォリン6Dの発現したHEK細胞では,発現していないHEK細胞に比べ神経軸索の伸展が顕著に減少することが明らかになった.
この2つの実験から,セマフォリン6Dは単独では網膜交差領域における神経軸索の伸展に対し阻害的にはたらくが,視交差に発現するほかのタンパク質がセマフォリン6Dの機能を変化させ,神経軸索の伸展を促進しているものと推定された.そこで,視交差の放射状グリア細胞にセマフォリン6Dと共発現しているNr-CAMと,視交差の正中線に存在するニューロンに発現しセマフォリン6Dの受容体であるプレキシンA1に注目した.視交差の放射状グリア細胞と同様にセマフォリン6DとNr-CAMとを共発現させたHEK細胞と,視交差の正中線に存在するニューロンと同様にプレキシンA1を発現させたHEK細胞を作製し,この2つのHEK細胞を混合したうえで網膜交差領域の移植片を培養した.その結果,セマフォリン6D,Nr-CAM,プレキシンA1の三者が発現したHEK細胞では網膜交差領域における神経軸索の伸展は促進されることがわかった.以上の結果から,セマフォリン6D単独では網膜交差領域における神経軸索の伸展に対し阻害的にはたらくが,Nr-CAMとプレキシンA1が存在するとセマフォリン6Dは神経軸索の伸展に対し促進的にはたらくことが明らかになった.
3.Nr-CAMとプレキシンA1は網膜交差領域に発現しセマフォリン6Dのシグナルを伝達する
培養細胞を使用した実験から,視交差およびHEK細胞に発現させたセマフォリン6D,Nr-CAM,プレキシンA1は網膜交差領域における神経軸索の伸展に特異的な影響を及ぼしており,セマフォリン6Dのシグナルを伝達する受容体が網膜交差領域に発現しているものと推定された.そこで,胎生14.5日齢の網膜においてセマフォリン6Dの受容体であるプレキシンA1の発現を調べたところ網膜交差領域において特異的に発現していることがわかった.また,Nr-CAMも網膜交差領域においてプレキシンA1と共発現し,両者とも網膜非交差領域に発現している転写因子Zic2とは共発現していないことが明らかになった(図1b).
この結果から,網膜交差領域に発現するプレキシンA1およびNr-CAMがセマフォリン6Dのシグナルを伝達していると推定されたため,プレキシンA1ノックアウトマウス,Nr-CAMノックアウトマウス,および,プレキシンA1 Nr-CAMダブルノックアウトマウスに由来する網膜交差領域の移植片と野生型マウスに由来する視交差の分散細胞とを共培養し,そこでの神経軸索の伸展の変化について検討した.視交差の分散細胞のうえで培養したプレキシンA1ノックアウトマウスおよびNr-CAMノックアウトマウスに由来する網膜交差領域からの神経軸索は,野生型マウスに由来する網膜からの神経軸索に比べ顕著に短く,プレキシンA1 Nr-CAMダブルノックアウトマウスに由来する神経軸索は単独のノックアウトマウスに比べさらに減少していることが明らかになった.つぎに,これらの神経軸索の伸展の減少が視交差におけるセマフォリン6Dシグナルに依存した現象であるかどうかを検討するため,セマフォリン6D,Nr-CAM,プレキシンA1の三者が発現しているHEK細胞のうえで,プレキシンA1ノックアウトマウス,Nr-CAMノックアウトマウス,および,プレキシンA1 Nr-CAMダブルノックアウトマウスに由来する網膜交差領域の移植片を培養し,そこでの神経軸索の伸展の変化について検討した.視交差の分散細胞のうえでの結果と同様に,プレキシンA1ノックアウトマウスおよびNr-CAMノックアウトマウスに由来する神経軸索の伸展においては,野生型マウスに由来する神経軸索の伸展に比べ促進能が減少し,プレキシンA1 Nr-CAMダブルノックアウトマウスでは神経軸索の伸展はまったく促進されないことが明らかになった.
さらに,種々の結合実験から,Nr-CAMはセマフォリン6Dの新規の受容体であり,また,Nr-CAMはプレキシンA1と結合することでセマフォリン6Dの結合能を上昇させていることがわかった.これらの結果から,網膜交差領域に発現するプレキシンA1とNr-CAMが視交差からのセマフォリン6Dのシグナルを伝達し,網膜交差領域における神経軸索の伸展を制御しているものと考えられた.
4.セマフォリン6D,Nr-CAM,プレキシンA1の三者は網膜交差領域からの視神経の交差ガイダンスを制御している
以上の培養実験の結果から,セマフォリン6D,Nr-CAM,プレキシンA1の三者が生体において網膜交差領域からの視神経の交差ガイダンスを制御しているものと推定された.そこで,胎生15日目のセマフォリン6Dノックアウトマウス,プレキシンA1ノックアウトマウス,Nr-CAMノックアウトマウス,および,プレキシンA1 Nr-CAMダブルノックアウトマウスの片眼にトレーサーを注入し,視交差における視神経の交差ガイダンスに変化がみられるかどうか検討した.これらのノックアウトマウスのうち,セマフォリン6DノックアウトマウスとプレキシンA1 Nr-CAMダブルノックアウトマウスにおいて,網膜交差領域からの視神経軸索の一部は交差できず視交差において同じ側の脳に投射することが明らかになった(図2a).胎生後期(胎生18~19日目)や生後においても,セマフォリン6DノックアウトマウスとプレキシンA1 Nr-CAMダブルノックアウトマウスには同様の表現型がみられた.これら個体レベルでの実験から,セマフォリン6D,Nr-CAM,プレキシンA1の三者が網膜交差領域からの視神経の交差ガイダンスを制御していることが明らかになった.
おわりに
以上の結果から,ガイダンスタンパク質であるセマフォリン6Dが視交差に発現し,プレキシンA1とNr-CAMが網膜交差領域の神経軸索と視交差において別々の細胞に発現し,これらのタンパク質が巧妙に相互作用することでセマフォリン6Dの機能を反発因子から誘引因子へと変換し,網膜交差領域からの神経軸索を視交差において誘引することで視神経の交差ガイダンスを制御していることが明らかになった(図2b).しかし,セマフォリン6DノックアウトマウスやプレキシンA1 Nr-CAMダブルノックアウトマウスでは網膜交差領域からの視神経軸索のうち一部のみが同じ側の脳に投射することから,ほかのタンパク質も視神経の交差ガイダンスを制御していることが考えられる.そのひとつとして,最近,網膜交差領域にセマフォリンの別の受容体であるNeuropilin1が発現し,そのリガンドであるVEGFが視交差に発現し網膜交差領域の神経軸索を誘引することで視神経の交差ガイダンスを制御していることが報告された7).これらの知見は,いままで不明であった視神経の交差ガイダンスの分子機構の解明,さらに,哺乳類が獲得した立体視に関する分子機構の解明にもつながると考えられる.また,これらの神経ガイダンスタンパク質とその受容体による相互作用やそれにともなう機能に関する新たな分子機構は,視神経のガイダンスのみならず,脊髄や前脳における神経ガイダンスにも適用され広く認知されるものと考えられる.
文 献
- Williams, S. E., Mann, F., Erskine, L. et al.: Ephrin-B2 and EphB1 mediate retinal axon divergence at the optic chiasm. Neuron, 39, 919-935 (2003)[PubMed]
- Herrera, E., Brown, L., Aruga, J. et al.: Zic2 patterns binocular vision by specifying the uncrossed retinal projection. Cell, 114, 545-557 (2003)[PubMed]
- Lee, R., Petros, T. J., Mason, C. A.: Zic2 regulates retinal ganglion cell axon avoidance of ephrinB2 through inducing expression of the guidance receptor EphB1. J. Neurosci., 28, 5910-5919 (2004)[PubMed]
- Williams, S. E., Grumet, M., Colman, D. R. et al.: A role for Nr-CAM in the patterning of binocular visual pathways. Neuron, 50, 535-547 (2006)[PubMed]
- Falk, J., Bechara, A., Fiore, R. et al.: Dual functional activity of semaphorin 3B is required for positioning the anterior commissure. Neuron, 48, 63-75 (2005)[PubMed]
- Yoshida, Y., Han, B., Mendelsohn, M. et al.: PlexinA1 signaling directs the segregation of proprioceptive sensory axons in the developing spinal cord. Neuron, 52, 775-788 (2006)[PubMed]
- Erskine, L., Reijntjes, S., Pratt, T. et al.: VEGF signaling through neuropilin 1 guides commissural axon crossing at the optic chiasm. Neuron, 70, 951-965 (2011)[PubMed]
著者プロフィール
略歴:2006年 大阪大学大学院理学研究科 修了.同年より米国Columbia大学Associate Research Scientist.
研究テーマ:視神経のガイダンスの制御機構の解明とその応用.
抱負:眼を“知る”ことから,将来,再生にむけ眼を“創る”ことに焦点をあてたい.
Carol Mason
米国Columbia大学Professor.
© 2012 桑島孝明・Carol Mason Licensed under CC 表示 2.1 日本