減数分裂前期の相同染色体の認識と対合に非コードRNAが関与する
丁 大橋・平岡 泰
(情報通信研究機構未来ICT研究所 バイオICT研究室)
email:丁 大橋
DOI: 10.7875/first.author.2012.069
Meiosis-specific non-coding RNA mediates robust pairing of homologous chromosomes in meiosis.
Da-Qiao Ding, Kasumi Okamasa, Miho Yamane, Chihiro Tsutsumi, Tokuko Haraguchi, Masayuki Yamamoto, Yasushi Hiraoka
Science, 336, 732-736 (2012)
減数分裂における相同染色体の組換えは,第1減数分裂における還元型の染色体分配に必須である.相同組換えにさきだち相同染色体どうしが互いに認識し対合する必要があるが,相同染色体の相互認識の分子機構についてはほとんど解明されていない.筆者らは,分裂酵母の第2染色体にあるsme2遺伝子から転写される減数分裂に特異的な非コードRNAが,相同染色体の相互認識に寄与していることを発見した.sme2遺伝子の付近の染色体領域は減数分裂前期の初期から相同組換えに依存しない高い対合頻度を示し,それはsme2遺伝子の転写産物であるmeiRNA-Lがsme2遺伝子座に集積することによりひき起こされていた.sme2遺伝子を本来の遺伝子座から別の染色体へと移動すると,本来の遺伝子座の付近での染色体の対合は抑えられ,sme2遺伝子の移動した染色体領域の付近では組換えに非依存的に相同染色体の対合が促進された.この発見により,減数分裂前期において転写され染色体に滞留するRNAが,染色体の相互認識に積極的な役割をはたしていることが示された.
有性生殖の基本をつかさどる減数分裂の分子機構の解明は,基礎生物学においても医学的な観点からも非常に重要である.減数分裂前期のおもなイベントとして,DNAの複製,相同染色体の対合,シナプトネマ複合体の形成と組換えがある.このうち,相同染色体の対合は親世代から受け継いだ相同染色体が互いどうしをみつけ接着する過程であり,正常な対合が相同組換えおよび相同染色体の還元型の分配に不可欠である.相同染色体の対合に関する研究は減数分裂の初期段階において非常に重要で,とくに相同染色体の相互認識の機構がもっとも謎にみちた問題であり,いまだ不明なことが多い1).
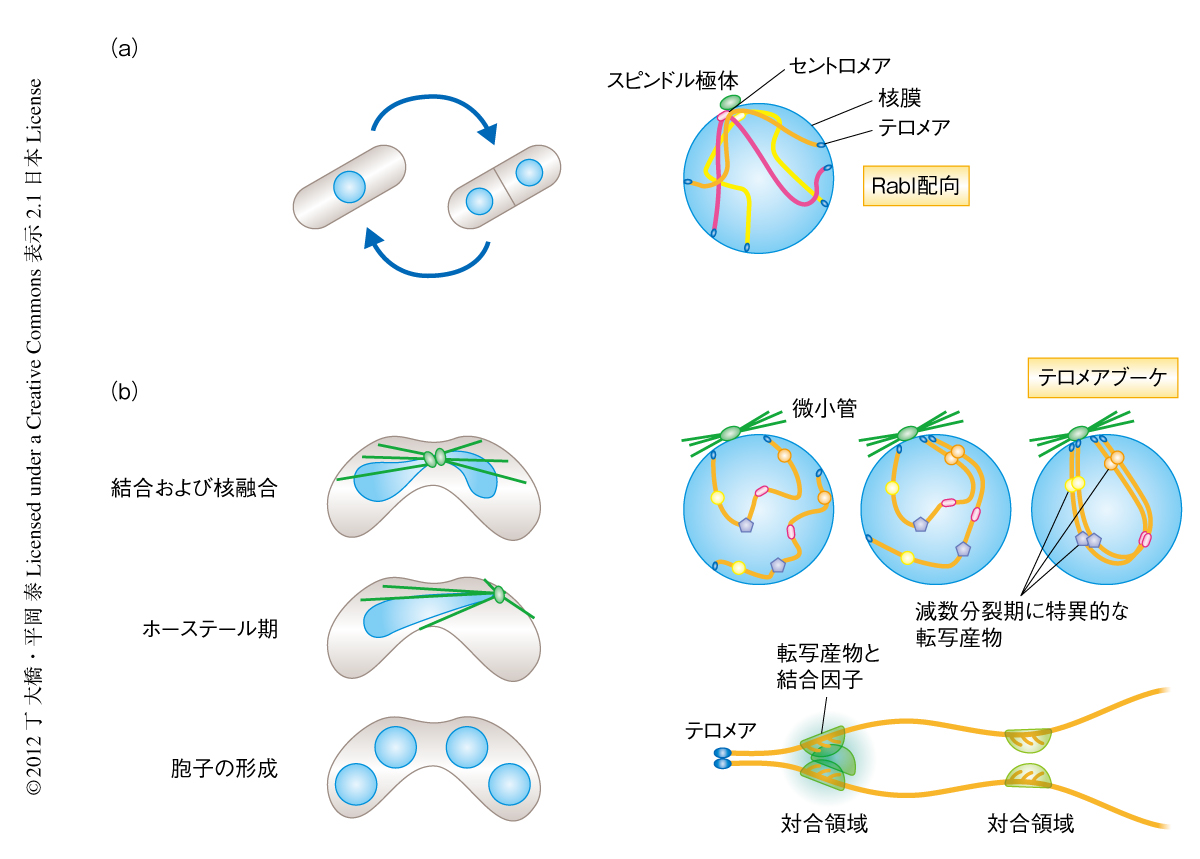
近年の筆者らの研究により,テロメアブーケの形成およびテロメアの先導する核の運動が,核において相同染色体を整列させ空間的に接近させるため必要であることが明らかになってきた2-4).テロメアブーケとは,減数分裂前期においてすべての染色体末端のテロメアが核膜の一箇所に集合し染色体を花束のように束ねる現象で,酵母から植物や哺乳類まで共通にみられる5).分裂酵母では,窒素源の枯渇により減数分裂が誘導され,接合型(性別)の異なる1倍体細胞が接合し,核融合をへて2倍体細胞になる.核融合の過程と同時にテロメアがスピンドル極体(spindle pole body:SPB)に集合し,ホーステール核(horsetail nucleus)とよばれるテロメアブーケを形成する2)(図1).分裂酵母のホーステール期は減数分裂前期に相当し,約2時間のホーステール期に核はたえず往復運動し相同染色体の対合および組換えが行われる.筆者らは,染色体領域を可視化して対合の生細胞観察を行うことにより,ブーケ配向と核の運動とが相同染色体を空間的に近づかせ,さらに,相同組換えが安定な染色体の対合を実現することをすでに明らかにしていた3).しかし,空間的に近づいた染色体がどのように相同なパートナーをみつけ対になるのかは謎であった.
筆者らは,分裂酵母を用いて相同染色体の対合を研究してきた.分裂酵母ではMei2という減数分裂を制御するタンパク質が存在し,そのタンパク質はホーステール期においてsme2遺伝子座にドットを形成する6).2倍体のホーステール核にsme2遺伝子座は2つあるにもかかわらずMei2ドットは1つしか観察されないことから,sme2遺伝子座が対合しやすいという可能性が示唆された.sme2遺伝子座の対合を調べるため,その近傍にlacOリピート配列を挿入し,この配列に結合するLacIをGFPにより標識したものを発現させることにより染色体領域を可視化した.その結果,これまでに調べたテロメア以外のどの染色体領域よりも,sme2遺伝子座は高い対合率を示すことがわかった.これまで調べた染色体領域ではホーステール期の進行とともに対合頻度は20%から80%まで徐々に上昇するのが典型的で,この上昇は相同組換えに依存する.しかし,sme2遺伝子座はホーステール期の初期から約70%の対合率を示し,しかも,相同組換えを必要としなかった.sme2遺伝子を別の染色体に移動すると,もとの遺伝子座での対合頻度は減少し,sme2遺伝子の移動した遺伝子座の対合頻度は相同組換えに非依存的に上昇したことから,sme2遺伝子は相同組換えに非依存的に対合を強く促進することがわかった.
一方,sme2遺伝子座の対合はテロメアブーケの形成と核の運動とに依存した.テロメアクラスターの形成あるいは核の運動の欠損株では,sme2遺伝子座もほかの染色体領域と同様に対合できなかった.これは,sme2遺伝子座の対合は相同染色体の整列したあとにはたらいていることを意味していた.おもしろいことに,本来の第2染色体にsme2遺伝子座をもつ1倍体細胞と,sme2遺伝子座を第1染色体に移動した1倍体細胞とを掛け合わせると,約30%の細胞において,異なる染色体にある2つのsme2遺伝子が一時的に異所的な対合をした.このことから,sme2遺伝子座は非相同染色体に存在する状況でも互いを認識する能力のあることが示唆された.しかし,この異所的な対合は一過的であり,やがて離れてしまった.
sme2遺伝子による対合の生物学的な意味を知るため,相同組換え率を調べた.組換えマーカーの近くにsme2遺伝子があると,sme2遺伝子のない場合より相同組換え率が約1.6倍高くなった.また,sme2遺伝子による対合促進作用の影響の範囲を調べたところ,sme2遺伝子から200 kb以内の範囲で有効であった.以上の結果から,sme2遺伝子座は対合のホットスポットであり,相同染色体の相互認識,対合および組換えを促進する役割をはたしていることが明らかになった.
sme2遺伝子はタンパク質をコードしない,約1.5 kbの減数分裂期に特異的なmeiRNA-Lという非コードRNAをコードする7,8).sme2遺伝子のプロモーター領域を削除する,または,転写の開始に必要なTATAボックスに変異を導入すると,meiRNA-Lの転写は大きく減少し対合も完全に阻害された.このことから,sme2遺伝子の転写産物であるmeiRNA-Lが対合に必須であることが明らかになった.さらに,相同染色体の片方だけからの転写では対合の促進は起こらなかったことから,相同染色体の双方からの転写が対合に必要であることが明らかになった.
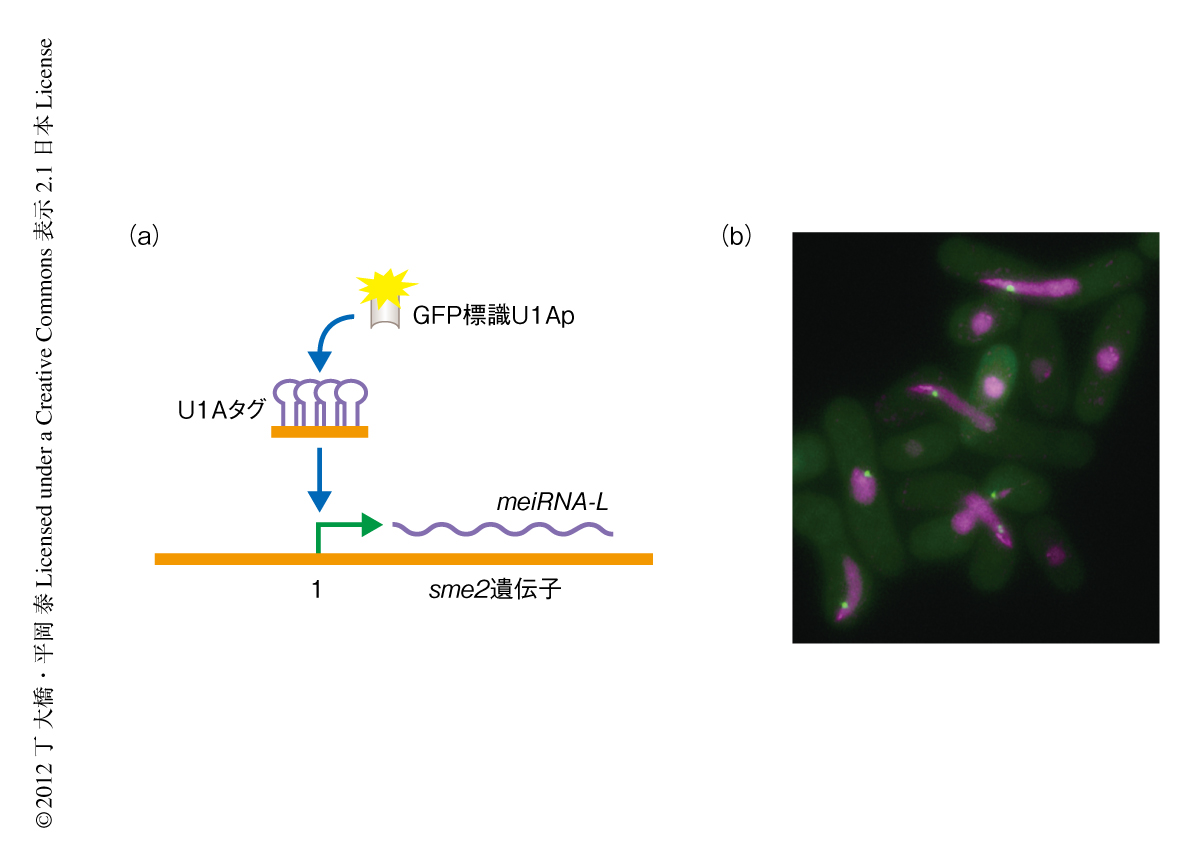
さらにmeiRNA-Lの局在を調べるため,sme2遺伝子の5’末端にU1Aタグ配列を挿入し,この配列に結合するU1ApをGFPにより標識したものを発現させることによりmeiRNA-Lを可視化した(図2a).その結果,meiRNA-Lは染色体に集積しMei2ドットと共局在することがわかった(図2b).また,sme2遺伝子の3’末端には複数のポリA付加シグナルが存在するが,それを欠損すると転写の読み過ごし(リードスルー)が起こり長いmRNAが検出された.このような欠損株ではsme2遺伝子座の対合の促進はみられなかった.そのような長いRNAの局在を観察すると,核の全体にわたり複数の小さいRNAのドットが特定の場所もなく観察されたことから,リードスルーしたRNAは転写部位にとどまることのできないことがわかった.これらの事実から,sme2遺伝子座に滞留するmeiRNA-Lドットが相同染色体の対合をひき起こす要因であることが示された.
Mei2は分裂酵母において減数分裂の進行に必須なタンパク質であり,sme2遺伝子はMei2の温度感受性欠損を抑制することでクローニングされた遺伝子である.Mei2にはRNA結合ドメインが存在し,Mei2との結合によりsme2遺伝子が制御されている可能性のあることから,Mei2ドットとsme2遺伝子との関係を分離させることを試みた.sme2遺伝子の5’側の574塩基を除くことにより核においてMei2ドットが形成されなくなったが,この5’側を欠損したmeiRNA-Lは依然として全長のRNAと同じ場所にRNAのドットを形成し野生株と同様に対合を促進した.したがって,sme2遺伝子の5’側はMei2ドットの形成に必要であるが,Mei2はmeiRNA-Lの蓄積や対合には必要ではないことがわかった.
一方,Mei2ドットと共局在するもうひとつのタンパク質をしてMmi1があり,これは栄養増殖に必須である.Mmi1は栄養増殖期の細胞において減数分裂に特異的なmRNAを認識し,これをエキソソームにひきわたし分解させることで減数分裂期への進行を抑制し栄養増殖期を維持する.Mmi1の変異株では減数分裂に特異的なmRNAが分解されず栄養増殖が阻害される.meiRNA-Lの3’側には多数のMmi1認識モチーフが存在し,減数分裂期になるとMmi1はmeiRNA-Lドットに集合する結果,減数分裂に特異的なmRNAは分解をまぬがれ減数分裂が正常に進行できるようになる9).sme2遺伝子の5’側の574塩基を除いた変異株においてもMmi1はRNAのドットに集まり,減数分裂は正常に進行し野生株と同様に対合を促進した.さらに,mmi1-48変異株では野生株よりも対合が促進された.これは,meiRNA-Lの量あるいは安定性が上昇したためと思われた.この結果は,染色体に滞留するRNAが対合を促進するという結論を支持した.
哺乳類,植物や真菌類では,DNA切断をともなう相同組換えがシナプトネマ複合体の形成と対合とに必須である.一方,ショウジョウバエなどではDNA切断をともなう相同組換えがなくてもシナプトネマ複合体の形成と対合ができることから,DNAの切断に依存せずに染色体を認識する分子機構の存在が示唆されている.テロメアブーケの形成と核の運動は染色体のあいだの空間的な距離を縮め染色体を同じ方向に整列させるが,個々の相同染色体の認識に直接に関与する分子機構ではない.染色体に蓄積する減数分裂期に特異的な非コードRNAが染色体の認識に寄与するという今回の新しい発見は,DNAの切断に依存しない相同染色体の認識機構をはじめて提示した.対合するべき相同染色体を識別するため,損傷が致命的なエラーにつながるDNAそのものではなく,DNAを鋳型にして多コピー合成のできるRNAを利用することは合理的であると考えられる.また,染色体のいくつかの領域においてこのような非コードRNAの集積があれば,染色体にバーコードのように識別しやすい特徴をあたえ(図1b),相同染色体の認識を効率よく実現できると考えられる.今後,sme2遺伝子座以外の対合領域の同定,RNAドット形成の分子機構の解明,相互認識をつかさどるタンパク質の同定などを進めていきたい.
略歴:1991年 東京大学大学院理学研究科にて博士号取得,1992年 郵政省通信総合研究所(現 情報通信研究機構)研究員,1995年より同 主任研究員.
研究テーマ:相同染色体の認識および対合の分子機構.
抱負:分裂酵母が減数分裂期に誘導されると,染色体の核における配置や方向,染色体の構造などがドラマティックに変わり,核そのものも激しく運動する.このような一連の染色体の動態はすべて相同染色体の対合と組換えのためのものと考えられる.そのような相同染色体の認識および対合の分子機構を解明していきたい.
平岡 泰(Yasushi Hiraoka)
大阪大学大学院生命機能研究科 教授.情報通信研究機構未来ICT研究所 主管研究員 兼任.
研究室URL:http://www2.nict.go.jp/advanced_ict/bio/w131103/CellMagic/index.html
© 2012 丁 大橋・平岡 泰 Licensed under CC 表示 2.1 日本
(情報通信研究機構未来ICT研究所 バイオICT研究室)
email:丁 大橋
DOI: 10.7875/first.author.2012.069
Meiosis-specific non-coding RNA mediates robust pairing of homologous chromosomes in meiosis.
Da-Qiao Ding, Kasumi Okamasa, Miho Yamane, Chihiro Tsutsumi, Tokuko Haraguchi, Masayuki Yamamoto, Yasushi Hiraoka
Science, 336, 732-736 (2012)
この論文に出現する遺伝子・タンパク質のUniprot ID
要 約
減数分裂における相同染色体の組換えは,第1減数分裂における還元型の染色体分配に必須である.相同組換えにさきだち相同染色体どうしが互いに認識し対合する必要があるが,相同染色体の相互認識の分子機構についてはほとんど解明されていない.筆者らは,分裂酵母の第2染色体にあるsme2遺伝子から転写される減数分裂に特異的な非コードRNAが,相同染色体の相互認識に寄与していることを発見した.sme2遺伝子の付近の染色体領域は減数分裂前期の初期から相同組換えに依存しない高い対合頻度を示し,それはsme2遺伝子の転写産物であるmeiRNA-Lがsme2遺伝子座に集積することによりひき起こされていた.sme2遺伝子を本来の遺伝子座から別の染色体へと移動すると,本来の遺伝子座の付近での染色体の対合は抑えられ,sme2遺伝子の移動した染色体領域の付近では組換えに非依存的に相同染色体の対合が促進された.この発見により,減数分裂前期において転写され染色体に滞留するRNAが,染色体の相互認識に積極的な役割をはたしていることが示された.
はじめに
有性生殖の基本をつかさどる減数分裂の分子機構の解明は,基礎生物学においても医学的な観点からも非常に重要である.減数分裂前期のおもなイベントとして,DNAの複製,相同染色体の対合,シナプトネマ複合体の形成と組換えがある.このうち,相同染色体の対合は親世代から受け継いだ相同染色体が互いどうしをみつけ接着する過程であり,正常な対合が相同組換えおよび相同染色体の還元型の分配に不可欠である.相同染色体の対合に関する研究は減数分裂の初期段階において非常に重要で,とくに相同染色体の相互認識の機構がもっとも謎にみちた問題であり,いまだ不明なことが多い1).
近年の筆者らの研究により,テロメアブーケの形成およびテロメアの先導する核の運動が,核において相同染色体を整列させ空間的に接近させるため必要であることが明らかになってきた2-4).テロメアブーケとは,減数分裂前期においてすべての染色体末端のテロメアが核膜の一箇所に集合し染色体を花束のように束ねる現象で,酵母から植物や哺乳類まで共通にみられる5).分裂酵母では,窒素源の枯渇により減数分裂が誘導され,接合型(性別)の異なる1倍体細胞が接合し,核融合をへて2倍体細胞になる.核融合の過程と同時にテロメアがスピンドル極体(spindle pole body:SPB)に集合し,ホーステール核(horsetail nucleus)とよばれるテロメアブーケを形成する2)(図1).分裂酵母のホーステール期は減数分裂前期に相当し,約2時間のホーステール期に核はたえず往復運動し相同染色体の対合および組換えが行われる.筆者らは,染色体領域を可視化して対合の生細胞観察を行うことにより,ブーケ配向と核の運動とが相同染色体を空間的に近づかせ,さらに,相同組換えが安定な染色体の対合を実現することをすでに明らかにしていた3).しかし,空間的に近づいた染色体がどのように相同なパートナーをみつけ対になるのかは謎であった.
1.高頻度に対合する染色体領域の発見
筆者らは,分裂酵母を用いて相同染色体の対合を研究してきた.分裂酵母ではMei2という減数分裂を制御するタンパク質が存在し,そのタンパク質はホーステール期においてsme2遺伝子座にドットを形成する6).2倍体のホーステール核にsme2遺伝子座は2つあるにもかかわらずMei2ドットは1つしか観察されないことから,sme2遺伝子座が対合しやすいという可能性が示唆された.sme2遺伝子座の対合を調べるため,その近傍にlacOリピート配列を挿入し,この配列に結合するLacIをGFPにより標識したものを発現させることにより染色体領域を可視化した.その結果,これまでに調べたテロメア以外のどの染色体領域よりも,sme2遺伝子座は高い対合率を示すことがわかった.これまで調べた染色体領域ではホーステール期の進行とともに対合頻度は20%から80%まで徐々に上昇するのが典型的で,この上昇は相同組換えに依存する.しかし,sme2遺伝子座はホーステール期の初期から約70%の対合率を示し,しかも,相同組換えを必要としなかった.sme2遺伝子を別の染色体に移動すると,もとの遺伝子座での対合頻度は減少し,sme2遺伝子の移動した遺伝子座の対合頻度は相同組換えに非依存的に上昇したことから,sme2遺伝子は相同組換えに非依存的に対合を強く促進することがわかった.
一方,sme2遺伝子座の対合はテロメアブーケの形成と核の運動とに依存した.テロメアクラスターの形成あるいは核の運動の欠損株では,sme2遺伝子座もほかの染色体領域と同様に対合できなかった.これは,sme2遺伝子座の対合は相同染色体の整列したあとにはたらいていることを意味していた.おもしろいことに,本来の第2染色体にsme2遺伝子座をもつ1倍体細胞と,sme2遺伝子座を第1染色体に移動した1倍体細胞とを掛け合わせると,約30%の細胞において,異なる染色体にある2つのsme2遺伝子が一時的に異所的な対合をした.このことから,sme2遺伝子座は非相同染色体に存在する状況でも互いを認識する能力のあることが示唆された.しかし,この異所的な対合は一過的であり,やがて離れてしまった.
sme2遺伝子による対合の生物学的な意味を知るため,相同組換え率を調べた.組換えマーカーの近くにsme2遺伝子があると,sme2遺伝子のない場合より相同組換え率が約1.6倍高くなった.また,sme2遺伝子による対合促進作用の影響の範囲を調べたところ,sme2遺伝子から200 kb以内の範囲で有効であった.以上の結果から,sme2遺伝子座は対合のホットスポットであり,相同染色体の相互認識,対合および組換えを促進する役割をはたしていることが明らかになった.
2.sme2遺伝子の対合促進作用は相同染色体の双方の転写に依存する
sme2遺伝子はタンパク質をコードしない,約1.5 kbの減数分裂期に特異的なmeiRNA-Lという非コードRNAをコードする7,8).sme2遺伝子のプロモーター領域を削除する,または,転写の開始に必要なTATAボックスに変異を導入すると,meiRNA-Lの転写は大きく減少し対合も完全に阻害された.このことから,sme2遺伝子の転写産物であるmeiRNA-Lが対合に必須であることが明らかになった.さらに,相同染色体の片方だけからの転写では対合の促進は起こらなかったことから,相同染色体の双方からの転写が対合に必要であることが明らかになった.
さらにmeiRNA-Lの局在を調べるため,sme2遺伝子の5’末端にU1Aタグ配列を挿入し,この配列に結合するU1ApをGFPにより標識したものを発現させることによりmeiRNA-Lを可視化した(図2a).その結果,meiRNA-Lは染色体に集積しMei2ドットと共局在することがわかった(図2b).また,sme2遺伝子の3’末端には複数のポリA付加シグナルが存在するが,それを欠損すると転写の読み過ごし(リードスルー)が起こり長いmRNAが検出された.このような欠損株ではsme2遺伝子座の対合の促進はみられなかった.そのような長いRNAの局在を観察すると,核の全体にわたり複数の小さいRNAのドットが特定の場所もなく観察されたことから,リードスルーしたRNAは転写部位にとどまることのできないことがわかった.これらの事実から,sme2遺伝子座に滞留するmeiRNA-Lドットが相同染色体の対合をひき起こす要因であることが示された.
3.Mei2ドットはロバストなsme2遺伝子座の対合に必要か
Mei2は分裂酵母において減数分裂の進行に必須なタンパク質であり,sme2遺伝子はMei2の温度感受性欠損を抑制することでクローニングされた遺伝子である.Mei2にはRNA結合ドメインが存在し,Mei2との結合によりsme2遺伝子が制御されている可能性のあることから,Mei2ドットとsme2遺伝子との関係を分離させることを試みた.sme2遺伝子の5’側の574塩基を除くことにより核においてMei2ドットが形成されなくなったが,この5’側を欠損したmeiRNA-Lは依然として全長のRNAと同じ場所にRNAのドットを形成し野生株と同様に対合を促進した.したがって,sme2遺伝子の5’側はMei2ドットの形成に必要であるが,Mei2はmeiRNA-Lの蓄積や対合には必要ではないことがわかった.
一方,Mei2ドットと共局在するもうひとつのタンパク質をしてMmi1があり,これは栄養増殖に必須である.Mmi1は栄養増殖期の細胞において減数分裂に特異的なmRNAを認識し,これをエキソソームにひきわたし分解させることで減数分裂期への進行を抑制し栄養増殖期を維持する.Mmi1の変異株では減数分裂に特異的なmRNAが分解されず栄養増殖が阻害される.meiRNA-Lの3’側には多数のMmi1認識モチーフが存在し,減数分裂期になるとMmi1はmeiRNA-Lドットに集合する結果,減数分裂に特異的なmRNAは分解をまぬがれ減数分裂が正常に進行できるようになる9).sme2遺伝子の5’側の574塩基を除いた変異株においてもMmi1はRNAのドットに集まり,減数分裂は正常に進行し野生株と同様に対合を促進した.さらに,mmi1-48変異株では野生株よりも対合が促進された.これは,meiRNA-Lの量あるいは安定性が上昇したためと思われた.この結果は,染色体に滞留するRNAが対合を促進するという結論を支持した.
おわりに
哺乳類,植物や真菌類では,DNA切断をともなう相同組換えがシナプトネマ複合体の形成と対合とに必須である.一方,ショウジョウバエなどではDNA切断をともなう相同組換えがなくてもシナプトネマ複合体の形成と対合ができることから,DNAの切断に依存せずに染色体を認識する分子機構の存在が示唆されている.テロメアブーケの形成と核の運動は染色体のあいだの空間的な距離を縮め染色体を同じ方向に整列させるが,個々の相同染色体の認識に直接に関与する分子機構ではない.染色体に蓄積する減数分裂期に特異的な非コードRNAが染色体の認識に寄与するという今回の新しい発見は,DNAの切断に依存しない相同染色体の認識機構をはじめて提示した.対合するべき相同染色体を識別するため,損傷が致命的なエラーにつながるDNAそのものではなく,DNAを鋳型にして多コピー合成のできるRNAを利用することは合理的であると考えられる.また,染色体のいくつかの領域においてこのような非コードRNAの集積があれば,染色体にバーコードのように識別しやすい特徴をあたえ(図1b),相同染色体の認識を効率よく実現できると考えられる.今後,sme2遺伝子座以外の対合領域の同定,RNAドット形成の分子機構の解明,相互認識をつかさどるタンパク質の同定などを進めていきたい.
文 献
- Gerton, J. L. & Hawley, R. S.: Homologous chromosome interactions in meiosis: diversity amidst conservation. Nat. Rev. Genet., 6, 477-487 (2005)[PubMed]
- Chikashige, Y., Ding, D. Q., Funabiki, H. et al.: Telomere-led premeiotic chromosome movement in fission yeast. Science, 264, 270-273 (1994)[PubMed]
- Ding, D. Q., Yamamoto, A., Haraguchi, T. et al.: Dynamics of homologous chromosome pairing during meiotic prophase in fission yeast. Dev. Cell, 6, 329-341 (2004)[PubMed]
- Ding, D. Q. & Hiraoka, Y.: Nuclear movement enforcing chromosome alignment in fission yeast: meiosis without homolog synapsis. in Recombination and Meiosis (Egel, R. & Lankenau, D.- H. ed). pp. 231-247, Springer-Verlag, Berlin (2007)
- Scherthan, H.: A bouquet makes ends meet. Nat. Rev. Mol. Cell Biol., 2, 621-627 (2001)[PubMed]
- Shimada, T., Yamashita, A. & Yamamoto, M.: The fission yeast meiotic regulator Mei2p forms a dot structure in the horse-tail nucleus in association with the sme2 locus on chromosome II. Mol. Biol. Cell, 14, 2461-2469 (2003)[PubMed]
- Watanabe, Y. & Yamamoto, M.: S. pombe mei2+ encodes an RNA-binding protein essential for premeiotic DNA synthesis and meiosis I, which cooperates with a novel RNA species meiRNA. Cell, 78, 487-498 (1994)[PubMed]
- Yamashita, A., Shichino, Y., Tanaka, H. et al.: Hexanucleotide motifs mediate recruitment of the RNA elimination machinery to silent meiotic genes. Open Biol., 2, 120014 (2012)[PubMed]
- Harigaya, Y., Tanaka, H., Yamanaka, S. et al.: Selective elimination of mRNA prevents an incidence of untimely meiosis. Nature, 442, 45-50 (2006)[PubMed]
著者プロフィール
略歴:1991年 東京大学大学院理学研究科にて博士号取得,1992年 郵政省通信総合研究所(現 情報通信研究機構)研究員,1995年より同 主任研究員.
研究テーマ:相同染色体の認識および対合の分子機構.
抱負:分裂酵母が減数分裂期に誘導されると,染色体の核における配置や方向,染色体の構造などがドラマティックに変わり,核そのものも激しく運動する.このような一連の染色体の動態はすべて相同染色体の対合と組換えのためのものと考えられる.そのような相同染色体の認識および対合の分子機構を解明していきたい.
平岡 泰(Yasushi Hiraoka)
大阪大学大学院生命機能研究科 教授.情報通信研究機構未来ICT研究所 主管研究員 兼任.
研究室URL:http://www2.nict.go.jp/advanced_ict/bio/w131103/CellMagic/index.html
© 2012 丁 大橋・平岡 泰 Licensed under CC 表示 2.1 日本