ペルオキシレドキシンは脳虚血ののちに起こる炎症において鍵となるタンパク質である
七田 崇・吉村昭彦
(慶應義塾大学医学部 微生物学・免疫学教室)
email:吉村昭彦
DOI: 10.7875/first.author.2012.068
Peroxiredoxin family proteins are key initiators of post-ischemic inflammation in the brain.
Takashi Shichita, Eiichi Hasegawa, Akihiro Kimura, Rimpei Morita, Ryota Sakaguchi, Ichiro Takada, Takashi Sekiya, Hiroaki Ooboshi, Takanari Kitazono, Toru Yanagawa, Tetsuro Ishii, Hideo Takahashi, Shuji Mori, Masahiro Nishibori, Kazumichi Kuroda, Shizuo Akira, Kensuke Miyake, Akihiko Yoshimura
Nature Medicine, 18, 911-917 (2012)
脳虚血における再灌流ののちの組織の傷害において,脳組織の損傷ののちの炎症は病態の重要な進行過程のひとつである.しかしながら,脳虚血ののちに起こる炎症の際に浸潤マクロファージが活性化される分子機構は十分に明らかになってはいなかった.筆者らは,ペルオキシレドキシンが虚血により壊死におちいった脳細胞から細胞外へと放出され,Toll様受容体であるTLR2とTLR4に依存的に浸潤したマクロファージを活性化し,インターロイキン23を含む炎症性サイトカインの発現を誘導することを明らかにした.ペルオキシレドキシンの細胞外への放出は脳虚血ののち12時間より起こり,その中和抗体の投与により炎症性サイトカインの発現や梗塞巣の拡大を抑制することができた.このように,細胞外に放出されたペルオキシレドキシンは新規の損傷関連分子パターンであり,これを阻害する薬剤は有効な神経保護剤となりうる.
わが国では,脳卒中の約7割は脳梗塞であり,患者の数は100万人以上であるが,死因および寝たきりの原因の主たるものである.脳梗塞に対する治療法として世界的に認められているのは組織プラスミノーゲン活性化因子の発症4.5時間以内での投与のみであり,脳梗塞に対する有効な神経保護療法はほとんどないのが現状である.したがって,神経保護を目的とした治療可能時間の長い治療法が必要とされている1,2).
一方で,脳虚血ののちに起こる炎症は脳梗塞の重要な進行過程のひとつであり,患者の予後や神経症状とも密接に関連する.虚血により脳細胞が壊死におちいると,組織にマクロファージが浸潤して炎症をひき起こす.これまで,筆者らは,浸潤したマクロファージの産生するインターロイキン23が,発症から24時間以降にさらに遅れて浸潤するγδT細胞からのインターロイキン17の産生を誘導することにより,炎症を遷延化させる分子機構を明らかにした3).脳梗塞に対しては早期の治療開始が原則であり,マクロファージの産生するインターロイキン23の効果を阻止できれば有効な神経保護療法となるものと考えられるが,虚血を起こした脳において浸潤したマクロファージがどのように活性化されインターロイキン23を産生するかについては明らかになっていなかった.
近年,脳のような無菌的な臓器における炎症の惹起には,本来は細菌やウイルスなどを外敵として認識するための自然免疫をになうToll様受容体(Toll-like receptor:TLR)が,重要な役割をもつことが明らかになってきている4).すなわち,自己の組織に由来する物質が組織の傷害にともない変化あるいは細胞外へと放出されて,浸潤したマクロファージに存在するToll様受容体を刺激することが炎症の開始点であると考えられる.従来,このような組織の傷害にともない細胞外へと放出される自己組織に由来する物質は損傷関連分子パターン(damage-associated molecular pattern:DAMP)とよばれており,HMGB1,熱ショックタンパク質,βアミロイド,酸化脂質,核酸などが研究されてきた.しかし,虚血におちいった脳においてToll様受容体を刺激し浸潤したマクロファージを活性化する損傷関連分子パターンは不明であった.
まず,脳梗塞ののちの炎症の惹起にToll様受容体が必要かどうかを確認した.Toll様受容体ファミリーのうちTLR2あるいはTLR4を欠損したマウスでは,虚血を起こした脳に浸潤した血液細胞において炎症性サイトカインの発現が減少していた.Toll様受容体はミクログリアなどの脳細胞にも存在する.骨髄キメラを作製し血液細胞またはミクログリアを含む脳細胞のどちらかでToll様受容体を欠損させた状態にすると,血液細胞においてTLR2あるいはTLR4を欠損した場合には梗塞巣の体積が縮小し炎症性サイトカインの発現が減少したが,脳細胞においてTLR2あるいはTLR4を欠損させても変化を認めなかった.したがって,脳に浸潤する血液細胞のTLR2およびTLR4が炎症の惹起に重要だと考えられた.さらに,細胞分画の結果,脳虚血ののち24時間において浸潤するマクロファージがTNFαやインターロイキン23を含む炎症性サイトカインの主要な産生細胞であることがわかった.TLR2およびTLR4のダブルノックアウトマウスでは脳梗塞ののちの炎症性サイトカインの産生も,γδT細胞からのインターロイキン17の産生も,著しく減弱していた.よって,脳虚血ののち約1日で浸潤するマクロファージのもつTLR2およびTLR4が,脳虚血のちの炎症と梗塞巣の拡大に重要な役割をはたしていることが明らかになった.
虚血を起こした脳に浸潤したマクロファージがどのようにインターロイキン23を産生するのかを探るため,マウスの脳抽出液を作製し,マクロファージの類縁の細胞であるマウスの培養樹状細胞に添加したところ,培養樹状細胞は活性化されインターロイキン23やインターロイキン1β,TNFαなどの炎症性サイトカインを産生した.脳抽出液の活性は熱処理やタンパク分解酵素処理により消失したことから,そこに含まれるタンパク質成分が重要だと考えられた.そこで,脳抽出液を部分分画したのちスクロース濃度勾配にかけたところ,細胞質に存在する約15~25 kDaのタンパク質がインターロイキン23の誘導能をもつことが判明した.この画分を最終的に質量分析により解析し,得られた候補タンパク質について大腸菌を用いて組換え体を作製した.これらの組換え体を細菌に由来するToll様受容体の活性化因子であるリポ多糖を除去したうえで培養樹状細胞に添加したところ,候補タンパク質のなかでペルオキシレドキシン(peroxiredoxin:Prx)ファミリータンパク質Prx1,Prx2,Prx5,Prx6が強力なインターロイキン23の誘導能をもつことを発見した.HMGB1もインターロイキン23の誘導活性をもっていたが,ペルオキシレドキシンのほうが誘導活性は強かった.さらに,TLR2およびTLR4を欠損した培養樹状細胞ではペルオキシレドキシンによるインターロイキン23の誘導は消失していたことから,ペルオキシレドキシンがTLR2およびTLR4を介して培養樹状細胞を刺激しているものと考えられた.
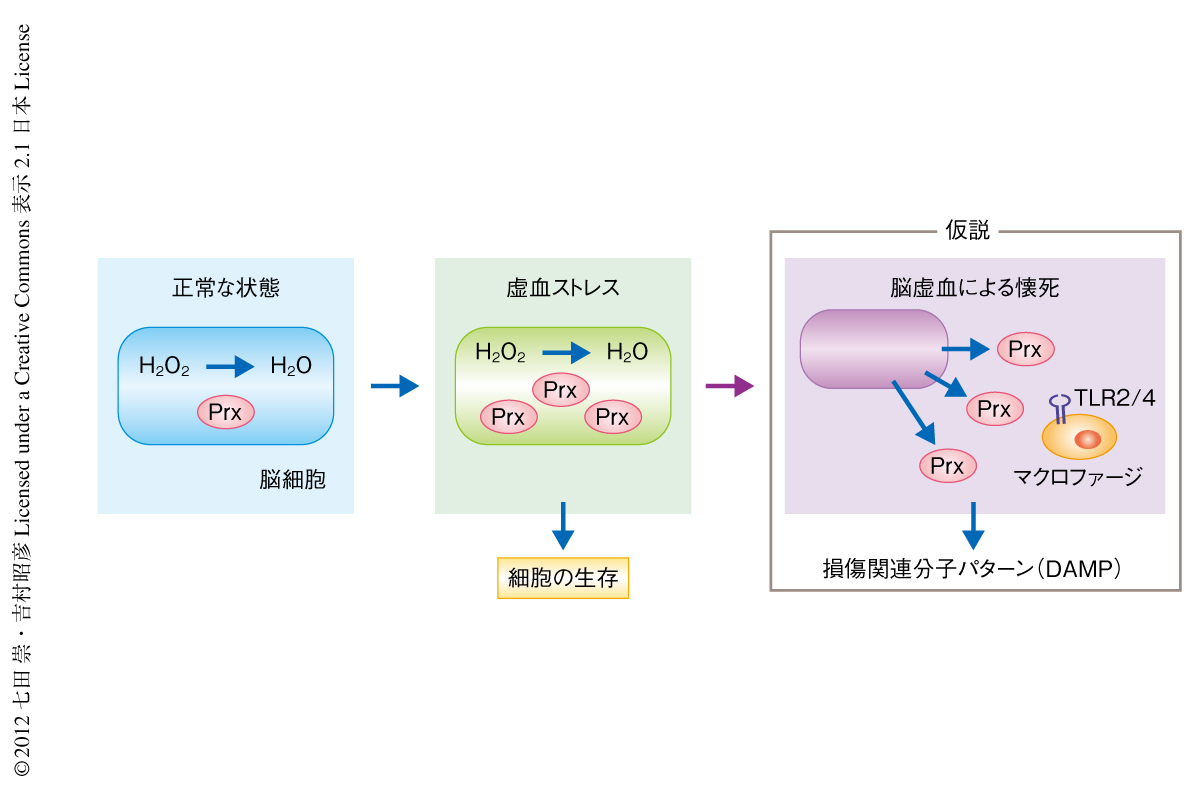
ペルオキシレドキシンは多くの組織に発現しており,これまで細胞保護効果をもつタンパク質として研究されてきた.ペルオキシレドキシンにはPrx1~Prx6まで6つのサブタイプが存在し,活性酸素を代謝し水に変える酵素活性をもつ5).脳梗塞ののち,Prx1,Prx2,Prx5,Prx6の発現は急速に上昇した.このことから,虚血におちいった脳細胞では虚血ストレスにより活性酸素が産生されるが,これを除去するために脳細胞ではペルオキシレドキシンが産生されて細胞の保護にはたらくが,いよいよ脳虚血により細胞が破壊されると,ペルオキシレドキシンは細胞外へと放出され損傷関連分子パターンとしてToll様受容体を活性化し炎症を惹起するのではないか,という仮説を組み立てた(図1).
ペルオキシレドキシンの動態を明らかにするため,一過性脳虚血モデルマウスを用い,虚血を起こした脳におけるPrx6の発現を免疫染色法により検出した.Prx6は梗塞巣に一致して脳虚血ののち12時間から発現を認め,脳虚血ののち24時間にピークに,そののち減少した.共焦点顕微鏡により詳細に観察すると,傷害をうけたTUNEL陽性の脳細胞の周囲に死細胞に由来すると思われるPrx6陽性の凝集物が多数存在しており,仮説どおりに,脳細胞の虚血による壊死にともないペルオキシレドキシンが細胞外へと放出されたものと考えられた.さらに,Prx6を含む凝集物は浸潤したマクロファージとその細胞の表面において接触していた.このことから,細胞外へと放出されたペルオキシレドキシンがTLR2およびTLR4を介して浸潤したマクロファージを刺激しているものと考えられた.
これまで,脳虚血ののちの炎症においてはHMGB1が重要な損傷関連分子パターンとして研究されてきた.しかし,HMGB1は脳虚血における再灌流の2~4時間のちという非常に早期に細胞外へと放出されており,脳虚血の12時間のちには細胞外のHMGB1は消失していることが報告されていた.HMGB1の中和抗体を一過性脳虚血モデルマウスに対し脳虚血における再灌流の直後に投与すると,梗塞の体積は縮小し脳保護効果が認められた.ところが,浸潤した血液細胞において炎症性サイトカインを減少させる効果は著明でなかった.これは,HMGB1の放出される時間帯は脳虚血ののち2~4時間であり,炎症細胞の浸潤よりも早期に終了するためと考えられた.実際に,HMGB1は脳血液関門の破綻に寄与することが報告されており,非常に早期に機能する損傷関連分子パターンであるものと考えられる6).
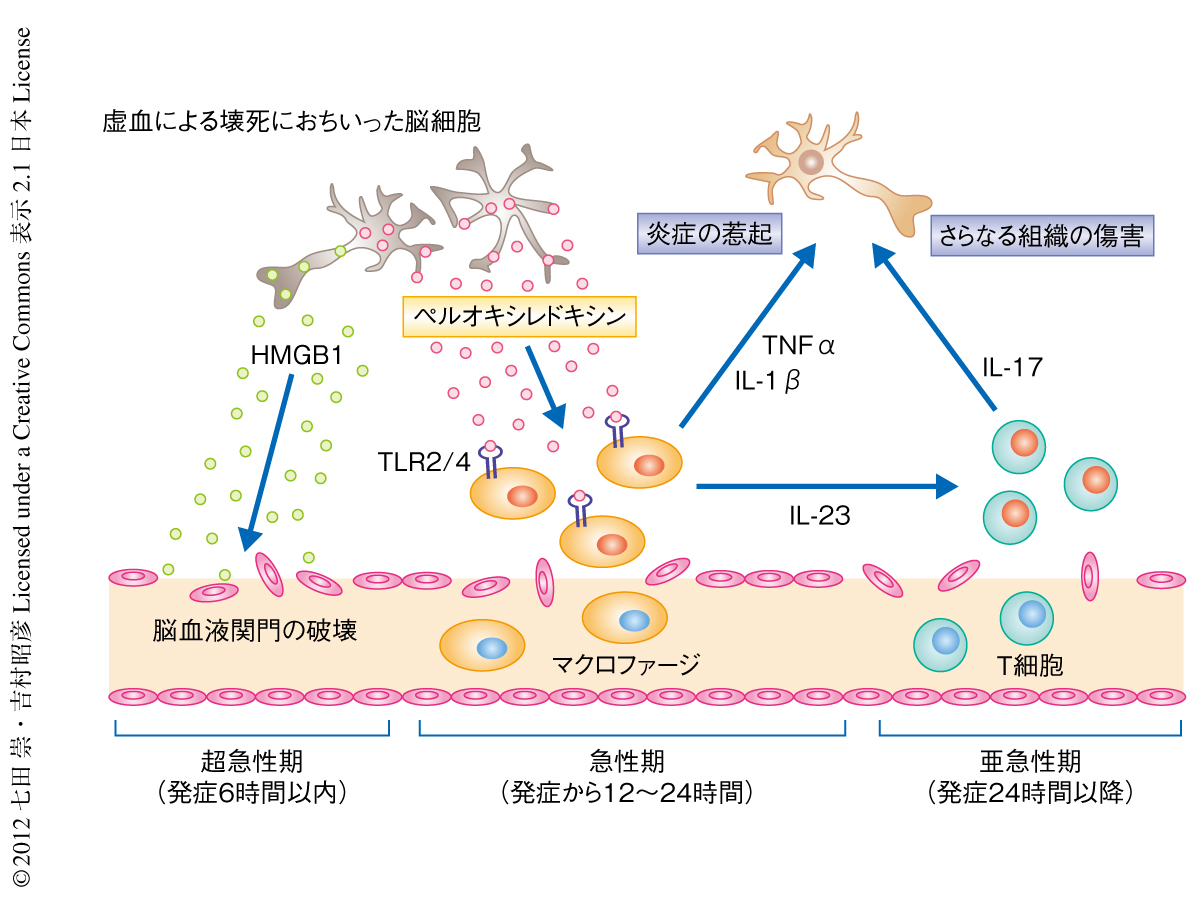
一方で,ペルオキシレドキシンの細胞外への放出は脳虚血における再灌流ののち12時間から認められた.マクロファージなどの血液細胞の脳への浸潤もこの時期より顕著になることから,HMGB1ではなくペルオキシレドキシンがToll様受容体を介しマクロファージを直接的に活性化している可能性が考えられた.抗Prx1抗体,抗Prx2抗体,抗Prx5抗体,抗Prx6抗体の混合液を一過性脳虚血モデルマウスに対し脳虚血における再灌流の直後に投与すると,梗塞の体積は縮小し,浸潤した血液細胞において炎症性サイトカインは減少していた.脳虚血における再灌流ののち12時間においてペルオキシレドキシンの中和抗体を投与した場合でも梗塞の体積を縮小させることができた.一方,HMGB1の中和抗体は脳虚血における再灌流ののち12時間における投与では梗塞の体積を縮小させる効果はなかった.このように,細胞外へと放出されたペルオキシレドキシンは浸潤した血液細胞を活性化させるのに重要な損傷関連分子パターンであり,浸潤したマクロファージからインターロイキン23やインターロイキン1β,TNFαを産生させることにより炎症の促進や組織の傷害をひき起こすものと考えられた(図2).
さらに,ペルオキシレドキシンが脳虚血ののちの炎症の惹起にかかわることを確かめるため,その活性中心の探索を行った.ペルオキシレドキシンの変異タンパク質を作製して培養樹状細胞を刺激する実験を行ったところ,Prx5において70番目~90番目のアミノ酸配列にインターロイキン23を誘導する活性の存在することが明らかになった.この活性部位にはペルオキシレドキシンファミリーに共通したα3ヘリックス構造が存在しており,いずれのα3ヘリックス構造もインターロイキン23の誘導能をもつことが判明した.そこで,Prx5とPrx6についてこの部位の中和抗体を作製して一過性脳梗塞モデルマウスに投与したところ,抗Prx1抗体,抗Prx2抗体,抗Prx5抗体,抗Prx6の混合液と同じ程度の効果が認められた.
以上より,脳虚血ののちの炎症において,1)脳において炎症を惹起させるタンパク質としてペルオキシレドキシンを同定したこと,2)ペルオキシレドキシンは細胞の内外で2つの機能をもつ,すなわち,細胞内では活性酸素を代謝することで神経保護作用を発揮するが,細胞外では損傷関連分子パターンとして機能し炎症を惹起すること,3)ペルオキシレドキシンとHMGB1とは異なる時期に異なる作用をもつ損傷関連分子パターンであること,を明らかにした.
実際に,脳梗塞の患者の脳組織においても細胞の外液でペルオキシレドキシンの濃度の上昇することが報告されている7).細胞外のペルオキシレドキシンを治療標的とすることにより,治療可能時間の長い新規の脳保護療法を開発できる可能性が示唆された.
(慶應義塾大学医学部 微生物学・免疫学教室)
email:吉村昭彦
DOI: 10.7875/first.author.2012.068
Peroxiredoxin family proteins are key initiators of post-ischemic inflammation in the brain.
Takashi Shichita, Eiichi Hasegawa, Akihiro Kimura, Rimpei Morita, Ryota Sakaguchi, Ichiro Takada, Takashi Sekiya, Hiroaki Ooboshi, Takanari Kitazono, Toru Yanagawa, Tetsuro Ishii, Hideo Takahashi, Shuji Mori, Masahiro Nishibori, Kazumichi Kuroda, Shizuo Akira, Kensuke Miyake, Akihiko Yoshimura
Nature Medicine, 18, 911-917 (2012)
要 約
脳虚血における再灌流ののちの組織の傷害において,脳組織の損傷ののちの炎症は病態の重要な進行過程のひとつである.しかしながら,脳虚血ののちに起こる炎症の際に浸潤マクロファージが活性化される分子機構は十分に明らかになってはいなかった.筆者らは,ペルオキシレドキシンが虚血により壊死におちいった脳細胞から細胞外へと放出され,Toll様受容体であるTLR2とTLR4に依存的に浸潤したマクロファージを活性化し,インターロイキン23を含む炎症性サイトカインの発現を誘導することを明らかにした.ペルオキシレドキシンの細胞外への放出は脳虚血ののち12時間より起こり,その中和抗体の投与により炎症性サイトカインの発現や梗塞巣の拡大を抑制することができた.このように,細胞外に放出されたペルオキシレドキシンは新規の損傷関連分子パターンであり,これを阻害する薬剤は有効な神経保護剤となりうる.
はじめに
わが国では,脳卒中の約7割は脳梗塞であり,患者の数は100万人以上であるが,死因および寝たきりの原因の主たるものである.脳梗塞に対する治療法として世界的に認められているのは組織プラスミノーゲン活性化因子の発症4.5時間以内での投与のみであり,脳梗塞に対する有効な神経保護療法はほとんどないのが現状である.したがって,神経保護を目的とした治療可能時間の長い治療法が必要とされている1,2).
一方で,脳虚血ののちに起こる炎症は脳梗塞の重要な進行過程のひとつであり,患者の予後や神経症状とも密接に関連する.虚血により脳細胞が壊死におちいると,組織にマクロファージが浸潤して炎症をひき起こす.これまで,筆者らは,浸潤したマクロファージの産生するインターロイキン23が,発症から24時間以降にさらに遅れて浸潤するγδT細胞からのインターロイキン17の産生を誘導することにより,炎症を遷延化させる分子機構を明らかにした3).脳梗塞に対しては早期の治療開始が原則であり,マクロファージの産生するインターロイキン23の効果を阻止できれば有効な神経保護療法となるものと考えられるが,虚血を起こした脳において浸潤したマクロファージがどのように活性化されインターロイキン23を産生するかについては明らかになっていなかった.
近年,脳のような無菌的な臓器における炎症の惹起には,本来は細菌やウイルスなどを外敵として認識するための自然免疫をになうToll様受容体(Toll-like receptor:TLR)が,重要な役割をもつことが明らかになってきている4).すなわち,自己の組織に由来する物質が組織の傷害にともない変化あるいは細胞外へと放出されて,浸潤したマクロファージに存在するToll様受容体を刺激することが炎症の開始点であると考えられる.従来,このような組織の傷害にともない細胞外へと放出される自己組織に由来する物質は損傷関連分子パターン(damage-associated molecular pattern:DAMP)とよばれており,HMGB1,熱ショックタンパク質,βアミロイド,酸化脂質,核酸などが研究されてきた.しかし,虚血におちいった脳においてToll様受容体を刺激し浸潤したマクロファージを活性化する損傷関連分子パターンは不明であった.
1.マクロファージのもつTLR2およびTLR4は脳梗塞ののちの炎症の惹起に必須である
まず,脳梗塞ののちの炎症の惹起にToll様受容体が必要かどうかを確認した.Toll様受容体ファミリーのうちTLR2あるいはTLR4を欠損したマウスでは,虚血を起こした脳に浸潤した血液細胞において炎症性サイトカインの発現が減少していた.Toll様受容体はミクログリアなどの脳細胞にも存在する.骨髄キメラを作製し血液細胞またはミクログリアを含む脳細胞のどちらかでToll様受容体を欠損させた状態にすると,血液細胞においてTLR2あるいはTLR4を欠損した場合には梗塞巣の体積が縮小し炎症性サイトカインの発現が減少したが,脳細胞においてTLR2あるいはTLR4を欠損させても変化を認めなかった.したがって,脳に浸潤する血液細胞のTLR2およびTLR4が炎症の惹起に重要だと考えられた.さらに,細胞分画の結果,脳虚血ののち24時間において浸潤するマクロファージがTNFαやインターロイキン23を含む炎症性サイトカインの主要な産生細胞であることがわかった.TLR2およびTLR4のダブルノックアウトマウスでは脳梗塞ののちの炎症性サイトカインの産生も,γδT細胞からのインターロイキン17の産生も,著しく減弱していた.よって,脳虚血ののち約1日で浸潤するマクロファージのもつTLR2およびTLR4が,脳虚血のちの炎症と梗塞巣の拡大に重要な役割をはたしていることが明らかになった.
2.ペルオキシレドキシンは脳抽出液に存在するインターロイキン23の強力な誘導タンパク質である
虚血を起こした脳に浸潤したマクロファージがどのようにインターロイキン23を産生するのかを探るため,マウスの脳抽出液を作製し,マクロファージの類縁の細胞であるマウスの培養樹状細胞に添加したところ,培養樹状細胞は活性化されインターロイキン23やインターロイキン1β,TNFαなどの炎症性サイトカインを産生した.脳抽出液の活性は熱処理やタンパク分解酵素処理により消失したことから,そこに含まれるタンパク質成分が重要だと考えられた.そこで,脳抽出液を部分分画したのちスクロース濃度勾配にかけたところ,細胞質に存在する約15~25 kDaのタンパク質がインターロイキン23の誘導能をもつことが判明した.この画分を最終的に質量分析により解析し,得られた候補タンパク質について大腸菌を用いて組換え体を作製した.これらの組換え体を細菌に由来するToll様受容体の活性化因子であるリポ多糖を除去したうえで培養樹状細胞に添加したところ,候補タンパク質のなかでペルオキシレドキシン(peroxiredoxin:Prx)ファミリータンパク質Prx1,Prx2,Prx5,Prx6が強力なインターロイキン23の誘導能をもつことを発見した.HMGB1もインターロイキン23の誘導活性をもっていたが,ペルオキシレドキシンのほうが誘導活性は強かった.さらに,TLR2およびTLR4を欠損した培養樹状細胞ではペルオキシレドキシンによるインターロイキン23の誘導は消失していたことから,ペルオキシレドキシンがTLR2およびTLR4を介して培養樹状細胞を刺激しているものと考えられた.
ペルオキシレドキシンは多くの組織に発現しており,これまで細胞保護効果をもつタンパク質として研究されてきた.ペルオキシレドキシンにはPrx1~Prx6まで6つのサブタイプが存在し,活性酸素を代謝し水に変える酵素活性をもつ5).脳梗塞ののち,Prx1,Prx2,Prx5,Prx6の発現は急速に上昇した.このことから,虚血におちいった脳細胞では虚血ストレスにより活性酸素が産生されるが,これを除去するために脳細胞ではペルオキシレドキシンが産生されて細胞の保護にはたらくが,いよいよ脳虚血により細胞が破壊されると,ペルオキシレドキシンは細胞外へと放出され損傷関連分子パターンとしてToll様受容体を活性化し炎症を惹起するのではないか,という仮説を組み立てた(図1).
3.ペルオキシレドキシンは脳梗塞ののち12時間から発現し浸潤したマクロファージに作用する
ペルオキシレドキシンの動態を明らかにするため,一過性脳虚血モデルマウスを用い,虚血を起こした脳におけるPrx6の発現を免疫染色法により検出した.Prx6は梗塞巣に一致して脳虚血ののち12時間から発現を認め,脳虚血ののち24時間にピークに,そののち減少した.共焦点顕微鏡により詳細に観察すると,傷害をうけたTUNEL陽性の脳細胞の周囲に死細胞に由来すると思われるPrx6陽性の凝集物が多数存在しており,仮説どおりに,脳細胞の虚血による壊死にともないペルオキシレドキシンが細胞外へと放出されたものと考えられた.さらに,Prx6を含む凝集物は浸潤したマクロファージとその細胞の表面において接触していた.このことから,細胞外へと放出されたペルオキシレドキシンがTLR2およびTLR4を介して浸潤したマクロファージを刺激しているものと考えられた.
4.脳虚血ののちの炎症においてペルオキシレドキシンとHMGB1とは異なる時期に異なる作用をもつ
これまで,脳虚血ののちの炎症においてはHMGB1が重要な損傷関連分子パターンとして研究されてきた.しかし,HMGB1は脳虚血における再灌流の2~4時間のちという非常に早期に細胞外へと放出されており,脳虚血の12時間のちには細胞外のHMGB1は消失していることが報告されていた.HMGB1の中和抗体を一過性脳虚血モデルマウスに対し脳虚血における再灌流の直後に投与すると,梗塞の体積は縮小し脳保護効果が認められた.ところが,浸潤した血液細胞において炎症性サイトカインを減少させる効果は著明でなかった.これは,HMGB1の放出される時間帯は脳虚血ののち2~4時間であり,炎症細胞の浸潤よりも早期に終了するためと考えられた.実際に,HMGB1は脳血液関門の破綻に寄与することが報告されており,非常に早期に機能する損傷関連分子パターンであるものと考えられる6).
一方で,ペルオキシレドキシンの細胞外への放出は脳虚血における再灌流ののち12時間から認められた.マクロファージなどの血液細胞の脳への浸潤もこの時期より顕著になることから,HMGB1ではなくペルオキシレドキシンがToll様受容体を介しマクロファージを直接的に活性化している可能性が考えられた.抗Prx1抗体,抗Prx2抗体,抗Prx5抗体,抗Prx6抗体の混合液を一過性脳虚血モデルマウスに対し脳虚血における再灌流の直後に投与すると,梗塞の体積は縮小し,浸潤した血液細胞において炎症性サイトカインは減少していた.脳虚血における再灌流ののち12時間においてペルオキシレドキシンの中和抗体を投与した場合でも梗塞の体積を縮小させることができた.一方,HMGB1の中和抗体は脳虚血における再灌流ののち12時間における投与では梗塞の体積を縮小させる効果はなかった.このように,細胞外へと放出されたペルオキシレドキシンは浸潤した血液細胞を活性化させるのに重要な損傷関連分子パターンであり,浸潤したマクロファージからインターロイキン23やインターロイキン1β,TNFαを産生させることにより炎症の促進や組織の傷害をひき起こすものと考えられた(図2).
さらに,ペルオキシレドキシンが脳虚血ののちの炎症の惹起にかかわることを確かめるため,その活性中心の探索を行った.ペルオキシレドキシンの変異タンパク質を作製して培養樹状細胞を刺激する実験を行ったところ,Prx5において70番目~90番目のアミノ酸配列にインターロイキン23を誘導する活性の存在することが明らかになった.この活性部位にはペルオキシレドキシンファミリーに共通したα3ヘリックス構造が存在しており,いずれのα3ヘリックス構造もインターロイキン23の誘導能をもつことが判明した.そこで,Prx5とPrx6についてこの部位の中和抗体を作製して一過性脳梗塞モデルマウスに投与したところ,抗Prx1抗体,抗Prx2抗体,抗Prx5抗体,抗Prx6の混合液と同じ程度の効果が認められた.
おわりに
以上より,脳虚血ののちの炎症において,1)脳において炎症を惹起させるタンパク質としてペルオキシレドキシンを同定したこと,2)ペルオキシレドキシンは細胞の内外で2つの機能をもつ,すなわち,細胞内では活性酸素を代謝することで神経保護作用を発揮するが,細胞外では損傷関連分子パターンとして機能し炎症を惹起すること,3)ペルオキシレドキシンとHMGB1とは異なる時期に異なる作用をもつ損傷関連分子パターンであること,を明らかにした.
実際に,脳梗塞の患者の脳組織においても細胞の外液でペルオキシレドキシンの濃度の上昇することが報告されている7).細胞外のペルオキシレドキシンを治療標的とすることにより,治療可能時間の長い新規の脳保護療法を開発できる可能性が示唆された.
文 献
- Moskowitz, M. A., Lo, E. H., Iadecola, C.: The science of stroke: mechanisms in search of treatments. Neuron, 67, 181-198 (2010)[PubMed]
- Iadecola, C., Anrather, J.: The immunology of stroke: from mechanisms to translation. Nat. Med., 17, 796-808 (2011)[PubMed]
- Shichita, T., Sugiyama, Y., Ooboshi, H. et al.: Pivotal role of cerebral interleukin-17-producing γδT cells in the delayed phase of ischemic brain injury. Nat. Med., 15, 946-950 (2009)[PubMed]
- Chen, C. J., Kono, H., Golenbock, D. et al.: Identification of a key pathway required for the sterile inflammatory response triggered by dying cells. Nat. Med., 13, 851-856 (2007)[PubMed]
- Wood, Z. A., Schroder, E., Robin Harris, J. et al.: Structure, mechanism and regulation of peroxiredoxins. Trends Biochem. Sci., 28, 32-40 (2003)[PubMed]
- Zhang, J., Takahashi, H. K., Liu, K. et al.: Anti-high mobility group box-1 monoclonal antibody protects the blood-brain barrier from ischemia-induced disruption in rats. Stroke, 42, 1420-1428 (2011)[PubMed]
- Dayon, L., Turck, N., Garci-Berrocoso, T. et al.: Brain extracellular fluid protein changes in acute stroke patients. J. Proteome Res., 10, 1043-1051 (2011)[PubMed]
著者プロフィール
略歴:2010年 九州大学大学院医学系学府博士課程 修了,2011年 科学技術振興機構 さきがけ研究員を経て,2012年より慶應義塾大学医学部 助教.
研究テーマ:神経免疫,炎症と組織修復の分子機構.
抱負:脳梗塞など神経疾患における炎症の機構を明らかにして,患者さんの症状を軽減し回復させるような新規の治療法を開発したい.
吉村 昭彦(Akihiko Yoshimura)
慶應義塾大学医学部 教授.
研究室URL:http://new.immunoreg.jp/
© 2012 七田 崇・吉村昭彦 Licensed under CC 表示 2.1 日本