“Hikeshi”は分子シャペロンHsp70を核に輸送し熱ストレスによる核の損傷から細胞を守る
小瀬真吾・今本尚子
(理化学研究所基幹研究所 今本細胞核機能研究室)
email:小瀬真吾,今本尚子
DOI: 10.7875/first.author.2012.067
Hikeshi, a nuclear import carrier for hsp70s, protects cells from heat shock-induced nuclear damage.
Shingo Kose, Maiko Furuta, Naoko Imamoto
Cell, 149, 578-589 (2012)
熱などのさまざまなストレスのもとでは,核と細胞質とのあいだの主要なタンパク質の輸送を担うImportinβファミリー経路は抑制される.一方で,分子シャペロンHsp70はストレスに応答して細胞質から核へとその局在を変化させることが知られていた.筆者らは,熱ストレスの際のHsp70の核への輸送に必須なタンパク質を生化学的に同定し,Hikeshiと命名した.HikeshiはヒトではC11orf73遺伝子にコードされており,酵母からヒトまで進化的に保存されているが,その機能はまったく未知であった.この研究から,HikeshiはATP型のHsp70と効率よく結合し,核膜孔を構成するタンパク質と相互作用することにより核膜孔を通過する活性をもつ新規の輸送タンパク質であることが明らかになった.また,Hikeshi経路は熱ストレスによる損傷から細胞を守り正常な細胞機能を回復するために非常に重要であり,熱から細胞を防御する機能の少なくとも一部は核に輸送されたHsp70によるものと考えられた.
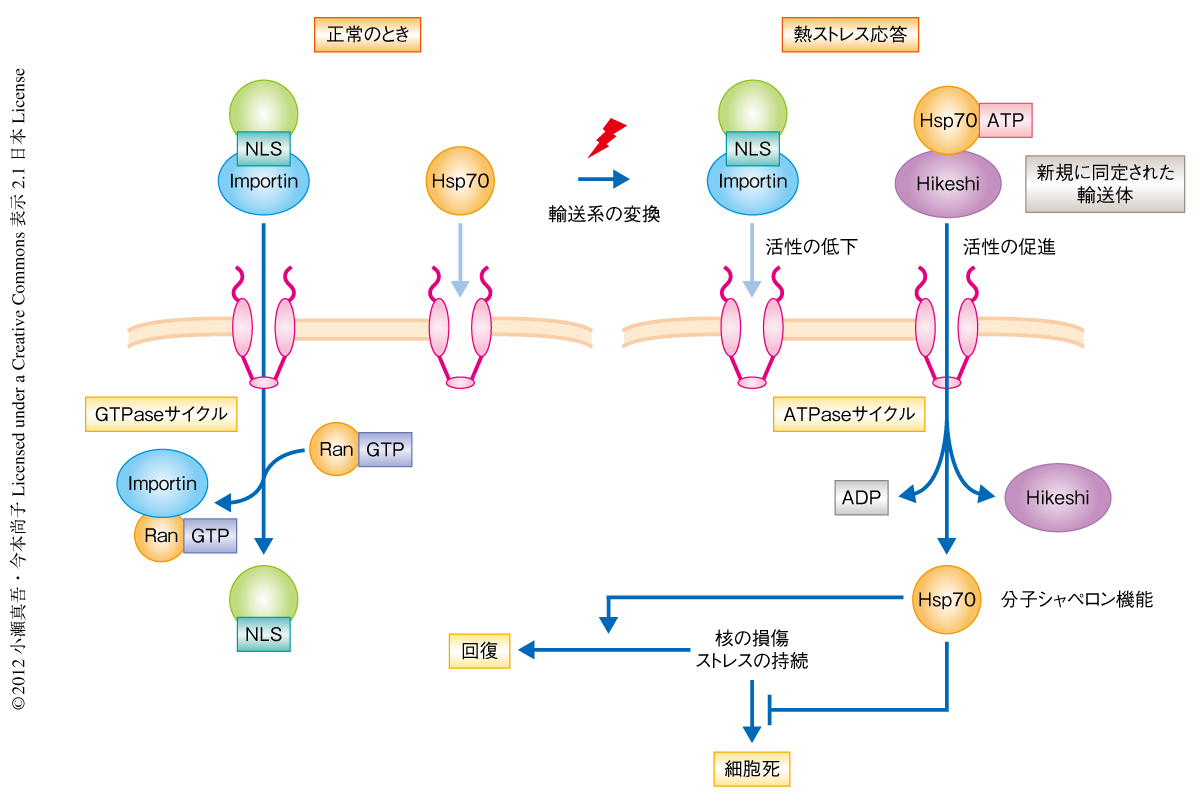
真核生物では,核において機能するタンパク質の大部分は細胞質においてImportinβファミリーに属する輸送タンパク質に結合し,核膜孔を通過して核の内部へと輸送される1).しかし,細胞が熱などさまざまなストレスをうけた状態では,Importinβファミリータンパク質による輸送活性は顕著に低下することが明らかになった2,3)(図1).一方,代表的な分子シャペロンであるHsp70は熱などのストレスに応答し,細胞における局在を細胞質から核へとすみやかに変化させることが古くから知られていた4).しかし,その局在変化の分子機構や機能についての理解は不十分なままであった.今回,筆者らは,セミインタクト細胞を用いたin vitro輸送系を用いてHsp70の核への輸送に必須なタンパク質を探索し,新しい輸送タンパク質としてHikeshiを同定した.
この研究分野では,界面活性剤であるジギトニンの処理により細胞膜に透過性をもたせたセミインタクト細胞をよく使用する.このセミインタクト細胞に細胞抽出液やATPなどをくわえることで,生細胞における核と細胞質とのあいだの分子輸送反応を再構築することができるのである.そこで最初に,このin vitro輸送系を用いて,熱ストレス応答の際の核へのタンパク質の輸送の再構築を試みた.通常の細胞抽出液ではImportinβファミリータンパク質に依存的な核への輸送は効率よく起こったが,Hsp70の核への輸送はあまり起こらなかった.しかし,熱ショック処理をした細胞から得た細胞抽出液を用いると,逆に,Importinβファミリータンパク質に依存的な核への輸送の効率は低下したが,Hsp70の核への輸送活性は上昇した.そこで,熱ショック処理をした細胞から得た細胞抽出液を生化学的に分画し,Hsp70の核への輸送に必須な分子の同定を試みた.
Importinβファミリーなど輸送タンパク質として機能するタンパク質は,核膜孔を構成するタンパク質との弱い疎水性相互作用が重要であると考えられている5).実際,フェニル-Sepharoseなどの疎水性カラムを使うと比較的簡単にImportinβファミリータンパク質を濃縮することができる.そこで,このフェニル-Sepharoseを使用してHeLa細胞抽出液を,Importinβファミリータンパク質を含む分画と含まない分画とに分け,in vitro輸送アッセイを行った.その結果,Importinβファミリータンパク質を含まない画分のみではHsp70の核への輸送はみられず,Importinβファミリータンパク質を含む画分とATPが必要であることがわかった.しかし,既知のどの組換えImportinβファミリータンパク質を用いてもHsp70の核への輸送活性はみられなかった.そこで,Importinβファミリータンパク質を含む画分をさらに生化学的に分離精製し,最終的にHsp70の核への輸送活性と密接に相関するタンパク質C11orf73を見い出し,のちにこれをHikeshiと命名した.さらに,siRNA処理によりHikeshiの発現を低下させた細胞では,熱ショック処理によってもHsp70の核への局在は観察されなかった.
HikeshiはImportinβファミリーとの相同性はみられなかったが,出芽酵母のOpi10pと高い相同性をもち,進化的に高く保存されていた6,7).しかし,どの生物種においてもその機能は不明であった.そこで,Hikeshiが輸送タンパク質として機能するかどうかを明らかにするため,基質であるHsp70との結合様式,および,Hikeshiの核膜孔の通過活性を解析した.
HikeshiとHsp70との相互作用はATPに依存的であり,Hsp70のコシャペロンでありHsp70のATPase活性を促進するHsp40は,HikeshiとHsp70との解離に作用した.また,Importinβファミリータンパク質を含まない画分をさらに解析することで,Hsp70のATP/ADP交換反応を促進するHsp110ファミリーは,Hsp70の核への輸送を促進することがわかった.これらの結果は,HikeshiのHsp70との結合とその輸送活性は,Hsp70のATPaseサイクルと密接に関連していることを示していた.つまり,HikeshiはATP型のHsp70と結合しHsp70を核に輸送する.そして,Hsp70に結合したATPのADPへの加水分解反応にともない,HikeshiとHsp70は解離すると考えられた(図2).
つぎに,Hikeshiの核膜孔の通過活性を解析したところ,Importinβファミリータンパク質と同様に,単独で核膜孔を通過する活性があり,核膜孔を構成するタンパク質であるNup62やNup153などとの相互作用が確認できた.
これらの結果から,Hikeshiは熱ストレスの際に機能する新しい核-細胞質間輸送タンパク質であると判断した.
siRNAによりHikeshiの発現を低下させた細胞では,熱ショック処理ののち正常な温度にもどしても細胞の生存率は顕著に低下した.また,生細胞イメージングによる解析から,siRNAによりHikeshiをノックダウンした細胞では正常な温度にもどっても再び細胞分裂期に入る細胞は少なく,さらに,細胞分裂期に入った細胞でもそののち細胞死を起こす確率が非常に高いことが判明した.このような熱ショック処理によるHikeshiノックダウン細胞の生存率の低下に対し,熱ショック処理のまえに核局在化シグナルを付加したHsc70(Hsp70のホモログ)を発現させておくと50%程度の生存率の上昇がみられた.これらの結果は,熱ストレスの際の細胞の損傷からの回復にHsp70の核における機能が重要であることを強く示唆していた.
さらに,Hikeshiをノックダウンした細胞では熱ストレス応答におけるさまざまな現象が正常な温度にもどしたあとにも持続することが観察された.熱ショック処理によるHsp70 mRNAの一過的な発現や転写因子HSF1の核ストレス顆粒の形成は,正常な温度にもどしてもすぐには解消されず,対照の細胞に比べ顕著に持続したのである.また,核小体タンパク質Nucleolinは熱ショック処理により核小体から遊離し,正常な温度における細胞の回復にともない再び核小体に集積するが,Hikeshiをノックダウンした細胞ではこのNucleolinの核小体への再集積についても顕著な遅れが観察された.
これらの結果は,Hikeshi経路とHsp70の核における機能は,熱ストレスにおける核のさまざまな損傷を軽減し,その回復に非常に重要な機能をはたしていることを示すものであった(図2).
筆者らは,熱ストレスの際に機能する新しい核-細胞質間輸送タンパク質Hikeshiを同定した.Hikeshiは一般的な核への輸送タンパク質の属するImportinβファミリーには属していない.つまり,細胞がストレスをうけている状態では,正常なときとは異なる輸送経路が構築されることを示している.このような輸送系の変換が細胞にとりどのような生理的な意味をもつのかはまだこれからの課題であるが,この研究から,少なくとも熱ストレス応答において分子シャペロンHsp70が核に輸送され,核において機能することの重要性を示すことができた.Hsp70など分子シャペロンの機能は非常に多岐にわたり,さまざまな機能や分子機構が詳細に解析されてきた.しかし,核における分子シャペロンの機能には未知な部分が多い.この研究の成果から,そのような分子シャペロンの核における機能解析への展開も期待できる.
(理化学研究所基幹研究所 今本細胞核機能研究室)
email:小瀬真吾,今本尚子
DOI: 10.7875/first.author.2012.067
Hikeshi, a nuclear import carrier for hsp70s, protects cells from heat shock-induced nuclear damage.
Shingo Kose, Maiko Furuta, Naoko Imamoto
Cell, 149, 578-589 (2012)
要 約
熱などのさまざまなストレスのもとでは,核と細胞質とのあいだの主要なタンパク質の輸送を担うImportinβファミリー経路は抑制される.一方で,分子シャペロンHsp70はストレスに応答して細胞質から核へとその局在を変化させることが知られていた.筆者らは,熱ストレスの際のHsp70の核への輸送に必須なタンパク質を生化学的に同定し,Hikeshiと命名した.HikeshiはヒトではC11orf73遺伝子にコードされており,酵母からヒトまで進化的に保存されているが,その機能はまったく未知であった.この研究から,HikeshiはATP型のHsp70と効率よく結合し,核膜孔を構成するタンパク質と相互作用することにより核膜孔を通過する活性をもつ新規の輸送タンパク質であることが明らかになった.また,Hikeshi経路は熱ストレスによる損傷から細胞を守り正常な細胞機能を回復するために非常に重要であり,熱から細胞を防御する機能の少なくとも一部は核に輸送されたHsp70によるものと考えられた.
はじめに
真核生物では,核において機能するタンパク質の大部分は細胞質においてImportinβファミリーに属する輸送タンパク質に結合し,核膜孔を通過して核の内部へと輸送される1).しかし,細胞が熱などさまざまなストレスをうけた状態では,Importinβファミリータンパク質による輸送活性は顕著に低下することが明らかになった2,3)(図1).一方,代表的な分子シャペロンであるHsp70は熱などのストレスに応答し,細胞における局在を細胞質から核へとすみやかに変化させることが古くから知られていた4).しかし,その局在変化の分子機構や機能についての理解は不十分なままであった.今回,筆者らは,セミインタクト細胞を用いたin vitro輸送系を用いてHsp70の核への輸送に必須なタンパク質を探索し,新しい輸送タンパク質としてHikeshiを同定した.
1.Hikeshiは熱ストレスの際のHsp70の核への輸送に必須である
この研究分野では,界面活性剤であるジギトニンの処理により細胞膜に透過性をもたせたセミインタクト細胞をよく使用する.このセミインタクト細胞に細胞抽出液やATPなどをくわえることで,生細胞における核と細胞質とのあいだの分子輸送反応を再構築することができるのである.そこで最初に,このin vitro輸送系を用いて,熱ストレス応答の際の核へのタンパク質の輸送の再構築を試みた.通常の細胞抽出液ではImportinβファミリータンパク質に依存的な核への輸送は効率よく起こったが,Hsp70の核への輸送はあまり起こらなかった.しかし,熱ショック処理をした細胞から得た細胞抽出液を用いると,逆に,Importinβファミリータンパク質に依存的な核への輸送の効率は低下したが,Hsp70の核への輸送活性は上昇した.そこで,熱ショック処理をした細胞から得た細胞抽出液を生化学的に分画し,Hsp70の核への輸送に必須な分子の同定を試みた.
Importinβファミリーなど輸送タンパク質として機能するタンパク質は,核膜孔を構成するタンパク質との弱い疎水性相互作用が重要であると考えられている5).実際,フェニル-Sepharoseなどの疎水性カラムを使うと比較的簡単にImportinβファミリータンパク質を濃縮することができる.そこで,このフェニル-Sepharoseを使用してHeLa細胞抽出液を,Importinβファミリータンパク質を含む分画と含まない分画とに分け,in vitro輸送アッセイを行った.その結果,Importinβファミリータンパク質を含まない画分のみではHsp70の核への輸送はみられず,Importinβファミリータンパク質を含む画分とATPが必要であることがわかった.しかし,既知のどの組換えImportinβファミリータンパク質を用いてもHsp70の核への輸送活性はみられなかった.そこで,Importinβファミリータンパク質を含む画分をさらに生化学的に分離精製し,最終的にHsp70の核への輸送活性と密接に相関するタンパク質C11orf73を見い出し,のちにこれをHikeshiと命名した.さらに,siRNA処理によりHikeshiの発現を低下させた細胞では,熱ショック処理によってもHsp70の核への局在は観察されなかった.
2.HikeshiはHsp70を核に輸送する輸送タンパク質として機能する
HikeshiはImportinβファミリーとの相同性はみられなかったが,出芽酵母のOpi10pと高い相同性をもち,進化的に高く保存されていた6,7).しかし,どの生物種においてもその機能は不明であった.そこで,Hikeshiが輸送タンパク質として機能するかどうかを明らかにするため,基質であるHsp70との結合様式,および,Hikeshiの核膜孔の通過活性を解析した.
HikeshiとHsp70との相互作用はATPに依存的であり,Hsp70のコシャペロンでありHsp70のATPase活性を促進するHsp40は,HikeshiとHsp70との解離に作用した.また,Importinβファミリータンパク質を含まない画分をさらに解析することで,Hsp70のATP/ADP交換反応を促進するHsp110ファミリーは,Hsp70の核への輸送を促進することがわかった.これらの結果は,HikeshiのHsp70との結合とその輸送活性は,Hsp70のATPaseサイクルと密接に関連していることを示していた.つまり,HikeshiはATP型のHsp70と結合しHsp70を核に輸送する.そして,Hsp70に結合したATPのADPへの加水分解反応にともない,HikeshiとHsp70は解離すると考えられた(図2).
つぎに,Hikeshiの核膜孔の通過活性を解析したところ,Importinβファミリータンパク質と同様に,単独で核膜孔を通過する活性があり,核膜孔を構成するタンパク質であるNup62やNup153などとの相互作用が確認できた.
これらの結果から,Hikeshiは熱ストレスの際に機能する新しい核-細胞質間輸送タンパク質であると判断した.
3.Hikeshi経路は熱ストレスによる核の損傷を軽減し正常な状態への回復に機能する
siRNAによりHikeshiの発現を低下させた細胞では,熱ショック処理ののち正常な温度にもどしても細胞の生存率は顕著に低下した.また,生細胞イメージングによる解析から,siRNAによりHikeshiをノックダウンした細胞では正常な温度にもどっても再び細胞分裂期に入る細胞は少なく,さらに,細胞分裂期に入った細胞でもそののち細胞死を起こす確率が非常に高いことが判明した.このような熱ショック処理によるHikeshiノックダウン細胞の生存率の低下に対し,熱ショック処理のまえに核局在化シグナルを付加したHsc70(Hsp70のホモログ)を発現させておくと50%程度の生存率の上昇がみられた.これらの結果は,熱ストレスの際の細胞の損傷からの回復にHsp70の核における機能が重要であることを強く示唆していた.
さらに,Hikeshiをノックダウンした細胞では熱ストレス応答におけるさまざまな現象が正常な温度にもどしたあとにも持続することが観察された.熱ショック処理によるHsp70 mRNAの一過的な発現や転写因子HSF1の核ストレス顆粒の形成は,正常な温度にもどしてもすぐには解消されず,対照の細胞に比べ顕著に持続したのである.また,核小体タンパク質Nucleolinは熱ショック処理により核小体から遊離し,正常な温度における細胞の回復にともない再び核小体に集積するが,Hikeshiをノックダウンした細胞ではこのNucleolinの核小体への再集積についても顕著な遅れが観察された.
これらの結果は,Hikeshi経路とHsp70の核における機能は,熱ストレスにおける核のさまざまな損傷を軽減し,その回復に非常に重要な機能をはたしていることを示すものであった(図2).
おわりに
筆者らは,熱ストレスの際に機能する新しい核-細胞質間輸送タンパク質Hikeshiを同定した.Hikeshiは一般的な核への輸送タンパク質の属するImportinβファミリーには属していない.つまり,細胞がストレスをうけている状態では,正常なときとは異なる輸送経路が構築されることを示している.このような輸送系の変換が細胞にとりどのような生理的な意味をもつのかはまだこれからの課題であるが,この研究から,少なくとも熱ストレス応答において分子シャペロンHsp70が核に輸送され,核において機能することの重要性を示すことができた.Hsp70など分子シャペロンの機能は非常に多岐にわたり,さまざまな機能や分子機構が詳細に解析されてきた.しかし,核における分子シャペロンの機能には未知な部分が多い.この研究の成果から,そのような分子シャペロンの核における機能解析への展開も期待できる.
文 献
- Stewart, M.: Molecular mechanism of the nuclear protein import cycle. Nat. Rev. Mol. Cell Biol., 8, 195-208 (2007)[PubMed]
- Furuta, M., Kose, S., Koike, M. et al.: Heat-shock induced nuclear retention and recycling inhibition of importinα. Genes Cells, 9, 429-441 (2004)[PubMed]
- Miyamoto, Y., Saiwaki, T., Yamashita, J. et al.: Cellular stresses induce the nuclear accumulation of importinα and cause a conventional nuclear import block. J. Cell Biol., 165, 617-623 (2004)[PubMed]
- Velazquez, J. M. & Lindquist, S.: hsp70: nuclear concentration during environmental stress and cytoplasmic storage during recovery. Cell, 36, 655-662 (1984)[PubMed]
- Ribbeck, K. & Gorlich, D.: The permeability barrier of nuclear pore complexes appears to operate via hydrophobic exclusion. EMBO J., 21, 2664-2671 (2002)[PubMed]
- Hancock, L. C., Behta, R. P. & Lopes, J. M.: Genomic analysis of the Opi- phenotype. Genetics, 173, 621-634 (2006)[PubMed]
- Fernandez-Valdivia, R., Zhang, Y., Pai, S. et al.: l7Rn6 encodes a novel protein required for clara cell function in mouse lung development. Genetics, 172, 389-399 (2006)[PubMed]
著者プロフィール
略歴:2000年 大阪大学大学院医学研究科博士課程 修了,同年 国立遺伝学研究所 助手を経て,2002年より理化学研究所 研究員.
研究テーマ:核と細胞質とのあいだの分子輸送機構.
今本 尚子(Naoko Imamoto)
理化学研究所基幹研究所 主任研究員.
研究室URL:http://www.riken.jp/celldynamics/index.html
© 2012 小瀬真吾・今本尚子 Licensed under CC 表示 2.1 日本