スフィンゴシン1-リン酸の代謝経路の全容とSjögren-Larsson症候群の原因遺伝子の関与
木原 章雄
(北海道大学大学院薬学研究院 生化学研究室)
email:木原章雄
DOI: 10.7875/first.author.2012.064
The Sjögren-Larsson syndrome gene encodes a hexadecenal dehydrogenase of the sphingosine 1-phosphate degradation pathway.
Kanae Nakahara, Aya Ohkuni, Takuya Kitamura, Kensuke Abe, Tatsuro Naganuma, Yusuke Ohno, Raphael A. Zoeller, Akio Kihara
Molecular Cell, 46, 461-471 (2012)
スフィンゴ脂質の代謝産物であるスフィンゴシン1-リン酸は,脂質メディエーターとしてだけでなく,スフィンゴ脂質からグリセロ脂質への唯一の代謝経路における中間体としても重要な役割をはたす.この代謝経路の存在は報告から40年以上も経過しているが,その詳細は不明なまま残されていた.スフィンゴシン1-リン酸はまず脂肪族アルデヒドであるヘキサデセナールに変換され,不明な3段階の変換をへてパルミトイルCoAに変換されたのち,グリセロ脂質に変換される.筆者らは,スフィンゴシン1-リン酸がヘキサデセナール,ヘキサデセン酸,ヘキサデセノイルCoA,パルミトイルCoAの順に変換されることを見い出し,スフィンゴシン1-リン酸の代謝経路の全容を明らかにした.また,ヘキサデセナールからヘキサデセン酸への変換を担う脂肪族アルデヒドデヒドロゲナーゼとしてALDH3A2を同定した.ALDH3A2遺伝子は皮膚神経疾患であるSjögren-Larsson症候群の原因遺伝子として知られている.筆者らは,スフィンゴシン1-リン酸の代謝産物であるヘキサデセナールの蓄積がSjögren-Larsson症候群の発症にかかわる可能性を提唱した.
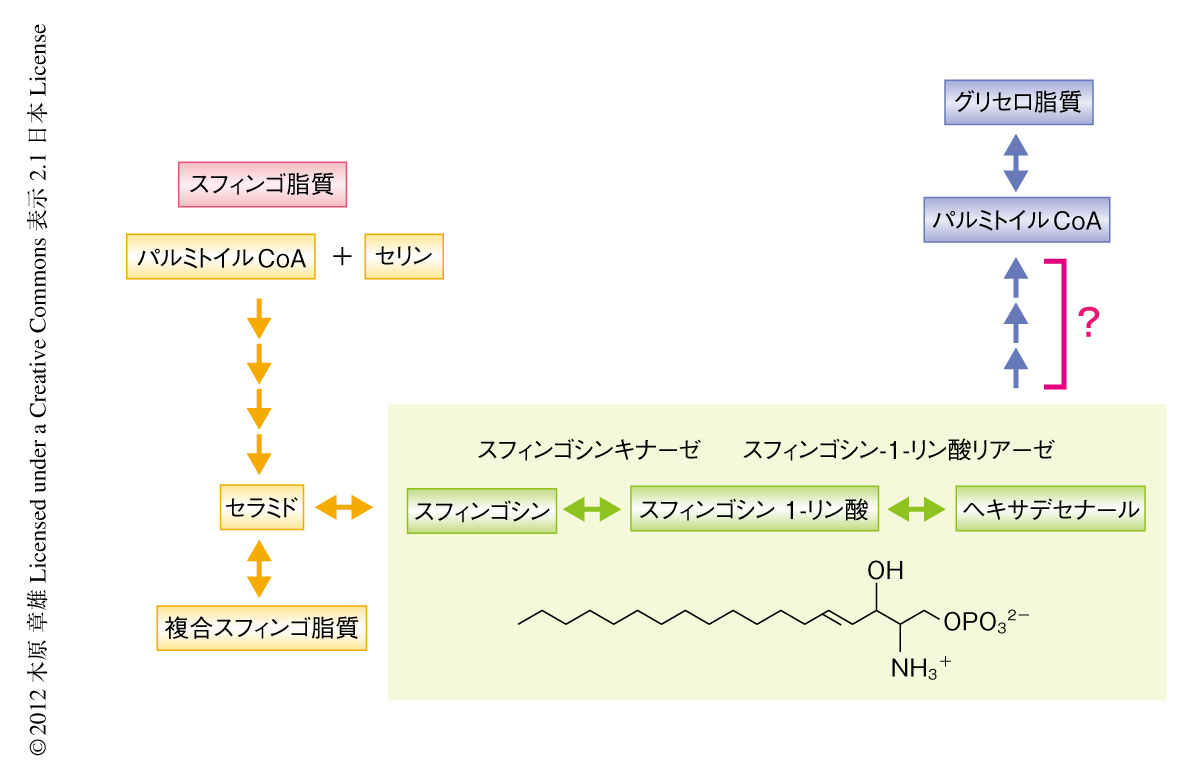
スフィンゴ脂質はグリセロ脂質,コレステロールとならび真核生物における主要な脂質のひとつである.スフィンゴ脂質の代謝産物であるスフィンゴシン1-リン酸は免疫系や血管系などにおいて重要な役割をはたす脂質メディエーターであり,その免疫系における役割を利用したフィンゴリモド(FTY720)は,2011年,多発性硬化症の治療薬として認可された1,2).また,スフィンゴシン1-リン酸は脂質メディエーターとしてだけでなく,スフィンゴ脂質の代謝中間体としても重要な役割をはたす1)(図1).このスフィンゴシン1-リン酸を介した代謝経路はスフィンゴ脂質にとりグリセロ脂質まで代謝できる唯一の経路であるため,スフィンゴ脂質の恒常性において重要であることが予想される.
スフィンゴ脂質がスフィンゴシン1-リン酸を介しグリセロ脂質へと代謝されることは1960年代後半にはすでに報告されていたが3),驚くべきことに,その代謝経路の全容は40年以上も経過した現在まで不明なまま残されていた.この経路では,スフィンゴシン1-リン酸はまずスフィンゴシン-1-リン酸リアーゼにより2位と3位とのあいだで不可逆的に開裂され,ホスホエタノールアミンと脂肪族アルデヒドであるヘキサデセナール(C16:1アルデヒド)になる1).スフィンゴシン-1-リン酸リアーゼはすでに同定されており,哺乳類ではSPL遺伝子,出芽酵母ではDPL1遺伝子にコードされている.以前の研究により,この経路において代謝されたスフィンゴシン1-リン酸は,グリセロ脂質においてはおもにパルミチン酸として存在することが明らかになっている3).脂肪酸がほかの脂質に代謝されるには必ず活性型であるアシルCoAに変換されなくてはならないので,スフィンゴシン1-リン酸はパルミトイルCoAに変換されたのちグリセロ脂質に取り込まれることが予測された.ヘキサデセナールがパルミトイルCoAまで代謝されるためには,1)アルデヒドの脂肪酸への変換,2)脂肪酸のアシルCoAへの変換,3)二重結合の飽和,の3つのステップが必要である.しかし,この3ステップの順序とそれぞれの反応を触媒する酵素は不明であった.
スフィンゴ脂質の代謝異常症としてNiemann-Pick病やFabry病を含む約40種のスフィンゴリピドーシスが知られている4).しかし,これまでスフィンゴシン1-リン酸の代謝異常症については報告されていない.アルデヒドは物性として反応性が高く,とくに1級アミンとは容易に反応することから,生体においてすみやかに代謝しないと毒性を示す.スフィンゴシン1-リン酸の代謝産物であるヘキサデセナールもアルデヒドであり,その代謝異常は疾患に結びつくことが予想されるが,代謝酵素(脂肪族アルデヒドデヒドロゲナーゼ)が未同定なため疾患とのかかわりは明らかになっていなかった.
スフィンゴ脂質の骨格であるセラミドは,2つの疎水鎖(長鎖塩基と脂肪酸)がアミド結合した構造をもつ1).哺乳類の主要な長鎖塩基は4位と5位とのあいだにtrans型の二重結合をもつスフィンゴシンである.スフィンゴシン1-リン酸はスフィンゴシンの1位がスフィンゴシンキナーゼによりリン酸化されることにより生じる.哺乳類の長鎖塩基には二重結合をもたないジヒドロスフィンゴシンも存在し,スフィンゴシンおよびスフィンゴシン1-リン酸と同様に代謝される.ジヒドロスフィンゴシンはリン酸化されジヒドロスフィンゴシン1-リン酸に変換されたのち,スフィンゴシン-1-リン酸リアーゼによりヘキサデカナール(C16:0アルデヒド)となり,最終的にグリセロ脂質まで代謝される.ヘキサデカナールはヘキサデセナールと異なり二重結合をもたないため,その代謝経路はヘキサデカナール→パルミチン酸→パルミトイルCoAであることが容易に予測される1).そこで,まずジヒドロスフィンゴシンおよびジヒドロスフィンゴシン1-リン酸の代謝における脂肪族アルデヒドデヒドロゲナーゼの同定を行うことで,スフィンゴシン1-リン酸の代謝経路の解明の足がかりにしようと考えた.
ジヒドロスフィンゴシンおよびジヒドロスフィンゴシン1-リン酸をグリセロ脂質に変換する代謝経路は酵母から哺乳類まで保存されているので,この経路にかかわる脂肪族アルデヒドデヒドロゲナーゼの同定に遺伝学的な手法の利用が可能な出芽酵母Saccharomyces cerevisiaeを使用し,野生株と8つのアルデヒドデヒドロゲナーゼ遺伝子欠損株を[4,5-3H]ジヒドロスフィンゴシンで標識した.野生株ではジヒドロスフィンゴシンはスフィンゴ脂質とグリセロ脂質の両方に代謝されたが,8つのアルデヒドデヒドロゲナーゼ遺伝子欠損株のうちHFD1遺伝子欠損株のみ,ジヒドロスフィンゴシンからグリセロ脂質への代謝が完全に遮断されていた.このことは,HFD1遺伝子の産物であるHfd1がジヒドロスフィンンゴシン1-リン酸の代謝経路で生じるヘキサデカナールをヘキサデセン酸に変換する脂肪族アルデヒドデヒドロゲナーゼであることを示していた.
出芽酵母のHfd1は,哺乳類におけるSjögren-Larsson症候群の原因遺伝子であるALDH3A2にコードされるALDH3A2と高い相同性を示す.そこで,ヒトのALDH3A2遺伝子をクローニングし出芽酵母HFD1遺伝子欠損株において発現させたところ,ジヒドロスフィンゴシンの代謝は回復した.このことから,ALDH3A2はHfd1との相同性が高いだけでなく,Hfd1の機能的なホモログであることが明らかになった.また,この結果は,ALDH3A2がジヒドロスフィンゴシンおよびジヒドロスフィンゴシン1-リン酸の代謝にかかわることを示唆していた.
スフィンゴシンおよびスフィンゴシン1-リン酸からグリセロ脂質への代謝をモニターするためには追跡の可能な放射能標識スフィンゴシンが必要であったが,市販されている[3-3H]スフィンゴシンはその用途には使用できない.放射能標識された3位の3Hはスフィンゴシン1-リン酸がヘキサデセナールに変換する過程で取り除かれてしまうからである.追跡の可能なスフィンゴシンを入手できないことが,長年にわたりスフィンゴシンおよびスフィンゴシン1-リン酸の代謝経路が不明なまま残されてきた原因の一端であると思われる.この問題を解決するため,[9,10-3H]パルミチン酸を原料として追跡の可能な[11,12-3H]スフィンゴシンを調製した.この[11,12-3H]スフィンゴシンを用いて哺乳類細胞(HEK293T細胞およびF9細胞)を標識し,[4,5-3H]ジヒドロスフィンゴシンの代謝と比較したところ,両者はともにスフィンゴ脂質とグリセロ脂質に代謝されその効率に差はみられなかった.
出芽酵母が天然にもつ長鎖塩基はジヒドロスフィンゴシンと4位に水酸基をもつフィトスフィンゴシンである.スフィンゴシンは出芽酵母には存在しないが,培地に添加されたスフィンゴシンは細胞に取り込まれスフィンゴ脂質の合成に利用される5).出芽酵母を[11,12-3H]スフィンゴシンにより標識すると,大部分の[11,12-3H]スフィンゴシンはグリセロ脂質へと代謝され,スフィンゴ脂質への代謝はわずかであった.グリセロ脂質へと代謝された[11,12-3H]スフィンゴシンの脂肪酸の分子種を調べたところ,すべてがパルミチン酸であることが判明し,これは哺乳類細胞における代謝と同じであった.このことより,スフィンゴシンおよびスフィンゴシン1-リン酸の代謝経路は出芽酵母から哺乳類まで保存されていることが明らかになった.
出芽酵母HFD1遺伝子欠損株を[11,12-3H]スフィンゴシンにより標識したところ,[11,12-3H]スフィンゴシンはグリセロ脂質へとは代謝されなかった.また,この欠損株にヒトのALDH3A2を発現させるとグリセロ脂質への代謝は回復した.このことから,Hfd1とALDH3A2はヘキサデカナールだけでなくヘキサデセナールも基質とすることが示唆された.このことを検証するため,精製したALDH3A2を用いたin vitroアッセイを行った.その結果,ALDH3A2はヘキサデカナールとヘキサデセナールを,それぞれ対応する脂肪酸,パルミチン酸(C16:0)とヘキサデセン酸(C16:1)に効率よく変換した.
FAA-K1A細胞はCHO-K1細胞を親株とし脂肪族アルデヒドデヒドロゲナーゼ変異株として単離された6).FAA-K1A細胞の脂肪族アルデヒドデヒドロゲナーゼ活性はCHO-K1細胞の約10%にまで低下していることが報告されている6).FAA-K1A株ではALDH3A2遺伝子のmRNAの発現量はRT-PCR法により検出感度以下まで低下していた.CHO-K1細胞では[11,12-3H]スフィンゴシンはHEK293T細胞やF9細胞と同様にスフィンゴ脂質とグリセロ脂質へと代謝されたが,FAA-K1A細胞ではグリセロ脂質(エステル型グリセロ脂質)への代謝が減少し,その代わり,エーテル型脂質への代謝が観察された.FAA-K1A細胞におけるスフィンゴシンからホスファチジルコリンへの代謝はCHO-K1細胞に比べ半分以下に低下していたが,新たに,飽和長鎖アルコールが1位にエーテル結合したプラズマニルコリンが産生されていた.また,FAA-K1A細胞ではスフィンゴシンからのホスファチジルエタノールアミンへの代謝も検出できないレベルにまで低下していたが,ビニルエーテル結合を1位にもつプラズメニルエタノールアミン(エタノールアミンプラズマローゲン)への代謝が観察された.このようなエーテル型脂質の合成における前駆体は長鎖アルコールであることから,ALDH3A2遺伝子の欠損によりスフィンゴシンに由来する長鎖アルデヒドが長鎖脂肪酸へと代謝されず,細胞において還元され長鎖アルコールとなり,エーテル型脂質の合成に使用されたものと考えられた.以上のように,哺乳類細胞を用いた解析からもALDH3A2がスフィンゴシンおよびスフィンゴシン1-リン酸の代謝に関与することが示された.
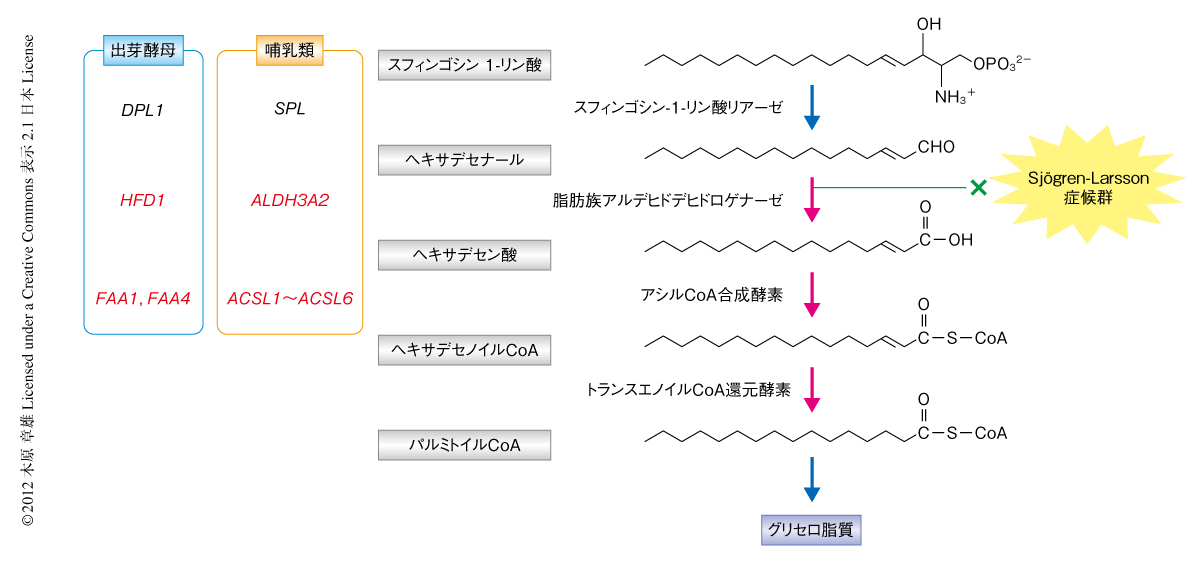
この研究の以前は,長鎖塩基および長鎖塩基1-リン酸の代謝にかかわるアシルCoA合成酵素も未同定であった.出芽酵母の変異株と放射能標識された長鎖塩基を用いた解析により,7つある出芽酵母のアシルCoA合成酵素のうち,Faa1とFaa4が長鎖塩基および長鎖塩基1-リン酸の代謝経路において機能するアシルCoA合成酵素であることを見い出した.また,[11,12-3H]スフィンゴシンによりFAA1遺伝子とFAA4遺伝子の二重変異株を標識するとヘキサデセン酸が蓄積することを見い出した.このことは,Faa1およびFaa4の基質はヘキサデセン酸であり,生成物はヘキサデセノイルCoAであることを示していた.Hfd1/ALDH3A2はスフィンゴシン1-リン酸の代謝経路においてヘキサデセナールをヘキサデセン酸に変換する脂肪族アルデヒドデヒドロゲナーゼであるという結果とあわせて,この結果は,スフィンゴシン1-リン酸がヘキサデセナール,ヘキサデセン酸,ヘキサデセノイルCoAと変換されたのち,二重結合の飽和をうけてパルミトイルCoAとなることを示した(図2).
哺乳類には26種のアシルCoA合成酵素が存在し7),そのうち,長鎖脂肪酸に特異的なアシルCoA合成酵素であるACSLファミリー(ACSL1,ACSL3,ACSL4,ACSL5,ACSL6)が出芽酵母のFaa1およびFaa4ともっとも高い相同性を示す.これらACSLファミリーメンバーのそれぞれをFAA1遺伝子とFAA4遺伝子の二重変異株において発現させると,いずれもスフィンゴシンからグリセロ脂質への代謝を正常に回復させた.以上の結果より,出芽酵母のFaa1とFaa4,および,哺乳類のACSLファミリーが長鎖塩基および長鎖塩基1-リン酸の代謝にはたらくアシルCoA合成酵素であることが明らかになった.
この研究では,スフィンゴシン1-リン酸の代謝経路の全貌とその経路にかかわる脂肪族アルデヒドデヒドロゲナーゼおよびアシルCoA合成酵素の同定に成功した(図2).Sjögren-Larsson症候群は皮膚魚鱗癬,重度の精神遅滞,痙性対麻痺を三徴候とする常染色体劣性の遺伝様式をもつ遺伝子疾患である8).その発症機構として,ALDH3A2遺伝子の変異によりALDH3A2の基質であるアルデヒドが蓄積し細胞あるいは組織に障害をあたえることが考えられているが,生体においてどのアルデヒドがおもな原因となっているかはいまだ不明である.筆者らは,この研究の結果をふまえ,Sjögren-Larsson症候群の患者においてスフィンゴシン1-リン酸の代謝産物であるヘキサデセナールが蓄積することがその発症にかかわっている可能性を提唱した.
略歴:1998年 京都大学大学院理学研究科博士課程 修了,同年 京都大学ウイルス研究所 研究員,1999年 基礎生物学研究所 研究員,2001年 北海道大学大学院薬学研究科 助手,2005年 同 助教授を経て,2008年 同 教授.
研究テーマ:脂質の多彩な生理機能と病態.
抱負:スフィンゴ脂質,極長鎖脂肪酸,脂質非対称,タンパク質のパルミトイル化など,脂質のかかわる多彩な機能を研究している.これらの解析をつうじて,脂質の新たな役割や疾患とのかかわりについて明らかにしていきたい.
研究室URL:http://www.pharm.hokudai.ac.jp/seika/index.html
© 2012 木原 章雄 Licensed under CC 表示 2.1 日本
(北海道大学大学院薬学研究院 生化学研究室)
email:木原章雄
DOI: 10.7875/first.author.2012.064
The Sjögren-Larsson syndrome gene encodes a hexadecenal dehydrogenase of the sphingosine 1-phosphate degradation pathway.
Kanae Nakahara, Aya Ohkuni, Takuya Kitamura, Kensuke Abe, Tatsuro Naganuma, Yusuke Ohno, Raphael A. Zoeller, Akio Kihara
Molecular Cell, 46, 461-471 (2012)
要 約
スフィンゴ脂質の代謝産物であるスフィンゴシン1-リン酸は,脂質メディエーターとしてだけでなく,スフィンゴ脂質からグリセロ脂質への唯一の代謝経路における中間体としても重要な役割をはたす.この代謝経路の存在は報告から40年以上も経過しているが,その詳細は不明なまま残されていた.スフィンゴシン1-リン酸はまず脂肪族アルデヒドであるヘキサデセナールに変換され,不明な3段階の変換をへてパルミトイルCoAに変換されたのち,グリセロ脂質に変換される.筆者らは,スフィンゴシン1-リン酸がヘキサデセナール,ヘキサデセン酸,ヘキサデセノイルCoA,パルミトイルCoAの順に変換されることを見い出し,スフィンゴシン1-リン酸の代謝経路の全容を明らかにした.また,ヘキサデセナールからヘキサデセン酸への変換を担う脂肪族アルデヒドデヒドロゲナーゼとしてALDH3A2を同定した.ALDH3A2遺伝子は皮膚神経疾患であるSjögren-Larsson症候群の原因遺伝子として知られている.筆者らは,スフィンゴシン1-リン酸の代謝産物であるヘキサデセナールの蓄積がSjögren-Larsson症候群の発症にかかわる可能性を提唱した.
はじめに
スフィンゴ脂質はグリセロ脂質,コレステロールとならび真核生物における主要な脂質のひとつである.スフィンゴ脂質の代謝産物であるスフィンゴシン1-リン酸は免疫系や血管系などにおいて重要な役割をはたす脂質メディエーターであり,その免疫系における役割を利用したフィンゴリモド(FTY720)は,2011年,多発性硬化症の治療薬として認可された1,2).また,スフィンゴシン1-リン酸は脂質メディエーターとしてだけでなく,スフィンゴ脂質の代謝中間体としても重要な役割をはたす1)(図1).このスフィンゴシン1-リン酸を介した代謝経路はスフィンゴ脂質にとりグリセロ脂質まで代謝できる唯一の経路であるため,スフィンゴ脂質の恒常性において重要であることが予想される.
スフィンゴ脂質がスフィンゴシン1-リン酸を介しグリセロ脂質へと代謝されることは1960年代後半にはすでに報告されていたが3),驚くべきことに,その代謝経路の全容は40年以上も経過した現在まで不明なまま残されていた.この経路では,スフィンゴシン1-リン酸はまずスフィンゴシン-1-リン酸リアーゼにより2位と3位とのあいだで不可逆的に開裂され,ホスホエタノールアミンと脂肪族アルデヒドであるヘキサデセナール(C16:1アルデヒド)になる1).スフィンゴシン-1-リン酸リアーゼはすでに同定されており,哺乳類ではSPL遺伝子,出芽酵母ではDPL1遺伝子にコードされている.以前の研究により,この経路において代謝されたスフィンゴシン1-リン酸は,グリセロ脂質においてはおもにパルミチン酸として存在することが明らかになっている3).脂肪酸がほかの脂質に代謝されるには必ず活性型であるアシルCoAに変換されなくてはならないので,スフィンゴシン1-リン酸はパルミトイルCoAに変換されたのちグリセロ脂質に取り込まれることが予測された.ヘキサデセナールがパルミトイルCoAまで代謝されるためには,1)アルデヒドの脂肪酸への変換,2)脂肪酸のアシルCoAへの変換,3)二重結合の飽和,の3つのステップが必要である.しかし,この3ステップの順序とそれぞれの反応を触媒する酵素は不明であった.
スフィンゴ脂質の代謝異常症としてNiemann-Pick病やFabry病を含む約40種のスフィンゴリピドーシスが知られている4).しかし,これまでスフィンゴシン1-リン酸の代謝異常症については報告されていない.アルデヒドは物性として反応性が高く,とくに1級アミンとは容易に反応することから,生体においてすみやかに代謝しないと毒性を示す.スフィンゴシン1-リン酸の代謝産物であるヘキサデセナールもアルデヒドであり,その代謝異常は疾患に結びつくことが予想されるが,代謝酵素(脂肪族アルデヒドデヒドロゲナーゼ)が未同定なため疾患とのかかわりは明らかになっていなかった.
1.ALDH3A2はスフィンゴシン1-リン酸の代謝経路においてはたらく脂肪族アルデヒドデヒドロゲナーゼである
スフィンゴ脂質の骨格であるセラミドは,2つの疎水鎖(長鎖塩基と脂肪酸)がアミド結合した構造をもつ1).哺乳類の主要な長鎖塩基は4位と5位とのあいだにtrans型の二重結合をもつスフィンゴシンである.スフィンゴシン1-リン酸はスフィンゴシンの1位がスフィンゴシンキナーゼによりリン酸化されることにより生じる.哺乳類の長鎖塩基には二重結合をもたないジヒドロスフィンゴシンも存在し,スフィンゴシンおよびスフィンゴシン1-リン酸と同様に代謝される.ジヒドロスフィンゴシンはリン酸化されジヒドロスフィンゴシン1-リン酸に変換されたのち,スフィンゴシン-1-リン酸リアーゼによりヘキサデカナール(C16:0アルデヒド)となり,最終的にグリセロ脂質まで代謝される.ヘキサデカナールはヘキサデセナールと異なり二重結合をもたないため,その代謝経路はヘキサデカナール→パルミチン酸→パルミトイルCoAであることが容易に予測される1).そこで,まずジヒドロスフィンゴシンおよびジヒドロスフィンゴシン1-リン酸の代謝における脂肪族アルデヒドデヒドロゲナーゼの同定を行うことで,スフィンゴシン1-リン酸の代謝経路の解明の足がかりにしようと考えた.
ジヒドロスフィンゴシンおよびジヒドロスフィンゴシン1-リン酸をグリセロ脂質に変換する代謝経路は酵母から哺乳類まで保存されているので,この経路にかかわる脂肪族アルデヒドデヒドロゲナーゼの同定に遺伝学的な手法の利用が可能な出芽酵母Saccharomyces cerevisiaeを使用し,野生株と8つのアルデヒドデヒドロゲナーゼ遺伝子欠損株を[4,5-3H]ジヒドロスフィンゴシンで標識した.野生株ではジヒドロスフィンゴシンはスフィンゴ脂質とグリセロ脂質の両方に代謝されたが,8つのアルデヒドデヒドロゲナーゼ遺伝子欠損株のうちHFD1遺伝子欠損株のみ,ジヒドロスフィンゴシンからグリセロ脂質への代謝が完全に遮断されていた.このことは,HFD1遺伝子の産物であるHfd1がジヒドロスフィンンゴシン1-リン酸の代謝経路で生じるヘキサデカナールをヘキサデセン酸に変換する脂肪族アルデヒドデヒドロゲナーゼであることを示していた.
出芽酵母のHfd1は,哺乳類におけるSjögren-Larsson症候群の原因遺伝子であるALDH3A2にコードされるALDH3A2と高い相同性を示す.そこで,ヒトのALDH3A2遺伝子をクローニングし出芽酵母HFD1遺伝子欠損株において発現させたところ,ジヒドロスフィンゴシンの代謝は回復した.このことから,ALDH3A2はHfd1との相同性が高いだけでなく,Hfd1の機能的なホモログであることが明らかになった.また,この結果は,ALDH3A2がジヒドロスフィンゴシンおよびジヒドロスフィンゴシン1-リン酸の代謝にかかわることを示唆していた.
2.追跡の可能なスフィンゴシンの調製とスフィンゴシンの哺乳類細胞および出芽酵母における代謝
スフィンゴシンおよびスフィンゴシン1-リン酸からグリセロ脂質への代謝をモニターするためには追跡の可能な放射能標識スフィンゴシンが必要であったが,市販されている[3-3H]スフィンゴシンはその用途には使用できない.放射能標識された3位の3Hはスフィンゴシン1-リン酸がヘキサデセナールに変換する過程で取り除かれてしまうからである.追跡の可能なスフィンゴシンを入手できないことが,長年にわたりスフィンゴシンおよびスフィンゴシン1-リン酸の代謝経路が不明なまま残されてきた原因の一端であると思われる.この問題を解決するため,[9,10-3H]パルミチン酸を原料として追跡の可能な[11,12-3H]スフィンゴシンを調製した.この[11,12-3H]スフィンゴシンを用いて哺乳類細胞(HEK293T細胞およびF9細胞)を標識し,[4,5-3H]ジヒドロスフィンゴシンの代謝と比較したところ,両者はともにスフィンゴ脂質とグリセロ脂質に代謝されその効率に差はみられなかった.
出芽酵母が天然にもつ長鎖塩基はジヒドロスフィンゴシンと4位に水酸基をもつフィトスフィンゴシンである.スフィンゴシンは出芽酵母には存在しないが,培地に添加されたスフィンゴシンは細胞に取り込まれスフィンゴ脂質の合成に利用される5).出芽酵母を[11,12-3H]スフィンゴシンにより標識すると,大部分の[11,12-3H]スフィンゴシンはグリセロ脂質へと代謝され,スフィンゴ脂質への代謝はわずかであった.グリセロ脂質へと代謝された[11,12-3H]スフィンゴシンの脂肪酸の分子種を調べたところ,すべてがパルミチン酸であることが判明し,これは哺乳類細胞における代謝と同じであった.このことより,スフィンゴシンおよびスフィンゴシン1-リン酸の代謝経路は出芽酵母から哺乳類まで保存されていることが明らかになった.
出芽酵母HFD1遺伝子欠損株を[11,12-3H]スフィンゴシンにより標識したところ,[11,12-3H]スフィンゴシンはグリセロ脂質へとは代謝されなかった.また,この欠損株にヒトのALDH3A2を発現させるとグリセロ脂質への代謝は回復した.このことから,Hfd1とALDH3A2はヘキサデカナールだけでなくヘキサデセナールも基質とすることが示唆された.このことを検証するため,精製したALDH3A2を用いたin vitroアッセイを行った.その結果,ALDH3A2はヘキサデカナールとヘキサデセナールを,それぞれ対応する脂肪酸,パルミチン酸(C16:0)とヘキサデセン酸(C16:1)に効率よく変換した.
3.ALDH3A2遺伝子を欠損した哺乳類細胞では長鎖塩基はエーテル型脂質へと代謝される
FAA-K1A細胞はCHO-K1細胞を親株とし脂肪族アルデヒドデヒドロゲナーゼ変異株として単離された6).FAA-K1A細胞の脂肪族アルデヒドデヒドロゲナーゼ活性はCHO-K1細胞の約10%にまで低下していることが報告されている6).FAA-K1A株ではALDH3A2遺伝子のmRNAの発現量はRT-PCR法により検出感度以下まで低下していた.CHO-K1細胞では[11,12-3H]スフィンゴシンはHEK293T細胞やF9細胞と同様にスフィンゴ脂質とグリセロ脂質へと代謝されたが,FAA-K1A細胞ではグリセロ脂質(エステル型グリセロ脂質)への代謝が減少し,その代わり,エーテル型脂質への代謝が観察された.FAA-K1A細胞におけるスフィンゴシンからホスファチジルコリンへの代謝はCHO-K1細胞に比べ半分以下に低下していたが,新たに,飽和長鎖アルコールが1位にエーテル結合したプラズマニルコリンが産生されていた.また,FAA-K1A細胞ではスフィンゴシンからのホスファチジルエタノールアミンへの代謝も検出できないレベルにまで低下していたが,ビニルエーテル結合を1位にもつプラズメニルエタノールアミン(エタノールアミンプラズマローゲン)への代謝が観察された.このようなエーテル型脂質の合成における前駆体は長鎖アルコールであることから,ALDH3A2遺伝子の欠損によりスフィンゴシンに由来する長鎖アルデヒドが長鎖脂肪酸へと代謝されず,細胞において還元され長鎖アルコールとなり,エーテル型脂質の合成に使用されたものと考えられた.以上のように,哺乳類細胞を用いた解析からもALDH3A2がスフィンゴシンおよびスフィンゴシン1-リン酸の代謝に関与することが示された.
4.スフィンゴシン1-リン酸はヘキサデセン酸およびヘキサデセノイルCoAを介してグリセロ脂質へと代謝される
この研究の以前は,長鎖塩基および長鎖塩基1-リン酸の代謝にかかわるアシルCoA合成酵素も未同定であった.出芽酵母の変異株と放射能標識された長鎖塩基を用いた解析により,7つある出芽酵母のアシルCoA合成酵素のうち,Faa1とFaa4が長鎖塩基および長鎖塩基1-リン酸の代謝経路において機能するアシルCoA合成酵素であることを見い出した.また,[11,12-3H]スフィンゴシンによりFAA1遺伝子とFAA4遺伝子の二重変異株を標識するとヘキサデセン酸が蓄積することを見い出した.このことは,Faa1およびFaa4の基質はヘキサデセン酸であり,生成物はヘキサデセノイルCoAであることを示していた.Hfd1/ALDH3A2はスフィンゴシン1-リン酸の代謝経路においてヘキサデセナールをヘキサデセン酸に変換する脂肪族アルデヒドデヒドロゲナーゼであるという結果とあわせて,この結果は,スフィンゴシン1-リン酸がヘキサデセナール,ヘキサデセン酸,ヘキサデセノイルCoAと変換されたのち,二重結合の飽和をうけてパルミトイルCoAとなることを示した(図2).
哺乳類には26種のアシルCoA合成酵素が存在し7),そのうち,長鎖脂肪酸に特異的なアシルCoA合成酵素であるACSLファミリー(ACSL1,ACSL3,ACSL4,ACSL5,ACSL6)が出芽酵母のFaa1およびFaa4ともっとも高い相同性を示す.これらACSLファミリーメンバーのそれぞれをFAA1遺伝子とFAA4遺伝子の二重変異株において発現させると,いずれもスフィンゴシンからグリセロ脂質への代謝を正常に回復させた.以上の結果より,出芽酵母のFaa1とFaa4,および,哺乳類のACSLファミリーが長鎖塩基および長鎖塩基1-リン酸の代謝にはたらくアシルCoA合成酵素であることが明らかになった.
おわりに
この研究では,スフィンゴシン1-リン酸の代謝経路の全貌とその経路にかかわる脂肪族アルデヒドデヒドロゲナーゼおよびアシルCoA合成酵素の同定に成功した(図2).Sjögren-Larsson症候群は皮膚魚鱗癬,重度の精神遅滞,痙性対麻痺を三徴候とする常染色体劣性の遺伝様式をもつ遺伝子疾患である8).その発症機構として,ALDH3A2遺伝子の変異によりALDH3A2の基質であるアルデヒドが蓄積し細胞あるいは組織に障害をあたえることが考えられているが,生体においてどのアルデヒドがおもな原因となっているかはいまだ不明である.筆者らは,この研究の結果をふまえ,Sjögren-Larsson症候群の患者においてスフィンゴシン1-リン酸の代謝産物であるヘキサデセナールが蓄積することがその発症にかかわっている可能性を提唱した.
文 献
- Kihara, A., Mitsutake, S., Mizutani, Y. et al.: Metabolism and biological functions of two phosphorylated sphingolipids, sphingosine 1-phosphate and ceramide 1-phosphate. Prog. Lipid Res., 46, 126-144 (2007)[PubMed]
- Kihara, A. & Igarashi, Y.: Production and release of sphingosine 1-phosphate and the phosphorylated form of the immunomodulator FTY720. Biochim. Biophys. Acta, 1781, 496-502 (2008)[PubMed]
- Stoffel, W. & Sticht, G.: Metabolism of sphingosine bases, I. Degradation and incorporation of [3-14C]erythro-DL-dihydrosphingosine and [7-3H2]erythroDL-sphingosine into sphingolipids of rat liver. Hoppe Seylers Z. Physiol. Chem., 348, 941-943 (1967)[PubMed]
- Sillence, D. J. & Platt, F. M.: Storage diseases: new insights into sphingolipid functions. Trends Cell Biol., 13, 195-203 (2003)[PubMed]
- Tani, M., Kihara, A., & Igarashi, Y.: Rescue of cell growth by sphingosine with disruption of lipid microdomain formation in Saccharomyces cerevisiae deficient in sphingolipid biosynthesis. Biochem. J., 394, 237-242 (2006)[PubMed]
- James, P. F. & Zoeller, R. A.: Isolation of animal cell mutants defective in long-chain fatty aldehyde dehydrogenase. Sensitivity to fatty aldehydes and Schiff's base modification of phospholipids: implications for Sjögren-Larsson syndrome. J. Biol. Chem., 272, 23532-23539 (1997)[PubMed]
- Watkins, P. A., Maiguel, D., Jia, Z. et al.: Evidence for 26 distinct acyl-coenzyme A synthetase genes in the human genome. J. Lipid Res., 48, 2736-2750 (2007)[PubMed]
- Rizzo, W. B.: Sjögren-Larsson syndrome: molecular genetics and biochemical pathogenesis of fatty aldehyde dehydrogenase deficiency. Mol. Genet. Metab., 90, 1-9 (2007)[PubMed]
著者プロフィール
略歴:1998年 京都大学大学院理学研究科博士課程 修了,同年 京都大学ウイルス研究所 研究員,1999年 基礎生物学研究所 研究員,2001年 北海道大学大学院薬学研究科 助手,2005年 同 助教授を経て,2008年 同 教授.
研究テーマ:脂質の多彩な生理機能と病態.
抱負:スフィンゴ脂質,極長鎖脂肪酸,脂質非対称,タンパク質のパルミトイル化など,脂質のかかわる多彩な機能を研究している.これらの解析をつうじて,脂質の新たな役割や疾患とのかかわりについて明らかにしていきたい.
研究室URL:http://www.pharm.hokudai.ac.jp/seika/index.html
© 2012 木原 章雄 Licensed under CC 表示 2.1 日本