抑制性の受容体PD-1は腸管における免疫グロブリンAの選択を制御することにより腸内細菌叢の構成の変化にかかわる
河本新平・Sidonia Fagarasan
(理化学研究所免疫・アレルギー科学総合研究センター 粘膜免疫研究チーム)
email:河本新平
DOI: 10.7875/first.author.2012.058
The inhibitory receptor PD-1 regulates IgA selection and bacterial composition in the gut.
Shimpei Kawamoto, Thinh H. Tran, Mikako Maruya, Keiichiro Suzuki, Yasuko Doi, Yumi Tsutsui, Lucia M. Kato, Sidonia Fagarasan
Science, 336, 485-489 (2012)
免疫グロブリンAは腸内細菌の制御に関与しており,宿主の腸管の免疫系のみならず全身免疫系の恒常性の維持に重要な役割をはたしている.筆者らは,抑制性の受容体として知られるPD-1が免疫グロブリンAの選択に非常に重要であることを見い出した.PD-1ノックアウトマウスではパイエル板の胚中心においてB細胞の選択を補助する濾胞性ヘルパーT細胞の数が2.7倍に増え,胚中心におけるB細胞の選択に問題が生じていた.その結果,PD-1ノックアウトマウスの腸管に分泌されている免疫グロブリンAは腸内細菌に対し結合力が低く,それにより腸内細菌叢の構成が変化していることが明らかになった.また,この腸内細菌叢の変化が全身免疫系の過剰な活性化につながっている可能性も示唆された.以上により,抑制性の受容体PD-1は腸管における免疫グロブリンAの選択に関与し腸内細菌を制御することで,腸管のみならず全身免疫系の恒常性の維持に関与していることが明らかになった.
腸管には莫大な数の腸内細菌が存在し,常時,宿主の免疫系とのあいだで恒常性を維持している.宿主と腸内細菌との恒常性の維持において非常に重要な役割をはたしている腸管の免疫グロブリンAは,おもにパイエル板の胚中心とよばれる部位においてT細胞に依存的に産生されることが明らかになっている1).抗原による刺激をうけたB細胞はパイエル板の胚中心においてAID(activation-induced cytidine deaminase)を発現し,免疫グロブリンAが誘導されるのと同時に抗体の多様性を獲得すべく体細胞超突然変異を起こし,濾胞性ヘルパーT細胞とよばれるT細胞の補助のもと,最終的に抗原に対し高い親和性をもつ免疫グロブリンA陽性の胚中心B細胞が選択される2,3).濾胞性ヘルパーT細胞は細胞の表面に抑制性の受容体であるPD-1(programmed cell death-1)を高発現しており4),近年,このPD-1が濾胞性ヘルパーT細胞の機能になんらかの影響を及ぼしていることが明らかになりつつある5).PD-1はおもに活性化したT細胞に発現しており,負のシグナルを伝達することで細胞の増殖を抑え免疫系を抑制する機能をもつものと考えられている.実際に,PD-1ノックアウトマウスはマウスの系統によりさまざまな自己免疫疾患を示すが6-8),興味深いことに,これらのマウスを腸内細菌が存在しない無菌条件において飼育した場合には自己免疫疾患の生じないことが知られていた9).このことは,腸内細菌が自己免疫疾患になんらかの影響を及ぼしていることを示唆しているものの,その分子機構については明らかになっていなかった.
筆者らは,これまでに,免疫グロブリンAは腸管において腸内細菌の制御に関与しており,腸管のみならず全身免疫系の恒常性の維持に重要な役割をはたしていることを報告してきた.そこで今回,PD-1ノックアウトマウスにおける免疫グロブリンAの産生および腸内細菌叢の変化について検討し,それらが自己免疫疾患にどのような影響を及ぼしているのかにつき明らかにすることを試みた.
PD-1が腸内細菌叢を制御しているのかどうか調べるため,細菌培養法および16SリボソームRNA塩基配列解析法を用いて,野生型マウスおよびPD-1ノックアウトマウスにおける腸内細菌叢の構成について検討した.その結果,腸内細菌の総数には差はみられなかったが,驚くべきことに,PD-1ノックアウトマウスでは腸内細菌叢の構成が大きく変化していた.すなわち,PD-1ノックアウトマウスでは野生型マウスと比べ嫌気性細菌の総数が93~95%も減少しており,さらに興味深いことに,Bifidobacterium属細菌やBacteroides属細菌のような健康な個体において多数をしめる細菌10) がPD-1ノックアウトマウスでは検出できないもしくは著しく減少していた一方,野生型マウスではほとんど検出されないEnterobacteriaceae科細菌が約400倍にも増加していた.
なぜ,PD-1ノックアウトマウスでは腸内細菌叢のバランスが大きく変化しているのだろうか? 腸内細菌叢のバランスを制御するのに重要な腸管における免疫グロブリンAについて検討を試みた.小腸の粘膜固有層に存在し大量の免疫グロブリンAを分泌する免疫グロブリンA産生形質細胞の総数は野生型マウスとPD-1ノックアウトマウスとのあいだで差はみられず,腸管に分泌される免疫グロブリンAの量も変わりなかった.しかしながら,フローサイトメーターを用いて免疫グロブリンAにより表面をおおわれている腸内細菌の割合を確認したところ,PD-1ノックアウトマウスでは野生型マウスに比べこのような腸内細菌の割合が減少していた.以上の結果から,PD-1ノックアウトマウスにおいては,野生型マウスと比較して免疫グロブリンAの量的な変化はないものの,腸内細菌に対し結合力の低い免疫グロブリンAが分泌されるという,免疫グロブリンAの質的な変化のみられることが明らかになった.
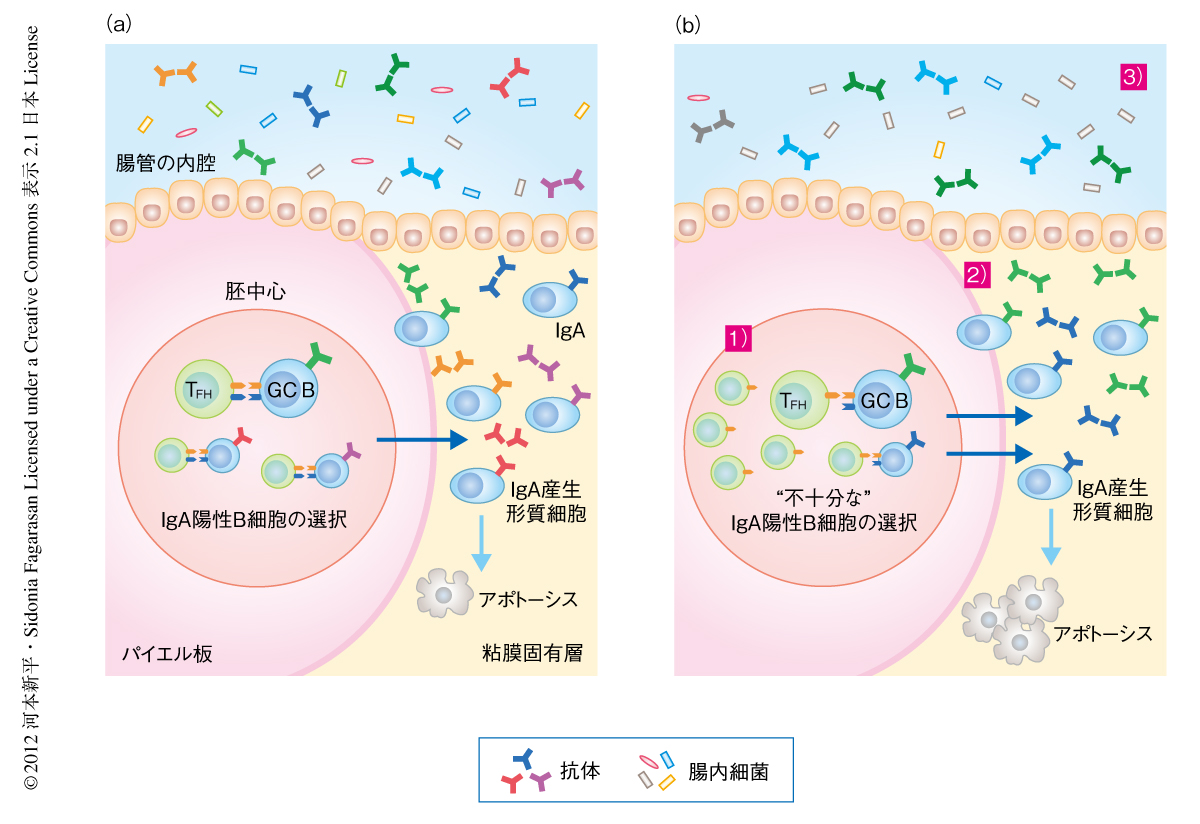
腸管の免疫グロブリンAはパイエル板の胚中心においてB細胞に誘導され,AIDによる体細胞超突然変異をへることでそれ自体のもつ抗原特異性をさらに高めている.このB細胞の成熟過程において,濾胞性ヘルパーT細胞の補助のもと,抗原に対し高い親和性を示す免疫グロブリンA陽性B細胞が選択され,最終的に小腸の粘膜固有層において免疫グロブリンA産生形質細胞へと分化する.そこで,PD-1ノックアウトマウスにおける免疫グロブリンAの質的な変化の原因を明らかにするため,パイエル板の胚中心B細胞および濾胞性ヘルパーT細胞の数を確認した.PD-1ノックアウトマウスではパイエル板の胚中心が大きくなり野生型マウスと比べ胚中心B細胞の総数が1.7倍に増加し,さらに,濾胞性ヘルパーT細胞の総数も2.7倍に増加していた.また,PD-1ノックアウトマウスにおいて濾胞性ヘルパーT細胞からのサイトカインの産生を確認したところ,野生型マウスに比べ胚中心B細胞の成熟に重要なサイトカインであるインターロイキン21の産生量は低く,これとは対称的に,炎症性サイトカインであるインターフェロンγの産生量は高かった.これらの結果から,PD-1ノックアウトマウスでは濾胞性ヘルパーT細胞の質的な変化とともにその数の異常な増加がみられ,それにともない胚中心B細胞の異常な増加が確認された.
パイエル板における胚中心B細胞の増殖およびパイエル板での入れ替わりをブロモデオキシウリジンを用いて検討した.ブロモデオキシウリジンは細胞分裂を行っている細胞のDNAに取り込まれることにより増殖している細胞を標識することができる.まず,パイエル板においてブロモデオキシウリジンの投与のち数時間でのブロモデオキシウリジン陽性B細胞の割合を調べることで,野生型マウスとPD-1ノックアウトマウスとのあいだで胚中心B細胞の細胞増殖を比較したが,パイエル板における胚中心B細胞の増殖に差はみられなかった.つぎに,パイエル板における胚中心B細胞の入れ替わりを検討するためブロモデオキシウリジンを長期間にわたり投与する実験を行った.ブロモデオキシウリジンを10日間にわたりマウスに経口投与して胚中心B細胞をほぼすべて標識し,投与を中止したあとのブロモデオキシウリジン陽性細胞の減少を確認することでパイエル板における胚中心B細胞の入れ替わりを検討した.その結果,PD-1ノックアウトマウスでは胚中心B細胞の細胞増殖には差はみられなかったにもかからず,ブロモデオキシウリジン陽性胚中心B細胞のパイエル板からの消失は野生型マウスに比べ早く,PD-1ノックアウトマウスにおいてはB細胞がより早く胚中心における選択を通過して外部にでていく可能性が示唆された.さらに,胚中心における選択をより早く通過した免疫グロブリンA陽性B細胞の最終的な運命を確認する目的で,野生型マウスとPD-1ノックアウトマウスとのあいだで小腸の粘膜固有層における免疫グロブリンA産生形質細胞のアポトーシスを比較したところ,PD-1ノックアウトマウスではアポトーシスを起こしている免疫グロブリンA産生形質細胞の割合が有意に高かった.この結果から,パイエル板の胚中心をより早く通過した免疫グロブリンA陽性B細胞は適切な選択をうけることができず,粘膜固有層において免疫グロブリンA産生形質細胞へと効率よく分化できないことが明らかになった.
以上より,PD-1ノックアウトマウスにおいては濾胞性ヘルパーT細胞の過剰な補助によりB細胞がパイエル板の胚中心を早く通過することで,胚中心における免疫グロブリンAの選択が適切に行われず,結果的に,本来は除かれるべき腸内細菌に対し結合力の低い免疫グロブリンAをもつB細胞が選択され,最終的に免疫グロブリンA産生形質細胞へと分化していることが明らかになった.
腸管免疫グロブリンAの質的な変化によりひき起こされた腸内細菌叢の変化が全身免疫系にどのような影響を及ぼしているのかを検討した.PD-1ノックアウトマウスでは野生型マウスに比べ腸管および末梢リンパ節において炎症性サイトカインであるインターフェロンγを産生するT細胞が増加しており,さらに,末梢リンパ節に正常の状態では誘導されることのない胚中心が存在していた.また,通常は腸管にしかみられないはずの腸内細菌に対する抗体が血清からも検出されたことから,PD-1ノックアウトマウスでは通常は腸管免疫系のなかにとどめられている腸内細菌の抗原が全身免疫系にもれだし,全身免疫系を過剰に活性化させている可能性が示唆された.実際に,PD-1ノックアウトマウスに抗生物質を投与して腸内細菌を除いた場合,このような全身免疫系の異常な活性化は抑えられたことから,PD-1ノックアウトマウスにおける腸内細菌叢の変化が全身免疫系の過剰な活性化につながっている可能性が示唆された.
以上の結果から,腸管における免疫グロブリンAの質的な異常によりひき起こされる腸内細菌叢の変化が全身免疫系の過剰な活性化につながり,自己免疫疾患などの病態を増強している可能性が示唆された(図1).
この研究により,抑制性の受容体であるPD-1は腸管における免疫グロブリンAの産生を介し腸内細菌のバランスを制御していることが明らかになった.また,腸管における免疫グロブリンAの異常によりひき起こされる腸内細菌叢の変化は全身免疫系を活性化し,自己免疫疾患などの病態を増強している可能性が示唆された.しかし,腸管において免疫グロブリンAは実際にどのようにして腸内細菌叢の構成を制御しているのか,また,腸内細菌叢はどのような分子機構により全身免疫系に影響を及ぼしているのかについてはいまだ不明な点が多く,今後の研究が期待される.これらの問題を解決することで,自己免疫疾患の症状をやわらげたり予防したりする新たな治療法の開発にもつながっていくと期待される.
略歴:2011年 京都大学大学院医学研究科 修了,同年より理化学研究所免疫・アレルギー科学総合研究センター 基礎科学特別研究員.
研究テーマ:腸管における免疫グロブリンAによる腸内細菌の制御の機構.
Sidonia Fagarasan
理化学研究所免疫・アレルギー科学総合研究センター チームリーダー.
研究室URL:http://web.rcai.riken.jp/mucosal/
© 2012 河本新平・Sidonia Fagarasan Licensed under CC 表示 2.1 日本
(理化学研究所免疫・アレルギー科学総合研究センター 粘膜免疫研究チーム)
email:河本新平
DOI: 10.7875/first.author.2012.058
The inhibitory receptor PD-1 regulates IgA selection and bacterial composition in the gut.
Shimpei Kawamoto, Thinh H. Tran, Mikako Maruya, Keiichiro Suzuki, Yasuko Doi, Yumi Tsutsui, Lucia M. Kato, Sidonia Fagarasan
Science, 336, 485-489 (2012)
要 約
免疫グロブリンAは腸内細菌の制御に関与しており,宿主の腸管の免疫系のみならず全身免疫系の恒常性の維持に重要な役割をはたしている.筆者らは,抑制性の受容体として知られるPD-1が免疫グロブリンAの選択に非常に重要であることを見い出した.PD-1ノックアウトマウスではパイエル板の胚中心においてB細胞の選択を補助する濾胞性ヘルパーT細胞の数が2.7倍に増え,胚中心におけるB細胞の選択に問題が生じていた.その結果,PD-1ノックアウトマウスの腸管に分泌されている免疫グロブリンAは腸内細菌に対し結合力が低く,それにより腸内細菌叢の構成が変化していることが明らかになった.また,この腸内細菌叢の変化が全身免疫系の過剰な活性化につながっている可能性も示唆された.以上により,抑制性の受容体PD-1は腸管における免疫グロブリンAの選択に関与し腸内細菌を制御することで,腸管のみならず全身免疫系の恒常性の維持に関与していることが明らかになった.
はじめに
腸管には莫大な数の腸内細菌が存在し,常時,宿主の免疫系とのあいだで恒常性を維持している.宿主と腸内細菌との恒常性の維持において非常に重要な役割をはたしている腸管の免疫グロブリンAは,おもにパイエル板の胚中心とよばれる部位においてT細胞に依存的に産生されることが明らかになっている1).抗原による刺激をうけたB細胞はパイエル板の胚中心においてAID(activation-induced cytidine deaminase)を発現し,免疫グロブリンAが誘導されるのと同時に抗体の多様性を獲得すべく体細胞超突然変異を起こし,濾胞性ヘルパーT細胞とよばれるT細胞の補助のもと,最終的に抗原に対し高い親和性をもつ免疫グロブリンA陽性の胚中心B細胞が選択される2,3).濾胞性ヘルパーT細胞は細胞の表面に抑制性の受容体であるPD-1(programmed cell death-1)を高発現しており4),近年,このPD-1が濾胞性ヘルパーT細胞の機能になんらかの影響を及ぼしていることが明らかになりつつある5).PD-1はおもに活性化したT細胞に発現しており,負のシグナルを伝達することで細胞の増殖を抑え免疫系を抑制する機能をもつものと考えられている.実際に,PD-1ノックアウトマウスはマウスの系統によりさまざまな自己免疫疾患を示すが6-8),興味深いことに,これらのマウスを腸内細菌が存在しない無菌条件において飼育した場合には自己免疫疾患の生じないことが知られていた9).このことは,腸内細菌が自己免疫疾患になんらかの影響を及ぼしていることを示唆しているものの,その分子機構については明らかになっていなかった.
筆者らは,これまでに,免疫グロブリンAは腸管において腸内細菌の制御に関与しており,腸管のみならず全身免疫系の恒常性の維持に重要な役割をはたしていることを報告してきた.そこで今回,PD-1ノックアウトマウスにおける免疫グロブリンAの産生および腸内細菌叢の変化について検討し,それらが自己免疫疾患にどのような影響を及ぼしているのかにつき明らかにすることを試みた.
1.PD-1ノックアウトマウスにおける腸内細菌叢の変化と腸管における免疫グロブリンAの質的な変化
PD-1が腸内細菌叢を制御しているのかどうか調べるため,細菌培養法および16SリボソームRNA塩基配列解析法を用いて,野生型マウスおよびPD-1ノックアウトマウスにおける腸内細菌叢の構成について検討した.その結果,腸内細菌の総数には差はみられなかったが,驚くべきことに,PD-1ノックアウトマウスでは腸内細菌叢の構成が大きく変化していた.すなわち,PD-1ノックアウトマウスでは野生型マウスと比べ嫌気性細菌の総数が93~95%も減少しており,さらに興味深いことに,Bifidobacterium属細菌やBacteroides属細菌のような健康な個体において多数をしめる細菌10) がPD-1ノックアウトマウスでは検出できないもしくは著しく減少していた一方,野生型マウスではほとんど検出されないEnterobacteriaceae科細菌が約400倍にも増加していた.
なぜ,PD-1ノックアウトマウスでは腸内細菌叢のバランスが大きく変化しているのだろうか? 腸内細菌叢のバランスを制御するのに重要な腸管における免疫グロブリンAについて検討を試みた.小腸の粘膜固有層に存在し大量の免疫グロブリンAを分泌する免疫グロブリンA産生形質細胞の総数は野生型マウスとPD-1ノックアウトマウスとのあいだで差はみられず,腸管に分泌される免疫グロブリンAの量も変わりなかった.しかしながら,フローサイトメーターを用いて免疫グロブリンAにより表面をおおわれている腸内細菌の割合を確認したところ,PD-1ノックアウトマウスでは野生型マウスに比べこのような腸内細菌の割合が減少していた.以上の結果から,PD-1ノックアウトマウスにおいては,野生型マウスと比較して免疫グロブリンAの量的な変化はないものの,腸内細菌に対し結合力の低い免疫グロブリンAが分泌されるという,免疫グロブリンAの質的な変化のみられることが明らかになった.
2.パイエル板における免疫グロブリンA陽性B細胞の選択の異常
腸管の免疫グロブリンAはパイエル板の胚中心においてB細胞に誘導され,AIDによる体細胞超突然変異をへることでそれ自体のもつ抗原特異性をさらに高めている.このB細胞の成熟過程において,濾胞性ヘルパーT細胞の補助のもと,抗原に対し高い親和性を示す免疫グロブリンA陽性B細胞が選択され,最終的に小腸の粘膜固有層において免疫グロブリンA産生形質細胞へと分化する.そこで,PD-1ノックアウトマウスにおける免疫グロブリンAの質的な変化の原因を明らかにするため,パイエル板の胚中心B細胞および濾胞性ヘルパーT細胞の数を確認した.PD-1ノックアウトマウスではパイエル板の胚中心が大きくなり野生型マウスと比べ胚中心B細胞の総数が1.7倍に増加し,さらに,濾胞性ヘルパーT細胞の総数も2.7倍に増加していた.また,PD-1ノックアウトマウスにおいて濾胞性ヘルパーT細胞からのサイトカインの産生を確認したところ,野生型マウスに比べ胚中心B細胞の成熟に重要なサイトカインであるインターロイキン21の産生量は低く,これとは対称的に,炎症性サイトカインであるインターフェロンγの産生量は高かった.これらの結果から,PD-1ノックアウトマウスでは濾胞性ヘルパーT細胞の質的な変化とともにその数の異常な増加がみられ,それにともない胚中心B細胞の異常な増加が確認された.
パイエル板における胚中心B細胞の増殖およびパイエル板での入れ替わりをブロモデオキシウリジンを用いて検討した.ブロモデオキシウリジンは細胞分裂を行っている細胞のDNAに取り込まれることにより増殖している細胞を標識することができる.まず,パイエル板においてブロモデオキシウリジンの投与のち数時間でのブロモデオキシウリジン陽性B細胞の割合を調べることで,野生型マウスとPD-1ノックアウトマウスとのあいだで胚中心B細胞の細胞増殖を比較したが,パイエル板における胚中心B細胞の増殖に差はみられなかった.つぎに,パイエル板における胚中心B細胞の入れ替わりを検討するためブロモデオキシウリジンを長期間にわたり投与する実験を行った.ブロモデオキシウリジンを10日間にわたりマウスに経口投与して胚中心B細胞をほぼすべて標識し,投与を中止したあとのブロモデオキシウリジン陽性細胞の減少を確認することでパイエル板における胚中心B細胞の入れ替わりを検討した.その結果,PD-1ノックアウトマウスでは胚中心B細胞の細胞増殖には差はみられなかったにもかからず,ブロモデオキシウリジン陽性胚中心B細胞のパイエル板からの消失は野生型マウスに比べ早く,PD-1ノックアウトマウスにおいてはB細胞がより早く胚中心における選択を通過して外部にでていく可能性が示唆された.さらに,胚中心における選択をより早く通過した免疫グロブリンA陽性B細胞の最終的な運命を確認する目的で,野生型マウスとPD-1ノックアウトマウスとのあいだで小腸の粘膜固有層における免疫グロブリンA産生形質細胞のアポトーシスを比較したところ,PD-1ノックアウトマウスではアポトーシスを起こしている免疫グロブリンA産生形質細胞の割合が有意に高かった.この結果から,パイエル板の胚中心をより早く通過した免疫グロブリンA陽性B細胞は適切な選択をうけることができず,粘膜固有層において免疫グロブリンA産生形質細胞へと効率よく分化できないことが明らかになった.
以上より,PD-1ノックアウトマウスにおいては濾胞性ヘルパーT細胞の過剰な補助によりB細胞がパイエル板の胚中心を早く通過することで,胚中心における免疫グロブリンAの選択が適切に行われず,結果的に,本来は除かれるべき腸内細菌に対し結合力の低い免疫グロブリンAをもつB細胞が選択され,最終的に免疫グロブリンA産生形質細胞へと分化していることが明らかになった.
3.PD-1ノックアウトマウスにおける腸内細菌叢の構成の変化が全身免疫系を過剰に活性化する
腸管免疫グロブリンAの質的な変化によりひき起こされた腸内細菌叢の変化が全身免疫系にどのような影響を及ぼしているのかを検討した.PD-1ノックアウトマウスでは野生型マウスに比べ腸管および末梢リンパ節において炎症性サイトカインであるインターフェロンγを産生するT細胞が増加しており,さらに,末梢リンパ節に正常の状態では誘導されることのない胚中心が存在していた.また,通常は腸管にしかみられないはずの腸内細菌に対する抗体が血清からも検出されたことから,PD-1ノックアウトマウスでは通常は腸管免疫系のなかにとどめられている腸内細菌の抗原が全身免疫系にもれだし,全身免疫系を過剰に活性化させている可能性が示唆された.実際に,PD-1ノックアウトマウスに抗生物質を投与して腸内細菌を除いた場合,このような全身免疫系の異常な活性化は抑えられたことから,PD-1ノックアウトマウスにおける腸内細菌叢の変化が全身免疫系の過剰な活性化につながっている可能性が示唆された.
以上の結果から,腸管における免疫グロブリンAの質的な異常によりひき起こされる腸内細菌叢の変化が全身免疫系の過剰な活性化につながり,自己免疫疾患などの病態を増強している可能性が示唆された(図1).
おわりに
この研究により,抑制性の受容体であるPD-1は腸管における免疫グロブリンAの産生を介し腸内細菌のバランスを制御していることが明らかになった.また,腸管における免疫グロブリンAの異常によりひき起こされる腸内細菌叢の変化は全身免疫系を活性化し,自己免疫疾患などの病態を増強している可能性が示唆された.しかし,腸管において免疫グロブリンAは実際にどのようにして腸内細菌叢の構成を制御しているのか,また,腸内細菌叢はどのような分子機構により全身免疫系に影響を及ぼしているのかについてはいまだ不明な点が多く,今後の研究が期待される.これらの問題を解決することで,自己免疫疾患の症状をやわらげたり予防したりする新たな治療法の開発にもつながっていくと期待される.
文 献
- Fagarasan, S., Kawamoto, S., Kanagawa, O. et al.: Adaptive immune regulation in the gut: T cell-dependent and T cell-independent IgA synthesis. Annu. Rev. Immunol., 28, 243-273 (2010)[PubMed]
- Jacob, J., Kelsoe, G., Rajewsky, K. et al.: Intraclonal generation of antibody mutants in germinal centres. Nature, 354, 389-392 (1991)[PubMed]
- Muramatsu, M., Kinoshita, K., Fagarasan, S. et al.: Class switch recombination and hypermutation require activation-induced cytidine deaminase (AID), a potential RNA editing enzyme. Cell, 102, 553-563 (2000)[PubMed]
- Haynes, N. M., Allen, C. D., Lesley, R. et al.: Role of CXCR5 and CCR7 in follicular Th cell positioning and appearance of a programmed cell death gene-1high germinal center-associated subpopulation. J. Immunol., 179, 5099-5108 (2007)[PubMed]
- Good-Jacobson, K. L., Szumilas, C. G., Chen, L. et al.: PD-1 regulates germinal center B cell survival and the formation and affinity of long-lived plasma cells. Nat. Immunol., 11, 535-542 (2010)[PubMed]
- Okazaki, T. & Honjo, T.: The PD-1-PD-L pathway in immunological tolerance. Trends Immunol., 27, 195-201 (2006)[PubMed]
- Nishimura, H., Nose, M., Hiai, H. et al.: Development of lupus-like autoimmune diseases by disruption of the PD-1 gene encoding an ITIM motif-carrying immunoreceptor. Immunity, 11, 141-151 (1999)[PubMed]
- Nishimura, H., Okazaki, T., Tanaka, Y. et al.: Autoimmune dilated cardiomyopathy in PD-1 receptor-deficient mice. Science, 291, 319-322 (2001)[PubMed]
- Okazaki, T., Okazaki, I. M., Wang, J. et al.: PD-1 and LAG-3 inhibitory co-receptors act synergistically to prevent autoimmunity in mice. J. Exp. Med., 208, 395-407 (2011)[PubMed]
- Ley, R. E., Backhed, F., Turnbaugh, P. et al.: Obesity alters gut microbial ecology. Proc. Natl. Acad. Sci. USA, 102, 11070-11075 (2005)[PubMed]
著者プロフィール
略歴:2011年 京都大学大学院医学研究科 修了,同年より理化学研究所免疫・アレルギー科学総合研究センター 基礎科学特別研究員.
研究テーマ:腸管における免疫グロブリンAによる腸内細菌の制御の機構.
Sidonia Fagarasan
理化学研究所免疫・アレルギー科学総合研究センター チームリーダー.
研究室URL:http://web.rcai.riken.jp/mucosal/
© 2012 河本新平・Sidonia Fagarasan Licensed under CC 表示 2.1 日本