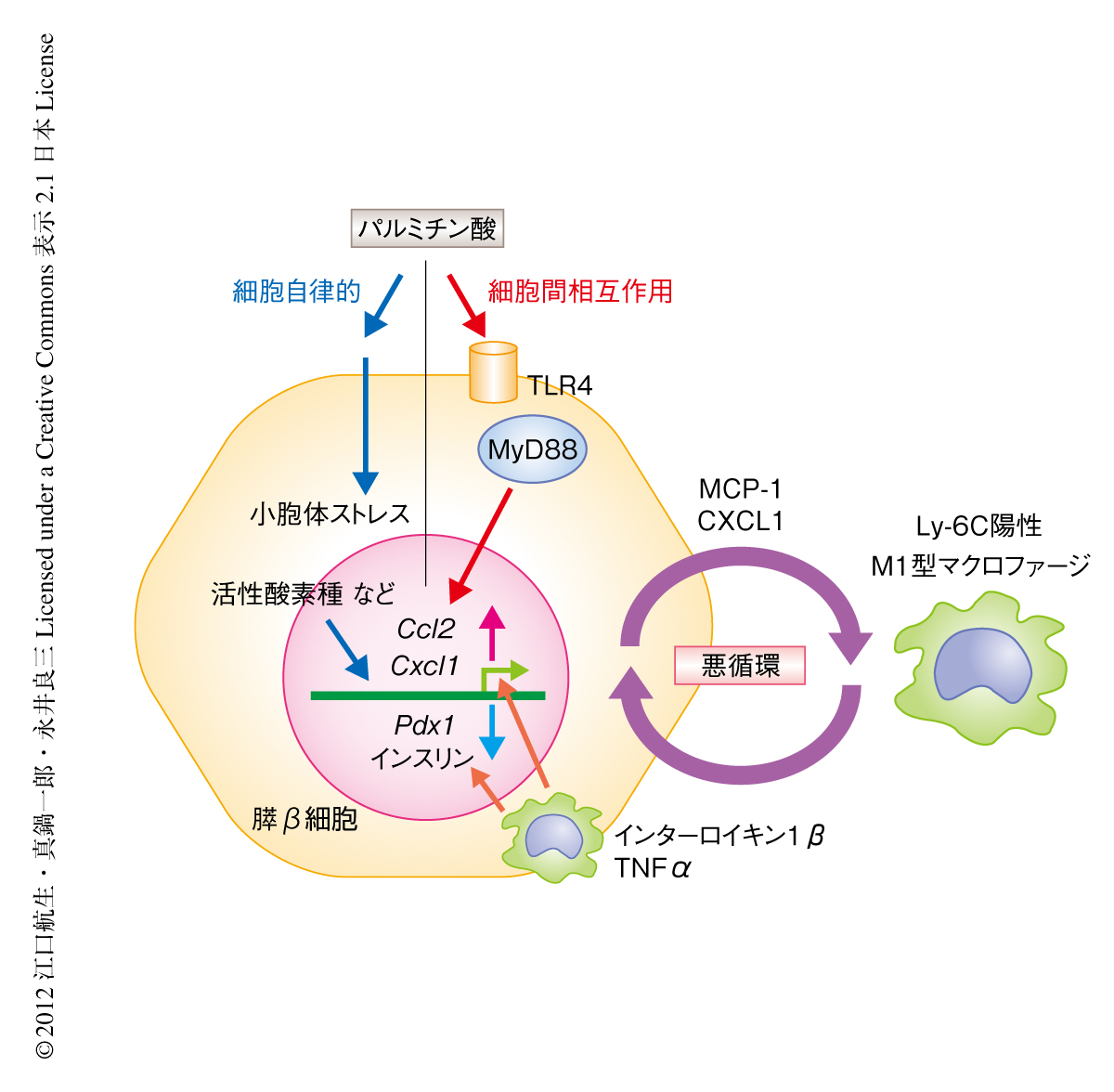
2型糖尿病での膵β細胞の機能障害において炎症性マクロファージの浸潤が重要な役割をはたす
江口航生・真鍋一郎・永井良三
(東京大学大学院医学系研究科 循環器内科学)
email:江口航生
DOI: 10.7875/first.author.2012.051
Saturated fatty acid and TLR signaling link β cell dysfunction and islet inflammation.
Kosei Eguchi, Ichiro Manabe, Yumiko Oishi-Tanaka, Mitsuru Ohsugi, Nozomu Kono, Fusa Ogata, Nobuhiro Yagi, Umeharu Ohto, Masao Kimoto, Kensuke Miyake, Kazuyuki Tobe, Hiroyuki Arai, Takashi Kadowaki, Ryozo Nagai
Cell Metabolism, 15, 518-533 (2012)
2型糖尿病の病態は末梢臓器におけるインスリン抵抗性と膵β細胞からのインスリンの分泌不全により特徴づけられる.インスリン抵抗性については近年の研究により慢性炎症のはたす役割がますます明らかになっている一方,膵β細胞の機能障害において炎症のはたす役割はいまだ明らかになっていない.パルミチン酸はウェスタンダイエットに多く含まれ,膵β細胞に直接に細胞障害を惹起することが以前より知られている飽和脂肪酸である.筆者らは,このパルミチン酸をマウス個体に投与するモデルを確立した.このモデルを用いることにより,パルミチン酸は膵β細胞に存在するToll様受容体TLR4を介してケモカインを分泌させ,CD11b陽性Ly-6C陽性のM1型炎症性マクロファージを膵島に呼び寄せることにより膵島に炎症を惹起させていることが示された.そして,この膵島の炎症は膵β細胞の機能障害を起こすと同時に,ケモカインの発現の増幅を起こす悪循環を生じていることが明らかになった.実際に,2型糖尿病モデルマウスの膵島でもM1型マクロファージが集積し,インターロイキン1βやTNFαなどの炎症性サイトカインの発現が上昇していた.以上のいずれのモデルマウスでもM1型マクロファージの集積を抑えることにより膵β細胞の機能に回復が認められ,膵島の炎症を標的とした薬物が新たな治療戦略となる可能性が示唆された.
脂質摂取量の増加および身体活動量の低下にともない肥満と2型糖尿病が急速に増加しており,その分子機構の解明と新たな治療法の開発が世界的に大きな課題となっている.最近では,肥満に関連する疾患の発症機構において炎症のはたす役割がますます明らかになっている.肥満者や2型糖尿病患者では血中の炎症性サイトカインのレベルが上昇しており,これら炎症性サイトカインがインスリンシグナルを阻害することが知られている.一方,膵β細胞の機能障害においては,最近になり,インターロイキン1受容体のアンタゴニストが2型糖尿病患者の血糖のレベルと膵β細胞の機能を回復するとの報告や1),2型糖尿病患者の膵島にマクロファージが集積しているとの観察報告があるが2),2型糖尿病において膵島に炎症があるならどのような分子機構で惹起されているのか,膵β細胞の機能障害へ直接の寄与の有無など,今後の解明が必要とされている.
さて,肥満において2型糖尿病を惹起する因子は多様であると考えられるが,そのひとつに遊離脂肪酸があげられる.肥満では血中の遊離脂肪酸のレベルが上昇しており,飽和脂肪酸の多い食事と血中の飽和脂肪酸の濃度の上昇は2型糖尿病の新規発症の独立した危険因子である.また,パルミチン酸などの飽和脂肪酸が培養膵β細胞に細胞障害性を示すことから,“脂肪毒性”が膵β細胞の機能障害に寄与することが提唱されている.しかし,長鎖飽和脂肪酸は常温では固体であることなどから,個体における膵β細胞へのはたらきは不明のままである.
この研究では,2型糖尿病での膵β細胞の機能障害における膵島の炎症の存在とそのはたす役割を明らかにし,また,膵島に炎症が惹起される分子機構についてパルミチン酸投与モデルにおける膵島での自然免疫シグナルに着目して検討を行った.さらに,その結果を2型糖尿病モデルマウスであるdb/dbマウスおよびKK-Ayマウスにおいて検証した.
パルミチン酸が培養細胞において膵β細胞の機能障害を生じることについては以前より複数の報告があるが3),パルミチン酸は常温で固体であることから個体における作用についてはいまだ不明のままである.そこで,マウスに静脈からパルミチン酸エチルを持続的に投与することにより血中の遊離パルミチン酸のみを選択的に増加させる方法を確立した.この手法を用いると,パルミチン酸の持続投与は14時間以内にインスリン遺伝子および糖尿病に関与する転写因子をコードするPdx1遺伝子の発現を低下させるとともに,膵島のグルコース反応性インスリン分泌を阻害した.つまり,パルミチン酸はマウス個体において膵β細胞の急速な機能障害をひき起こすことが明らかになった.
パルミチン酸はマクロファージのもつToll様受容体(Toll-like receptor:TLR)であるTLR4を活性化することが報告されており4),また,膵β細胞にはTLR4の発現することが報告されている5).これより,パルミチン酸によるマウス個体における膵β細胞の機能障害においてTLR4シグナルの関与する可能性を検討することにした.TLR4またはToll様受容体のアダプタータンパク質であるMyd88のノックアウトマウスに静脈からのパルミチン酸の持続的な投与を行った結果,これらのノックアウトマウスではパルミチン酸による膵β細胞の機能障害が有意に抑制されており,パルミチン酸による膵β細胞の機能障害はTLR4-MyD88シグナルを介していることを同定した.一方,MIN6培養β細胞におけるパルミチン酸による膵β細胞の機能障害においては,TLR4あるいはMyd88のsiRNAによるノックダウンによって変化は認められなかった.以上より,マウス個体では培養細胞で同定されたシグナル機構のほか,膵β細胞において急速な機能障害をひき起こすまったく新しい機序の重要であることが示唆された.
以上のin vitroおよびin vivoにおける結果から,in vivoにおいては膵β細胞とほかの細胞との細胞間相互作用を介した膵β細胞の機能障害の機構のある可能性を検討した.膵臓をインスリンおよびCD11bの蛍光抗体により染色し共焦点顕微鏡による観察を行ったところ,膵島には定常状態において多数のCD11b陽性細胞の存在することが明らかになった.さらにくわしく検討するため,単離した膵島に存在する免疫細胞をフローサイトメトリーにより解析した.その結果,膵島には定常状態においてCD11b陽性Ly-6C陰性細胞が存在し,パルミチン酸の持続投与はこの常在の細胞とは異なるCD11b陽性Ly-6C陽性細胞を特異的に動員することが明らかになった.これらの細胞をセルソーターで回収し形態および遺伝子発現を解析したところ,CD11b陽性Ly-6C陽性細胞はインターロイキン1βとTNFα(tumor necrosis factorα,腫瘍壊死因子α)を発現するM1型炎症性マクロファージであり,それに対して,CD11b陽性Ly-6C陰性を示す常在性のマクロファージはインターロイキン10を発現しCD206陽性およびCD301陽性であるM2型マクロファージの形質を示した6).すなわち,パルミチン酸の持続投与は膵島に存在するマクロファージのM1型マクロファージへの極性シフトを生じることが示された.
パルミチン酸はどのようにして膵島においてマクロファージの極性シフトを生じさせるのだろうか.単離した膵島におけるmRNA解析ではパルミチン酸の持続投与によりMCP-1をコードするCcl2遺伝子やCXCL1をコードするCxcl1遺伝子などケモカイン遺伝子の発現が誘導されており,Ccl2ノックアウトマウスではM1型マクロファージの集積が有意に抑制されていて,CCL2-CCR2シグナルを含むケモカインシグナルの活性化がM1型マクロファージを膵島に呼び寄せていると同定した.
さらにTLR4ノックアウトマウスおよびMyd88ノックアウトマウスにおいて同様の解析を行ったところ膵島におけるケモカイン遺伝子の発現誘導は認められず,M1型マクロファージの集積は有意に抑制されていた.そこで,野生型マウスとTLR4ノックアウトマウスとを用いた骨髄移植実験を行った.その結果,骨髄に由来する細胞のTLR4はM1型マクロファージの集積には必要でなく,受容側の臓器のTLR4がM1型マクロファージの集積に必須であることが明らかになった.さらに,M1型マクロファージの集積は膵外分泌腺では認められず膵島に特異性のあったことから,膵島に特異的かつ膵島の主要な細胞種である膵β細胞に着目した.まず,MIN6培養β細胞においてパルミチン酸の持続投与はTLR4-MyD88シグナルに依存的にCcl2遺伝子およびCxcl1遺伝子の発現を誘導し,さらに,パルミチン酸を持続投与したマウスからセルソーターを用いて単離した膵β細胞でもCcl2遺伝子およびCxcl1遺伝子の発現が強く誘導されていた.以上より,膵β細胞はTLR4-MyD88シグナルを介してパルミチン酸に応答し,ケモカインを産生することにより膵島へM1型マクロファージを動員すると考えられた.
以上のマウス個体の解析結果をより具体的に理解するため,培養細胞の共培養系における評価を行うことにした.MIN6β細胞のみで培養,または,MIN6β細胞とRaw264マクロファージとを100対1の割合で共培養し,14時間のパルミチン酸の持続投与による刺激を行うと,MIN6β細胞のみの培養ではグルコース反応性インスリン分泌が増強されるのに対し共培養ではそれが抑制された.そこで,MIN6β細胞とRaw264マクロファージとをBoydenチェンバーを用いて共培養しそれぞれの細胞のmRNAを解析すると,互いの存在が,MIN6β細胞においてはケモカインをコードするCcl2遺伝子およびCxcl1遺伝子の発現を,Raw264マクロファージにおいては炎症性サイトカインであるインターロイキン1βおよびTNFαをそれぞれコードするIl1b遺伝子およびTnfa遺伝子の発現を,大きく増幅することが観察された.さらに,パルミチン酸により刺激したRaw264マクロファージの培養上清は,MIN6β細胞におけるパルミチン酸によるCcl2遺伝子やCxcl1遺伝子の発現誘導,および,インスリン遺伝子やPdx1遺伝子の発現抑制を増強すること,そして,これらはインターロイキン1βおよびTNFαの中和抗体により部分的に抑制されることが観察された.すなわち,膵β細胞からのケモカインによりいったん膵島へのM1型マクロファージの集積がはじまると,炎症性サイトカインを介した膵β細胞とマクロファージとの相互作用により炎症および膵β細胞の機能障害がさらに亢進する,という悪循環を形成することが明らかになった.
以上の結果から,パルミチン酸の持続投与による膵β細胞の機能障害におけるM1型マクロファージの役割を直接的に評価する必要があると考えた.クロドロネート内包リポソーム7) により膵島へのM1型マクロファージの集積を阻害すると,パルミチン酸による膵島におけるインターロイキン1βおよびTNFαの誘導はほぼ完全に抑えられ,また,膵β細胞の機能障害はほぼ完全に抑制されることがわかった.すなわち,in vivoにおける14時間のパルミチン酸の持続投与による急速な膵β細胞の機能障害においては,M1型マクロファージの集積と膵島の炎症が主要な役割を担うことが明らかになった.
ここまでに明らかにされたM1型マクロファージの集積による炎症プロセスが2型糖尿病の発症に寄与しているのかどうかを検討するため,糖尿病モデルマウスであるdb/dbマウスおよびKK-Ayマウスの膵島の解析を行った.その結果,いずれのモデルマウスの膵島においても炎症性メディエーターをコードするCcl2遺伝子,Il1b遺伝子,Tnfa遺伝子などの発現が上昇しており,M1型マクロファージの集積も認めた.db/dbマウスおよびKK-Ayマウスにおいてクロドロネート内包リポソームによりM1型マクロファージを除去したところ,膵島においてインスリン遺伝子およびPdx1遺伝子の発現が回復し,経口グルコース負荷試験により耐糖能の改善を認め,経静脈グルコース負荷試験における初期のインスリン分泌,および,単離した膵島におけるグルコース反応性インスリン分泌は改善した.すなわち,M1型マクロファージの集積と膵島の炎症による膵β細胞の機能障害の機構は,これら2型糖尿病モデルマウスにおいても重要な役割をはたすことが明らかになった.
この研究は,以前より知られているパルミチン酸による直接的な膵β細胞の機能障害にくわえ,膵β細胞がToll様受容体TLR4を介してパルミチン酸を感知しM1型マクロファージを動員することにより惹起される炎症のプロセスが膵β細胞の機能障害を生じるという,新しい機序を明らかにした(図1).さらに,M1型マクロファージを中心とした炎症のプロセスが糖尿病モデルマウスであるdb/dbマウスおよびKK-Ayマウスでも重要であったことから,2型糖尿病における膵β細胞の機能障害に炎症の機序が広く寄与していることが示唆された.肥満においては,脂肪組織や肝臓におけるインスリン抵抗性の惹起,さらには,動脈硬化の病態形成においても炎症が大きく寄与している.今回の結果は,肥満を背景とする病態に広く炎症が寄与していることを示すとともに,遊離脂肪酸が肥満を背景とする炎症の惹起に重要であることを示唆した.
略歴:2008年 東京大学大学院医学系研究科博士課程 修了,2010年より東京大学大学院医学系研究科 特任助教(現 助教).
研究テーマ:心血管疾患および代謝性疾患における脂肪毒性と炎症の役割.非免疫細胞におけるToll様受容体の活性化機構と役割.
関心事:ヒトの摂食行動がいかにして心血管疾患や代謝性疾患につながるのか.
真鍋 一郎(Ichiro Manabe)
東京大学大学院医学系研究科 講師.
永井 良三(Ryozo Nagai)
自治医科大学 学長.
© 2012 江口航生・真鍋一郎・永井良三 Licensed under CC 表示 2.1 日本
(東京大学大学院医学系研究科 循環器内科学)
email:江口航生
DOI: 10.7875/first.author.2012.051
Saturated fatty acid and TLR signaling link β cell dysfunction and islet inflammation.
Kosei Eguchi, Ichiro Manabe, Yumiko Oishi-Tanaka, Mitsuru Ohsugi, Nozomu Kono, Fusa Ogata, Nobuhiro Yagi, Umeharu Ohto, Masao Kimoto, Kensuke Miyake, Kazuyuki Tobe, Hiroyuki Arai, Takashi Kadowaki, Ryozo Nagai
Cell Metabolism, 15, 518-533 (2012)
この論文に出現する遺伝子・タンパク質のUniprot ID
TLR, インスリン, Toll様受容体TLR4(Q9QUK6), ケモカイン, CD11b(P05555), Ly-6C, インターロイキン1β(P10749), TNFα(P06804), 炎症性サイトカイン, インターロイキン1受容体のアンタゴニスト(P18510), Pdx1(P52946), TLR4(Q9QUK6), Myd88(P22366), Toll様受容体, Toll-like receptor, MyD88(P22366), tumor necrosis factorα(P06804), 腫瘍壊死因子α(P06804), インターロイキン10(P18893), CD206(Q61830), CD301(P49300), MCP-1(P10148), Ccl2(P10148), CXCL1(P12850), Cxcl1(P12850), CCL2(P10148), CCR2(P51683), Il1b(P10749), Tnfa(P06804)
要 約
2型糖尿病の病態は末梢臓器におけるインスリン抵抗性と膵β細胞からのインスリンの分泌不全により特徴づけられる.インスリン抵抗性については近年の研究により慢性炎症のはたす役割がますます明らかになっている一方,膵β細胞の機能障害において炎症のはたす役割はいまだ明らかになっていない.パルミチン酸はウェスタンダイエットに多く含まれ,膵β細胞に直接に細胞障害を惹起することが以前より知られている飽和脂肪酸である.筆者らは,このパルミチン酸をマウス個体に投与するモデルを確立した.このモデルを用いることにより,パルミチン酸は膵β細胞に存在するToll様受容体TLR4を介してケモカインを分泌させ,CD11b陽性Ly-6C陽性のM1型炎症性マクロファージを膵島に呼び寄せることにより膵島に炎症を惹起させていることが示された.そして,この膵島の炎症は膵β細胞の機能障害を起こすと同時に,ケモカインの発現の増幅を起こす悪循環を生じていることが明らかになった.実際に,2型糖尿病モデルマウスの膵島でもM1型マクロファージが集積し,インターロイキン1βやTNFαなどの炎症性サイトカインの発現が上昇していた.以上のいずれのモデルマウスでもM1型マクロファージの集積を抑えることにより膵β細胞の機能に回復が認められ,膵島の炎症を標的とした薬物が新たな治療戦略となる可能性が示唆された.
はじめに
脂質摂取量の増加および身体活動量の低下にともない肥満と2型糖尿病が急速に増加しており,その分子機構の解明と新たな治療法の開発が世界的に大きな課題となっている.最近では,肥満に関連する疾患の発症機構において炎症のはたす役割がますます明らかになっている.肥満者や2型糖尿病患者では血中の炎症性サイトカインのレベルが上昇しており,これら炎症性サイトカインがインスリンシグナルを阻害することが知られている.一方,膵β細胞の機能障害においては,最近になり,インターロイキン1受容体のアンタゴニストが2型糖尿病患者の血糖のレベルと膵β細胞の機能を回復するとの報告や1),2型糖尿病患者の膵島にマクロファージが集積しているとの観察報告があるが2),2型糖尿病において膵島に炎症があるならどのような分子機構で惹起されているのか,膵β細胞の機能障害へ直接の寄与の有無など,今後の解明が必要とされている.
さて,肥満において2型糖尿病を惹起する因子は多様であると考えられるが,そのひとつに遊離脂肪酸があげられる.肥満では血中の遊離脂肪酸のレベルが上昇しており,飽和脂肪酸の多い食事と血中の飽和脂肪酸の濃度の上昇は2型糖尿病の新規発症の独立した危険因子である.また,パルミチン酸などの飽和脂肪酸が培養膵β細胞に細胞障害性を示すことから,“脂肪毒性”が膵β細胞の機能障害に寄与することが提唱されている.しかし,長鎖飽和脂肪酸は常温では固体であることなどから,個体における膵β細胞へのはたらきは不明のままである.
この研究では,2型糖尿病での膵β細胞の機能障害における膵島の炎症の存在とそのはたす役割を明らかにし,また,膵島に炎症が惹起される分子機構についてパルミチン酸投与モデルにおける膵島での自然免疫シグナルに着目して検討を行った.さらに,その結果を2型糖尿病モデルマウスであるdb/dbマウスおよびKK-Ayマウスにおいて検証した.
1.パルミチン酸はマウス個体において膵β細胞の機能障害を生じる
パルミチン酸が培養細胞において膵β細胞の機能障害を生じることについては以前より複数の報告があるが3),パルミチン酸は常温で固体であることから個体における作用についてはいまだ不明のままである.そこで,マウスに静脈からパルミチン酸エチルを持続的に投与することにより血中の遊離パルミチン酸のみを選択的に増加させる方法を確立した.この手法を用いると,パルミチン酸の持続投与は14時間以内にインスリン遺伝子および糖尿病に関与する転写因子をコードするPdx1遺伝子の発現を低下させるとともに,膵島のグルコース反応性インスリン分泌を阻害した.つまり,パルミチン酸はマウス個体において膵β細胞の急速な機能障害をひき起こすことが明らかになった.
2.パルミチン酸によるマウス個体における膵β細胞の急速な機能障害はTLR4-Myd88シグナルを介している
パルミチン酸はマクロファージのもつToll様受容体(Toll-like receptor:TLR)であるTLR4を活性化することが報告されており4),また,膵β細胞にはTLR4の発現することが報告されている5).これより,パルミチン酸によるマウス個体における膵β細胞の機能障害においてTLR4シグナルの関与する可能性を検討することにした.TLR4またはToll様受容体のアダプタータンパク質であるMyd88のノックアウトマウスに静脈からのパルミチン酸の持続的な投与を行った結果,これらのノックアウトマウスではパルミチン酸による膵β細胞の機能障害が有意に抑制されており,パルミチン酸による膵β細胞の機能障害はTLR4-MyD88シグナルを介していることを同定した.一方,MIN6培養β細胞におけるパルミチン酸による膵β細胞の機能障害においては,TLR4あるいはMyd88のsiRNAによるノックダウンによって変化は認められなかった.以上より,マウス個体では培養細胞で同定されたシグナル機構のほか,膵β細胞において急速な機能障害をひき起こすまったく新しい機序の重要であることが示唆された.
3.パルミチン酸は炎症性マクロファージを膵島に呼び寄せる
以上のin vitroおよびin vivoにおける結果から,in vivoにおいては膵β細胞とほかの細胞との細胞間相互作用を介した膵β細胞の機能障害の機構のある可能性を検討した.膵臓をインスリンおよびCD11bの蛍光抗体により染色し共焦点顕微鏡による観察を行ったところ,膵島には定常状態において多数のCD11b陽性細胞の存在することが明らかになった.さらにくわしく検討するため,単離した膵島に存在する免疫細胞をフローサイトメトリーにより解析した.その結果,膵島には定常状態においてCD11b陽性Ly-6C陰性細胞が存在し,パルミチン酸の持続投与はこの常在の細胞とは異なるCD11b陽性Ly-6C陽性細胞を特異的に動員することが明らかになった.これらの細胞をセルソーターで回収し形態および遺伝子発現を解析したところ,CD11b陽性Ly-6C陽性細胞はインターロイキン1βとTNFα(tumor necrosis factorα,腫瘍壊死因子α)を発現するM1型炎症性マクロファージであり,それに対して,CD11b陽性Ly-6C陰性を示す常在性のマクロファージはインターロイキン10を発現しCD206陽性およびCD301陽性であるM2型マクロファージの形質を示した6).すなわち,パルミチン酸の持続投与は膵島に存在するマクロファージのM1型マクロファージへの極性シフトを生じることが示された.
4.膵β細胞においてM1型マクロファージの集積にはTLR4-Myd88シグナルが必須である
パルミチン酸はどのようにして膵島においてマクロファージの極性シフトを生じさせるのだろうか.単離した膵島におけるmRNA解析ではパルミチン酸の持続投与によりMCP-1をコードするCcl2遺伝子やCXCL1をコードするCxcl1遺伝子などケモカイン遺伝子の発現が誘導されており,Ccl2ノックアウトマウスではM1型マクロファージの集積が有意に抑制されていて,CCL2-CCR2シグナルを含むケモカインシグナルの活性化がM1型マクロファージを膵島に呼び寄せていると同定した.
さらにTLR4ノックアウトマウスおよびMyd88ノックアウトマウスにおいて同様の解析を行ったところ膵島におけるケモカイン遺伝子の発現誘導は認められず,M1型マクロファージの集積は有意に抑制されていた.そこで,野生型マウスとTLR4ノックアウトマウスとを用いた骨髄移植実験を行った.その結果,骨髄に由来する細胞のTLR4はM1型マクロファージの集積には必要でなく,受容側の臓器のTLR4がM1型マクロファージの集積に必須であることが明らかになった.さらに,M1型マクロファージの集積は膵外分泌腺では認められず膵島に特異性のあったことから,膵島に特異的かつ膵島の主要な細胞種である膵β細胞に着目した.まず,MIN6培養β細胞においてパルミチン酸の持続投与はTLR4-MyD88シグナルに依存的にCcl2遺伝子およびCxcl1遺伝子の発現を誘導し,さらに,パルミチン酸を持続投与したマウスからセルソーターを用いて単離した膵β細胞でもCcl2遺伝子およびCxcl1遺伝子の発現が強く誘導されていた.以上より,膵β細胞はTLR4-MyD88シグナルを介してパルミチン酸に応答し,ケモカインを産生することにより膵島へM1型マクロファージを動員すると考えられた.
5.パルミチン酸は膵β細胞とマクロファージとの相互作用を起こし炎症の増悪の悪循環を形成する
以上のマウス個体の解析結果をより具体的に理解するため,培養細胞の共培養系における評価を行うことにした.MIN6β細胞のみで培養,または,MIN6β細胞とRaw264マクロファージとを100対1の割合で共培養し,14時間のパルミチン酸の持続投与による刺激を行うと,MIN6β細胞のみの培養ではグルコース反応性インスリン分泌が増強されるのに対し共培養ではそれが抑制された.そこで,MIN6β細胞とRaw264マクロファージとをBoydenチェンバーを用いて共培養しそれぞれの細胞のmRNAを解析すると,互いの存在が,MIN6β細胞においてはケモカインをコードするCcl2遺伝子およびCxcl1遺伝子の発現を,Raw264マクロファージにおいては炎症性サイトカインであるインターロイキン1βおよびTNFαをそれぞれコードするIl1b遺伝子およびTnfa遺伝子の発現を,大きく増幅することが観察された.さらに,パルミチン酸により刺激したRaw264マクロファージの培養上清は,MIN6β細胞におけるパルミチン酸によるCcl2遺伝子やCxcl1遺伝子の発現誘導,および,インスリン遺伝子やPdx1遺伝子の発現抑制を増強すること,そして,これらはインターロイキン1βおよびTNFαの中和抗体により部分的に抑制されることが観察された.すなわち,膵β細胞からのケモカインによりいったん膵島へのM1型マクロファージの集積がはじまると,炎症性サイトカインを介した膵β細胞とマクロファージとの相互作用により炎症および膵β細胞の機能障害がさらに亢進する,という悪循環を形成することが明らかになった.
6.M1型マクロファージはパルミチン酸によるin vivoでの膵β細胞の機能障害に必須である
以上の結果から,パルミチン酸の持続投与による膵β細胞の機能障害におけるM1型マクロファージの役割を直接的に評価する必要があると考えた.クロドロネート内包リポソーム7) により膵島へのM1型マクロファージの集積を阻害すると,パルミチン酸による膵島におけるインターロイキン1βおよびTNFαの誘導はほぼ完全に抑えられ,また,膵β細胞の機能障害はほぼ完全に抑制されることがわかった.すなわち,in vivoにおける14時間のパルミチン酸の持続投与による急速な膵β細胞の機能障害においては,M1型マクロファージの集積と膵島の炎症が主要な役割を担うことが明らかになった.
7.炎症性マクロファージは糖尿病モデルマウスにおける膵β細胞の機能障害において重要な役割をはたす
ここまでに明らかにされたM1型マクロファージの集積による炎症プロセスが2型糖尿病の発症に寄与しているのかどうかを検討するため,糖尿病モデルマウスであるdb/dbマウスおよびKK-Ayマウスの膵島の解析を行った.その結果,いずれのモデルマウスの膵島においても炎症性メディエーターをコードするCcl2遺伝子,Il1b遺伝子,Tnfa遺伝子などの発現が上昇しており,M1型マクロファージの集積も認めた.db/dbマウスおよびKK-Ayマウスにおいてクロドロネート内包リポソームによりM1型マクロファージを除去したところ,膵島においてインスリン遺伝子およびPdx1遺伝子の発現が回復し,経口グルコース負荷試験により耐糖能の改善を認め,経静脈グルコース負荷試験における初期のインスリン分泌,および,単離した膵島におけるグルコース反応性インスリン分泌は改善した.すなわち,M1型マクロファージの集積と膵島の炎症による膵β細胞の機能障害の機構は,これら2型糖尿病モデルマウスにおいても重要な役割をはたすことが明らかになった.
おわりに
この研究は,以前より知られているパルミチン酸による直接的な膵β細胞の機能障害にくわえ,膵β細胞がToll様受容体TLR4を介してパルミチン酸を感知しM1型マクロファージを動員することにより惹起される炎症のプロセスが膵β細胞の機能障害を生じるという,新しい機序を明らかにした(図1).さらに,M1型マクロファージを中心とした炎症のプロセスが糖尿病モデルマウスであるdb/dbマウスおよびKK-Ayマウスでも重要であったことから,2型糖尿病における膵β細胞の機能障害に炎症の機序が広く寄与していることが示唆された.肥満においては,脂肪組織や肝臓におけるインスリン抵抗性の惹起,さらには,動脈硬化の病態形成においても炎症が大きく寄与している.今回の結果は,肥満を背景とする病態に広く炎症が寄与していることを示すとともに,遊離脂肪酸が肥満を背景とする炎症の惹起に重要であることを示唆した.
文 献
- Larsen, C. M., Faulenbach, M., Vaag, A. et al.: Interleukin-1-receptor antagonist in type 2 diabetes mellitus. N. Engl. J. Med., 356, 1517-1526 (2007)[PubMed]
- Ehses, J.A., Perren, A., Eppler, E. et al.: Increased number of islet-associated macrophages in type 2 diabetes. Diabetes, 56, 2356-2370 (2007)[PubMed]
- Diakogiannaki, E., Welters, H. J. & Morgan, N. G.: Differential regulation of the endoplasmic reticulum stress response in pancreatic β-cells exposed to long-chain saturated and monounsaturated fatty acids. J. Endocrinol., 197, 553-563 (2008)[PubMed]
- Lee, J. Y., Sohn, K. H., Rhee, S. H. et al.: Saturated fatty acids, but not unsaturated fatty acids, induce the expression of cyclooxygenase-2 mediated through Toll-like receptor 4. J. Biol. Chem., 276, 16683-16689 (2001)[PubMed]
- Schulthess, F. T., Paroni, F., Sauter, N. S. et al.: CXCL10 impairs β cell function and viability in diabetes through TLR4 signaling. Cell Metab., 9, 125-139 (2009)[PubMed]
- Lawrence, T. & Natoli, G.: Transcriptional regulation of macrophage polarization: enabling diversity with identity. Nat. Rev. Immunol., 11, 750-761 (2011)[PubMed]
- Van Rooijen, N.: The liposome-mediated macrophage 'suicide' technique. J. Immunol. Methods, 124, 1-6 (1989)[PubMed]
著者プロフィール
略歴:2008年 東京大学大学院医学系研究科博士課程 修了,2010年より東京大学大学院医学系研究科 特任助教(現 助教).
研究テーマ:心血管疾患および代謝性疾患における脂肪毒性と炎症の役割.非免疫細胞におけるToll様受容体の活性化機構と役割.
関心事:ヒトの摂食行動がいかにして心血管疾患や代謝性疾患につながるのか.
真鍋 一郎(Ichiro Manabe)
東京大学大学院医学系研究科 講師.
永井 良三(Ryozo Nagai)
自治医科大学 学長.
© 2012 江口航生・真鍋一郎・永井良三 Licensed under CC 表示 2.1 日本