シナプスの機能を恒常的に制御する逆行性シグナル伝達はシナプス後細胞におけるTORシグナル伝達経路に依存する
鶴留 一也
(カナダMcGill大学Department of Physiology)
email:鶴留一也
DOI: 10.7875/first.author.2012.048
TOR is required for the retrograde regulation of synaptic homeostasis at the Drosophila neuromuscular junction.
Jay Penney, Kazuya Tsurudome, Edward H. Liao, Fatima Elazzouzi, Mark Livingstone, Miranda Gonzalez, Nahum Sonenberg, A. Pejmun Haghighi
Neuron, 74, 166-178 (2012)
ニューロンどうしのつながりを担うシナプスは,神経回路の発達の過程で形成と削減とがくり返されその機能に必要なものが生き残っていく.いったん安定したシナプスでは,そのシナプス伝達を確実なものとするために刺激に対する神経伝達物質の放出を補償する機構が必要となる.なんらかの原因によりシナプス伝達にかかわるタンパク質がうまく機能しなくなりシナプス伝達の効率が下がった場合でも,神経伝達物質の放出量を増加することにより恒常的にシナプス機能を維持する機構の存在が示されているが,その具体的な担い手はまだ明らかになっていない.この論文で,筆者らは,シナプス後細胞においてTORにより制御される翻訳機構が逆行性シナプス伝達の制御に必要であることを示した.TORは4E-BPあるいはS6Kを介する2つのシグナル伝達経路をつうじてキャップ結合タンパク質eIF4Eの活性を制御する.eIF4Eが活性化されるとmRNAの5’側非翻訳領域にあるキャップ構造とキャップ結合タンパク質複合体との相互作用が増加し,通常の状態では翻訳されにくい,込み入った構造をとる5’側非翻訳領域をもつmRNAの翻訳の促進されることが確認された.このTORシグナル伝達経路による翻訳の活性化を利用することにより,その標的となる逆行性シグナル伝達にかかわるタンパク質を同定できるものと期待される.
神経系の発達が最終段階をむかえると,確立された神経回路の機能を保つためニューロンどうしの接合部であるシナプスは安定な情報の伝達能力をもつことが望まれる.ニューロンが外部からうけた刺激に応じてその情報をほかのニューロンへと確実に伝えるためには,大きく分けて2つの方法が考えられる.ひとつは,シナプス後細胞において受容体のはたらきを増強し確実に情報を受け取れる体制を整えること,すなわち,シナプス後細胞における受容体の発現の上昇およびシナプスへの局在化の促進である.学習などにかかわるシナプス可塑性では,この方法によりシナプス機能の強化の行われていることが多い1).もうひとつは,シナプス後細胞でひき起こされる反応をモニターしシナプスに放出される神経伝達物質を刺激に応じた適切な量とすることで,たとえば,シナプス後細胞において受容体が機能不全におちいり神経伝達物質の放出に対し十分に反応できない場合,シナプス前細胞は神経伝達物質の放出量を増加することにより一定の刺激に対し相応の反応をシナプス後細胞にひき起こすことができる.この恒常的な神経伝達物質の放出量の制御は,シナプス後細胞からシナプス前細胞への逆行性シグナル伝達により行われているものと考えられている.シナプス後細胞において受容体は翻訳のレベルでその発現が局所的に促進されることが知られているが1,2),その一方で,その翻訳が逆行性シグナル伝達による神経伝達物質の放出量の制御に関係しているかどうかはこれまで不明であった.
ショウジョウバエ3令幼虫の筋接合部のシナプスでは,グルタミン酸受容体チャネルのサブユニットのひとつをコードするGluRIIA遺伝子についてその変異体が開発され,逆行性シナプス伝達における機能制御のモデルとして研究が行われている3).このGluRIIA変異体ではグルタミン酸受容体チャネルによる電流の透過量が野生型の約半分となっているため,刺激に対し野生型と同等の反応をひき起こすのに必要な神経伝達物質の放出量が約2倍になっている.筆者らは,このモデルシナプスを用い,翻訳が恒常的なシナプス機能の制御機構に対しどのように影響をあたえているかを調べた.
GluRIIA変異体において起こるシナプス機能の制御機構は翻訳によりどのような影響をうけるのだろうか? この点を明らかにするため,eIF2αとeIF4Eという2つの重要な翻訳開始因子4) について検討した.それぞれの翻訳開始因子の変異体のヘテロ接合体とGluRIIA変異体のホモ接合体との二重変異体を作製しその発現量をGluRIIA変異体において抑制したところ,eIF2α変異のヘテロ接合体では影響はなかったが,eIF4E変異のヘテロ接合体ではGluRIIA変異体におけるシナプス機能の制御機構が阻害されシナプス伝達物質の放出量が減少していた.このことは,eIF4Eを介する翻訳開始機構が逆行性シグナル伝達を介する恒常的なシナプス機能の制御機構において重要な役割を担っていることを意味した.
つぎに,eIF4Eを制御しているTOR(target of rapamycin)について検討した.TORはさまざまな生体情報をとりまとめタンパク質合成や代謝反応など多様なシグナル伝達をひき起こし5),シナプス可塑性などへの関与も報告されているが6),恒常的なシナプス機能の制御機構への関与については知られていない.TOR変異体のヘテロ接合体とGluRIIA変異体のホモ接合体との二重変異体を用いた実験の結果,TOR変異体のヘテロ接合体でもまた,eIF4E変異体のヘテロ接合体と同じく,GluRIIA変異体におけるシナプス機能の制御機構が阻害されることが示された.また,野生型GluRIIA遺伝子をもつショウジョウバエでは,TOR変異およびeIF2α変異はともにGluRIIA遺伝子の発現量を低下させグルタミン酸受容体の神経伝達物質に対する反応を減少させるが,eIF2α変異体ではシナプス機能の制御機構により神経伝達物質の放出量が増加するのに対し,TOR変異体ではシナプス機能の制御機構は阻害され通常よりも弱い反応を示すようになった.以上の結果から,恒常的なシナプス機能の制御機構にはTORにより制御されるeIF4Eを介した翻訳開始機構が重要な役割をはたしていることが明らかになった.
TORが恒常的なシナプス機能の制御機構に関与していることが明らかになったが,TORはシナプス前細胞とシナプス後細胞のどちらで機能しているのだろうか? TOR変異体とGluRIIA変異体との二重変異体において,シナプス前細胞のみあるいはシナプス後細胞のみでTORを過剰発現したところ,シナプス後細胞において過剰発現させたときのみシナプス機能の制御機構のはたらくことがわかった.さらに,GluRIIA変異体においてRNAi法によりシナプス前細胞あるいはシナプス後細胞のいずれかでTORをノックダウンしたところ,同様に,シナプス後細胞においてノックダウンしたときのみシナプス機能の制御機構が阻害される結果となった.これらより,恒常的なシナプス機能の制御機構にはシナプス後細胞においてTORの機能が必要であることが示された.
神経系の発達段階においてどのくらいの時間TORが機能することが必要なのだろうか? GluRIIA変異をもつショウジョウバエ幼虫にTORを抑制するラパマイシンをさまざまな時間あたえたところ,6時間では影響はみられなかったが,12時間をこえるとシナプス増強の抑制されることが観察された.これにより,適正なレベルでのシナプス機能の維持にはシナプス後細胞においてある程度の時間TORが持続的に機能することが必要であることがわかった.
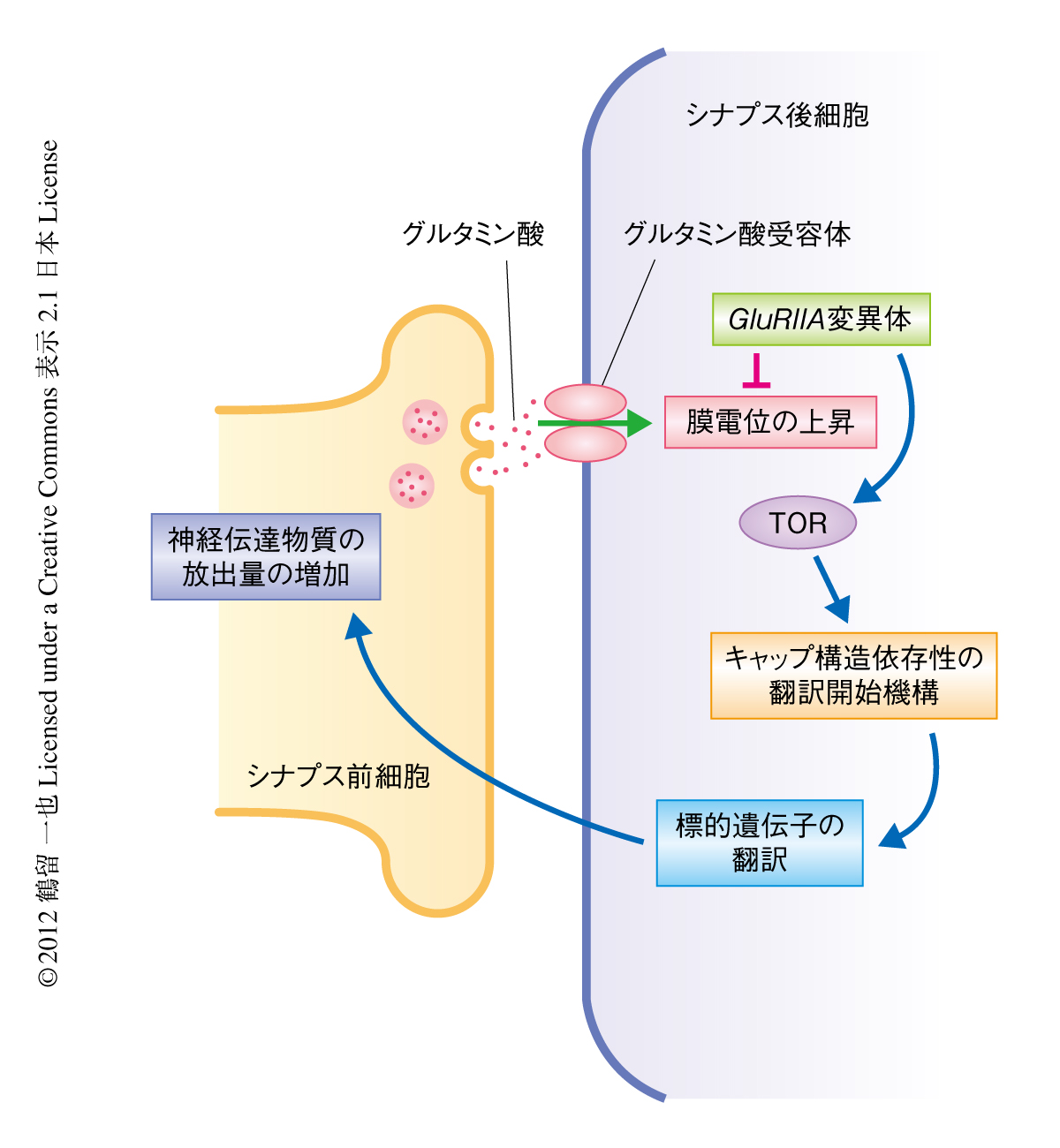
TORはさまざまな生体シグナルの処理にかかわっているが,キャップ構造依存性の翻訳開始機構の制御にも関与している7).具体的には,翻訳開始因子eIF4Eと結合してeIF4Eのキャップ結合タンパク質複合体への集合を抑制する4E-BPをリン酸化により抑制したり,S6Kをリン酸化することによりこれを活性化させ,さらに下流の翻訳開始因子eIF4Bをリン酸化して翻訳開始を促進したりする(図1).恒常的なシナプス機能の制御機構においてもこれらのシグナル伝達経路が使われているのかどうかを調べるため,GluRIIA変異体のシナプス後細胞において恒常的活性型4E-BPを過剰発現させたり,S6K変異体のヘテロ接合体とGluRIIA変異体との二重変異体を作製したりしたところ,どちらにおいても恒常的なシナプス機能の制御機構が阻害をうけていることが明らかになった.さらに,GluRIIA変異体ではリン酸化されて活性化したS6Kのタンパク質量が野生型に比べ増加していることがわかった.これらの結果より,4E-BPを経由するシグナル伝達経路とS6Kを経由するシグナル伝達経路というTORの2つのシグナル伝達経路を介した翻訳開始の制御が恒常的なシナプス機能の制御機構に不可欠であることが示された.
これまで,GluRIIA変異体における恒常的なシナプス機能の制御機構においてTORが重要であることが示されてきたが,TORはシナプス機能の制御機構を起こす逆行性シグナル伝達をひき起こすのに十分なのだろうか? TORを野生型ショウジョウバエのシナプス後細胞において過剰発現させたところ,神経伝達物質の放出量の過剰な増加がひき起こされた.この過剰な増加はeIF4E変異あるいはS6K変異をヘテロ接合として導入することにより抑制された.また,シナプス前膜において神経伝達物質の放出のための立体構造を構成するタンパク質Brp 8) の変異体をヘテロ接合として導入することによっても抑制することができたため,この神経伝達物質の過剰な放出は逆行性シグナル伝達によりひき起こされるシナプス前細胞におけるタンパク質の構成変化に依存することが示された.さらに,恒常的活性型S6Kをシナプス後細胞に過剰発現させた場合にもTORを過剰発現させたときと同様のシナプス機能の増強がみられた.これにより,TORの過剰な活性が翻訳開始機構を活性化し,逆行性シグナル伝達によりシナプス前細胞からの過剰な神経伝達物質の放出をひき起こすことが示された.
TORの過剰発現によりひき起こされた神経伝達物質の過剰な放出と,GluRIIA変異体で観察されるシナプス機能の増強は,同じシグナル伝達経路によるものなのだろうか? この疑問に答えるため,GluRIIA変異体のシナプス後細胞においてTORを過剰発現させた.その結果,TORの過剰発現はそれ以上の神経伝達物質の放出を増加することはなく,GluRIIA変異体で起こるシナプス機能の増強と同じレベルの増強が起こり,神経伝達物質の放出量は適正なレベルにとどまることが示された.これにより,GluRIIA変異体の恒常的なシナプス機能の制御機構と,TORの過剰発現により起こる神経伝達物質の放出量の増加は,同じ逆行性シグナル伝達経路によりひき起こされていることが確認された.
TORはキャップ結合タンパク質eIF4Eを介してキャップ構造依存性の翻訳開始機構を活性化し標的遺伝子の翻訳を促進するものと考えられるが,なぜ,標的遺伝子(この場合は,シナプス機能の制御機構にかかわる遺伝子)の翻訳が特異的に促進されるのだろうか? この疑問に対し,mRNAの5’側非翻訳領域の構造的な複雑さの違いが翻訳開始に影響をあたえているためではないかという仮説をたてた.mRNAの5’側非翻訳領域の安定度は,その2次構造の複雑さを反映するフォールディング自由エネルギーにより表される9).このフォールディング自由エネルギーを指標とし,安定な構造をもつmRNAからやや不安定な構造をもつ3種類のmRNAの5’側非翻訳領域についてその発現を調べたところ,フォールディング自由エネルギーが比較的小さく不安定な5’側非翻訳領域をもつmRNAは高い発現を示したのに対し,フォールディング自由エネルギーが大きく安定な5’側非翻訳領域をもつmRNAからの発現は非常に低かった.さらに,安定した構造をもつ5’側非翻訳領域とGFPをコードする領域とを組み合わせたmRNAを作製し,野生型およびTORを過剰発現させたショウジョウバエに導入してGFPの発現を調べたところ,TORの過剰発現体では野生型に比べGFPの発現が増加していることがわかった.つまり,フォールディング自由エネルギーの大きい安定な5’側非翻訳領域をもつmRNAは,TORが活性化し翻訳が活発化するまではあまり翻訳されず待機状態となっていることが示唆された.恒常的なシナプス機能の制御機構にかかわる逆行性シグナル伝達を担うタンパク質は,フォールディング自由エネルギーの比較的大きい安定な5’側非翻訳領域をもつmRNAから翻訳されると推測され,そのため,TORが活性化されたときに特異的に翻訳が促進されるものと考えられた.このことから,フォールディング自由エネルギーの大きさを目安としたスクリーニングにより,TORの標的となる逆行性シグナル伝達にかかわるタンパク質を同定できるものと期待される.
今回の研究では,恒常的なシナプス機能の制御機構にTORを中心とする翻訳開始機構が機能していることが明らかにされた(図2).これまで,シナプス前細胞における神経伝達物質の放出量の制御にかかわる機構について研究が進んでいたが8,10),シナプス後細胞におけるTORの役割が明らかにされたことで,シナプス前細胞とシナプス後細胞のそれぞれにおけるシグナル伝達の流れが大まかに示された.
TORはその機能の多様さからさまざまな疾患において関連タンパク質としてあげられている11).TORとそのシグナル伝達経路を構成するタンパク質に異常が起こった場合に起こりうる疾患には,おもなものとして結節性硬化症,パーキンソン病,アルツハイマー病,ハンチントン病などがあげられ,そのなかにはTORの異常な活性化によりニューロンの疲弊や細胞死をひき起こすものも含まれる.TORによるニューロンの過剰な発火は今回の研究により明らかにされたシグナル伝達経路によってもひき起こされるので,さらに詳細な検討を重ねることにより,いくつかの病態に結びつくような生理学的な知見が得られるのではないかと期待される.
今後の課題としては,まず,TORにより翻訳の促進をうける標的タンパク質の探索があげられる.シナプス前細胞へシグナルを伝達するタンパク質ではGbbなどが候補として研究されてきたが10),それ以外にもシナプス機能を特異的に制御する逆行性シグナル伝達タンパク質の存在も否定できない.どのような経路でシナプス前細胞へシグナルが伝達されているかを明らかにすることができれば,その経路を利用することで異常なシグナル伝達によるニューロンの過剰な活動を防ぐ薬剤の開発などにもつながると期待される.また,TORがどのようなシグナルをうけて活性化されるのかを調べることも恒常的なシナプス機能の制御機構の全体像を知るために重要なので,TORを中心としたシグナル伝達経路についてもさらに検討していきたい.
略歴:2006年 九州工業大学大学院生命体工学研究科博士課程 修了,同年 カナダMcGill大学 博士研究員を経て,2011年より同 リサーチアソシエイト.
研究テーマ:ショウジョウバエの筋接合部におけるシナプス伝達機能の制御機構.
抱負:日進月歩の進展があり変化の激しい分野だが,日々の研究を大切にして大きなテーマとして成就できるようがんばりたい.また,新しい技術の導入や新規のプロジェクトにも積極的に挑戦していきたい.
© 2012 鶴留 一也 Licensed under CC 表示 2.1 日本
(カナダMcGill大学Department of Physiology)
email:鶴留一也
DOI: 10.7875/first.author.2012.048
TOR is required for the retrograde regulation of synaptic homeostasis at the Drosophila neuromuscular junction.
Jay Penney, Kazuya Tsurudome, Edward H. Liao, Fatima Elazzouzi, Mark Livingstone, Miranda Gonzalez, Nahum Sonenberg, A. Pejmun Haghighi
Neuron, 74, 166-178 (2012)
要 約
ニューロンどうしのつながりを担うシナプスは,神経回路の発達の過程で形成と削減とがくり返されその機能に必要なものが生き残っていく.いったん安定したシナプスでは,そのシナプス伝達を確実なものとするために刺激に対する神経伝達物質の放出を補償する機構が必要となる.なんらかの原因によりシナプス伝達にかかわるタンパク質がうまく機能しなくなりシナプス伝達の効率が下がった場合でも,神経伝達物質の放出量を増加することにより恒常的にシナプス機能を維持する機構の存在が示されているが,その具体的な担い手はまだ明らかになっていない.この論文で,筆者らは,シナプス後細胞においてTORにより制御される翻訳機構が逆行性シナプス伝達の制御に必要であることを示した.TORは4E-BPあるいはS6Kを介する2つのシグナル伝達経路をつうじてキャップ結合タンパク質eIF4Eの活性を制御する.eIF4Eが活性化されるとmRNAの5’側非翻訳領域にあるキャップ構造とキャップ結合タンパク質複合体との相互作用が増加し,通常の状態では翻訳されにくい,込み入った構造をとる5’側非翻訳領域をもつmRNAの翻訳の促進されることが確認された.このTORシグナル伝達経路による翻訳の活性化を利用することにより,その標的となる逆行性シグナル伝達にかかわるタンパク質を同定できるものと期待される.
はじめに
神経系の発達が最終段階をむかえると,確立された神経回路の機能を保つためニューロンどうしの接合部であるシナプスは安定な情報の伝達能力をもつことが望まれる.ニューロンが外部からうけた刺激に応じてその情報をほかのニューロンへと確実に伝えるためには,大きく分けて2つの方法が考えられる.ひとつは,シナプス後細胞において受容体のはたらきを増強し確実に情報を受け取れる体制を整えること,すなわち,シナプス後細胞における受容体の発現の上昇およびシナプスへの局在化の促進である.学習などにかかわるシナプス可塑性では,この方法によりシナプス機能の強化の行われていることが多い1).もうひとつは,シナプス後細胞でひき起こされる反応をモニターしシナプスに放出される神経伝達物質を刺激に応じた適切な量とすることで,たとえば,シナプス後細胞において受容体が機能不全におちいり神経伝達物質の放出に対し十分に反応できない場合,シナプス前細胞は神経伝達物質の放出量を増加することにより一定の刺激に対し相応の反応をシナプス後細胞にひき起こすことができる.この恒常的な神経伝達物質の放出量の制御は,シナプス後細胞からシナプス前細胞への逆行性シグナル伝達により行われているものと考えられている.シナプス後細胞において受容体は翻訳のレベルでその発現が局所的に促進されることが知られているが1,2),その一方で,その翻訳が逆行性シグナル伝達による神経伝達物質の放出量の制御に関係しているかどうかはこれまで不明であった.
ショウジョウバエ3令幼虫の筋接合部のシナプスでは,グルタミン酸受容体チャネルのサブユニットのひとつをコードするGluRIIA遺伝子についてその変異体が開発され,逆行性シナプス伝達における機能制御のモデルとして研究が行われている3).このGluRIIA変異体ではグルタミン酸受容体チャネルによる電流の透過量が野生型の約半分となっているため,刺激に対し野生型と同等の反応をひき起こすのに必要な神経伝達物質の放出量が約2倍になっている.筆者らは,このモデルシナプスを用い,翻訳が恒常的なシナプス機能の制御機構に対しどのように影響をあたえているかを調べた.
1.恒常的なシナプス機能の制御機構への翻訳開始因子の関与
GluRIIA変異体において起こるシナプス機能の制御機構は翻訳によりどのような影響をうけるのだろうか? この点を明らかにするため,eIF2αとeIF4Eという2つの重要な翻訳開始因子4) について検討した.それぞれの翻訳開始因子の変異体のヘテロ接合体とGluRIIA変異体のホモ接合体との二重変異体を作製しその発現量をGluRIIA変異体において抑制したところ,eIF2α変異のヘテロ接合体では影響はなかったが,eIF4E変異のヘテロ接合体ではGluRIIA変異体におけるシナプス機能の制御機構が阻害されシナプス伝達物質の放出量が減少していた.このことは,eIF4Eを介する翻訳開始機構が逆行性シグナル伝達を介する恒常的なシナプス機能の制御機構において重要な役割を担っていることを意味した.
つぎに,eIF4Eを制御しているTOR(target of rapamycin)について検討した.TORはさまざまな生体情報をとりまとめタンパク質合成や代謝反応など多様なシグナル伝達をひき起こし5),シナプス可塑性などへの関与も報告されているが6),恒常的なシナプス機能の制御機構への関与については知られていない.TOR変異体のヘテロ接合体とGluRIIA変異体のホモ接合体との二重変異体を用いた実験の結果,TOR変異体のヘテロ接合体でもまた,eIF4E変異体のヘテロ接合体と同じく,GluRIIA変異体におけるシナプス機能の制御機構が阻害されることが示された.また,野生型GluRIIA遺伝子をもつショウジョウバエでは,TOR変異およびeIF2α変異はともにGluRIIA遺伝子の発現量を低下させグルタミン酸受容体の神経伝達物質に対する反応を減少させるが,eIF2α変異体ではシナプス機能の制御機構により神経伝達物質の放出量が増加するのに対し,TOR変異体ではシナプス機能の制御機構は阻害され通常よりも弱い反応を示すようになった.以上の結果から,恒常的なシナプス機能の制御機構にはTORにより制御されるeIF4Eを介した翻訳開始機構が重要な役割をはたしていることが明らかになった.
2.恒常的なシナプス機能の制御機構にはシナプス後細胞においてTORが関与する
TORが恒常的なシナプス機能の制御機構に関与していることが明らかになったが,TORはシナプス前細胞とシナプス後細胞のどちらで機能しているのだろうか? TOR変異体とGluRIIA変異体との二重変異体において,シナプス前細胞のみあるいはシナプス後細胞のみでTORを過剰発現したところ,シナプス後細胞において過剰発現させたときのみシナプス機能の制御機構のはたらくことがわかった.さらに,GluRIIA変異体においてRNAi法によりシナプス前細胞あるいはシナプス後細胞のいずれかでTORをノックダウンしたところ,同様に,シナプス後細胞においてノックダウンしたときのみシナプス機能の制御機構が阻害される結果となった.これらより,恒常的なシナプス機能の制御機構にはシナプス後細胞においてTORの機能が必要であることが示された.
神経系の発達段階においてどのくらいの時間TORが機能することが必要なのだろうか? GluRIIA変異をもつショウジョウバエ幼虫にTORを抑制するラパマイシンをさまざまな時間あたえたところ,6時間では影響はみられなかったが,12時間をこえるとシナプス増強の抑制されることが観察された.これにより,適正なレベルでのシナプス機能の維持にはシナプス後細胞においてある程度の時間TORが持続的に機能することが必要であることがわかった.
3.TORは4E-BPあるいはS6Kを経由する2つのシグナル伝達経路をつうじeIF4Eの活性を制御する
TORはさまざまな生体シグナルの処理にかかわっているが,キャップ構造依存性の翻訳開始機構の制御にも関与している7).具体的には,翻訳開始因子eIF4Eと結合してeIF4Eのキャップ結合タンパク質複合体への集合を抑制する4E-BPをリン酸化により抑制したり,S6Kをリン酸化することによりこれを活性化させ,さらに下流の翻訳開始因子eIF4Bをリン酸化して翻訳開始を促進したりする(図1).恒常的なシナプス機能の制御機構においてもこれらのシグナル伝達経路が使われているのかどうかを調べるため,GluRIIA変異体のシナプス後細胞において恒常的活性型4E-BPを過剰発現させたり,S6K変異体のヘテロ接合体とGluRIIA変異体との二重変異体を作製したりしたところ,どちらにおいても恒常的なシナプス機能の制御機構が阻害をうけていることが明らかになった.さらに,GluRIIA変異体ではリン酸化されて活性化したS6Kのタンパク質量が野生型に比べ増加していることがわかった.これらの結果より,4E-BPを経由するシグナル伝達経路とS6Kを経由するシグナル伝達経路というTORの2つのシグナル伝達経路を介した翻訳開始の制御が恒常的なシナプス機能の制御機構に不可欠であることが示された.
4.シナプス後細胞においてTORは神経伝達物質の放出を促進する逆行性シグナル伝達をひき起こす
これまで,GluRIIA変異体における恒常的なシナプス機能の制御機構においてTORが重要であることが示されてきたが,TORはシナプス機能の制御機構を起こす逆行性シグナル伝達をひき起こすのに十分なのだろうか? TORを野生型ショウジョウバエのシナプス後細胞において過剰発現させたところ,神経伝達物質の放出量の過剰な増加がひき起こされた.この過剰な増加はeIF4E変異あるいはS6K変異をヘテロ接合として導入することにより抑制された.また,シナプス前膜において神経伝達物質の放出のための立体構造を構成するタンパク質Brp 8) の変異体をヘテロ接合として導入することによっても抑制することができたため,この神経伝達物質の過剰な放出は逆行性シグナル伝達によりひき起こされるシナプス前細胞におけるタンパク質の構成変化に依存することが示された.さらに,恒常的活性型S6Kをシナプス後細胞に過剰発現させた場合にもTORを過剰発現させたときと同様のシナプス機能の増強がみられた.これにより,TORの過剰な活性が翻訳開始機構を活性化し,逆行性シグナル伝達によりシナプス前細胞からの過剰な神経伝達物質の放出をひき起こすことが示された.
TORの過剰発現によりひき起こされた神経伝達物質の過剰な放出と,GluRIIA変異体で観察されるシナプス機能の増強は,同じシグナル伝達経路によるものなのだろうか? この疑問に答えるため,GluRIIA変異体のシナプス後細胞においてTORを過剰発現させた.その結果,TORの過剰発現はそれ以上の神経伝達物質の放出を増加することはなく,GluRIIA変異体で起こるシナプス機能の増強と同じレベルの増強が起こり,神経伝達物質の放出量は適正なレベルにとどまることが示された.これにより,GluRIIA変異体の恒常的なシナプス機能の制御機構と,TORの過剰発現により起こる神経伝達物質の放出量の増加は,同じ逆行性シグナル伝達経路によりひき起こされていることが確認された.
5.複雑で安定な5’側非翻訳領域をもつmRNAの翻訳はTOR活性に依存して制御される
TORはキャップ結合タンパク質eIF4Eを介してキャップ構造依存性の翻訳開始機構を活性化し標的遺伝子の翻訳を促進するものと考えられるが,なぜ,標的遺伝子(この場合は,シナプス機能の制御機構にかかわる遺伝子)の翻訳が特異的に促進されるのだろうか? この疑問に対し,mRNAの5’側非翻訳領域の構造的な複雑さの違いが翻訳開始に影響をあたえているためではないかという仮説をたてた.mRNAの5’側非翻訳領域の安定度は,その2次構造の複雑さを反映するフォールディング自由エネルギーにより表される9).このフォールディング自由エネルギーを指標とし,安定な構造をもつmRNAからやや不安定な構造をもつ3種類のmRNAの5’側非翻訳領域についてその発現を調べたところ,フォールディング自由エネルギーが比較的小さく不安定な5’側非翻訳領域をもつmRNAは高い発現を示したのに対し,フォールディング自由エネルギーが大きく安定な5’側非翻訳領域をもつmRNAからの発現は非常に低かった.さらに,安定した構造をもつ5’側非翻訳領域とGFPをコードする領域とを組み合わせたmRNAを作製し,野生型およびTORを過剰発現させたショウジョウバエに導入してGFPの発現を調べたところ,TORの過剰発現体では野生型に比べGFPの発現が増加していることがわかった.つまり,フォールディング自由エネルギーの大きい安定な5’側非翻訳領域をもつmRNAは,TORが活性化し翻訳が活発化するまではあまり翻訳されず待機状態となっていることが示唆された.恒常的なシナプス機能の制御機構にかかわる逆行性シグナル伝達を担うタンパク質は,フォールディング自由エネルギーの比較的大きい安定な5’側非翻訳領域をもつmRNAから翻訳されると推測され,そのため,TORが活性化されたときに特異的に翻訳が促進されるものと考えられた.このことから,フォールディング自由エネルギーの大きさを目安としたスクリーニングにより,TORの標的となる逆行性シグナル伝達にかかわるタンパク質を同定できるものと期待される.
おわりに
今回の研究では,恒常的なシナプス機能の制御機構にTORを中心とする翻訳開始機構が機能していることが明らかにされた(図2).これまで,シナプス前細胞における神経伝達物質の放出量の制御にかかわる機構について研究が進んでいたが8,10),シナプス後細胞におけるTORの役割が明らかにされたことで,シナプス前細胞とシナプス後細胞のそれぞれにおけるシグナル伝達の流れが大まかに示された.
TORはその機能の多様さからさまざまな疾患において関連タンパク質としてあげられている11).TORとそのシグナル伝達経路を構成するタンパク質に異常が起こった場合に起こりうる疾患には,おもなものとして結節性硬化症,パーキンソン病,アルツハイマー病,ハンチントン病などがあげられ,そのなかにはTORの異常な活性化によりニューロンの疲弊や細胞死をひき起こすものも含まれる.TORによるニューロンの過剰な発火は今回の研究により明らかにされたシグナル伝達経路によってもひき起こされるので,さらに詳細な検討を重ねることにより,いくつかの病態に結びつくような生理学的な知見が得られるのではないかと期待される.
今後の課題としては,まず,TORにより翻訳の促進をうける標的タンパク質の探索があげられる.シナプス前細胞へシグナルを伝達するタンパク質ではGbbなどが候補として研究されてきたが10),それ以外にもシナプス機能を特異的に制御する逆行性シグナル伝達タンパク質の存在も否定できない.どのような経路でシナプス前細胞へシグナルが伝達されているかを明らかにすることができれば,その経路を利用することで異常なシグナル伝達によるニューロンの過剰な活動を防ぐ薬剤の開発などにもつながると期待される.また,TORがどのようなシグナルをうけて活性化されるのかを調べることも恒常的なシナプス機能の制御機構の全体像を知るために重要なので,TORを中心としたシグナル伝達経路についてもさらに検討していきたい.
文 献
- Costa-Mattioli, M., Sossin, W. S., Klann, E. et al.: Translational control of long-lasting synaptic plasticity and memory. Neuron, 61, 10-26 (2009)[PubMed]
- Sigrist, S. J., Thiel, P. R., Reiff, D. F. et al.: Postsynaptic translation affects the efficacy and morphology of neuromuscular junctions. Nature, 405, 1062-1065 (2000)[PubMed]
- Petersen, S. A., Fetter, R. D., Noordermeer, J. N. et al.: Genetic analysis of glutamate receptors in Drosophila reveals a retrograde signal regulating presynaptic transmitter release. Neuron, 19, 1237-1248 (1997)[PubMed]
- Sonenberg, N. & Hinnebusch, A. G.: Regulation of translation initiation in eukaryotes: mechanisms and biological targets. Cell, 136, 731-745 (2009)[PubMed]
- Laplante, M. & Sabatini, D. M.: mTOR signaling in growth control and disease. Cell, 149, 274-293 (2012)[PubMed]
- Hoeffer, C. A. & Klann, E.: mTOR signaling: at the crossroads of plasticity, memory and disease. Trends Neurosci., 33, 67-75 (2010)[PubMed]
- Ma, X. M. & Blenis. J.: Molecular mechanisms of mTOR-mediated translational control. Nat. Rev. Mol. Cell Biol., 10, 307-318 (2009)[PubMed]
- Tsurudome, K., Tsang, K., Liao, E. H. et al.: The Drosophila miR-310 cluster negatively regulates synaptic strength at neuromuscular junction. Neuron, 68, 879-893 (2010)[PubMed] [新着論文レビュー]
- Ringner, M. & Krogh, M.: Folding free energies of 5’-UTRs impact post-transcriptional regulation on a genomic scale in yeast. PLoS Comput. Biol., 1, e72 (2005)[PubMed]
- Ball, R. W., Warren-Paquin, M., Tsurudome, K. et al.: Retrograde BMP signaling controls synaptic growth at the NMJ by regulating trio expression in motor neurons. Neuron, 66, 536-549 (2010)[PubMed]
- Swiech, L., Perycz, M., Malik, A. et al.: Role of mTOR in physiology and pathology of the nervous system. Biochim. Biohys. Acta., 1784, 116-132 (2008)[PubMed]
著者プロフィール
略歴:2006年 九州工業大学大学院生命体工学研究科博士課程 修了,同年 カナダMcGill大学 博士研究員を経て,2011年より同 リサーチアソシエイト.
研究テーマ:ショウジョウバエの筋接合部におけるシナプス伝達機能の制御機構.
抱負:日進月歩の進展があり変化の激しい分野だが,日々の研究を大切にして大きなテーマとして成就できるようがんばりたい.また,新しい技術の導入や新規のプロジェクトにも積極的に挑戦していきたい.
© 2012 鶴留 一也 Licensed under CC 表示 2.1 日本