Dom34-Hbs1複合体は異常mRNAの3’末端で停滞したリボソームを解離しmRNA品質管理機構に普遍的な役割をはたす
稲田 利文
(東北大学大学院薬学研究科 遺伝子制御薬学分野)
email:稲田利文
DOI: 10.7875/first.author.2012.050
Dom34:Hbs1 plays a general role in quality-control systems by dissociation of a stalled ribosome at the 3’ end of aberrant mRNA.
Tatsuhisa Tsuboi, Kazushige Kuroha, Kazuhei Kudo, Shiho Makino, Eri Inoue, Isao Kashima, Toshifumi Inada
Molecular Cell, 46, 518-529 (2012)
近年のヒトゲノム研究により遺伝子疾患の原因となる変異が数多く同定されているが,ほとんどの遺伝病についてその治療法は確立されてない.遺伝病の原因となる変異遺伝子のmRNAは細胞のもつmRNA品質管理機構により迅速に分解されるため,変異をもつ異常タンパク質の発現は抑制されている.終止コドンをもたないノンストップmRNAは代表的な異常mRNAのひとつであり,ノンストップmRNA分解機構により迅速に分解される.この機構においては,ノンストップmRNAの3’末端に停滞したリボソームがmRNAから解離したのち,エキソソームにより3’末端から迅速に分解されるというモデルが提唱されている.このmRNAの3’末端で停滞したリボソームがmRNAから解離する反応はエキソソームによるノンストップmRNAの分解に必須であるが,その分子機構は長らく不明であった.筆者らは,リボソームがmRNAの3’末端で停滞したとき,翻訳終結因子eRF1-eRF3複合体と相同性をもつDom34-Hbs1複合体が翻訳伸長複合体のA部位に結合し,リボソームを解離させることを明らかにした.この研究により,細胞のもつ新たなmRNA品質管理機構のしくみが分子レベルで明らかになっただけでなく,遺伝病の原因ともなるさまざまな異常タンパク質の生合成を効率的に抑制する治療薬の開発にも貢献することが期待される.
異常mRNAは細胞のもつmRNA品質管理機構により認識され排除されることにより,遺伝子発現の正確性は保証されている.このmRNA品質管理機構については,1)本来の位置より上流に終止コドンをもつmRNAを分解するナンセンス変異依存性mRNA分解機構1)(nonsense-mediated mRNA decay:NMD),2)終止コドンをもたないノンストップmRNAを分解する機構2)(non-stop decay:NSD),3)翻訳伸長反応が途中で停止したmRNAを分解する機構3)(no-go decay:NGD),などが知られている.これらのmRNA品質管理機構においては異常な翻訳終結もしくは伸長阻害が引き金となり,異常mRNAが迅速に分解されることで異常タンパク質の発現が抑制されると考えられてきた.筆者らは,異常mRNAに由来するタンパク質の発現抑制機構について解析し,mRNAの分解促進にくわえ,翻訳の抑制と異常タンパク質の分解が異常タンパク質の発現抑制に重要であることを明らかにしてきた4-6).
ノンストップmRNAは正常な細胞においてもORFの途中へのポリA鎖の付加により産生され,mRNA全体の数%をしめている.また,正常なmRNAが3’末端からエキソソームにより分解される反応の中間体としてもノンストップmRNAは生じる.さらに,翻訳伸長が途中で停止したmRNAを分解するNGDにおいてmRNAの分子内切断により生じる5’側の分解中間体もノンストップmRNAである.このように,細胞にはさまざまなノンストップmRNAが存在しており,これらは3’末端から迅速に分解されることで異常なタンパク質の発現が抑制されている.しかしながら,これらのノンストップmRNAがエキソソームにより3’末端から分解されるためには,ノンストップmRNAの3’末端で停滞したリボソームがmRNAから解離することが必須である.この反応は終止コドンに依存しない翻訳終結反応であり,翻訳終結因子eRF1に依存しないペプチド鎖の解離およびリボソームの解離の反応機構は長らく不明であった.3’末端で停滞したリボソームはSki7により解離しノンストップmRNAはエキソソームにより3’末端から迅速に分解されるというモデルが提唱されているが,このモデルを支持する実験データは報告されておらず,3’末端で停滞したリボソームが解離される分子機構は未解明のままであった.
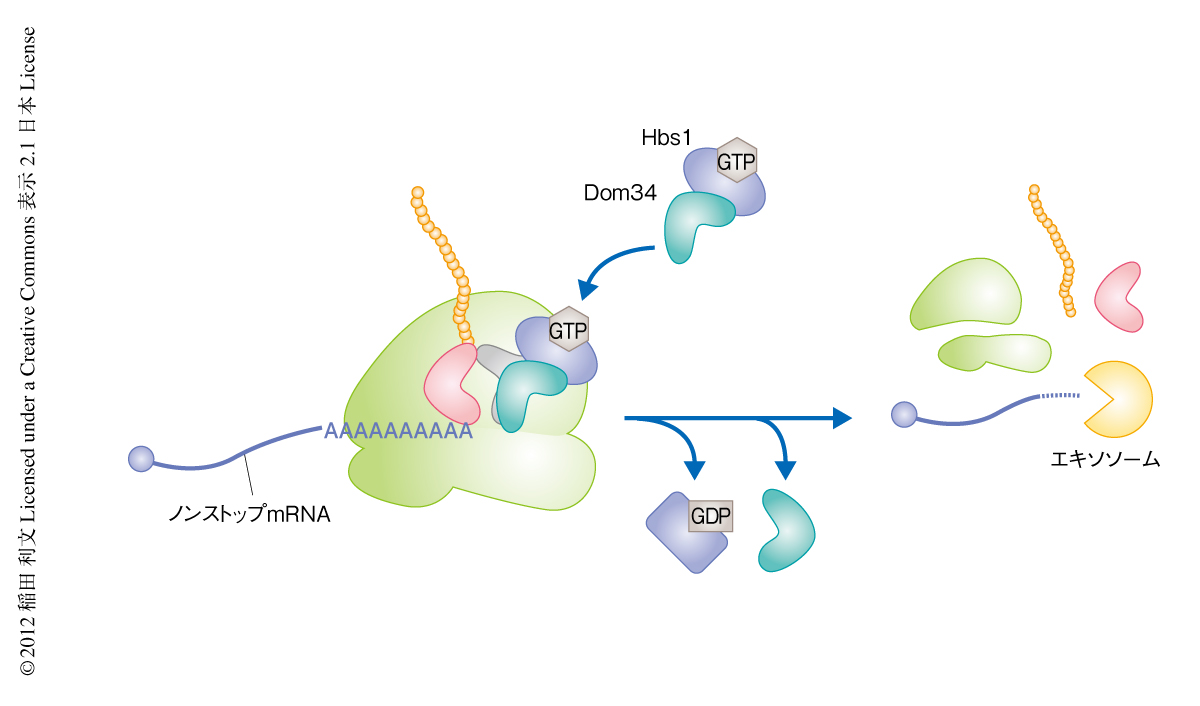
Dom34-Hbs1複合体は翻訳終結因子eRF1-eRF3複合体と相同性をもち,翻訳伸長複合体のA部位に結合しリボソームサブユニットの解離とリボソームからのペプチジルtRNAの解離をひき起こすことが生化学的な解析により示されていた7).しかしながら,生体におけるDom34-Hbs1複合体の機能は不明であった.そこで,ノンストップmRNAを分解するNSDにおけるDom34-Hbs1複合体の機能を解析するため,自己切断活性をもつハンマーヘッドリボザイムを用いて細胞内にノンストップmRNAを効率よく発現させる系を構築し,Dom34-Hbs1複合体がmRNAの3’末端で停滞したリボソームを解離させるのかどうか検討した.その結果,ノンストップmRNAに由来するタンパク質の生合成にはDom34-Hbs1複合体が必要であり8),Dom34-Hbs1複合体の存在しない細胞ではノンストップmRNAの3’末端で停滞したリボソームはペプチジルtRNAを含む状態で存在していることが明らかになった.この結果から,Dom34-Hbs1複合体は終止コドンに依存しない翻訳終結反応に必須であることがin vivoにおいてはじめて証明された(図1).同様の結果は,出芽酵母あるいはヒトの試験管内翻訳反応系を用いた生化学的な解析においても報告されている7,9).Dom34はtRNAときわめて類似した構造をもち8),GTP結合因子Hbs1との複合体として翻訳伸長複合体のA部位に結合し,終止コドンに依存することなくmRNAからリボソームを解離させることが明らかになった.
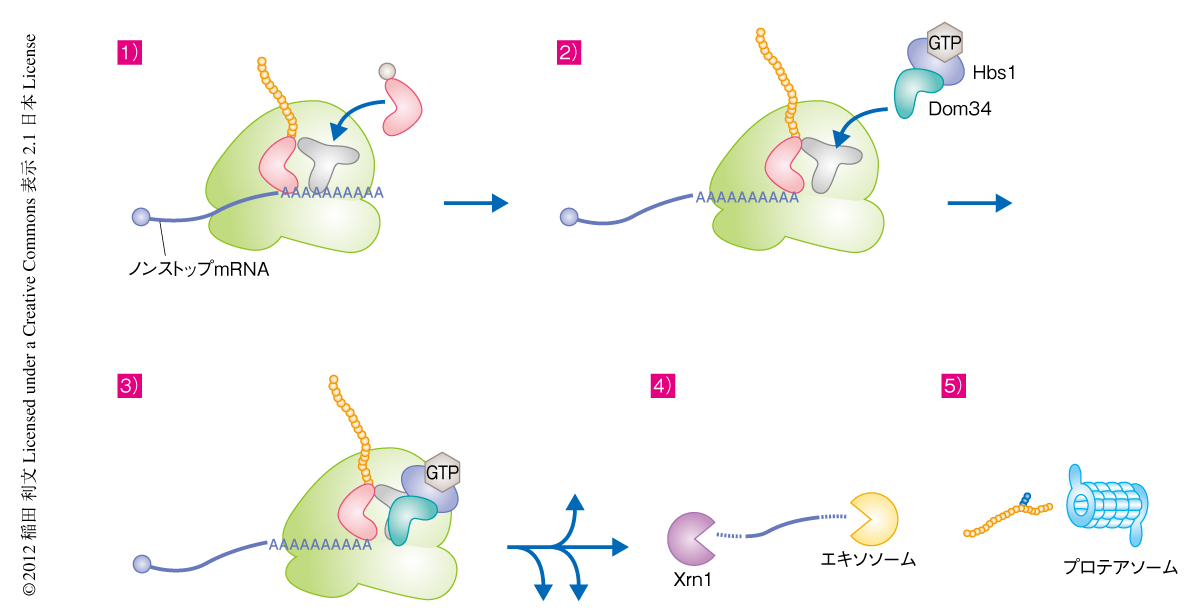
ノンストップmRNAの3’末端で停滞したリボソームがmRNAから解離する反応は,3’→5’方向のエキソヌクレアーゼ活性をもつエキソソーム複合体によるmRNAの分解に必須である.ノンストップmRNAの安定性をDom34-Hbs1複合体の存在しない細胞で測定したところ,Dom34-Hbs1複合体はノンストップmRNAの迅速な分解に必須であることが明らかになった.以前に筆者らは,ノンストップmRNAでは正常なmRNAでは翻訳されないポリA鎖が翻訳されて翻訳伸長が阻害されること,ノンストップmRNAに由来する異常タンパク質はプロテアソームにより迅速に分解されること,を報告した.そこで,今回のDom34-Hbs1複合体の機能解析の結果とあわせ,ノンストップmRNAを分解するNSDについて以下のような新規のモデルを提唱する(図2).1)ノンストップmRNAには終止コドンが存在しないため,正常なmRNAでは翻訳されないポリA鎖が翻訳されてポリリジンが生合成されることで,翻訳伸長反応が阻害される4-6).ポリリジンによる翻訳伸長反応の阻害の分子機構としては,リボソームトンネルと新生ポリペプチド鎖のもつポリリジンとの静電的な相互作用によりリボソームの活性あるいは構造が変化することによる可能性が考えられる.2)全体の数%ではノンストップmRNAの3’末端まで翻訳反応が起こり,その3’末端でリボソームが停止する.3)この翻訳伸長複合体のA部位にはコドンが存在しないため,翻訳終結因子eRF1やアミノアシルtRNAは結合できない.そのことから,このA部位にDom34-Hbs1複合体が結合しリボソームをノンストップmRNAから解離させる.4)ノンストップmRNAの3’末端は解放され,エキソソームがこれを3’末端から効率よく分解する.ノンストップmRNAのポリA鎖がリボソームにより翻訳されることでポリA結合タンパク質がポリA鎖から解離することにより,ノンストップmRNAはXrn1によっても5’末端からも効率よく分解される1).5)生合成された異常タンパク質はユビキチン化され,プロテアソームにより分解される5).
ノンストップmRNAを分解するNSDおいてだけでなく,翻訳伸長が途中で停止したmRNAを分解するNGDにおいても,翻訳伸長阻害に依存したmRNAの分子内切断により生じる2つの分解中間体のうち5’側の断片(5’側分解中間体)はノンストップmRNAである.NGDの5’側分解中間体におけるDom34-Hbs1複合体の機能を解析したところ,この5’側分解中間体の分解にもDom34-Hbs1複合体は必要であることがわかった.Dom34-Hbs1複合体は翻訳活性を失った異常リボソームRNAを迅速に分解する機構(nonfunctional rRNA decay:NRD)にも関与している.これらの結果から,Dom34-Hbs1複合体が“停滞したリボソーム”という共通した翻訳異常を認識し,NGD,NSD,NRDという3つのmRNA品質管理機構を作動させる普遍的な機能をもつことが明らかになった.
今回の研究により,ノンストップmRNAを分解するNSDと,翻訳伸長が途中で停止したmRNAを分解するNGDの分子機構の理解が大きく進んだ.しかしながら,ノンストップmRNAの3’末端で停滞したリボソームに結合している翻訳停止産物について,そのペプチド鎖解離反応を担うタンパク質は不明である.また,NGDを担うエンドヌクレアーゼの同定など解決すべき問題は山積している.現在,ノンストップmRNAに由来するタンパク質の分解機構について,国内外の多数の研究グループが精力的に解析を進めている.とくに,異常タンパク質の分解に関与するユビキチンリガーゼの特異性や,翻訳に共役したユビキチン化反応については,今後の数年で飛躍的に解明の進むものと予想される.さらに研究を進めることにより,種をこえて保存されたmRNA品質管理機構の全容を明らかにし,治療薬の開発につなげたい.
略歴:1992年 東京大学大学院理学系研究科博士課程 修了,同年 名古屋大学理学部 助手,1998年 米国California大学Berkeley校 研究員,2002年 名古屋大学理学部 助教授を経て,2010年より東北大学大学院薬学研究科 教授.
研究テーマ:遺伝子の発現制御をささえるmRNA品質管理機構の解明.すべてのmRNAは細胞のもつmRNA品質管理機構により正常な機能をもつことが保証されている.その解明は遺伝子発現の理解に不可欠であり,遺伝病治療薬の開発の基礎ともなるmRNA品質管理機構の解明を進めている.研究室見学大歓迎.
研究室URL:http://www.pharm.tohoku.ac.jp/~idenshi/idenshi-j.shtml
© 2012 稲田 利文 Licensed under CC 表示 2.1 日本
(東北大学大学院薬学研究科 遺伝子制御薬学分野)
email:稲田利文
DOI: 10.7875/first.author.2012.050
Dom34:Hbs1 plays a general role in quality-control systems by dissociation of a stalled ribosome at the 3’ end of aberrant mRNA.
Tatsuhisa Tsuboi, Kazushige Kuroha, Kazuhei Kudo, Shiho Makino, Eri Inoue, Isao Kashima, Toshifumi Inada
Molecular Cell, 46, 518-529 (2012)
要 約
近年のヒトゲノム研究により遺伝子疾患の原因となる変異が数多く同定されているが,ほとんどの遺伝病についてその治療法は確立されてない.遺伝病の原因となる変異遺伝子のmRNAは細胞のもつmRNA品質管理機構により迅速に分解されるため,変異をもつ異常タンパク質の発現は抑制されている.終止コドンをもたないノンストップmRNAは代表的な異常mRNAのひとつであり,ノンストップmRNA分解機構により迅速に分解される.この機構においては,ノンストップmRNAの3’末端に停滞したリボソームがmRNAから解離したのち,エキソソームにより3’末端から迅速に分解されるというモデルが提唱されている.このmRNAの3’末端で停滞したリボソームがmRNAから解離する反応はエキソソームによるノンストップmRNAの分解に必須であるが,その分子機構は長らく不明であった.筆者らは,リボソームがmRNAの3’末端で停滞したとき,翻訳終結因子eRF1-eRF3複合体と相同性をもつDom34-Hbs1複合体が翻訳伸長複合体のA部位に結合し,リボソームを解離させることを明らかにした.この研究により,細胞のもつ新たなmRNA品質管理機構のしくみが分子レベルで明らかになっただけでなく,遺伝病の原因ともなるさまざまな異常タンパク質の生合成を効率的に抑制する治療薬の開発にも貢献することが期待される.
はじめに
異常mRNAは細胞のもつmRNA品質管理機構により認識され排除されることにより,遺伝子発現の正確性は保証されている.このmRNA品質管理機構については,1)本来の位置より上流に終止コドンをもつmRNAを分解するナンセンス変異依存性mRNA分解機構1)(nonsense-mediated mRNA decay:NMD),2)終止コドンをもたないノンストップmRNAを分解する機構2)(non-stop decay:NSD),3)翻訳伸長反応が途中で停止したmRNAを分解する機構3)(no-go decay:NGD),などが知られている.これらのmRNA品質管理機構においては異常な翻訳終結もしくは伸長阻害が引き金となり,異常mRNAが迅速に分解されることで異常タンパク質の発現が抑制されると考えられてきた.筆者らは,異常mRNAに由来するタンパク質の発現抑制機構について解析し,mRNAの分解促進にくわえ,翻訳の抑制と異常タンパク質の分解が異常タンパク質の発現抑制に重要であることを明らかにしてきた4-6).
ノンストップmRNAは正常な細胞においてもORFの途中へのポリA鎖の付加により産生され,mRNA全体の数%をしめている.また,正常なmRNAが3’末端からエキソソームにより分解される反応の中間体としてもノンストップmRNAは生じる.さらに,翻訳伸長が途中で停止したmRNAを分解するNGDにおいてmRNAの分子内切断により生じる5’側の分解中間体もノンストップmRNAである.このように,細胞にはさまざまなノンストップmRNAが存在しており,これらは3’末端から迅速に分解されることで異常なタンパク質の発現が抑制されている.しかしながら,これらのノンストップmRNAがエキソソームにより3’末端から分解されるためには,ノンストップmRNAの3’末端で停滞したリボソームがmRNAから解離することが必須である.この反応は終止コドンに依存しない翻訳終結反応であり,翻訳終結因子eRF1に依存しないペプチド鎖の解離およびリボソームの解離の反応機構は長らく不明であった.3’末端で停滞したリボソームはSki7により解離しノンストップmRNAはエキソソームにより3’末端から迅速に分解されるというモデルが提唱されているが,このモデルを支持する実験データは報告されておらず,3’末端で停滞したリボソームが解離される分子機構は未解明のままであった.
1.Dom34-Hbs1複合体はmRNAの3’末端で停滞したリボソームを解離する
Dom34-Hbs1複合体は翻訳終結因子eRF1-eRF3複合体と相同性をもち,翻訳伸長複合体のA部位に結合しリボソームサブユニットの解離とリボソームからのペプチジルtRNAの解離をひき起こすことが生化学的な解析により示されていた7).しかしながら,生体におけるDom34-Hbs1複合体の機能は不明であった.そこで,ノンストップmRNAを分解するNSDにおけるDom34-Hbs1複合体の機能を解析するため,自己切断活性をもつハンマーヘッドリボザイムを用いて細胞内にノンストップmRNAを効率よく発現させる系を構築し,Dom34-Hbs1複合体がmRNAの3’末端で停滞したリボソームを解離させるのかどうか検討した.その結果,ノンストップmRNAに由来するタンパク質の生合成にはDom34-Hbs1複合体が必要であり8),Dom34-Hbs1複合体の存在しない細胞ではノンストップmRNAの3’末端で停滞したリボソームはペプチジルtRNAを含む状態で存在していることが明らかになった.この結果から,Dom34-Hbs1複合体は終止コドンに依存しない翻訳終結反応に必須であることがin vivoにおいてはじめて証明された(図1).同様の結果は,出芽酵母あるいはヒトの試験管内翻訳反応系を用いた生化学的な解析においても報告されている7,9).Dom34はtRNAときわめて類似した構造をもち8),GTP結合因子Hbs1との複合体として翻訳伸長複合体のA部位に結合し,終止コドンに依存することなくmRNAからリボソームを解離させることが明らかになった.
2.ノンストップmRNA分解機構の新たなモデル
ノンストップmRNAの3’末端で停滞したリボソームがmRNAから解離する反応は,3’→5’方向のエキソヌクレアーゼ活性をもつエキソソーム複合体によるmRNAの分解に必須である.ノンストップmRNAの安定性をDom34-Hbs1複合体の存在しない細胞で測定したところ,Dom34-Hbs1複合体はノンストップmRNAの迅速な分解に必須であることが明らかになった.以前に筆者らは,ノンストップmRNAでは正常なmRNAでは翻訳されないポリA鎖が翻訳されて翻訳伸長が阻害されること,ノンストップmRNAに由来する異常タンパク質はプロテアソームにより迅速に分解されること,を報告した.そこで,今回のDom34-Hbs1複合体の機能解析の結果とあわせ,ノンストップmRNAを分解するNSDについて以下のような新規のモデルを提唱する(図2).1)ノンストップmRNAには終止コドンが存在しないため,正常なmRNAでは翻訳されないポリA鎖が翻訳されてポリリジンが生合成されることで,翻訳伸長反応が阻害される4-6).ポリリジンによる翻訳伸長反応の阻害の分子機構としては,リボソームトンネルと新生ポリペプチド鎖のもつポリリジンとの静電的な相互作用によりリボソームの活性あるいは構造が変化することによる可能性が考えられる.2)全体の数%ではノンストップmRNAの3’末端まで翻訳反応が起こり,その3’末端でリボソームが停止する.3)この翻訳伸長複合体のA部位にはコドンが存在しないため,翻訳終結因子eRF1やアミノアシルtRNAは結合できない.そのことから,このA部位にDom34-Hbs1複合体が結合しリボソームをノンストップmRNAから解離させる.4)ノンストップmRNAの3’末端は解放され,エキソソームがこれを3’末端から効率よく分解する.ノンストップmRNAのポリA鎖がリボソームにより翻訳されることでポリA結合タンパク質がポリA鎖から解離することにより,ノンストップmRNAはXrn1によっても5’末端からも効率よく分解される1).5)生合成された異常タンパク質はユビキチン化され,プロテアソームにより分解される5).
3.mRNA品質管理機構におけるDom34-Hbs1複合体の普遍的な機能
ノンストップmRNAを分解するNSDおいてだけでなく,翻訳伸長が途中で停止したmRNAを分解するNGDにおいても,翻訳伸長阻害に依存したmRNAの分子内切断により生じる2つの分解中間体のうち5’側の断片(5’側分解中間体)はノンストップmRNAである.NGDの5’側分解中間体におけるDom34-Hbs1複合体の機能を解析したところ,この5’側分解中間体の分解にもDom34-Hbs1複合体は必要であることがわかった.Dom34-Hbs1複合体は翻訳活性を失った異常リボソームRNAを迅速に分解する機構(nonfunctional rRNA decay:NRD)にも関与している.これらの結果から,Dom34-Hbs1複合体が“停滞したリボソーム”という共通した翻訳異常を認識し,NGD,NSD,NRDという3つのmRNA品質管理機構を作動させる普遍的な機能をもつことが明らかになった.
おわりに
今回の研究により,ノンストップmRNAを分解するNSDと,翻訳伸長が途中で停止したmRNAを分解するNGDの分子機構の理解が大きく進んだ.しかしながら,ノンストップmRNAの3’末端で停滞したリボソームに結合している翻訳停止産物について,そのペプチド鎖解離反応を担うタンパク質は不明である.また,NGDを担うエンドヌクレアーゼの同定など解決すべき問題は山積している.現在,ノンストップmRNAに由来するタンパク質の分解機構について,国内外の多数の研究グループが精力的に解析を進めている.とくに,異常タンパク質の分解に関与するユビキチンリガーゼの特異性や,翻訳に共役したユビキチン化反応については,今後の数年で飛躍的に解明の進むものと予想される.さらに研究を進めることにより,種をこえて保存されたmRNA品質管理機構の全容を明らかにし,治療薬の開発につなげたい.
文 献
- Isken, O. & Maquat, L. E.: Quality control of eukaryotic mRNA: safeguarding cells from abnormal mRNA function. Genes Dev., 21, 1833-1856 (2007)[PubMed]
- van Hoof, A., Frischmeyer, P. A., Dietz, H. C. et al.: Exosome mediated recognition and degradation of mRNAs lacking a termination codon. Science, 295, 2262-2264 (2002)[PubMed]
- Doma, M. K. & Parker, R.: Endonucleolytic cleavage of eukaryotic mRNAs with stalls in translation elongation. Nature, 440, 561-564 (2006)[PubMed]
- Inada, T. & Aiba, H.: Translation of aberrant mRNAs lacking a termination codon or with a shortened 3'-UTR is repressed after initiation in yeast. EMBO J., 24, 1584-1595 (2005)[PubMed]
- Ito-Harashima, S., Kuroha, K., Tatematsu, T. et al.: Translation of the poly(A) tail plays crucial roles in nonstop mRNA surveillance via translation repression and protein destabilization by proteasome in yeast. Genes Dev., 21, 519-524 (2007)[PubMed]
- Dimitrova, L. N., Kuroha, K., Tatematsu, T. et al.: Nascent peptide-dependent translation arrest leads to Not4p-mediated protein degradation by the proteasome. J. Biol. Chem., 284, 10343-10352 (2009)[PubMed]
- Shoemaker C. J., Eyler, D. E., Green, R.: Dom34:Hbs1 promotes subunit dissociation and peptidyl-tRNA drop-off to initiate no-go decay. Science, 330, 369-372 (2010)[PubMed]
- Kobayashi, K., Kikuno, I., Kuroha, K. et al.: Structural basis for mRNA surveillance by archaeal Pelota and GTP-bound EF1α complex. Proc. Natl. Acad. Sci. USA, 107, 17575-17579 (2010)[PubMed]
- Pisareva, V. P., Shabkin, M. A., Hellen, C. U. et al.: Dissociation by Pelota, Hbs1 and ABCE1 of mammalian vacant 80S ribosomes and stalled elongation complexes. EMBO J., 30, 1804-1957 (2011)[PubMed]
著者プロフィール
略歴:1992年 東京大学大学院理学系研究科博士課程 修了,同年 名古屋大学理学部 助手,1998年 米国California大学Berkeley校 研究員,2002年 名古屋大学理学部 助教授を経て,2010年より東北大学大学院薬学研究科 教授.
研究テーマ:遺伝子の発現制御をささえるmRNA品質管理機構の解明.すべてのmRNAは細胞のもつmRNA品質管理機構により正常な機能をもつことが保証されている.その解明は遺伝子発現の理解に不可欠であり,遺伝病治療薬の開発の基礎ともなるmRNA品質管理機構の解明を進めている.研究室見学大歓迎.
研究室URL:http://www.pharm.tohoku.ac.jp/~idenshi/idenshi-j.shtml
© 2012 稲田 利文 Licensed under CC 表示 2.1 日本