線虫において増殖因子SVH-1はJNK型MAPキナーゼカスケードを介して軸索の再生を制御する
久本直毅・松本邦弘
(名古屋大学大学院理学研究科 生命理学専攻生体応答論講座)
email:久本直毅,松本邦弘
DOI: 10.7875/first.author.2012.043
The growth factor SVH-1 regulates axon regeneration in C. elegans via the JNK MAPK cascade.
Chun Li, Naoki Hisamoto, Paola Nix, Shuka Kanao, Tomoaki Mizuno, Michael Bastiani, Kunihiro Matsumoto
Nature Neuroscience, 15, 551-557 (2012)
ニューロンは軸索という長い突起をもっており,外傷などによりそれが切断された場合,その切断部分の先端から成長円錐を形成して伸長することにより機能的な軸索を再形成する.この再生の過程を軸索再生とよぶが,この過程がどのように制御されているかについては未解明の部分が多い.軸索再生の機構は種をこえて保存されており,モデル動物である線虫においても軸索再生の起こることが報告されている.最近,JNK型のMAPキナーゼカスケードが運動ニューロンの切断ののちの軸索再生を正に制御することが明らかになった.しかし,このカスケードがどのようなシグナルにより活性化されているのかはわかっていない.筆者らは,線虫の全遺伝子に対する網羅的なRNAiスクリーニングにより,軸索再生に関与する遺伝子として新たにsvh-1遺伝子とsvh-2遺伝子を同定した.svh-1遺伝子は新規の増殖因子を,svh-2遺伝子は増殖因子受容体型チロシンキナーゼをコードしていた.それぞれの遺伝子の欠失変異体を用いた解析から,SVH-1はSVH-2の上流かつ同一のカスケードにおいて機能しており,ともに軸索再生に重要であることが示された.SVH-1は頭部の感覚ニューロンであるADLニューロンにおいて特異的に発現し,そこから細胞の外に分泌されることにより機能した.一方,SVH-2は通常はニューロンにおいて発現していなかったが,軸索の切断をうけるとそのニューロンにおいて発現が誘導されることで軸索再生において機能していた.また,SVH-1からSVH-2へのシグナルを過剰に活性化させると軸索の再生能が顕著に亢進した.さらに,SVH-1からSVH-2へのシグナルがJNK型MAPキナーゼカスケードの上流において機能していることも明らかになった.以上の結果より,SVH-1からSVH-2へのシグナルは軸索の損傷に応じてJNK型MAPキナーゼカスケードを活性化し,軸索の再生を制御することが示唆された.
ニューロンにおける軸索の再生の研究は,事故や外科的な手術などにより切断をうけた神経を修復し機能的な状態まで回復させるために必要であり,社会的にも喫緊の課題である.哺乳動物のニューロンを用いた研究から,ニューロンの損傷ののち軸索を再生する能力は,ニューロン自体にもともと備わっている内在性の促進シグナルと,ニューロンの外部からの抑制シグナルにより制御されていることがわかっている1).内在性の促進シグナルとして,軸索の切断のときのCa2+の流入やcAMPの上昇,軸索から細胞体への逆行性輸送や微小管結合タンパク質GAP-43の発現誘導などが示唆されている.一方,外部からの抑制シグナルとしてNogo,MAG,OMgpなどが知られている2).しかし,軸索再生の制御に関する情報は断片的であり,中心的な役割を担うシグナルの実体および制御機構の大部分は未解明のままである.
軸索再生は哺乳動物だけではなく線虫Caenorhabditis elegansのような単純な生物でも起こることが示されている1).最近,線虫においてDLK-1,MKK-4,PMK-3からなるp38型MAPキナーゼカスケードが軸索再生に必須であることが報告された3,4).さらに,MLK-1,MEK-1,KGB-1から構成されるJNK型MAPKカスケードも,軸索の切断ののちの効率的な再生に必要であることが明らかになっている5).DLKやJNKはマウスの後根神経節の再生に必要であることから6,7),これらのタンパク質は線虫から哺乳動物まで種をこえて軸索再生を促進する役割をもつものと考えられる.しかし,線虫の軸索再生において,どのようなシグナルによりMAPキナーゼカスケードが活性化されるのかについては不明であった.そこで,筆者らは,遺伝学的な方法を用いたスクリーニングによりMAPキナーゼカスケードの上流で機能するタンパク質の探索を試みた.
筆者らは以前に,線虫のJNK型およびp38型のMAPキナーゼカスケードが,MAPキナーゼのホスファターゼであるVHP-1により負に制御されることを明らかにしていた8).vhp-1欠失変異体ではMAPキナーゼカスケードが過剰に活性化されるため幼虫致死の表現型を示す.事実,JNK型およびp38型のMAPキナーゼカスケードの構成タンパク質を欠損させるとvhp-1欠失変異体は正常に生育する.そこで,この性質を利用してJNK型およびp38型のMAPキナーゼカスケードにおいて機能する新たなタンパク質の同定を試みた.具体的には,線虫のRNAiライブラリーを用いたゲノムワイドな網羅的ノックダウンスクリーニングによりvhp-1変異体の致死性を抑圧する遺伝子を探索した.その結果,MLK-1,DLK-1をはじめとする既知のJNK型およびp38型のMAPキナーゼカスケードの構成タンパク質の遺伝子にくわえて10個の遺伝子が新たに同定され,それらをsvh-1からsvh-10と命名した(svh:suppressor of vhp-1).今回は,そのうちsvh-1遺伝子とsvh-2遺伝子について解析を行った.
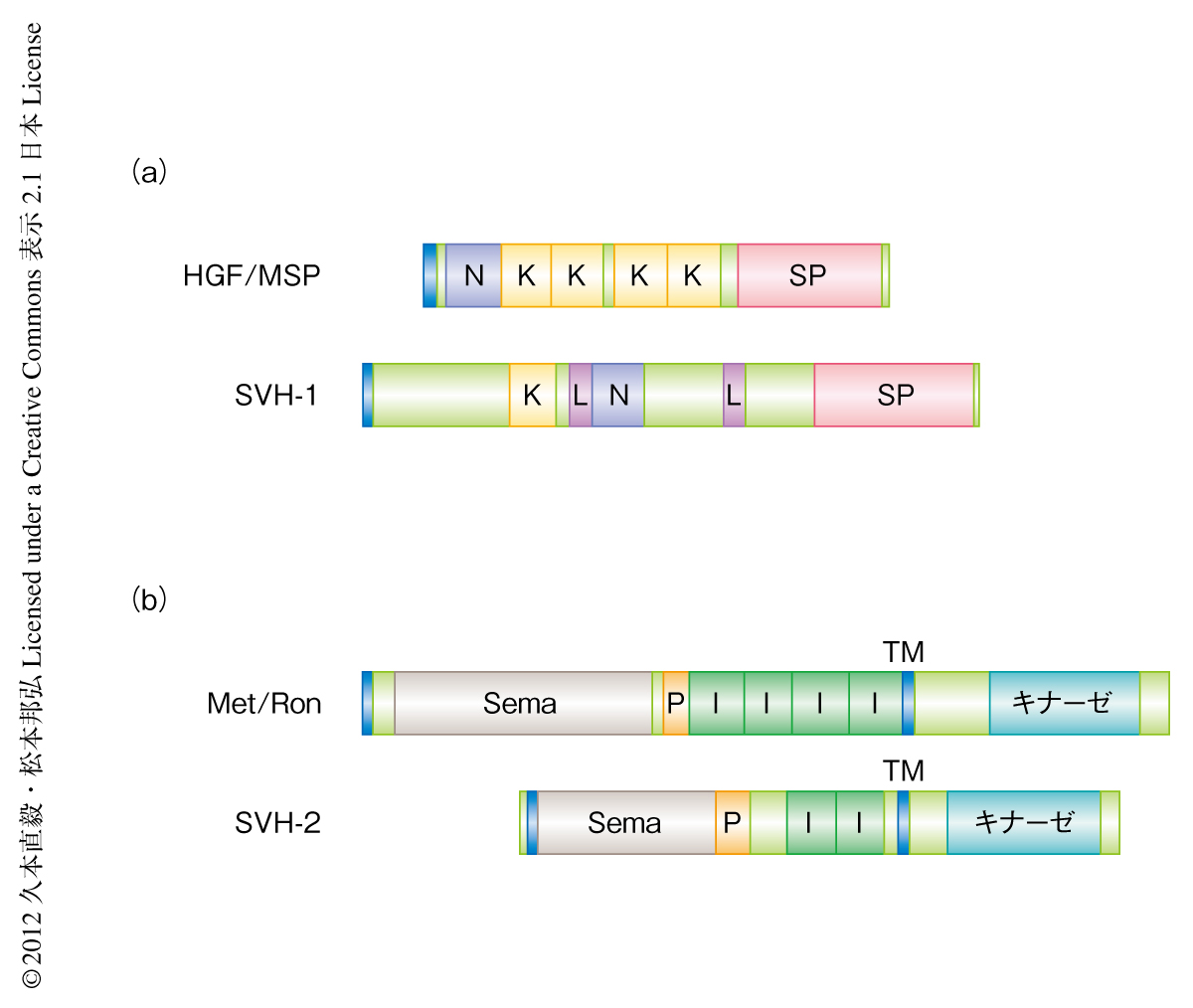
SVH-1はN末端にシグナルペプチドをもち,さらにKringleドメイン,Nドメイン,セリンプロテアーゼドメインなどをもつ新規の分泌タンパク質であった(図1a).これらのドメインは,ヒトのHGF(hepatocyte growth factor receptor,肝細胞増殖因子)やMSP(macrophage activating factor,マクロファージ活性化因子),プラスミノーゲンに存在することから,SVH-1はHGFおよびMSPを含むプラスミノーゲンスーパーファミリーに属するものと考えられた.一方,SVH-2はSemaドメイン,PSIドメイン,IPTドメイン,チロシンキナーゼドメインをもつ1回膜貫通受容体型チロシンキナーゼで(図1b),ヒトのHGF受容体であるc-MetやMSP受容体であるRonと高い相同性を示した.つぎに,SVH-1とSVH-2が軸索再生に関与するのかどうかを調べる目的で,svh-1遺伝子とsvh-2遺伝子の欠失変異体をそれぞれ作製し軸索再生に対する効果を調べた.なお,軸索の再生率はGFPで可視化したD型運動ニューロンの軸索をレーザーで切断することにより検討した.野生型の若い成虫の線虫では切断された軸索のうち約80%の軸索が再生した.一方,svh-1変異体およびsvh-2変異体ではどちらも軸索の再生率が約20%まで低下した.ちなみに,軸索を切断しない通常の状態ではsvh-1欠失変異およびsvh-2欠失変異は軸索の走行に影響しなかった.これらのことから,SVH-1とSVH-2はともに,発生の過程における軸索の走行には必要ないが,切断された軸索の再生に重要であることが示された.
SVH-1とSVH-2がどの細胞で機能しているのか調べる目的で,これらの遺伝子の発現パターンについて検討した.まず,svh-1遺伝子の発現パターンについて,svh-1遺伝子のプロモーターの下流に蛍光蛋白質Venusをコードする遺伝子を融合したコンストラクトを作製し解析を行った.その結果,ADLニューロンとよばれる頭部の感覚ニューロンにおいて特異的に発現がみられた.そこで,SVH-1はADLニューロンにおいて発現するだけで軸索再生の機能に十分なのかどうかを調べる目的で,svh-1遺伝子をADLニューロンにおいて特異的に発現するプロモーターにつないでsvh-1変異体に導入したところ,軸索再生の低下の表現型が回復した.さらに,野生型の線虫においてADLニューロンをレーザー照射により殺した場合,軸索の再生率はsvh-1変異体と同じレベルにまで低下した.これらのことから,SVH-1はADLニューロンにおいて発現することで軸索再生を制御することが明らかになった.同様に,svh-2遺伝子の発現パターンを調べたところ,筋肉や腸などでの発現はみられたが,D型運動ニューロンでは発現はみられなかった.しかし,軸索を切断されたD型運動ニューロンにおいてsvh-2遺伝子の発現が特異的に誘導されることが判明した.さらに,svh-2遺伝子をD型運動ニューロンにおいて特異的に発現するプロモーターにより発現させると,svh-2変異体の軸索再生の低下の表現型が回復した.したがって,SVH-2は切断されたD型運動ニューロンにおいて自律的に機能していた.以上の結果から,SVH-2は通常はD型運動ニューロンにおいて発現していないが,軸索を切断されると発現が誘導され,ADLニューロンから分泌されたSVH-1のシグナルを受け取り軸索再生を制御するものと考えられた.
SVH-1とSVH-2を過剰に活性化した場合の軸索再生への効果について検討した.野生型の線虫では軸索再生は約80%の割合で起こるが,そのうち,標的である背側にまで到達するものは約5%しかない.ところが,野生型の線虫においてSVH-1を多量に発現させると,再生した軸索の背側への到達率は40~60%まで促進された.このときの成長円錐のようすを観察したところ,野生型の線虫と比べ明らかに大きく活発であった.また,線虫の軸索の再生率は加齢とともに低下するが,SVH-1の多量の発現はその低下も抑えた.同様な表現型はSVH-2を多量に発現させたときにも観察された.さらに,svh-1欠失変異体においてSVH-2を多量に発現させると軸索再生が促進されるのに対し,svh-2欠失変異体においてSVH-1を多量に発現させても軸索再生は回復しなかった.この結果は,増殖因子であるSVH-1から受容体であるSVH-2へのシグナルという関係で軸索再生を制御していることを示していた.これらのことから,SVH-1からSVH-2へのシグナルの過剰な活性化は軸索の再生能を高め,加齢による軸索の再生率の低下を抑えることが明らかになった.
SVH-1とSVH-2は,MLK-1→MEK-1→KGB-1からなるJNK型MAPKカスケードと,DLK-1→1-MKK-4→PMK-3からなるp38型MAPKカスケードのどちらで機能しているのだろうか? この問題を生化学的な解析により検討した結果,SVH-2はMLK-1と直接に結合し,そのチロシン残基をリン酸化することを見い出した.一方,SVH-2とDLK-1とのあいだに生化学的な関連は見い出せなかった.さらに,svh-2欠失変異体においてKGB-1が顕著に活性の低下していることが明らかになった.以上の結果から,SVH-2はJNK型MAPKカスケードの上流において機能していると考えられた.
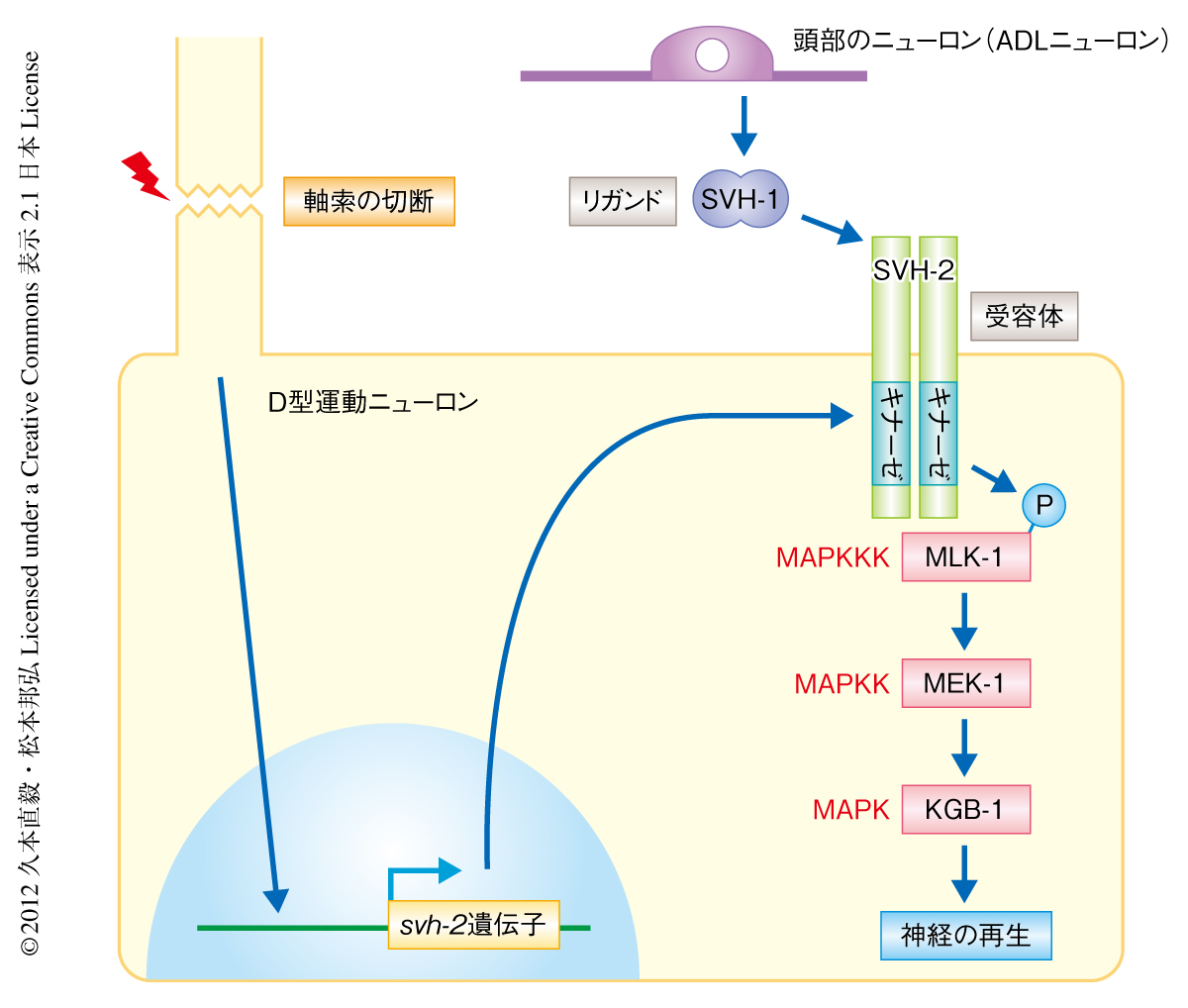
今回の研究から,増殖因子であるSVH-1と受容体であるSVH-2は線虫の軸索再生に必要なタンパク質であり,JNK型MAPKカスケードを介して軸索再生を制御していることが明らかになった.軸索を切断されたニューロンはsvh-2遺伝子の発現を誘導し,それによりつくられたSVH-2に対し頭部のニューロンより分泌されたSVH-1が結合することによりSVH-2が活性化する.活性化したSVH-2はMLK-1のリン酸化によりMLK-1→MEK-1→KGB-1からなるJNK型MAPKカスケードを活性化し軸索再生が起こると考えられた(図2).哺乳動物では軸索再生を外部から促進するタンパク質の候補として,発生の過程において軸索のガイダンスを外部から制御するタンパク質であるNGF(nerve growth factor,神経成長因子)やニューロトロフィン3,BDNF(brain-derived neurotrophic factor,脳由来神経栄養因子)などが検討されてきた1).しかし,これらの研究の多くは培養皿に分離されたニューロンへの投与というかたちで行われた実験によるものであり,これらの候補タンパク質が生体においてニューロンの切断ののちの軸索再生を制御しているのか,それとも,単にガイダンスタンパク質として作用しているだけなのかは定かでなかった.さらに,実験系,ニューロンの種類,研究者により異なる結果が報告されているため,ニューロンの切断ののちの軸索再生において,細胞外からの促進シグナルがin vivoにおいて本当に存在するのかどうかははっきりしていなかった.この研究は,軸索再生の誘導に細胞外のタンパク質が必要であることを明確に示し,その分子実体を明らかにしただけでなく,その下流のカスケードまで同定した点で軸索再生の研究における重要な知見のひとつになると思われる.
線虫のSVH-1はHGF,MSP,プラスミノーゲンに相同性をもち,SVH-2はMetおよびRonと相同性のあることから,哺乳動物においてもこれらと相同なタンパク質が軸索再生において重要な役割をはたしていることが推測される.現在のところ,哺乳動物においてSVH-1に相当するタンパク質がHGF,MSP,プラスミノーゲンのうちのどれなのか,あるいは,また別にあるのかについてははっきりしない.ただ興味深いことに,脊髄の損傷したマーモセットにHGFを投与すると損傷による運動障害からの回復が顕著に促進されるという報告のあることから9),HGFからMetへのシグナルそのもの,あるいは,それに類似したシグナルが霊長類を含む哺乳動物においても軸索再生を正に制御するシグナルとして機能する可能性が考えられる.今後,さらに研究を進めることにより,種をこえて保存された軸索再生の機構を明らかにできるのではないかと期待している.
略歴:名古屋大学大学院理学研究科 准教授.
研究テーマ:線虫をモデルとした神経疾患および再生.
松本 邦弘(Kunihiro Matsumoto)
名古屋大学大学院理学研究科 教授.
研究室URL:http://bunshi3.bio.nagoya-u.ac.jp/~bunshi6/matsumoto_new/index.html
© 2012 久本直毅・松本邦弘 Licensed under CC 表示 2.1 日本
(名古屋大学大学院理学研究科 生命理学専攻生体応答論講座)
email:久本直毅,松本邦弘
DOI: 10.7875/first.author.2012.043
The growth factor SVH-1 regulates axon regeneration in C. elegans via the JNK MAPK cascade.
Chun Li, Naoki Hisamoto, Paola Nix, Shuka Kanao, Tomoaki Mizuno, Michael Bastiani, Kunihiro Matsumoto
Nature Neuroscience, 15, 551-557 (2012)
要 約
ニューロンは軸索という長い突起をもっており,外傷などによりそれが切断された場合,その切断部分の先端から成長円錐を形成して伸長することにより機能的な軸索を再形成する.この再生の過程を軸索再生とよぶが,この過程がどのように制御されているかについては未解明の部分が多い.軸索再生の機構は種をこえて保存されており,モデル動物である線虫においても軸索再生の起こることが報告されている.最近,JNK型のMAPキナーゼカスケードが運動ニューロンの切断ののちの軸索再生を正に制御することが明らかになった.しかし,このカスケードがどのようなシグナルにより活性化されているのかはわかっていない.筆者らは,線虫の全遺伝子に対する網羅的なRNAiスクリーニングにより,軸索再生に関与する遺伝子として新たにsvh-1遺伝子とsvh-2遺伝子を同定した.svh-1遺伝子は新規の増殖因子を,svh-2遺伝子は増殖因子受容体型チロシンキナーゼをコードしていた.それぞれの遺伝子の欠失変異体を用いた解析から,SVH-1はSVH-2の上流かつ同一のカスケードにおいて機能しており,ともに軸索再生に重要であることが示された.SVH-1は頭部の感覚ニューロンであるADLニューロンにおいて特異的に発現し,そこから細胞の外に分泌されることにより機能した.一方,SVH-2は通常はニューロンにおいて発現していなかったが,軸索の切断をうけるとそのニューロンにおいて発現が誘導されることで軸索再生において機能していた.また,SVH-1からSVH-2へのシグナルを過剰に活性化させると軸索の再生能が顕著に亢進した.さらに,SVH-1からSVH-2へのシグナルがJNK型MAPキナーゼカスケードの上流において機能していることも明らかになった.以上の結果より,SVH-1からSVH-2へのシグナルは軸索の損傷に応じてJNK型MAPキナーゼカスケードを活性化し,軸索の再生を制御することが示唆された.
はじめに
ニューロンにおける軸索の再生の研究は,事故や外科的な手術などにより切断をうけた神経を修復し機能的な状態まで回復させるために必要であり,社会的にも喫緊の課題である.哺乳動物のニューロンを用いた研究から,ニューロンの損傷ののち軸索を再生する能力は,ニューロン自体にもともと備わっている内在性の促進シグナルと,ニューロンの外部からの抑制シグナルにより制御されていることがわかっている1).内在性の促進シグナルとして,軸索の切断のときのCa2+の流入やcAMPの上昇,軸索から細胞体への逆行性輸送や微小管結合タンパク質GAP-43の発現誘導などが示唆されている.一方,外部からの抑制シグナルとしてNogo,MAG,OMgpなどが知られている2).しかし,軸索再生の制御に関する情報は断片的であり,中心的な役割を担うシグナルの実体および制御機構の大部分は未解明のままである.
軸索再生は哺乳動物だけではなく線虫Caenorhabditis elegansのような単純な生物でも起こることが示されている1).最近,線虫においてDLK-1,MKK-4,PMK-3からなるp38型MAPキナーゼカスケードが軸索再生に必須であることが報告された3,4).さらに,MLK-1,MEK-1,KGB-1から構成されるJNK型MAPKカスケードも,軸索の切断ののちの効率的な再生に必要であることが明らかになっている5).DLKやJNKはマウスの後根神経節の再生に必要であることから6,7),これらのタンパク質は線虫から哺乳動物まで種をこえて軸索再生を促進する役割をもつものと考えられる.しかし,線虫の軸索再生において,どのようなシグナルによりMAPキナーゼカスケードが活性化されるのかについては不明であった.そこで,筆者らは,遺伝学的な方法を用いたスクリーニングによりMAPキナーゼカスケードの上流で機能するタンパク質の探索を試みた.
1.軸索再生を制御するタンパク質のスクリーニング
筆者らは以前に,線虫のJNK型およびp38型のMAPキナーゼカスケードが,MAPキナーゼのホスファターゼであるVHP-1により負に制御されることを明らかにしていた8).vhp-1欠失変異体ではMAPキナーゼカスケードが過剰に活性化されるため幼虫致死の表現型を示す.事実,JNK型およびp38型のMAPキナーゼカスケードの構成タンパク質を欠損させるとvhp-1欠失変異体は正常に生育する.そこで,この性質を利用してJNK型およびp38型のMAPキナーゼカスケードにおいて機能する新たなタンパク質の同定を試みた.具体的には,線虫のRNAiライブラリーを用いたゲノムワイドな網羅的ノックダウンスクリーニングによりvhp-1変異体の致死性を抑圧する遺伝子を探索した.その結果,MLK-1,DLK-1をはじめとする既知のJNK型およびp38型のMAPキナーゼカスケードの構成タンパク質の遺伝子にくわえて10個の遺伝子が新たに同定され,それらをsvh-1からsvh-10と命名した(svh:suppressor of vhp-1).今回は,そのうちsvh-1遺伝子とsvh-2遺伝子について解析を行った.
SVH-1はN末端にシグナルペプチドをもち,さらにKringleドメイン,Nドメイン,セリンプロテアーゼドメインなどをもつ新規の分泌タンパク質であった(図1a).これらのドメインは,ヒトのHGF(hepatocyte growth factor receptor,肝細胞増殖因子)やMSP(macrophage activating factor,マクロファージ活性化因子),プラスミノーゲンに存在することから,SVH-1はHGFおよびMSPを含むプラスミノーゲンスーパーファミリーに属するものと考えられた.一方,SVH-2はSemaドメイン,PSIドメイン,IPTドメイン,チロシンキナーゼドメインをもつ1回膜貫通受容体型チロシンキナーゼで(図1b),ヒトのHGF受容体であるc-MetやMSP受容体であるRonと高い相同性を示した.つぎに,SVH-1とSVH-2が軸索再生に関与するのかどうかを調べる目的で,svh-1遺伝子とsvh-2遺伝子の欠失変異体をそれぞれ作製し軸索再生に対する効果を調べた.なお,軸索の再生率はGFPで可視化したD型運動ニューロンの軸索をレーザーで切断することにより検討した.野生型の若い成虫の線虫では切断された軸索のうち約80%の軸索が再生した.一方,svh-1変異体およびsvh-2変異体ではどちらも軸索の再生率が約20%まで低下した.ちなみに,軸索を切断しない通常の状態ではsvh-1欠失変異およびsvh-2欠失変異は軸索の走行に影響しなかった.これらのことから,SVH-1とSVH-2はともに,発生の過程における軸索の走行には必要ないが,切断された軸索の再生に重要であることが示された.
2.svh-1遺伝子とsvh-2遺伝子の発現パターン
SVH-1とSVH-2がどの細胞で機能しているのか調べる目的で,これらの遺伝子の発現パターンについて検討した.まず,svh-1遺伝子の発現パターンについて,svh-1遺伝子のプロモーターの下流に蛍光蛋白質Venusをコードする遺伝子を融合したコンストラクトを作製し解析を行った.その結果,ADLニューロンとよばれる頭部の感覚ニューロンにおいて特異的に発現がみられた.そこで,SVH-1はADLニューロンにおいて発現するだけで軸索再生の機能に十分なのかどうかを調べる目的で,svh-1遺伝子をADLニューロンにおいて特異的に発現するプロモーターにつないでsvh-1変異体に導入したところ,軸索再生の低下の表現型が回復した.さらに,野生型の線虫においてADLニューロンをレーザー照射により殺した場合,軸索の再生率はsvh-1変異体と同じレベルにまで低下した.これらのことから,SVH-1はADLニューロンにおいて発現することで軸索再生を制御することが明らかになった.同様に,svh-2遺伝子の発現パターンを調べたところ,筋肉や腸などでの発現はみられたが,D型運動ニューロンでは発現はみられなかった.しかし,軸索を切断されたD型運動ニューロンにおいてsvh-2遺伝子の発現が特異的に誘導されることが判明した.さらに,svh-2遺伝子をD型運動ニューロンにおいて特異的に発現するプロモーターにより発現させると,svh-2変異体の軸索再生の低下の表現型が回復した.したがって,SVH-2は切断されたD型運動ニューロンにおいて自律的に機能していた.以上の結果から,SVH-2は通常はD型運動ニューロンにおいて発現していないが,軸索を切断されると発現が誘導され,ADLニューロンから分泌されたSVH-1のシグナルを受け取り軸索再生を制御するものと考えられた.
3.SVH-1からSVH-2へのシグナルの過剰な活性化は軸索再生を促進する
SVH-1とSVH-2を過剰に活性化した場合の軸索再生への効果について検討した.野生型の線虫では軸索再生は約80%の割合で起こるが,そのうち,標的である背側にまで到達するものは約5%しかない.ところが,野生型の線虫においてSVH-1を多量に発現させると,再生した軸索の背側への到達率は40~60%まで促進された.このときの成長円錐のようすを観察したところ,野生型の線虫と比べ明らかに大きく活発であった.また,線虫の軸索の再生率は加齢とともに低下するが,SVH-1の多量の発現はその低下も抑えた.同様な表現型はSVH-2を多量に発現させたときにも観察された.さらに,svh-1欠失変異体においてSVH-2を多量に発現させると軸索再生が促進されるのに対し,svh-2欠失変異体においてSVH-1を多量に発現させても軸索再生は回復しなかった.この結果は,増殖因子であるSVH-1から受容体であるSVH-2へのシグナルという関係で軸索再生を制御していることを示していた.これらのことから,SVH-1からSVH-2へのシグナルの過剰な活性化は軸索の再生能を高め,加齢による軸索の再生率の低下を抑えることが明らかになった.
4.SVH-2はJNK型MAPキナーゼカスケードの上流において機能する
SVH-1とSVH-2は,MLK-1→MEK-1→KGB-1からなるJNK型MAPKカスケードと,DLK-1→1-MKK-4→PMK-3からなるp38型MAPKカスケードのどちらで機能しているのだろうか? この問題を生化学的な解析により検討した結果,SVH-2はMLK-1と直接に結合し,そのチロシン残基をリン酸化することを見い出した.一方,SVH-2とDLK-1とのあいだに生化学的な関連は見い出せなかった.さらに,svh-2欠失変異体においてKGB-1が顕著に活性の低下していることが明らかになった.以上の結果から,SVH-2はJNK型MAPKカスケードの上流において機能していると考えられた.
おわりに
今回の研究から,増殖因子であるSVH-1と受容体であるSVH-2は線虫の軸索再生に必要なタンパク質であり,JNK型MAPKカスケードを介して軸索再生を制御していることが明らかになった.軸索を切断されたニューロンはsvh-2遺伝子の発現を誘導し,それによりつくられたSVH-2に対し頭部のニューロンより分泌されたSVH-1が結合することによりSVH-2が活性化する.活性化したSVH-2はMLK-1のリン酸化によりMLK-1→MEK-1→KGB-1からなるJNK型MAPKカスケードを活性化し軸索再生が起こると考えられた(図2).哺乳動物では軸索再生を外部から促進するタンパク質の候補として,発生の過程において軸索のガイダンスを外部から制御するタンパク質であるNGF(nerve growth factor,神経成長因子)やニューロトロフィン3,BDNF(brain-derived neurotrophic factor,脳由来神経栄養因子)などが検討されてきた1).しかし,これらの研究の多くは培養皿に分離されたニューロンへの投与というかたちで行われた実験によるものであり,これらの候補タンパク質が生体においてニューロンの切断ののちの軸索再生を制御しているのか,それとも,単にガイダンスタンパク質として作用しているだけなのかは定かでなかった.さらに,実験系,ニューロンの種類,研究者により異なる結果が報告されているため,ニューロンの切断ののちの軸索再生において,細胞外からの促進シグナルがin vivoにおいて本当に存在するのかどうかははっきりしていなかった.この研究は,軸索再生の誘導に細胞外のタンパク質が必要であることを明確に示し,その分子実体を明らかにしただけでなく,その下流のカスケードまで同定した点で軸索再生の研究における重要な知見のひとつになると思われる.
線虫のSVH-1はHGF,MSP,プラスミノーゲンに相同性をもち,SVH-2はMetおよびRonと相同性のあることから,哺乳動物においてもこれらと相同なタンパク質が軸索再生において重要な役割をはたしていることが推測される.現在のところ,哺乳動物においてSVH-1に相当するタンパク質がHGF,MSP,プラスミノーゲンのうちのどれなのか,あるいは,また別にあるのかについてははっきりしない.ただ興味深いことに,脊髄の損傷したマーモセットにHGFを投与すると損傷による運動障害からの回復が顕著に促進されるという報告のあることから9),HGFからMetへのシグナルそのもの,あるいは,それに類似したシグナルが霊長類を含む哺乳動物においても軸索再生を正に制御するシグナルとして機能する可能性が考えられる.今後,さらに研究を進めることにより,種をこえて保存された軸索再生の機構を明らかにできるのではないかと期待している.
文 献
- Liu, K., Tedeschi, A., Park, K. K. et al.: Neuronal intrinsic mechanisms of axon regeneration. Annu. Rev. Neurosci., 34, 131-152 (2011)[PubMed]
- 山下俊英: 軸索再生阻害機構とその制御による中枢神経再生治療. 蛋白質 核酸 酵素, 53, 406-410 (2008)
- Hammarlund, M., Nix, P., Hauth, L. et al.: Axon regeneration requires a conserved MAP kinase pathway. Science, 323, 802-806 (2009)[PubMed]
- Yan, D., Wu, Z., Chisholm, A. D. et al.: The DLK-1 kinase promotes mRNA stability and local translation in C. elegans synapses and axon regeneration. Cell, 138, 1005-1018 (2009)[PubMed]
- Nix, P., Hisamoto, N., Matsumoto, K. et al.: Axon regeneration requires coordinate activation of p38 and JNK MAPK pathways. Proc. Natl. Acad. Sci. USA, 108, 10738-10743 (2011)[PubMed]
- Itoh, A., Horiuchi, M., Bannerman, P. et al.: Impaired regenerative response of primary sensory neurons in ZPK/DLK gene-trap mice. Biochem. Biophys. Res. Commun., 383, 258-262 (2009)[PubMed]
- Barnat, M., Enslen, H., Propst, F. et al.: Distinct roles of c-Jun N-terminal kinase isoforms in neurite initiation and elongation during axonal regeneration. J. Neurosci., 30, 7804-7816 (2010)[PubMed]
- Mizuno, T., Hisamoto, N., Terada, T. et al.: The Caenorhabditis elegans MAPK phosphatase VHP-1 mediates a novel JNK-like signaling pathway in stress response. EMBO J., 23, 2226-2234 (2004)[PubMed]
- Kitamura, K., Fujiyoshi, K., Yamane, J. et al.: Human hepatocyte growth factor promotes functional recovery in primates after spinal cord injury. PLoS One, 6, e27706 (2011)[PubMed]
著者プロフィール
略歴:名古屋大学大学院理学研究科 准教授.
研究テーマ:線虫をモデルとした神経疾患および再生.
松本 邦弘(Kunihiro Matsumoto)
名古屋大学大学院理学研究科 教授.
研究室URL:http://bunshi3.bio.nagoya-u.ac.jp/~bunshi6/matsumoto_new/index.html
© 2012 久本直毅・松本邦弘 Licensed under CC 表示 2.1 日本