アロステリックな逆作動薬としての活性をもつ機能性抗体によるGタンパク質共役受容体の不活性化の分子機構
日野智也・岩田 想・村田武士
(ERATO岩田ヒト膜受容体構造プロジェクト)
email:村田武士
DOI: 10.7875/first.author.2012.037
G-protein-coupled receptor inactivation by an allosteric inverse-agonist antibody.
Tomoya Hino, Takatoshi Arakawa, Hiroko Iwanari, Takami Yurugi-Kobayashi, Chiyo Ikeda-Suno, Yoshiko Nakada-Nakura, Osamu Kusano-Arai, Simone Weyand, Tatsuro Shimamura, Norimichi Nomura, Alexander D. Cameron, Takuya Kobayashi, Takao Hamakubo, So Iwata, Takeshi Murata
Nature, 482, 237-240 (2012)
Gタンパク質共役受容体はホルモンや神経伝達物質など細胞の外部の情報を受容し,Gタンパク質の活性化を介して細胞内へ情報を伝達する役割を担う7回膜貫通型の膜タンパク質である.Gタンパク質共役受容体のかかわる生理機能は多種多様であり,多くの疾患に関与しているため,現在,もっとも重要な医薬標的タンパク質となっている.しかしながら,Gタンパク質共役受容体は本質的に構造ゆらぎをもつ不安定なタンパク質であることにくわえ,結晶化に必要な親水性の表面が著しく狭いことから,計算科学による合理的な創薬において必須な立体構造情報の取得は困難をきわめていた.筆者らは,Gタンパク質共役受容体の立体構造を認識するモノクローナル抗体の効率的な取得法の開発を行い,そのFabフラグメントによりGタンパク質共役受容体の親水性領域を人工的に拡張する結晶化の戦略を採用することで,ヒトに由来するアデノシンA2A受容体の2.7Å分解能での結晶構造の決定に成功した.興味深いことに,結晶化に用いた抗体はアデノシンA2A受容体に対するアゴニストの結合を著しく阻害する逆作動薬としての活性をもつ機能性抗体であった.この抗体はアデノシンA2A受容体の細胞内側の表面構造を広く認識し,とくに,抗体のCDR-H3の形成するβヘアピン構造がアデノシンA2A受容体のヘリックスバンドルに深く突き刺さるという特徴的な構造であった.この相互作用によりアデノシンA2A受容体の不活性型の構造を高度に安定化することでアゴニストの結合を阻害するアロステリックな機能阻害機構が新たに見い出された.この研究から,アデノシンA2A受容体のかかわるパーキンソン病に対する新規の治療薬の開発が可能になるとともに,Gタンパク質共役受容体の全般に対するこれまでにない新たな薬剤結合部位を示すことができた.
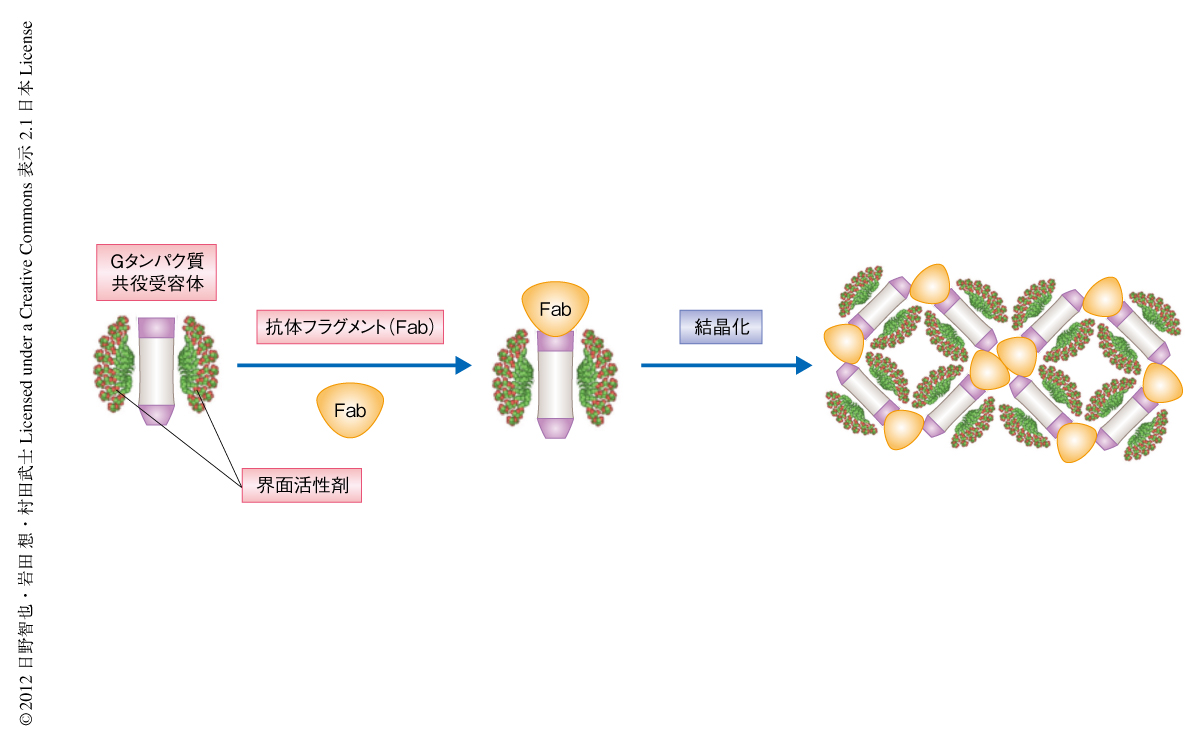
すべての生物は外部の環境に依存して生きている.したがって,外部環境の変化を感知することは生命の恒常性を維持するうえできわめて重要である.さらに,多細胞生物では細胞間のコミュニケーションが整然と行われることにより細胞の集合体としての組織あるいは個体がひとつの生命体として機能しうる.これらの環境情報の感知,ホルモンや情報伝達物質などを介した細胞間コミュニケーションにおいて主要な役割をはたすのがGタンパク質共役受容体(G protein-coupled receptor:GPCR)である.ヒトのゲノムには約800種のGタンパク質共役受容体がコードされていると見積もられており,多種多様な生理機能にかかわっている.そのため,現在,市販されている医薬品の約半数がこのGタンパク質共役受容体を標的としており,創薬においてもっとも重要な膜タンパク質となっている.近年,副作用が少なく効果の高い薬剤の設計および改良には,医薬標的となるタンパク質の立体構造にもとづいた合理的な創薬開発が有効であることが示されている.しかしながら,Gタンパク質共役受容体では,1)大きな構造変化が機能に直結しているため熱安定性が低い,2)大部分が細胞膜に埋もれており結晶化に必要な親水性の表面が著しく狭い,3)多数のフレキシブルなループ領域を含む,などの理由により結晶化がきわめて困難であるため,この研究の開始当時の2006年の時点では,ウシのロドプシンの立体構造が解かれているのみであった1).そこで,筆者らは,Gタンパク質共役受容体の結晶化を促進する手段として,親水性表面の大幅な拡張が可能であり立体構造の安定化も期待できる抗体のFabフラグメントを用いた結晶化の手法に着目し(図1),パーキンソン病などの神経変性疾患にかかわるとされるヒトに由来するアデノシンA2A受容体の結晶構造の解明を試みた.
抗体をGタンパク質共役受容体の結晶化の促進に活用するためには,抗体と結晶化の標的となるGタンパク質共役受容体との相対位置関係にゆらぎの少ないことが望まれる.N末端やC末端あるいはフレキシブルなループなどの連続したアミノ酸残基を認識する抗体はその条件をみたさず,結晶化には適さないと考えられる.一方,Gタンパク質共役受容体の特定の立体構造を認識する抗体であれば,Gタンパク質共役受容体と抗体との複合体は全体としてゆらぎの少ない,親水性領域の大きな膜タンパク質として扱うことが可能となるため,結晶化は容易になると予想される.しかしながら,Gタンパク質共役受容体に対する立体構造を認識するような抗体の作製には前例がなかったため,そのような抗体を効率的に取得するための技術として,1)マウスの血中での安定性および抗原性を高めるためのリピドAを含有するリポソームに再構成したGタンパク質共役受容体を抗原とするリポソーム免疫法,2)Gタンパク質共役受容体の天然構造を認識する抗体を選別するリポソームELISA法,3)変性した膜タンパク質には結合しない抗体を選別する変性ドットブロット法,を開発あるいは最適化し,ヒトに由来するアデノシンA2A受容体について立体構造を認識する抗体を24クローン得た.
立体構造を認識する抗体は標的とするタンパク質が機能する際の動きを固定化することにより,その機能を阻害する可能性のあることが知られている.今回,筆者らが得た抗体についても,アデノシンA2A受容体に対する機能性の評価を放射性リガンド結合アッセイ法により行った.その結果,24クローンの抗体のうち8クローンはアデノシンA2A受容体のアンタゴニスト(拮抗薬)であるZM241385への親和性をまったく変化させなかったが,一方で,高親和性のアゴニスト(作動薬)であるNECAへの親和性を低下させる機能をもつことがわかった.とくに,C2838抗体はNECAへの親和性を400倍以上も低下させた.このことは,この抗体がアデノシンA2A受容体の強力な逆作動薬(インバースアゴニスト)として機能することを意味した.また,抗体を結合したときのアデノシンA2A受容体の熱安定性の評価を行ったところ,抗体の存在しないときと比較して高い熱安定化の効果を得られることがわかった.以上のことから,C2838抗体はアデノシンA2A受容体の不活性型の構造を強く安定化させることによりアゴニストの結合を阻害することが予測された.
C2838抗体をFabフラグメント化し,メタノール資化性酵母Pichia pastorisを用いて発現させたアデノシンA2A受容体との複合体を調製したのち結晶化を行ったが,最初のスクリーニングでは結晶はまったく得られなかった.そこで,精製の手順,ゲルろ過による抗体の結合量,界面活性剤の種類などの検討を行ったところ,ゲルろ過を2回行うことで再現性よく結晶が得られるようになった.1回のゲルろ過では結晶はまったく得られず,また,3回以上のゲルろ過を行った場合にも結晶は得られるが再現性の低くなることから,アデノシンA2A受容体とともに共精製された脂質の量が結晶化には決定的に効いていたものと予想した.
得られた結晶は英国に液体窒素で凍結した状態で空輸し,放射光施設Diamond Light Sourceに新設されたマイクロフォーカスビームラインにおいてX線回折の測定を行った.アデノシンA2A受容体の結晶は通常の放射光施設ビームラインにおいて測定の可能な50~200μmの大きさであったが,ひとつの結晶の一部のみが高分解能でゆがみのないX線回折パターンを示したため,小さくフォーカスされたX線を用いてよい部分を探すことは構造を決定するうえで必須の作業であった.したがって,このような技術開発が進展していなければ今回の構造決定は不可能だったであろう.
このようにして得られたデータを用いて,アンタゴニストであるZM241385と結合したアデノシンA2A受容体とC2838抗体のFabフラグメントとの複合体の結晶構造を2.7Å分解能で決定した(PDB ID:3VG9,図2).このアデノシンA2A受容体の構造は,すでに報告されていた,細胞内第3ループをT4ファージに由来するリゾチームと置換したアデノシンA2A受容体とほぼ同一であった.しかし,今回の結晶構造では,このリゾチーム置換体では未解明であったGタンパク質との相互作用に重要な寄与をすると予想されている細胞内第3ループの構造を明瞭な電子密度で確認することができた.ヘリックスVとヘリックスVIの細胞の内側の部分ではαヘリックス構造が長くつづいており短いループにより連結されていた.
多くのGタンパク質共役受容体のヘリックスIIIにはAsp(Glu)-Arg-TyrからなるD/ERYモチーフが高度に保存されている.2000年に報告されたロドプシンの結晶構造から,D/ERYモチーフのArgはヘリックスVIのGluとionic lockとよばれる塩橋を形成し不活性型の構造の安定化に寄与することが明らかにされた.一方,これまでに構造解析されたアデノシンA2A受容体を含むT4ファージに由来するリゾチーム置換型のGタンパク質共役受容体の不活性型構造では2-6),ドーパミンD3受容体を除き,ionic lockの形成は認められなかった.これに対し,今回,解明された天然型の細胞内第3ループを含むアデノシンA2A受容体の結晶構造では,ionic lockに相当するArg102は直接的な塩橋ではないもののGlu228と水分子を介した水素結合により改変型のionic lockを形成していた.この相互作用には抗体の超可変領域のひとつであるCDR-H3も関与しており,抗体の結合によりヘリックスIIIとヘリックスVIとの相互作用が強く保たれていた.また,最近,報告された熱安定化の変異を導入したアデノシンA2A受容体の結晶構造では7),Arg102とGlu228との直接的な相互作用が確認されており今回の抗体との結合型の構造では,抗体のCDR-H3がionic lockの近傍に挿入されることにより,異なったかたちの相互作用が形成されたものと予想された.いずれにせよ,ヘリックスIIIとヘリックスVIの相対配置を固定化することは不活性型構造の安定化をひき起こす要因となっていることがうかがえた.
C2838抗体のFabフラグメントはアデノシンA2A受容体の細胞の内側の表面を幅広く認識するよう結合していた.とくに,抗体のCDR-H3は長く伸びたβヘアピン構造を形成し,アデノシンA2A受容体のヘリックスII,ヘリックスIII,ヘリックスVI,ヘリックスVIIにより形成されるポケットに突き刺さる特徴的な相互作用を示し,水素結合やファンデルワールス結合により強固に結合していた.抗体の全体ではすべてのCDR領域がアデノシンA2A受容体と相互作用し,全部で14個の水素結合により非常に安定な複合体を形成していた.
興味深いことに,アデノシンA2A受容体におけるCDR-H3の結合位置は,活性型オプシンに結合したGタンパク質αサブユニットのC末端ペプチドや8),β2アドレナリン受容体の活性型構造を安定化するナノボディNb80のCDR-3と9),同様の位置にあった.両者の決定的な違いは,C2838抗体のFabフラグメントは不活性型の構造を安定化するのに対し,後者は活性型の構造に結合することであった.オプシンの構造ではGタンパク質αサブユニットのC末端ペプチドはヘリックスII,ヘリックスIII,ヘリックスV,ヘリックスVI,ヘリックスVIIにより形成される大きなポケットにはまり込みD/ERYモチーフのArgと相互作用していた.β2アドレナリン受容体の構造ではNb80のCDR-3はGタンパク質αサブユニットのC末端ペプチドとよく似た位置に結合してはいるがそれとは異なりβヘアピン構造を形成していた.アデノシンA2A受容体の構造ではCDR-H3もNb80のCDR-3と同様のβヘアピン構造を形成していたがポケットの異なる位置で結合していた.β2アドレナリン受容体の構造ではNb80のCDR-3はヘリックスIIIとヘリックスVIとのあいだに位置し両方のヘリックス間の距離を活性化状態に保つのに対し,アデノシンA2A受容体の構造ではCDR-H3はCDR-3と比較して6ÅほどヘリックスIIへ近づきヘリックスVIを不活性型状態にとどめる位置に存在していた.この違いにより,改変型のionic lockの形成を含むヘリックスIIIとヘリックスVIとの緊密な相互作用を可能とし,不活性型構造の高度な安定化に寄与することが示唆された.
Gタンパク質共役受容体へのアゴニストの結合はヘリックスIII,ヘリックスVI,ヘリックスVIIの大きな構造変化を誘起する.この構造変化はGタンパク質結合ポケットの形成に必須である.いい換えると,細胞の外側にあるリガンド結合ポケットからの情報は,これらのヘリックスをとおして細胞の内側にあるGタンパク質結合ポケットへと伝わる.すなわち,細胞膜をはさんだ両方のポケットの構造は強く連結しているといえる.今回の研究により示された細胞内側ポケットへの抗体の結合によるリガンド結合能の変化は,これとは逆に,Gタンパク質結合部位がリガンド結合部位の構造を規定することを示唆した.すでに構造決定されているアゴニストが結合したT4ファージに由来するリゾチーム置換型のアデノシンA2A受容体と構造を比較すると10,11),アゴニストの結合にともないGタンパク質共役受容体において高度に保存され活性化の“トグルスイッチ”とよばれているヘリックスVIのTrp246は,不活性型状態ではアゴニストの一部であるリボースと立体障害を生ずる位置に存在したのに対し,活性型構造では細胞の内側へ移動していた.したがって,抗体のCDR-H3によりヘリックスIII,ヘリックスVI,ヘリックスVIIの細胞の内側の構造が固定化されるとTrp246の移動を含む細胞の外側のリガンド結合部位の構造変化が阻害されてしまうため,アゴニストの結合親和性が著しく低下しアロステリックな逆作動薬としての作用を示すものと考えられた(図3).
今回,ヒトに由来するアデノシンA2A受容体と逆作動薬としての活性をもつ抗体との複合体の結晶構造を解くことで,Gタンパク質共役受容体の活性化にともなう細胞の内側の構造変化を抑制することにより,アゴニストの結合能を著しく低下させられることが明らかになった.このことは,リガンド結合部位を含む細胞外の表面構造だけでなく,細胞内の表面構造も薬剤の標的部位として有効であることを示唆し,今後,これまでとはまったく異なる新しい薬剤の開発へとつながることが期待される.さらに,この研究は,抗体自体がGタンパク質共役受容体に対する薬剤として機能しうることを示した.抗Gタンパク質共役受容体抗体により,逆作動薬としての活性のみではなく,アゴニスト活性やアンタゴニスト活性,リガンド結合やGタンパク質活性化の細密な制御など,抗体の高い特異性を生かした副作用の少ない高機能な抗体医薬の発展へとつながる可能性がある.
また,この研究をとおして開発された立体構造を認識する抗体を作製する技術は,Gタンパク質共役受容体にかぎらず,さまざまな膜タンパク質の機能を解析するうえできわめて有用なツールとなりうる.たとえば,過渡的な構造変化を捕捉するような抗体をつくり出し複合体の結晶構造を解くことで,膜タンパク質のダイナミクスにせまることができると予想される.いままで技術的に困難であった膜タンパク質の動的な構造解析へとつながることを強く期待する.
略歴:2003年 名古屋大学大学院理学研究科博士課程 修了,同年 理化学研究所 協力研究員,および,同 基礎科学特別研究員,2007年 ERATO岩田ヒト膜受容体構造プロジェクト 研究員を経て,2011年より鳥取大学大学院工学研究科 講師.
研究テーマ:膜タンパク質の構造生物学.
抱負:むずかしい研究課題にチャレンジすることで,問題点を把握しこれを克服するという気概をつねにもちつづけたい.
岩田 想(So Iwata)
京都大学大学院医学研究科 教授.
村田 武士(Takeshi Murata)
略歴:2000年 東京理科大学大学院基礎工学研究科博士課程 修了,同年 英国Medical Research Council研究員,2005年 理化学研究所 基礎科学特別研究員,2006年 ERATO岩田ヒト膜受容体構造プロジェクト グループリーダー,2007年 京都大学大学院医学研究科 助教を経て,2009年より千葉大学大学院理学研究科 特任准教授.
研究テーマ:膜タンパク質の構造機能解析.
抱負:重要だと思っていること,言っていること,やっていることを一致させる.
© 2012 日野智也・岩田 想・村田武士 Licensed under CC 表示 2.1 日本
(ERATO岩田ヒト膜受容体構造プロジェクト)
email:村田武士
DOI: 10.7875/first.author.2012.037
G-protein-coupled receptor inactivation by an allosteric inverse-agonist antibody.
Tomoya Hino, Takatoshi Arakawa, Hiroko Iwanari, Takami Yurugi-Kobayashi, Chiyo Ikeda-Suno, Yoshiko Nakada-Nakura, Osamu Kusano-Arai, Simone Weyand, Tatsuro Shimamura, Norimichi Nomura, Alexander D. Cameron, Takuya Kobayashi, Takao Hamakubo, So Iwata, Takeshi Murata
Nature, 482, 237-240 (2012)
要 約
Gタンパク質共役受容体はホルモンや神経伝達物質など細胞の外部の情報を受容し,Gタンパク質の活性化を介して細胞内へ情報を伝達する役割を担う7回膜貫通型の膜タンパク質である.Gタンパク質共役受容体のかかわる生理機能は多種多様であり,多くの疾患に関与しているため,現在,もっとも重要な医薬標的タンパク質となっている.しかしながら,Gタンパク質共役受容体は本質的に構造ゆらぎをもつ不安定なタンパク質であることにくわえ,結晶化に必要な親水性の表面が著しく狭いことから,計算科学による合理的な創薬において必須な立体構造情報の取得は困難をきわめていた.筆者らは,Gタンパク質共役受容体の立体構造を認識するモノクローナル抗体の効率的な取得法の開発を行い,そのFabフラグメントによりGタンパク質共役受容体の親水性領域を人工的に拡張する結晶化の戦略を採用することで,ヒトに由来するアデノシンA2A受容体の2.7Å分解能での結晶構造の決定に成功した.興味深いことに,結晶化に用いた抗体はアデノシンA2A受容体に対するアゴニストの結合を著しく阻害する逆作動薬としての活性をもつ機能性抗体であった.この抗体はアデノシンA2A受容体の細胞内側の表面構造を広く認識し,とくに,抗体のCDR-H3の形成するβヘアピン構造がアデノシンA2A受容体のヘリックスバンドルに深く突き刺さるという特徴的な構造であった.この相互作用によりアデノシンA2A受容体の不活性型の構造を高度に安定化することでアゴニストの結合を阻害するアロステリックな機能阻害機構が新たに見い出された.この研究から,アデノシンA2A受容体のかかわるパーキンソン病に対する新規の治療薬の開発が可能になるとともに,Gタンパク質共役受容体の全般に対するこれまでにない新たな薬剤結合部位を示すことができた.
はじめに
すべての生物は外部の環境に依存して生きている.したがって,外部環境の変化を感知することは生命の恒常性を維持するうえできわめて重要である.さらに,多細胞生物では細胞間のコミュニケーションが整然と行われることにより細胞の集合体としての組織あるいは個体がひとつの生命体として機能しうる.これらの環境情報の感知,ホルモンや情報伝達物質などを介した細胞間コミュニケーションにおいて主要な役割をはたすのがGタンパク質共役受容体(G protein-coupled receptor:GPCR)である.ヒトのゲノムには約800種のGタンパク質共役受容体がコードされていると見積もられており,多種多様な生理機能にかかわっている.そのため,現在,市販されている医薬品の約半数がこのGタンパク質共役受容体を標的としており,創薬においてもっとも重要な膜タンパク質となっている.近年,副作用が少なく効果の高い薬剤の設計および改良には,医薬標的となるタンパク質の立体構造にもとづいた合理的な創薬開発が有効であることが示されている.しかしながら,Gタンパク質共役受容体では,1)大きな構造変化が機能に直結しているため熱安定性が低い,2)大部分が細胞膜に埋もれており結晶化に必要な親水性の表面が著しく狭い,3)多数のフレキシブルなループ領域を含む,などの理由により結晶化がきわめて困難であるため,この研究の開始当時の2006年の時点では,ウシのロドプシンの立体構造が解かれているのみであった1).そこで,筆者らは,Gタンパク質共役受容体の結晶化を促進する手段として,親水性表面の大幅な拡張が可能であり立体構造の安定化も期待できる抗体のFabフラグメントを用いた結晶化の手法に着目し(図1),パーキンソン病などの神経変性疾患にかかわるとされるヒトに由来するアデノシンA2A受容体の結晶構造の解明を試みた.
1.アデノシンA2A受容体に対するモノクローナル抗体の作製
抗体をGタンパク質共役受容体の結晶化の促進に活用するためには,抗体と結晶化の標的となるGタンパク質共役受容体との相対位置関係にゆらぎの少ないことが望まれる.N末端やC末端あるいはフレキシブルなループなどの連続したアミノ酸残基を認識する抗体はその条件をみたさず,結晶化には適さないと考えられる.一方,Gタンパク質共役受容体の特定の立体構造を認識する抗体であれば,Gタンパク質共役受容体と抗体との複合体は全体としてゆらぎの少ない,親水性領域の大きな膜タンパク質として扱うことが可能となるため,結晶化は容易になると予想される.しかしながら,Gタンパク質共役受容体に対する立体構造を認識するような抗体の作製には前例がなかったため,そのような抗体を効率的に取得するための技術として,1)マウスの血中での安定性および抗原性を高めるためのリピドAを含有するリポソームに再構成したGタンパク質共役受容体を抗原とするリポソーム免疫法,2)Gタンパク質共役受容体の天然構造を認識する抗体を選別するリポソームELISA法,3)変性した膜タンパク質には結合しない抗体を選別する変性ドットブロット法,を開発あるいは最適化し,ヒトに由来するアデノシンA2A受容体について立体構造を認識する抗体を24クローン得た.
2.得られた抗体はアデノシンA2A受容体に対する逆作動薬としての作用をもつ
立体構造を認識する抗体は標的とするタンパク質が機能する際の動きを固定化することにより,その機能を阻害する可能性のあることが知られている.今回,筆者らが得た抗体についても,アデノシンA2A受容体に対する機能性の評価を放射性リガンド結合アッセイ法により行った.その結果,24クローンの抗体のうち8クローンはアデノシンA2A受容体のアンタゴニスト(拮抗薬)であるZM241385への親和性をまったく変化させなかったが,一方で,高親和性のアゴニスト(作動薬)であるNECAへの親和性を低下させる機能をもつことがわかった.とくに,C2838抗体はNECAへの親和性を400倍以上も低下させた.このことは,この抗体がアデノシンA2A受容体の強力な逆作動薬(インバースアゴニスト)として機能することを意味した.また,抗体を結合したときのアデノシンA2A受容体の熱安定性の評価を行ったところ,抗体の存在しないときと比較して高い熱安定化の効果を得られることがわかった.以上のことから,C2838抗体はアデノシンA2A受容体の不活性型の構造を強く安定化させることによりアゴニストの結合を阻害することが予測された.
3.アデノシンA2A受容体と抗体のFabフラグメントとの複合体の結晶化と構造解析
C2838抗体をFabフラグメント化し,メタノール資化性酵母Pichia pastorisを用いて発現させたアデノシンA2A受容体との複合体を調製したのち結晶化を行ったが,最初のスクリーニングでは結晶はまったく得られなかった.そこで,精製の手順,ゲルろ過による抗体の結合量,界面活性剤の種類などの検討を行ったところ,ゲルろ過を2回行うことで再現性よく結晶が得られるようになった.1回のゲルろ過では結晶はまったく得られず,また,3回以上のゲルろ過を行った場合にも結晶は得られるが再現性の低くなることから,アデノシンA2A受容体とともに共精製された脂質の量が結晶化には決定的に効いていたものと予想した.
得られた結晶は英国に液体窒素で凍結した状態で空輸し,放射光施設Diamond Light Sourceに新設されたマイクロフォーカスビームラインにおいてX線回折の測定を行った.アデノシンA2A受容体の結晶は通常の放射光施設ビームラインにおいて測定の可能な50~200μmの大きさであったが,ひとつの結晶の一部のみが高分解能でゆがみのないX線回折パターンを示したため,小さくフォーカスされたX線を用いてよい部分を探すことは構造を決定するうえで必須の作業であった.したがって,このような技術開発が進展していなければ今回の構造決定は不可能だったであろう.
4.アデノシンA2A受容体と抗体のFabフラグメントとの複合体の結晶構造
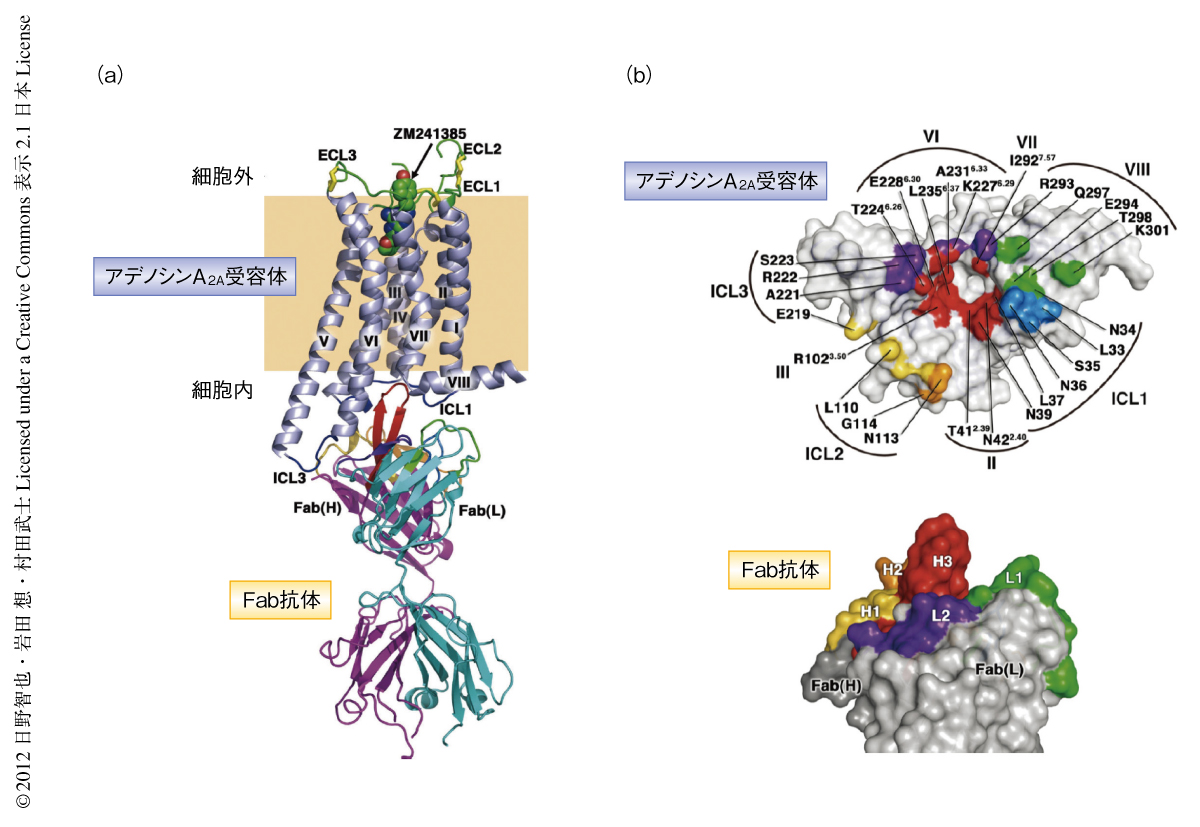
このようにして得られたデータを用いて,アンタゴニストであるZM241385と結合したアデノシンA2A受容体とC2838抗体のFabフラグメントとの複合体の結晶構造を2.7Å分解能で決定した(PDB ID:3VG9,図2).このアデノシンA2A受容体の構造は,すでに報告されていた,細胞内第3ループをT4ファージに由来するリゾチームと置換したアデノシンA2A受容体とほぼ同一であった.しかし,今回の結晶構造では,このリゾチーム置換体では未解明であったGタンパク質との相互作用に重要な寄与をすると予想されている細胞内第3ループの構造を明瞭な電子密度で確認することができた.ヘリックスVとヘリックスVIの細胞の内側の部分ではαヘリックス構造が長くつづいており短いループにより連結されていた.
多くのGタンパク質共役受容体のヘリックスIIIにはAsp(Glu)-Arg-TyrからなるD/ERYモチーフが高度に保存されている.2000年に報告されたロドプシンの結晶構造から,D/ERYモチーフのArgはヘリックスVIのGluとionic lockとよばれる塩橋を形成し不活性型の構造の安定化に寄与することが明らかにされた.一方,これまでに構造解析されたアデノシンA2A受容体を含むT4ファージに由来するリゾチーム置換型のGタンパク質共役受容体の不活性型構造では2-6),ドーパミンD3受容体を除き,ionic lockの形成は認められなかった.これに対し,今回,解明された天然型の細胞内第3ループを含むアデノシンA2A受容体の結晶構造では,ionic lockに相当するArg102は直接的な塩橋ではないもののGlu228と水分子を介した水素結合により改変型のionic lockを形成していた.この相互作用には抗体の超可変領域のひとつであるCDR-H3も関与しており,抗体の結合によりヘリックスIIIとヘリックスVIとの相互作用が強く保たれていた.また,最近,報告された熱安定化の変異を導入したアデノシンA2A受容体の結晶構造では7),Arg102とGlu228との直接的な相互作用が確認されており今回の抗体との結合型の構造では,抗体のCDR-H3がionic lockの近傍に挿入されることにより,異なったかたちの相互作用が形成されたものと予想された.いずれにせよ,ヘリックスIIIとヘリックスVIの相対配置を固定化することは不活性型構造の安定化をひき起こす要因となっていることがうかがえた.
5.アデノシンA2A受容体と抗体のFabフラグメントとの相互作用
C2838抗体のFabフラグメントはアデノシンA2A受容体の細胞の内側の表面を幅広く認識するよう結合していた.とくに,抗体のCDR-H3は長く伸びたβヘアピン構造を形成し,アデノシンA2A受容体のヘリックスII,ヘリックスIII,ヘリックスVI,ヘリックスVIIにより形成されるポケットに突き刺さる特徴的な相互作用を示し,水素結合やファンデルワールス結合により強固に結合していた.抗体の全体ではすべてのCDR領域がアデノシンA2A受容体と相互作用し,全部で14個の水素結合により非常に安定な複合体を形成していた.
興味深いことに,アデノシンA2A受容体におけるCDR-H3の結合位置は,活性型オプシンに結合したGタンパク質αサブユニットのC末端ペプチドや8),β2アドレナリン受容体の活性型構造を安定化するナノボディNb80のCDR-3と9),同様の位置にあった.両者の決定的な違いは,C2838抗体のFabフラグメントは不活性型の構造を安定化するのに対し,後者は活性型の構造に結合することであった.オプシンの構造ではGタンパク質αサブユニットのC末端ペプチドはヘリックスII,ヘリックスIII,ヘリックスV,ヘリックスVI,ヘリックスVIIにより形成される大きなポケットにはまり込みD/ERYモチーフのArgと相互作用していた.β2アドレナリン受容体の構造ではNb80のCDR-3はGタンパク質αサブユニットのC末端ペプチドとよく似た位置に結合してはいるがそれとは異なりβヘアピン構造を形成していた.アデノシンA2A受容体の構造ではCDR-H3もNb80のCDR-3と同様のβヘアピン構造を形成していたがポケットの異なる位置で結合していた.β2アドレナリン受容体の構造ではNb80のCDR-3はヘリックスIIIとヘリックスVIとのあいだに位置し両方のヘリックス間の距離を活性化状態に保つのに対し,アデノシンA2A受容体の構造ではCDR-H3はCDR-3と比較して6ÅほどヘリックスIIへ近づきヘリックスVIを不活性型状態にとどめる位置に存在していた.この違いにより,改変型のionic lockの形成を含むヘリックスIIIとヘリックスVIとの緊密な相互作用を可能とし,不活性型構造の高度な安定化に寄与することが示唆された.
6.逆作動薬としての活性をもつ抗体によるアデノシンA2A受容体の不活性化の機構
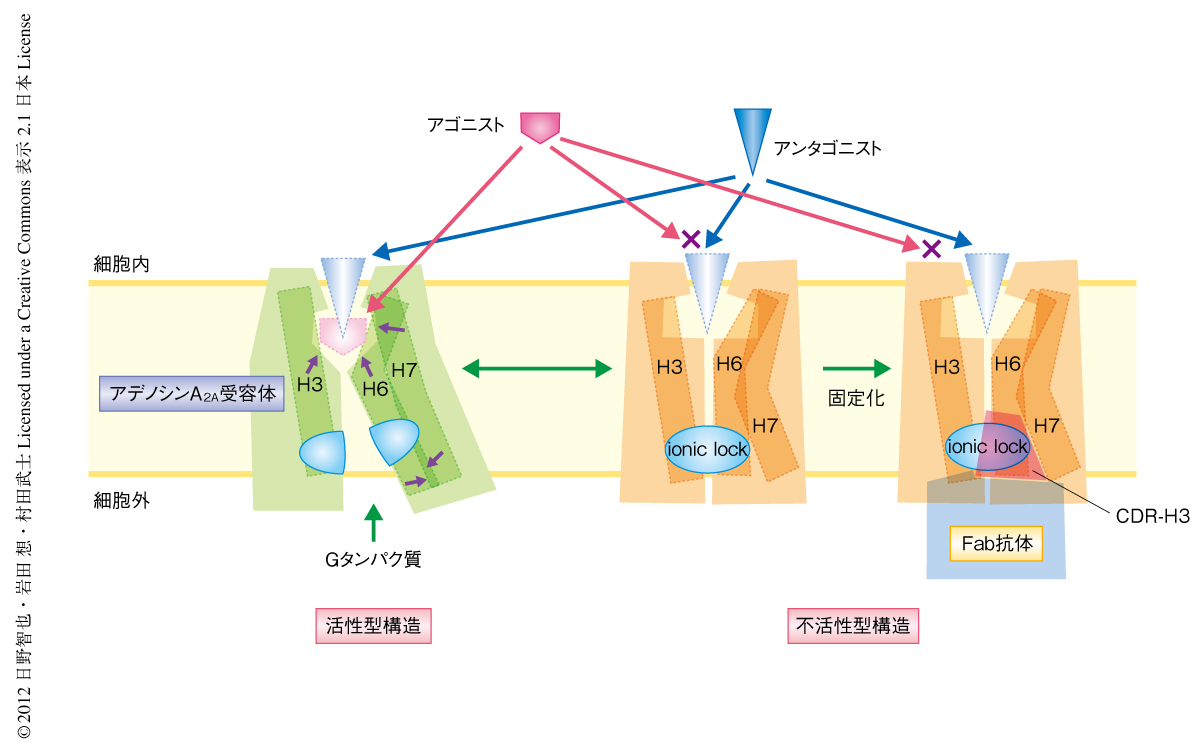
Gタンパク質共役受容体へのアゴニストの結合はヘリックスIII,ヘリックスVI,ヘリックスVIIの大きな構造変化を誘起する.この構造変化はGタンパク質結合ポケットの形成に必須である.いい換えると,細胞の外側にあるリガンド結合ポケットからの情報は,これらのヘリックスをとおして細胞の内側にあるGタンパク質結合ポケットへと伝わる.すなわち,細胞膜をはさんだ両方のポケットの構造は強く連結しているといえる.今回の研究により示された細胞内側ポケットへの抗体の結合によるリガンド結合能の変化は,これとは逆に,Gタンパク質結合部位がリガンド結合部位の構造を規定することを示唆した.すでに構造決定されているアゴニストが結合したT4ファージに由来するリゾチーム置換型のアデノシンA2A受容体と構造を比較すると10,11),アゴニストの結合にともないGタンパク質共役受容体において高度に保存され活性化の“トグルスイッチ”とよばれているヘリックスVIのTrp246は,不活性型状態ではアゴニストの一部であるリボースと立体障害を生ずる位置に存在したのに対し,活性型構造では細胞の内側へ移動していた.したがって,抗体のCDR-H3によりヘリックスIII,ヘリックスVI,ヘリックスVIIの細胞の内側の構造が固定化されるとTrp246の移動を含む細胞の外側のリガンド結合部位の構造変化が阻害されてしまうため,アゴニストの結合親和性が著しく低下しアロステリックな逆作動薬としての作用を示すものと考えられた(図3).
おわりに
今回,ヒトに由来するアデノシンA2A受容体と逆作動薬としての活性をもつ抗体との複合体の結晶構造を解くことで,Gタンパク質共役受容体の活性化にともなう細胞の内側の構造変化を抑制することにより,アゴニストの結合能を著しく低下させられることが明らかになった.このことは,リガンド結合部位を含む細胞外の表面構造だけでなく,細胞内の表面構造も薬剤の標的部位として有効であることを示唆し,今後,これまでとはまったく異なる新しい薬剤の開発へとつながることが期待される.さらに,この研究は,抗体自体がGタンパク質共役受容体に対する薬剤として機能しうることを示した.抗Gタンパク質共役受容体抗体により,逆作動薬としての活性のみではなく,アゴニスト活性やアンタゴニスト活性,リガンド結合やGタンパク質活性化の細密な制御など,抗体の高い特異性を生かした副作用の少ない高機能な抗体医薬の発展へとつながる可能性がある.
また,この研究をとおして開発された立体構造を認識する抗体を作製する技術は,Gタンパク質共役受容体にかぎらず,さまざまな膜タンパク質の機能を解析するうえできわめて有用なツールとなりうる.たとえば,過渡的な構造変化を捕捉するような抗体をつくり出し複合体の結晶構造を解くことで,膜タンパク質のダイナミクスにせまることができると予想される.いままで技術的に困難であった膜タンパク質の動的な構造解析へとつながることを強く期待する.
文 献
- Palczewski, K., Kumasaka, T., Hori, T. et al.: Crystal structure of rhodopsin: A G protein-coupled receptor. Science, 289, 739-745 (2000)[PubMed]
- Cherezov, V., Rosenbaum D. M., Hanson, M. A. et al.: High-resolution crystal structure of engineered human β2-adrenergic G protein-coupled receptor. Science, 318, 1258-1265 (2007)[PubMed]
- Jaakola V. P., Griffith, M. T., Hanson M. A. et al.: The 2.6 angstrom crystal structure of a human A2A adenosine receptor bound to an antagonist. Science, 322, 1211-1217 (2008)[PubMed]
- Wu, B., Chien, E. Y., Mol, C. D. et al.: Structures of the CXCR4 chemokine GPCR with small-molecule and cyclic peptide antagonists. Science, 330, 1066-1071 (2010)[PubMed]
- Chien, E. Y., Liu, W., Zhao, Q. et al.: Structure of the human dopamine D3 receptor in complex with a D2/D3 selective antagonist. Science, 330, 1091-1095 (2010)[PubMed]
- Shimamura, T., Shiroishi, M., Weyand, S. et al.: Structure of the human histamine H1 receptor complex with doxepin. Nature, 475, 65-70 (2011)[PubMed]
- Dore, A. S., Robertson, N., Errey, J. C. et al.: Structure of the adenosine A2A receptor in complex with ZM241385 and the xanthines XAC and caffeine. Structure, 19, 1283-1293 (2011)[PubMed]
- Scheerer, P., Park, J. H., Hildebrand, P. W. et al.: Crystal structure of opsin in its G-protein-interacting conformation. Nature, 455, 497-502 (2008)[PubMed]
- Rasmussen, S. G., Choi, H. J., Fung, J. J. et al.: Structure of a nanobody-stabilized active state of the β2 adrenoceptor. Nature, 469, 175-180 (2011)[PubMed]
- Xu, F., Wu, H., Katritch, V. et al.: Structure of an agonist-bound human A2A adenosine receptor. Science, 332, 322-327 (2011)[PubMed]
- Lebon, G., Warne, T., Edwards, P. C. et al.: Agonist-bound adenosine A2A receptor structures reveal common features of GPCR activation. Nature, 474, 521-525 (2011)[PubMed]
著者プロフィール
略歴:2003年 名古屋大学大学院理学研究科博士課程 修了,同年 理化学研究所 協力研究員,および,同 基礎科学特別研究員,2007年 ERATO岩田ヒト膜受容体構造プロジェクト 研究員を経て,2011年より鳥取大学大学院工学研究科 講師.
研究テーマ:膜タンパク質の構造生物学.
抱負:むずかしい研究課題にチャレンジすることで,問題点を把握しこれを克服するという気概をつねにもちつづけたい.
岩田 想(So Iwata)
京都大学大学院医学研究科 教授.
村田 武士(Takeshi Murata)
略歴:2000年 東京理科大学大学院基礎工学研究科博士課程 修了,同年 英国Medical Research Council研究員,2005年 理化学研究所 基礎科学特別研究員,2006年 ERATO岩田ヒト膜受容体構造プロジェクト グループリーダー,2007年 京都大学大学院医学研究科 助教を経て,2009年より千葉大学大学院理学研究科 特任准教授.
研究テーマ:膜タンパク質の構造機能解析.
抱負:重要だと思っていること,言っていること,やっていることを一致させる.
© 2012 日野智也・岩田 想・村田武士 Licensed under CC 表示 2.1 日本