ビタミンEは破骨細胞の融合を促進し骨量の減少をひき起こす
藤田浩二1・竹田 秀2
(1東京医科歯科大学大学院医歯学総合研究科 整形外科学分野,2慶應義塾大学医学部 腎臓内分泌代謝内科)
email:藤田浩二,竹田 秀
DOI: 10.7875/first.author.2012.038
Vitamin E decreases bone mass by stimulating osteoclast fusion.
Koji Fujita, Makiko Iwasaki, Hiroki Ochi, Toru Fukuda, Chengshan Ma, Takeshi Miyamoto, Kimitaka Takitani, Takako Negishi-Koga, Satoko Sunamura, Tatsuhiko Kodama, Hiroshi Takayanagi, Hiroshi Tamai, Shigeaki Kato, Hiroyuki Arai, Kenichi Shinomiya, Hiroshi Itoh, Atsushi Okawa, Shu Takeda
Nature Medicine, 18, 589-594 (2012)
筆者らは,ビタミンE欠損のマウスモデルであるαトコフェノール輸送タンパク質のノックアウトマウスは骨吸収の減少により高い骨量を示すことを発見した.培養細胞における検討により,αトコフェノールはその抗酸化作用とは独立した機構により破骨細胞の融合を促進することを示した.これは,αトコフェノールがp38 MAPキナーゼのリン酸化を介して転写因子Mitfを活性化し,つづいて,活性化されたMitfが破骨細胞の融合に必須のタンパク質DC-STAMPをコードする遺伝子のプロモーター領域に直接結合することによるものであった.実際に,αトコフェノール輸送タンパク質ノックアウトマウスでみられた高い骨量はDC-STAMPを高発現するトランスジェニックマウスと交配することで改善された.さらに,一般に摂取されているサプリメントに相当する量のαトコフェノールを添加した飼料を野生型のマウスやラットにあたえると骨量が減少した.以上の結果は,ビタミンEは破骨細胞の融合の制御を介した骨量の規定因子のひとつであることを示した.
骨の恒常性は骨芽細胞による骨形成と破骨細胞による骨吸収とのバランスにより維持されている1).破骨細胞は単核の前破骨細胞が融合することにより形成される多核の細胞である2).ビタミンA,ビタミンD,ビタミンKなどの脂溶性ビタミンは骨の恒常性の維持にきわめて重要であることが知られていたが3),同じ脂溶性ビタミンであるビタミンEについて骨における役割は不明であった.一般に,ビタミンEは抗酸化作用を示し動脈硬化や加齢に対し効果があると考えられていて,実際,ビタミンEのサプリメントは非常に人気があり米国では人口の10%以上が摂取している4).
ビタミンEにはαトコフェロールやトコトリエノールをはじめとする8種類の異性体が存在する.これらの異性体のうち,生体ではαトコフェロールがおもに活性をもっている.小腸から吸収されたαトコフェロールは肝臓にてαトコフェロール輸送タンパク質と選択的に結合し末梢組織へと供給される.ビタミンE欠損のマウスモデルであるαトコフェロール輸送タンパク質のノックアウトマウスは血中のαトコフェロールの濃度が低下し不妊や歩調の異常を示すが,αトコフェロール添加食の摂取により症状の改善することが知られている5,6).
はじめに,αトコフェノール輸送タンパク質ノックアウトマウスの椎体および大腿骨の骨量を計測したところ,野生型マウスに比べ増加していた.骨形態の計測による検討では,このノックアウトマウスは骨吸収が低下しており,また,個々の破骨細胞のサイズの減少も観察された.同時に,骨吸収のマーカーである血中におけるデオキシピリジノリン値も低下していた.一方で,骨形成に変化は認めなかった.つづいて,αトコフェノール輸送タンパク質ノックアウトマウスにαトコフェロール添加食をあたえると血中のαトコフェロール濃度が回復し,同時に,骨吸収の亢進は低下し骨量も正常化した.このことから,血中のαトコフェロールが骨吸収に影響を及ぼしていることが示唆された.血中のαトコフェロール濃度と破骨細胞との関係を調べるため,マウスの大腿骨から採取した骨髄細胞前駆細胞をM-CSFおよびRANKLで刺激し破骨細胞の分化を誘導する培養系を7),通常のウシの血清ではなくマウスの血清を用いて行った.その結果,αトコフェノール輸送タンパク質ノックアウトマウスの骨髄から得た破骨細胞前駆細胞をこのノックアウトマウスの血清で培養すると破骨細胞の形成は低下したが,野生型マウスの血清で培養すると破骨細胞の形成は正常化した.一方,野生型マウスの骨髄から得た破骨細胞前駆細胞をこのノックアウトマウスの血清で培養すると破骨細胞の形成は低下した.したがって,αトコフェノール輸送タンパク質ノックアウトマウスで認められる骨吸収の異常は破骨細胞の異常によるのではなく,血中のαトコフェロールによる二次的な異常であることが示唆された.以上の検討から,血中のαトコフェロールにより破骨細胞による骨吸収が制御されうることが明らかとなった.
αトコフェロールの破骨細胞に対する効果をin vitroにおいて検討した.野生型マウスの大腿骨から採取した破骨細胞前駆細胞をM-CSFおよびRANKLで刺激し破骨細胞の分化を誘導する培養系において7),培養液にαトコフェロールを添加すると破骨細胞の数が増加すると同時に,破骨細胞の融合が促進されαトコフェロールを添加しないときと比べ多核化が亢進した.一方,αトコフェロールは破骨細胞前駆細胞の増殖,成熟した破骨細胞のアポトーシス,および,骨芽細胞の分化には影響を及ぼさなかった.興味深いことに,破骨細胞の分化の後期,すなわち,RANKLによる刺激の開始ののち48時間~72時間の24時間にのみ,αトコフェロールを添加することで破骨細胞の多核化の亢進が再現された.また,αトコフェロールにより多核化が促進された破骨細胞は骨吸収能も亢進していた.この破骨細胞に対する多核化の亢進は抗酸化作用を示すビタミンEの異性体やほかの抗酸化剤では認められなかったため,αトコフェロールは抗酸化作用とは独立した機構より破骨細胞の多核化を促進するものと考えられた.
αトコフェロールにより多核化が促進された破骨細胞において破骨細胞に関連する遺伝子の発現を検討したところ,破骨細胞の分化の後期におけるマーカー遺伝子であるTrap遺伝子やCtsk遺伝子の発現上昇を認めた.さらに,細胞融合にかかわる遺伝子の発現を検討すると,破骨細胞の融合に必須のタンパク質DC-STAMP 8) をコードするTm7sf4遺伝子の発現上昇を認めた.一方,αトコフェノール輸送タンパク質ノックアウトマウスの骨ではTm7sf4遺伝子とTrapの発現が低下していた.この結果から,αトコフェロールはDC-STAMPの発現を介し破骨細胞の融合を制御している可能性が考えられた.
そこで,野生型マウスから得た破骨細胞前駆細胞について,Tm7sf4遺伝子のsiRNAによりDC-STAMPの発現をノックダウンしたうえで破骨細胞の分化を誘導したところ,破骨細胞は単核化しαトコフェロールによる多核化の促進作用は消失した.同様に,DC-STAMPノックアウトマウスの骨髄をin vitroにおいて分化させた破骨細胞においてもαトコフェロールによる破骨細胞の多核化の促進作用は消失していた.一方,レトロウイルスを用いてTm7sf4遺伝子を破骨前駆細胞に過剰に発現させ破骨細胞の分化を誘導すると,αトコフェロールによる刺激がなくても破骨細胞の多核化が促進された.さらに,αトコフェノール輸送タンパク質ノックアウトマウスにDC-STAMPを高発現するトランスジェニックマウスを交配させると,このノックアウトマウスでみられた骨吸収の低下や骨量の増加といった表現型は改善した.
こうして,αトコフェロールが破骨細胞においてDC-STAMPの発現を介し破骨細胞の多核化を制御していることが明らかにされた.
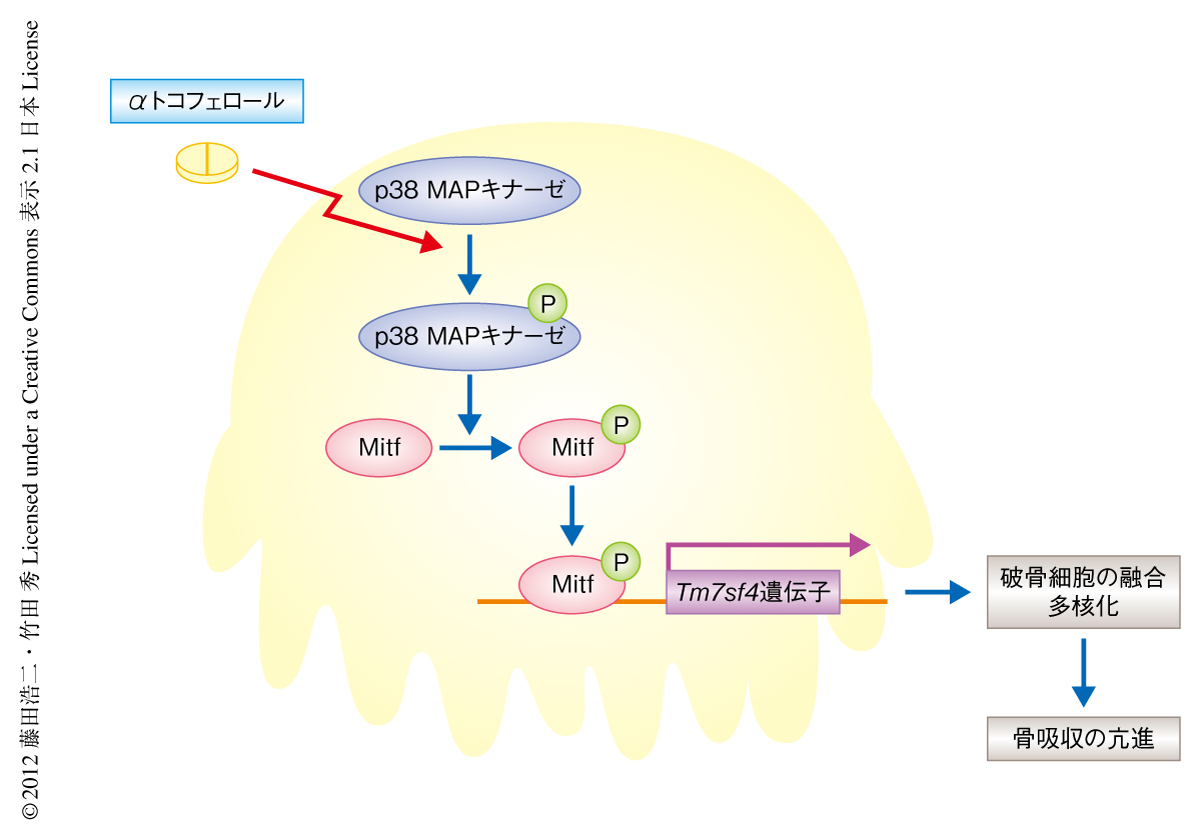
αトコフェロールの刺激による破骨細胞におけるシグナル伝達経路を明らかにするため,破骨細胞前駆細胞をαトコフェロールにより刺激したときのさまざまなタンパク質の発現および修飾について検討した.αトコフェロールの投与によりMKK3/6およびその下流のp38 MAPキナーゼのリン酸化が亢進した.p38 MAPキナーゼは破骨細胞の成熟や融合に必須の転写因子であるMitfの発現を促進することが知られているが9,10),HEK293細胞においてMitfを過剰に発現させてαトコフェロールにより刺激するとMitfのリン酸化の亢進することが確認された.さらに,クロマチン免疫沈降法による検討によりMitfはDC-STAMPをコードするTm7sf4遺伝子のプロモーター領域に結合することが確認された.さらなる検討において,破骨細胞前駆細胞についてmitf遺伝子のsiRNAによりMitfの発現をノックダウンすると破骨細胞は単核化しαトコフェロールによる多核化の促進作用は消失した.一方,破骨細胞前駆細胞についてレトロウイルスを用いてp38 MAPキナーゼをコードするMapk14遺伝子を過剰に発現させるとαトコフェロールの刺激のないときにも破骨細胞の多核化は促進されていた.以上の結果から,αトコフェロールが破骨細胞においてp38 MAPキナーゼおよびMitfのリン酸化を促進し,つづいて,リン酸化により活性化されたMitfがDC-STAMPをコードするTm7sf4遺伝子のプロモーター領域に結合することで破骨細胞の多核化を促進することが明らかになった(図1).
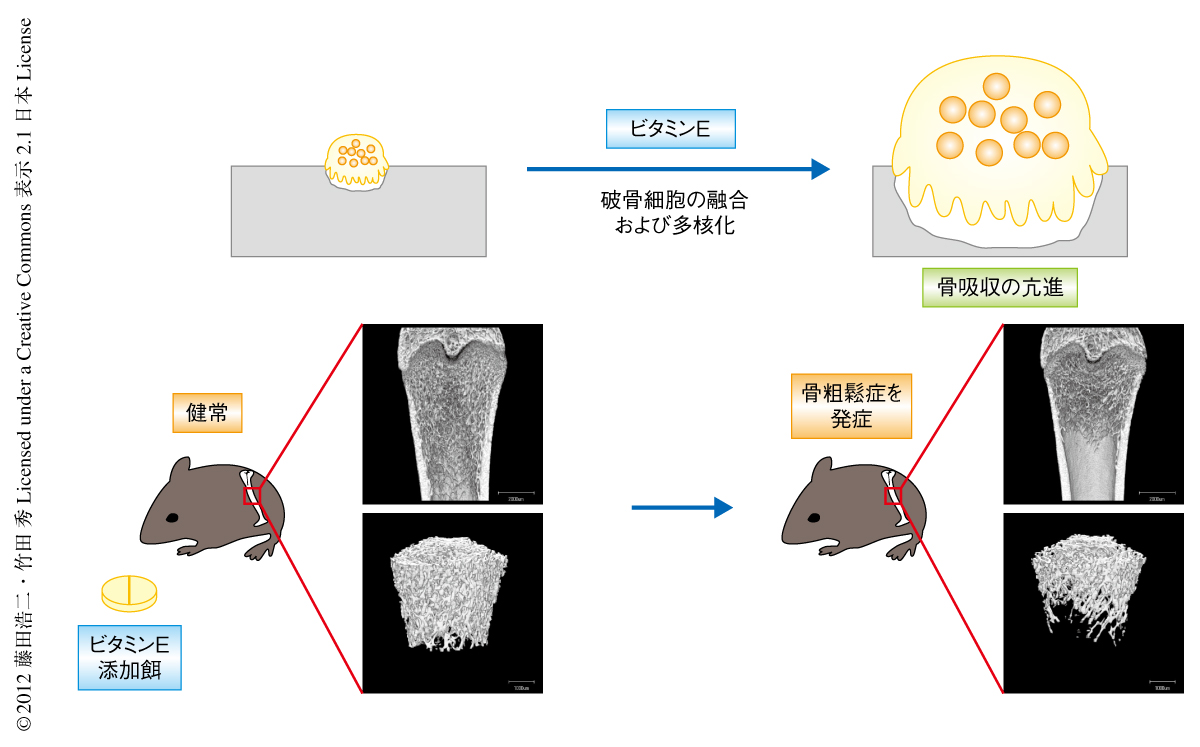
最後に,米国において一般的に摂取されているサプリメントに相当する量から換算し,体重あたり同じ程度の量のαトコフェロールを摂取するよう調製した飼料を野生型マウスや野生型ラットに8週間あたえたところ,骨吸収が亢進し骨量は約20%も減少した(図2).
αトコフェロールが破骨細胞においてp38 MAPキナーゼシグナル伝達経路を介しDC-STAMPをコードするTm7sf4遺伝子の発現を制御し,破骨細胞の融合および多核化を促進することを明らかにした.αトコフェロール添加食をあたえた野生型のマウスやラットでは骨吸収が亢進し骨量が減少した.以上の検討から,ビタミンEの過剰な摂取は骨吸収を刺激して骨量の減少をひき起こし,骨粗鬆症の原因となりうることが示唆された.
略歴:2011年 東京医科歯科大学大学院医歯学総合研究科 修了,同年より米国Mayo Clinic
リサーチフェロー.
竹田 秀(Shu Takeda)
慶應義塾大学医学部 特任准教授.
研究テーマ:骨代謝.
関心事:骨粗鬆症の新規の治療法.
© 2012 藤田浩二・竹田 秀 Licensed under CC 表示 2.1 日本
(1東京医科歯科大学大学院医歯学総合研究科 整形外科学分野,2慶應義塾大学医学部 腎臓内分泌代謝内科)
email:藤田浩二,竹田 秀
DOI: 10.7875/first.author.2012.038
Vitamin E decreases bone mass by stimulating osteoclast fusion.
Koji Fujita, Makiko Iwasaki, Hiroki Ochi, Toru Fukuda, Chengshan Ma, Takeshi Miyamoto, Kimitaka Takitani, Takako Negishi-Koga, Satoko Sunamura, Tatsuhiko Kodama, Hiroshi Takayanagi, Hiroshi Tamai, Shigeaki Kato, Hiroyuki Arai, Kenichi Shinomiya, Hiroshi Itoh, Atsushi Okawa, Shu Takeda
Nature Medicine, 18, 589-594 (2012)
要 約
筆者らは,ビタミンE欠損のマウスモデルであるαトコフェノール輸送タンパク質のノックアウトマウスは骨吸収の減少により高い骨量を示すことを発見した.培養細胞における検討により,αトコフェノールはその抗酸化作用とは独立した機構により破骨細胞の融合を促進することを示した.これは,αトコフェノールがp38 MAPキナーゼのリン酸化を介して転写因子Mitfを活性化し,つづいて,活性化されたMitfが破骨細胞の融合に必須のタンパク質DC-STAMPをコードする遺伝子のプロモーター領域に直接結合することによるものであった.実際に,αトコフェノール輸送タンパク質ノックアウトマウスでみられた高い骨量はDC-STAMPを高発現するトランスジェニックマウスと交配することで改善された.さらに,一般に摂取されているサプリメントに相当する量のαトコフェノールを添加した飼料を野生型のマウスやラットにあたえると骨量が減少した.以上の結果は,ビタミンEは破骨細胞の融合の制御を介した骨量の規定因子のひとつであることを示した.
はじめに
骨の恒常性は骨芽細胞による骨形成と破骨細胞による骨吸収とのバランスにより維持されている1).破骨細胞は単核の前破骨細胞が融合することにより形成される多核の細胞である2).ビタミンA,ビタミンD,ビタミンKなどの脂溶性ビタミンは骨の恒常性の維持にきわめて重要であることが知られていたが3),同じ脂溶性ビタミンであるビタミンEについて骨における役割は不明であった.一般に,ビタミンEは抗酸化作用を示し動脈硬化や加齢に対し効果があると考えられていて,実際,ビタミンEのサプリメントは非常に人気があり米国では人口の10%以上が摂取している4).
ビタミンEにはαトコフェロールやトコトリエノールをはじめとする8種類の異性体が存在する.これらの異性体のうち,生体ではαトコフェロールがおもに活性をもっている.小腸から吸収されたαトコフェロールは肝臓にてαトコフェロール輸送タンパク質と選択的に結合し末梢組織へと供給される.ビタミンE欠損のマウスモデルであるαトコフェロール輸送タンパク質のノックアウトマウスは血中のαトコフェロールの濃度が低下し不妊や歩調の異常を示すが,αトコフェロール添加食の摂取により症状の改善することが知られている5,6).
1.ビタミンE欠損のマウスモデルは骨吸収の亢進による骨量の減少を示す
はじめに,αトコフェノール輸送タンパク質ノックアウトマウスの椎体および大腿骨の骨量を計測したところ,野生型マウスに比べ増加していた.骨形態の計測による検討では,このノックアウトマウスは骨吸収が低下しており,また,個々の破骨細胞のサイズの減少も観察された.同時に,骨吸収のマーカーである血中におけるデオキシピリジノリン値も低下していた.一方で,骨形成に変化は認めなかった.つづいて,αトコフェノール輸送タンパク質ノックアウトマウスにαトコフェロール添加食をあたえると血中のαトコフェロール濃度が回復し,同時に,骨吸収の亢進は低下し骨量も正常化した.このことから,血中のαトコフェロールが骨吸収に影響を及ぼしていることが示唆された.血中のαトコフェロール濃度と破骨細胞との関係を調べるため,マウスの大腿骨から採取した骨髄細胞前駆細胞をM-CSFおよびRANKLで刺激し破骨細胞の分化を誘導する培養系を7),通常のウシの血清ではなくマウスの血清を用いて行った.その結果,αトコフェノール輸送タンパク質ノックアウトマウスの骨髄から得た破骨細胞前駆細胞をこのノックアウトマウスの血清で培養すると破骨細胞の形成は低下したが,野生型マウスの血清で培養すると破骨細胞の形成は正常化した.一方,野生型マウスの骨髄から得た破骨細胞前駆細胞をこのノックアウトマウスの血清で培養すると破骨細胞の形成は低下した.したがって,αトコフェノール輸送タンパク質ノックアウトマウスで認められる骨吸収の異常は破骨細胞の異常によるのではなく,血中のαトコフェロールによる二次的な異常であることが示唆された.以上の検討から,血中のαトコフェロールにより破骨細胞による骨吸収が制御されうることが明らかとなった.
2.αトコフェロールはin vitroにおいて破骨細胞の融合と多核化を促進する
αトコフェロールの破骨細胞に対する効果をin vitroにおいて検討した.野生型マウスの大腿骨から採取した破骨細胞前駆細胞をM-CSFおよびRANKLで刺激し破骨細胞の分化を誘導する培養系において7),培養液にαトコフェロールを添加すると破骨細胞の数が増加すると同時に,破骨細胞の融合が促進されαトコフェロールを添加しないときと比べ多核化が亢進した.一方,αトコフェロールは破骨細胞前駆細胞の増殖,成熟した破骨細胞のアポトーシス,および,骨芽細胞の分化には影響を及ぼさなかった.興味深いことに,破骨細胞の分化の後期,すなわち,RANKLによる刺激の開始ののち48時間~72時間の24時間にのみ,αトコフェロールを添加することで破骨細胞の多核化の亢進が再現された.また,αトコフェロールにより多核化が促進された破骨細胞は骨吸収能も亢進していた.この破骨細胞に対する多核化の亢進は抗酸化作用を示すビタミンEの異性体やほかの抗酸化剤では認められなかったため,αトコフェロールは抗酸化作用とは独立した機構より破骨細胞の多核化を促進するものと考えられた.
3.αトコフェロールはDC-STAMPの発現を介し破骨細胞の融合を制御する
αトコフェロールにより多核化が促進された破骨細胞において破骨細胞に関連する遺伝子の発現を検討したところ,破骨細胞の分化の後期におけるマーカー遺伝子であるTrap遺伝子やCtsk遺伝子の発現上昇を認めた.さらに,細胞融合にかかわる遺伝子の発現を検討すると,破骨細胞の融合に必須のタンパク質DC-STAMP 8) をコードするTm7sf4遺伝子の発現上昇を認めた.一方,αトコフェノール輸送タンパク質ノックアウトマウスの骨ではTm7sf4遺伝子とTrapの発現が低下していた.この結果から,αトコフェロールはDC-STAMPの発現を介し破骨細胞の融合を制御している可能性が考えられた.
そこで,野生型マウスから得た破骨細胞前駆細胞について,Tm7sf4遺伝子のsiRNAによりDC-STAMPの発現をノックダウンしたうえで破骨細胞の分化を誘導したところ,破骨細胞は単核化しαトコフェロールによる多核化の促進作用は消失した.同様に,DC-STAMPノックアウトマウスの骨髄をin vitroにおいて分化させた破骨細胞においてもαトコフェロールによる破骨細胞の多核化の促進作用は消失していた.一方,レトロウイルスを用いてTm7sf4遺伝子を破骨前駆細胞に過剰に発現させ破骨細胞の分化を誘導すると,αトコフェロールによる刺激がなくても破骨細胞の多核化が促進された.さらに,αトコフェノール輸送タンパク質ノックアウトマウスにDC-STAMPを高発現するトランスジェニックマウスを交配させると,このノックアウトマウスでみられた骨吸収の低下や骨量の増加といった表現型は改善した.
こうして,αトコフェロールが破骨細胞においてDC-STAMPの発現を介し破骨細胞の多核化を制御していることが明らかにされた.
4.αトコフェロールはp38およびMitfのリン酸化を介しDC-STAMPの発現を制御する
αトコフェロールの刺激による破骨細胞におけるシグナル伝達経路を明らかにするため,破骨細胞前駆細胞をαトコフェロールにより刺激したときのさまざまなタンパク質の発現および修飾について検討した.αトコフェロールの投与によりMKK3/6およびその下流のp38 MAPキナーゼのリン酸化が亢進した.p38 MAPキナーゼは破骨細胞の成熟や融合に必須の転写因子であるMitfの発現を促進することが知られているが9,10),HEK293細胞においてMitfを過剰に発現させてαトコフェロールにより刺激するとMitfのリン酸化の亢進することが確認された.さらに,クロマチン免疫沈降法による検討によりMitfはDC-STAMPをコードするTm7sf4遺伝子のプロモーター領域に結合することが確認された.さらなる検討において,破骨細胞前駆細胞についてmitf遺伝子のsiRNAによりMitfの発現をノックダウンすると破骨細胞は単核化しαトコフェロールによる多核化の促進作用は消失した.一方,破骨細胞前駆細胞についてレトロウイルスを用いてp38 MAPキナーゼをコードするMapk14遺伝子を過剰に発現させるとαトコフェロールの刺激のないときにも破骨細胞の多核化は促進されていた.以上の結果から,αトコフェロールが破骨細胞においてp38 MAPキナーゼおよびMitfのリン酸化を促進し,つづいて,リン酸化により活性化されたMitfがDC-STAMPをコードするTm7sf4遺伝子のプロモーター領域に結合することで破骨細胞の多核化を促進することが明らかになった(図1).
最後に,米国において一般的に摂取されているサプリメントに相当する量から換算し,体重あたり同じ程度の量のαトコフェロールを摂取するよう調製した飼料を野生型マウスや野生型ラットに8週間あたえたところ,骨吸収が亢進し骨量は約20%も減少した(図2).
おわりに
αトコフェロールが破骨細胞においてp38 MAPキナーゼシグナル伝達経路を介しDC-STAMPをコードするTm7sf4遺伝子の発現を制御し,破骨細胞の融合および多核化を促進することを明らかにした.αトコフェロール添加食をあたえた野生型のマウスやラットでは骨吸収が亢進し骨量が減少した.以上の検討から,ビタミンEの過剰な摂取は骨吸収を刺激して骨量の減少をひき起こし,骨粗鬆症の原因となりうることが示唆された.
文 献
- Karsenty, G., Kronenberg, H. M. & Settembre, C.: Genetic control of bone formation. Annu. Rev. Cell Dev. Biol., 25, 629-648 (2009)[PubMed]
- Teitelbaum, S. L. & Ross, F. P.: Genetic regulation of osteoclast development and function. Nat. Rev. Genet., 4, 638-649 (2003)[PubMed]
- Cockayne, S., Adamson, J., Lanham-New, S. et al.: Vitamin K and the prevention of fractures: systematic review and meta-analysis of randomized controlled trials. Arch. Intern. Med., 166, 1256-1261 (2006)[PubMed]
- Radimer, K., Bindewald, B., Hughes, J. et al.: Dietary supplement use by US adults: data from the National Health and Nutrition Examination Survey, 1999-2000. Am. J. Epidemiol., 160, 339-349 (2004)[PubMed]
- Jishage, K., Arita, M., Igarashi, K. et al.: α-tocopherol transfer protein is important for the normal development of placental labyrinthine trophoblasts in mice. J. Biol. Chem., 276, 1669-1672 (2001)[PubMed]
- Yokota, T., Igarashi, K., Uchihara, T. et al.: Delayed-onset ataxia in mice lacking α-tocopherol transfer protein: model for neuronal degeneration caused by chronic oxidative stress. Proc. Natl. Acad. Sci. USA, 98, 15185-15190 (2001)[PubMed]
- Sato, S., Hanada, R., Kimura, A. et al.: Central control of bone remodeling by neuromedin U. Nat. Med., 13, 1234-1240 (2007)[PubMed]
- Yagi, M., Miyamoto, T., Sawatani, Y. et al.: DC-STAMP is essential for cell-cell fusion in osteoclasts and foreign body giant cells. J. Exp. Med., 202, 345-351 (2005)[PubMed]
- Greenblatt, M. B., Shim, J. H., Zou, W. et al.: The p38 MAPK pathway is essential for skeletogenesis and bone homeostasis in mice. J. Clin. Invest., 120, 2457-2473 (2010)[PubMed]
- Steingrimsson, E., Tessarollo, L., Pathak, B. et al.: Mitf and Tfe3, two members of the Mitf-Tfe family of bHLH-Zip transcription factors, have important but functionally redundant roles in osteoclast development. Proc. Natl. Acad. Sci. USA, 99, 4477-4482 (2002)[PubMed]
著者プロフィール
略歴:2011年 東京医科歯科大学大学院医歯学総合研究科 修了,同年より米国Mayo Clinic
リサーチフェロー.
竹田 秀(Shu Takeda)
慶應義塾大学医学部 特任准教授.
研究テーマ:骨代謝.
関心事:骨粗鬆症の新規の治療法.
© 2012 藤田浩二・竹田 秀 Licensed under CC 表示 2.1 日本