脂質センサーGPR120の機能不全はマウスとヒトの両方で肥満をひき起こす
市村敦彦・平澤 明・辻本豪三
(京都大学大学院薬学研究科 ゲノム創薬科学分野)
email:市村敦彦,平澤 明,辻本豪三
DOI: 10.7875/first.author.2012.034
Dysfunction of lipid sensor GPR120 leads to obesity in both mouse and human.
Atsuhiko Ichimura, Akira Hirasawa, Odile Poulain-Godefroy, Amélie Bonnefond, Takafumi Hara, Loïc Yengo, Ikuo Kimura, Audrey Leloire, Ning Liu, Keiko Iida, Hélène Choquet, Philippe Besnard, Cécile Lecoeur, Sidonie Vivequin, Kumiko Ayukawa, Masato Takeuchi, Kentaro Ozawa, Maithé Tauber, Claudio Maffeis, Anita Morandi, Raffaella Buzzetti, Paul Elliott, Anneli Pouta, Marjo-Riitta Jarvelin, Antje Körner, Wieland Kiess, Marie Pigeyre, Roberto Caiazzo, Wim Van Hul, Luc Van Gaal, Fritz Horber, Beverley Balkau, Claire Lévy-Marchal, Konstantinos Rouskas, Anastasia Kouvatsi, Johannes Hebebrand, Anke Hinney, Andre Scherag, François Pattou, David Meyre, Taka-aki Koshimizu, Isabelle Wolowczuk, Gozoh Tsujimoto, Philippe Froguel
Nature, 483, 350-354 (2012)
肥満とそれにともなうさまざまな糖や脂質の代謝異常,脂肪肝といった症状が複合的に発症する状態はメタボリックシンドロームとよばれ,世界的に大きな問題となっている.メタボリックシンドロームの最大の要因は食生活にあると考えられており,わが国においても,近年,急速に進行した食生活の欧米化により動物性食品などの脂質が多量に摂取されるようになった.その結果,余剰のエネルギーが蓄積し肥満や糖尿病といった生活習慣病を発症する原因となっている.一方で,遊離の脂肪酸を天然のリガンドとする新たな一群のGタンパク質共役受容体ファミリーの発見により,脂肪酸がシグナル伝達物質としてはたらくことが明らかになった.筆者らはこれまでに,Gタンパク質共役受容体のひとつGPR120が遊離脂肪酸を内因性のリガンドとする脂肪酸の受容体であることを同定し,食事に由来する脂肪酸を感知しインクレチンホルモンの分泌を介して糖代謝を制御していることを見い出していた.これらの知見や,GPR120が脂肪組織にも発現する脂肪酸受容体であることから,GPR120の脂質代謝や代謝性の疾患への関与が予想された.他方,メタボリックシンドロームの発症において,環境要因としての食生活にくわえ遺伝的な要因が大きく寄与していることが指摘されていたが,食生活と遺伝的な素因との直接的な関係はこれまでに報告されていなかった.この研究では,脂肪酸受容体であるGタンパク質共役受容体GPR120に注目し,その機能と代謝性疾患とのかかわりについてマウスにおける機能解析を実施すると同時に,ヒトにおける遺伝子解析を行うことにより,GPR120は全身の糖脂質の代謝を制御する脂質センサーであることを見い出した.
食事に由来する脂質より得られる特定の脂肪酸は生体において必須のエネルギー源として利用される.一方で,近年,遊離の脂肪酸を天然のリガンドとする新たな一群のGタンパク質共役受容体ファミリーが発見されたことにより,脂肪酸は単なる栄養因子として利用されるだけでなく,シグナル伝達物質としてもはたらくことが明らかになった1-5).筆者らは,2005年,Gタンパク質共役受容体のひとつGPR120が遊離の不飽和長鎖脂肪酸の受容体であることを見い出した2).そして,腸管において高発現するGPR120は食事に由来する遊離脂肪酸により活性化されることでインクレチンホルモンであるGLP-1やCCKの分泌を促進し2,6),血糖の制御や食欲の調節を担うことを明らかにした.また,前駆脂肪細胞株である3T3-L1細胞を用いた検討から,GPR120は脂肪細胞の分化に必須であり脂肪細胞の成熟を促進するタンパク質として機能していることを報告した.これらの知見から,GPR120が全身の代謝に対しなんらかの役割をはたしていることが推定された.そこでこの研究では,GPR120が全身代謝においてはたす役割を明らかにするためGPR120ノックアウトマウスを用いた実験を行った.
GPR120ノックアウトマウスは通常食(13%脂肪)では野生型マウスと体重に差はなかったが,高脂肪食(60%脂肪)を負荷すると体重が有意に増加した(約10%の増加).エネルギーの消費量を野生型マウスとGPR120ノックアウトマウスとで比較したところ,行動量に差はなかったのに対し,9~10週齢においてGPR120ノックアウトマウスにおける明期(非活動時間)でのエネルギー消費量は有意に小さかった.つまり,GPR120ノックアウトマウスは特に若齢期における基礎代謝量が小さいため野生型マウスより肥満するものと考えられた.そこで,この体重の増加がどの組織の増加に起因しているのか調べた.その結果,体重の増加は皮下および内臓の脂肪組織と肝臓における重量の増加が原因であることがわかった.脂肪組織と肝臓につき組織切片を詳細に観察したところ,高脂肪食を負荷したGPR120ノックアウトマウスは野生型マウスに比べ脂肪細胞が肥大しており,脂肪組織へのマクロファージの浸潤の多いことがわかった.また,肝臓においてはOil Red O染色における陽性の部分と単位組織あたりの中性脂肪の含量が顕著に増加しており,いわゆる脂肪肝を呈していることが判明した.血中のパラメーターを比較したところコレステロールの増加と肝障害マーカーの顕著な上昇が認められた.以上の結果から,GPR120の欠損と高脂肪食の負荷により脂肪の肥大と脂肪肝をともなう肥満の惹起されることがわかった.
GPR120ノックアウトマウスにおける糖代謝について調べた.高脂肪食を負荷したGPR120ノックアウトマウスは野生型マウスに比べ空腹時血糖値とインスリン値がどちらも有意に高かった.また,インスリン負荷試験とグルコース負荷試験の結果からインスリン感受性と耐糖能がともに野生型マウスに比べ有意に低下していることがわかった.膵臓切片の観察からGPR120ノックアウトマウスでは膵島が有意に増大しており,インスリン感受性に対応するためインスリンの産生量の増加していることが示唆された.そこで,インスリン感受性の低下の原因を探るため,インスリンを静脈に注入して5分のちの白色脂肪組織,肝臓,骨格筋におけるインスリンに依存性のAKTのリン酸化について調べた.その結果,白色脂肪組織と肝臓においてインスリンシグナルの顕著な減弱がみられた.以上の結果から,GPR120の欠損と高脂肪食の負荷により末梢組織におけるインスリンシグナルの減弱に起因する糖代謝の異常の惹起されることがわかった.
さらに詳細な分子機構を解明するため,GPR120ノックアウトマウスの白色脂肪組織と肝臓における遺伝子発現をマイクロアレイにより網羅的に定量解析し野生型マウスと比較した.その結果,脂肪組織において,脂肪細胞分化マーカー遺伝子の発現低下,脂肪酸合成律速酵素遺伝子の発現低下,インスリンシグナル関連遺伝子の発現低下,および,炎症関連遺伝子の発現亢進がみられた.また,肝臓において,脂肪酸合成律速酵素遺伝子および脂肪酸トランスポーター遺伝子の発現亢進がみられた.マイクロアレイによる解析において差のあった遺伝子につき定量PCR法およびウェスタンブロット法によるmRNAレベルおよびタンパク質レベルでの発現解析を行った.その結果,白色脂肪組織において,脂肪分化マーカー遺伝子であるFabp4遺伝子,脂肪合成関連遺伝子であるScd1遺伝子,インスリンシグナル関連遺伝子の発現低下が,肝臓において,Scd1遺伝子および脂肪酸トランスポーター遺伝子の発現亢進,インスリンシグナル関連遺伝子の発現低下を確認した.また,GPR120ノックアウトマウスに由来する胎仔線維芽細胞を脂肪細胞に分化誘導して野生型の細胞と比較することにより,GPR120の欠損により脂肪細胞の分化の抑制されることがex vivoでの実験系によっても示された.GPR120は前駆脂肪細胞株である3T3-L1細胞を用いたin vitroでの実験からも脂肪細胞への分化を正に制御することが示されており7),一致した結果が得られた.これらの結果から,GPR120の欠損と高脂肪食の負荷により,白色脂肪組織においては分化の遅延と脂肪酸の合成の減少が,肝臓においては脂質の合成および取り込みの亢進が起こっており,この2つの組織におけるインスリンシグナルの減弱はインスリンシグナル関連タンパク質の発現低下に起因することが示唆された.
白色脂肪組織においてはGPR120が内因性に発現しており,その欠損が脂肪細胞自体の成熟をさまたげたことが一連の遺伝子発現の変化の原因と考えられた.一方で,肝臓においてはそもそも内因性のGPR120の発現がほとんどみられないため遺伝子発現の変化は脂肪組織における変化が間接的に影響を及ぼしたものと推定した.ここで,脂肪組織において発現は低下しているが肝臓においては顕著に発現の亢進している脂肪酸合成律速酵素SCD1に注目した.このSCD1はΔ9不飽和化酵素に分類され,炭素鎖の長さが16および18の飽和脂肪酸に対しΔ9位に不飽和結合を導入し,パルミトレイン酸およびオレイン酸を合成する酵素である8).特に,遊離のパルミトレイン酸は脂肪組織でのみ合成および放出され,脂質ホルモンとして肝臓における遺伝子発現を制御することが報告されていた9).そこで,白色脂肪組織,肝臓,血漿において構成脂肪と遊離脂肪の両者について,その組成を網羅的に解析した.その結果,高脂肪食を負荷したGPR120ノックアウトマウスでは肝臓の構成脂肪においてオレイン酸が増加しており,SCD1の酵素活性を示すC18:1対C18:0比が有意に増加していた.この結果は,さきの肝臓におけるScd1遺伝子の発現亢進と一致していた.さらに,白色脂肪組織におけるScd1遺伝子の発現低下に一致して,GPR120ノックアウトマウスでは白色脂肪細胞および血漿において遊離のパルミトレイン酸が減少していた.GPR120ノックアウトマウスに対し6時間にわたりパルミトレイン酸を注入すると肝臓におけるScd1遺伝子の発現が抑えられたことから,肝臓におけるScd1遺伝子の発現亢進は白色脂肪組織におけるScd1遺伝子の発現低下により脂質ホルモンであるパルミトレイン酸が減少したことが原因であると考えられた.以上の一連の解析から,GPR120は脂肪細胞の分化と成熟を正常に保つことにより全身の脂質代謝を制御するセンサーとしての役割をはたしており,その異常が高脂肪食による肥満や脂肪肝といった症状をひき起こすことが示された.
マウスにおける解析からGPR120がヒトの肥満の発症やエネルギー代謝においても重要なはたらきを担っていることが示唆された.そこで,ヒトにおいてGPR120が肥満に関与しているかどうかを検討した.まず,肥満者と正常者の皮下および内臓脂肪におけるGPR120の発現を比較したところ,肥満者において有意に亢進していた.さらに,312名のフランス人非血縁高度肥満者においてGPR120遺伝子の4つのエキソンの塩基配列を調べた.その結果,2つの非同義変異,270番目のArg残基のHis残基への変異と,67番目のArg残基のCys残基への変異を見い出した.これら2つの変異が肥満と関連しているかどうかさらに検証するため,GPR120遺伝子の遺伝子型を6942名の肥満者と7654名の非肥満者とで比較した.その結果,肥満者において270番目のArg残基のHis残基への変異の出現頻度が有意に高く,この変異が肥満と強く相関していることが明らかになった.以上の結果から,GPR120において270番目のArg残基のHis残基への変異がその機能に影響を及ぼしていることが考えられた.
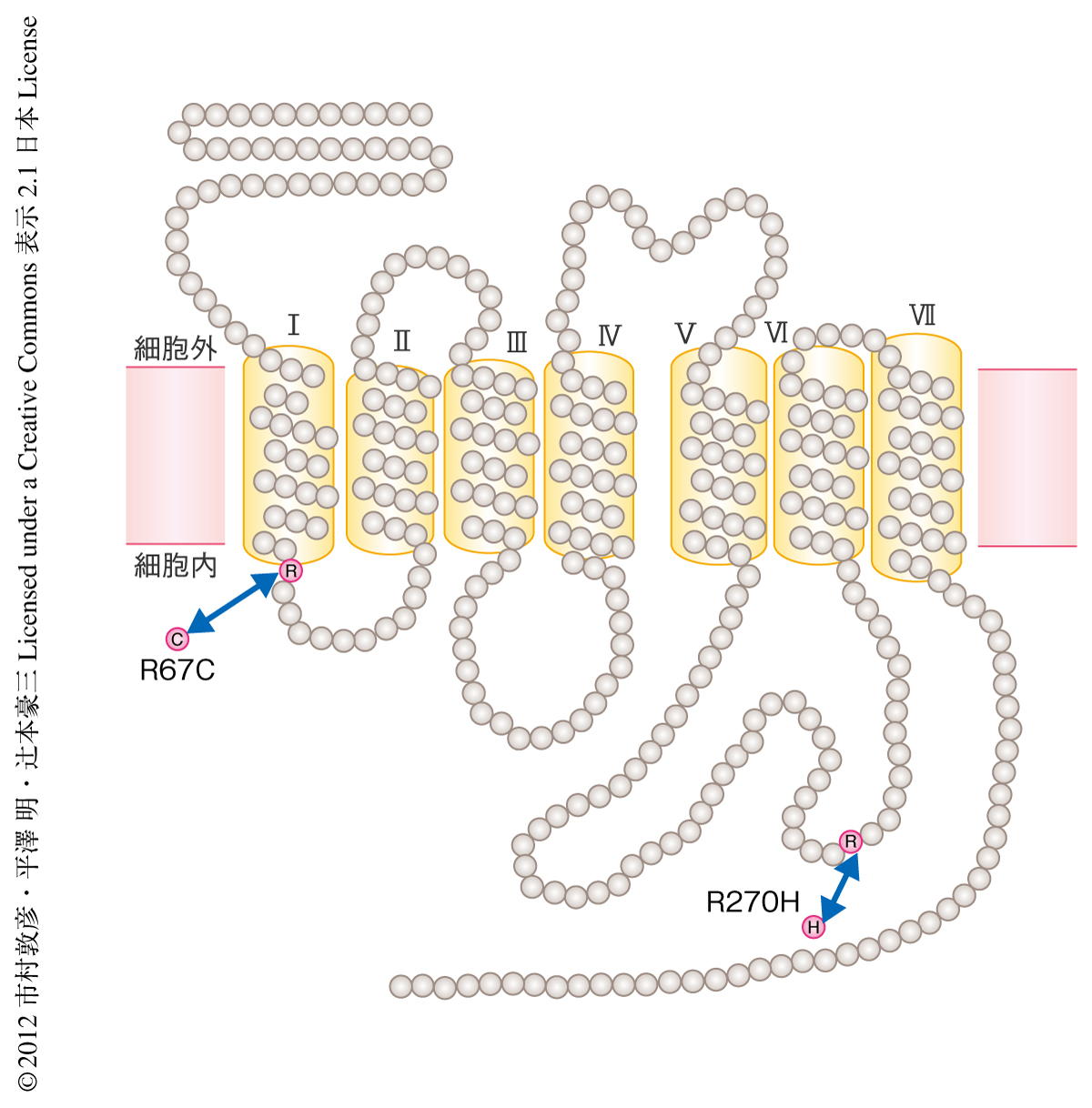
GPR120において,67番目のArg残基のCys残基への変異は1回膜貫通の直後の細胞内第1ループに,270番目のArg残基のHis残基への変異は細胞内第3ループに存在しており,いずれの変異もGタンパク質との共役やシグナル伝達に影響をあたえている可能性が考えられた(図1).そこで,この2つの変異がGPR120の機能に及ぼす影響を検討するため,これらの変異体を安定に発現したヒト胎児腎細胞株であるHEK293細胞を用いて内因性のアゴニストであるαリノレン酸に対する細胞内Ca2+応答を比較した.その結果,細胞内Ca2+応答は270番目のArg残基のHis残基への変異をもつGPR120においてほぼ完全に失われた.また,ヒト腸管細胞株であるNCI-H716細胞に270番目のArg残基のHis残基への変異をもつGPR120を強制発現させインクレチンホルモンであるGLP-1の分泌を調べた.その結果,野生型GPR120の強制発現によりαリノレン酸の刺激に応答しGLP-1が分泌されたのに対し,変異型GPR120ではGLP-1の分泌は惹起されなかった.これらの結果から,GPR120において270番目のArg残基のHis残基への変異により脂肪酸に対するシグナル伝達能が失われ生理的な活性もなくなることが示された.
GPR120において270番目のArg残基のHis残基への変異はヘテロ変異であっても肥満と相関していた.そこで,HEK293細胞に野生型のGPR120と270番目のArg残基のHis残基への変異をもつGPR120とを同時に発現させた場合のαリノレン酸の刺激による細胞内Ca2+応答を調べた.その結果,野生型GPR120のみを発現させた細胞に比べ,野生型GPR120と変異型GPR120とを同時に発現させた細胞では細胞内Ca2+応答が有意に低下した.以上の結果から,GPR120において270番目のArg残基のHis残基への変異はヘテロ変異であっても遊離の長鎖脂肪酸によるシグナル伝達を阻害しその機能を抑制することが示された.
270番目のArg残基のHis残基への変異型のGPR120をもつ肥満者10名と野生型のGPR120をもつ肥満者とを比較したところ,脂肪細胞分化マーカー遺伝子であるFABP4遺伝子の内臓脂肪における発現が変異型GPR120をもつ肥満者において有意に低下していた.この結果は,GPR120ノックアウトマウスにおける脂肪組織での遺伝子発現の変化と一致していた.
以上のヒトおよびマウスにおける一連の解析から,脂肪酸受容体であるGタンパク質共役受容体GPR120が脂肪センサーとして正常に機能することで,脂質の生合成の制御をつうじエネルギー代謝のバランスを保っていることが明らかになった.
この研究により,Gタンパク質共役受容体GPR120が環境要因である食事に由来する脂肪を感知して全身代謝を調節する遺伝的な要因であることが明らかになった(図2).また,この研究の結果は,GPR120の機能不全がヒトにおいても肥満や糖尿病に代表されるメタボリックシンドロームのリスクとなることを示した.これらの知見は,食事に由来する栄養状態である外部環境と生体の内部のホメオスタシスとのコミュニケーションを担う分子機構の存在することを示していた.一方で,現時点では,GPR120における270番目のArg残基のHis残基への変異がどのような分子機構によりその活性を失わせているのか詳細は不明であり,さらなる解析が必要である.また,日本人におけるこの変異が西欧人と同様に肥満リスクとなるかという遺伝学的な解析も待たれる.これらさらに詳細な解析を進めることで,将来的には,あらかじめGPR120遺伝子の遺伝子型を知ることにより脂質の摂取量を考慮するといった遺伝子診断にもとづくテーラーメイド医療への応用や,GPR120を標的としてその機能を制御する薬剤を開発することにより,代謝性疾患の予防や治療を実現したいと考えている.
略歴:2011年 京都大学大学院薬学研究科 修了,同年より東北大学大学院医学系研究科 助教.
研究テーマ:Gタンパク質共役受容体やプロテアーゼ阻害タンパク質を標的とする低分子化合物を用いた創薬の基礎研究.
抱負:新しい現象やこれまでになかった概念にもとづいた創薬に基礎研究により貢献したい.
平澤 明(Akira Hirasawa)
京都大学大学院薬学研究科 准教授.
辻本 豪三(Gozoh Tsujimoto)
京都大学大学院薬学研究科 教授.
研究室URL:http://gdds.pharm.kyoto-u.ac.jp/
© 2012 市村敦彦・平澤 明・辻本豪三 Licensed under CC 表示 2.1 日本
(京都大学大学院薬学研究科 ゲノム創薬科学分野)
email:市村敦彦,平澤 明,辻本豪三
DOI: 10.7875/first.author.2012.034
Dysfunction of lipid sensor GPR120 leads to obesity in both mouse and human.
Atsuhiko Ichimura, Akira Hirasawa, Odile Poulain-Godefroy, Amélie Bonnefond, Takafumi Hara, Loïc Yengo, Ikuo Kimura, Audrey Leloire, Ning Liu, Keiko Iida, Hélène Choquet, Philippe Besnard, Cécile Lecoeur, Sidonie Vivequin, Kumiko Ayukawa, Masato Takeuchi, Kentaro Ozawa, Maithé Tauber, Claudio Maffeis, Anita Morandi, Raffaella Buzzetti, Paul Elliott, Anneli Pouta, Marjo-Riitta Jarvelin, Antje Körner, Wieland Kiess, Marie Pigeyre, Roberto Caiazzo, Wim Van Hul, Luc Van Gaal, Fritz Horber, Beverley Balkau, Claire Lévy-Marchal, Konstantinos Rouskas, Anastasia Kouvatsi, Johannes Hebebrand, Anke Hinney, Andre Scherag, François Pattou, David Meyre, Taka-aki Koshimizu, Isabelle Wolowczuk, Gozoh Tsujimoto, Philippe Froguel
Nature, 483, 350-354 (2012)
要 約
肥満とそれにともなうさまざまな糖や脂質の代謝異常,脂肪肝といった症状が複合的に発症する状態はメタボリックシンドロームとよばれ,世界的に大きな問題となっている.メタボリックシンドロームの最大の要因は食生活にあると考えられており,わが国においても,近年,急速に進行した食生活の欧米化により動物性食品などの脂質が多量に摂取されるようになった.その結果,余剰のエネルギーが蓄積し肥満や糖尿病といった生活習慣病を発症する原因となっている.一方で,遊離の脂肪酸を天然のリガンドとする新たな一群のGタンパク質共役受容体ファミリーの発見により,脂肪酸がシグナル伝達物質としてはたらくことが明らかになった.筆者らはこれまでに,Gタンパク質共役受容体のひとつGPR120が遊離脂肪酸を内因性のリガンドとする脂肪酸の受容体であることを同定し,食事に由来する脂肪酸を感知しインクレチンホルモンの分泌を介して糖代謝を制御していることを見い出していた.これらの知見や,GPR120が脂肪組織にも発現する脂肪酸受容体であることから,GPR120の脂質代謝や代謝性の疾患への関与が予想された.他方,メタボリックシンドロームの発症において,環境要因としての食生活にくわえ遺伝的な要因が大きく寄与していることが指摘されていたが,食生活と遺伝的な素因との直接的な関係はこれまでに報告されていなかった.この研究では,脂肪酸受容体であるGタンパク質共役受容体GPR120に注目し,その機能と代謝性疾患とのかかわりについてマウスにおける機能解析を実施すると同時に,ヒトにおける遺伝子解析を行うことにより,GPR120は全身の糖脂質の代謝を制御する脂質センサーであることを見い出した.
はじめに
食事に由来する脂質より得られる特定の脂肪酸は生体において必須のエネルギー源として利用される.一方で,近年,遊離の脂肪酸を天然のリガンドとする新たな一群のGタンパク質共役受容体ファミリーが発見されたことにより,脂肪酸は単なる栄養因子として利用されるだけでなく,シグナル伝達物質としてもはたらくことが明らかになった1-5).筆者らは,2005年,Gタンパク質共役受容体のひとつGPR120が遊離の不飽和長鎖脂肪酸の受容体であることを見い出した2).そして,腸管において高発現するGPR120は食事に由来する遊離脂肪酸により活性化されることでインクレチンホルモンであるGLP-1やCCKの分泌を促進し2,6),血糖の制御や食欲の調節を担うことを明らかにした.また,前駆脂肪細胞株である3T3-L1細胞を用いた検討から,GPR120は脂肪細胞の分化に必須であり脂肪細胞の成熟を促進するタンパク質として機能していることを報告した.これらの知見から,GPR120が全身の代謝に対しなんらかの役割をはたしていることが推定された.そこでこの研究では,GPR120が全身代謝においてはたす役割を明らかにするためGPR120ノックアウトマウスを用いた実験を行った.
1.GPR120の欠損が代謝にあたえる影響
GPR120ノックアウトマウスは通常食(13%脂肪)では野生型マウスと体重に差はなかったが,高脂肪食(60%脂肪)を負荷すると体重が有意に増加した(約10%の増加).エネルギーの消費量を野生型マウスとGPR120ノックアウトマウスとで比較したところ,行動量に差はなかったのに対し,9~10週齢においてGPR120ノックアウトマウスにおける明期(非活動時間)でのエネルギー消費量は有意に小さかった.つまり,GPR120ノックアウトマウスは特に若齢期における基礎代謝量が小さいため野生型マウスより肥満するものと考えられた.そこで,この体重の増加がどの組織の増加に起因しているのか調べた.その結果,体重の増加は皮下および内臓の脂肪組織と肝臓における重量の増加が原因であることがわかった.脂肪組織と肝臓につき組織切片を詳細に観察したところ,高脂肪食を負荷したGPR120ノックアウトマウスは野生型マウスに比べ脂肪細胞が肥大しており,脂肪組織へのマクロファージの浸潤の多いことがわかった.また,肝臓においてはOil Red O染色における陽性の部分と単位組織あたりの中性脂肪の含量が顕著に増加しており,いわゆる脂肪肝を呈していることが判明した.血中のパラメーターを比較したところコレステロールの増加と肝障害マーカーの顕著な上昇が認められた.以上の結果から,GPR120の欠損と高脂肪食の負荷により脂肪の肥大と脂肪肝をともなう肥満の惹起されることがわかった.
2.GPR120ノックアウトマウスにおける糖代謝の異常
GPR120ノックアウトマウスにおける糖代謝について調べた.高脂肪食を負荷したGPR120ノックアウトマウスは野生型マウスに比べ空腹時血糖値とインスリン値がどちらも有意に高かった.また,インスリン負荷試験とグルコース負荷試験の結果からインスリン感受性と耐糖能がともに野生型マウスに比べ有意に低下していることがわかった.膵臓切片の観察からGPR120ノックアウトマウスでは膵島が有意に増大しており,インスリン感受性に対応するためインスリンの産生量の増加していることが示唆された.そこで,インスリン感受性の低下の原因を探るため,インスリンを静脈に注入して5分のちの白色脂肪組織,肝臓,骨格筋におけるインスリンに依存性のAKTのリン酸化について調べた.その結果,白色脂肪組織と肝臓においてインスリンシグナルの顕著な減弱がみられた.以上の結果から,GPR120の欠損と高脂肪食の負荷により末梢組織におけるインスリンシグナルの減弱に起因する糖代謝の異常の惹起されることがわかった.
3.GPR120ノックアウトマウスにおける遺伝子発現の網羅的な解析
さらに詳細な分子機構を解明するため,GPR120ノックアウトマウスの白色脂肪組織と肝臓における遺伝子発現をマイクロアレイにより網羅的に定量解析し野生型マウスと比較した.その結果,脂肪組織において,脂肪細胞分化マーカー遺伝子の発現低下,脂肪酸合成律速酵素遺伝子の発現低下,インスリンシグナル関連遺伝子の発現低下,および,炎症関連遺伝子の発現亢進がみられた.また,肝臓において,脂肪酸合成律速酵素遺伝子および脂肪酸トランスポーター遺伝子の発現亢進がみられた.マイクロアレイによる解析において差のあった遺伝子につき定量PCR法およびウェスタンブロット法によるmRNAレベルおよびタンパク質レベルでの発現解析を行った.その結果,白色脂肪組織において,脂肪分化マーカー遺伝子であるFabp4遺伝子,脂肪合成関連遺伝子であるScd1遺伝子,インスリンシグナル関連遺伝子の発現低下が,肝臓において,Scd1遺伝子および脂肪酸トランスポーター遺伝子の発現亢進,インスリンシグナル関連遺伝子の発現低下を確認した.また,GPR120ノックアウトマウスに由来する胎仔線維芽細胞を脂肪細胞に分化誘導して野生型の細胞と比較することにより,GPR120の欠損により脂肪細胞の分化の抑制されることがex vivoでの実験系によっても示された.GPR120は前駆脂肪細胞株である3T3-L1細胞を用いたin vitroでの実験からも脂肪細胞への分化を正に制御することが示されており7),一致した結果が得られた.これらの結果から,GPR120の欠損と高脂肪食の負荷により,白色脂肪組織においては分化の遅延と脂肪酸の合成の減少が,肝臓においては脂質の合成および取り込みの亢進が起こっており,この2つの組織におけるインスリンシグナルの減弱はインスリンシグナル関連タンパク質の発現低下に起因することが示唆された.
4.GPR120ノックアウトマウスにおける脂質の組成の網羅的な分析
白色脂肪組織においてはGPR120が内因性に発現しており,その欠損が脂肪細胞自体の成熟をさまたげたことが一連の遺伝子発現の変化の原因と考えられた.一方で,肝臓においてはそもそも内因性のGPR120の発現がほとんどみられないため遺伝子発現の変化は脂肪組織における変化が間接的に影響を及ぼしたものと推定した.ここで,脂肪組織において発現は低下しているが肝臓においては顕著に発現の亢進している脂肪酸合成律速酵素SCD1に注目した.このSCD1はΔ9不飽和化酵素に分類され,炭素鎖の長さが16および18の飽和脂肪酸に対しΔ9位に不飽和結合を導入し,パルミトレイン酸およびオレイン酸を合成する酵素である8).特に,遊離のパルミトレイン酸は脂肪組織でのみ合成および放出され,脂質ホルモンとして肝臓における遺伝子発現を制御することが報告されていた9).そこで,白色脂肪組織,肝臓,血漿において構成脂肪と遊離脂肪の両者について,その組成を網羅的に解析した.その結果,高脂肪食を負荷したGPR120ノックアウトマウスでは肝臓の構成脂肪においてオレイン酸が増加しており,SCD1の酵素活性を示すC18:1対C18:0比が有意に増加していた.この結果は,さきの肝臓におけるScd1遺伝子の発現亢進と一致していた.さらに,白色脂肪組織におけるScd1遺伝子の発現低下に一致して,GPR120ノックアウトマウスでは白色脂肪細胞および血漿において遊離のパルミトレイン酸が減少していた.GPR120ノックアウトマウスに対し6時間にわたりパルミトレイン酸を注入すると肝臓におけるScd1遺伝子の発現が抑えられたことから,肝臓におけるScd1遺伝子の発現亢進は白色脂肪組織におけるScd1遺伝子の発現低下により脂質ホルモンであるパルミトレイン酸が減少したことが原因であると考えられた.以上の一連の解析から,GPR120は脂肪細胞の分化と成熟を正常に保つことにより全身の脂質代謝を制御するセンサーとしての役割をはたしており,その異常が高脂肪食による肥満や脂肪肝といった症状をひき起こすことが示された.
5.ヒト肥満者におけるGPR120遺伝子の変異の解析
マウスにおける解析からGPR120がヒトの肥満の発症やエネルギー代謝においても重要なはたらきを担っていることが示唆された.そこで,ヒトにおいてGPR120が肥満に関与しているかどうかを検討した.まず,肥満者と正常者の皮下および内臓脂肪におけるGPR120の発現を比較したところ,肥満者において有意に亢進していた.さらに,312名のフランス人非血縁高度肥満者においてGPR120遺伝子の4つのエキソンの塩基配列を調べた.その結果,2つの非同義変異,270番目のArg残基のHis残基への変異と,67番目のArg残基のCys残基への変異を見い出した.これら2つの変異が肥満と関連しているかどうかさらに検証するため,GPR120遺伝子の遺伝子型を6942名の肥満者と7654名の非肥満者とで比較した.その結果,肥満者において270番目のArg残基のHis残基への変異の出現頻度が有意に高く,この変異が肥満と強く相関していることが明らかになった.以上の結果から,GPR120において270番目のArg残基のHis残基への変異がその機能に影響を及ぼしていることが考えられた.
6.ヒトにおけるGPR120の変異体の機能解析
GPR120において,67番目のArg残基のCys残基への変異は1回膜貫通の直後の細胞内第1ループに,270番目のArg残基のHis残基への変異は細胞内第3ループに存在しており,いずれの変異もGタンパク質との共役やシグナル伝達に影響をあたえている可能性が考えられた(図1).そこで,この2つの変異がGPR120の機能に及ぼす影響を検討するため,これらの変異体を安定に発現したヒト胎児腎細胞株であるHEK293細胞を用いて内因性のアゴニストであるαリノレン酸に対する細胞内Ca2+応答を比較した.その結果,細胞内Ca2+応答は270番目のArg残基のHis残基への変異をもつGPR120においてほぼ完全に失われた.また,ヒト腸管細胞株であるNCI-H716細胞に270番目のArg残基のHis残基への変異をもつGPR120を強制発現させインクレチンホルモンであるGLP-1の分泌を調べた.その結果,野生型GPR120の強制発現によりαリノレン酸の刺激に応答しGLP-1が分泌されたのに対し,変異型GPR120ではGLP-1の分泌は惹起されなかった.これらの結果から,GPR120において270番目のArg残基のHis残基への変異により脂肪酸に対するシグナル伝達能が失われ生理的な活性もなくなることが示された.
GPR120において270番目のArg残基のHis残基への変異はヘテロ変異であっても肥満と相関していた.そこで,HEK293細胞に野生型のGPR120と270番目のArg残基のHis残基への変異をもつGPR120とを同時に発現させた場合のαリノレン酸の刺激による細胞内Ca2+応答を調べた.その結果,野生型GPR120のみを発現させた細胞に比べ,野生型GPR120と変異型GPR120とを同時に発現させた細胞では細胞内Ca2+応答が有意に低下した.以上の結果から,GPR120において270番目のArg残基のHis残基への変異はヘテロ変異であっても遊離の長鎖脂肪酸によるシグナル伝達を阻害しその機能を抑制することが示された.
270番目のArg残基のHis残基への変異型のGPR120をもつ肥満者10名と野生型のGPR120をもつ肥満者とを比較したところ,脂肪細胞分化マーカー遺伝子であるFABP4遺伝子の内臓脂肪における発現が変異型GPR120をもつ肥満者において有意に低下していた.この結果は,GPR120ノックアウトマウスにおける脂肪組織での遺伝子発現の変化と一致していた.
以上のヒトおよびマウスにおける一連の解析から,脂肪酸受容体であるGタンパク質共役受容体GPR120が脂肪センサーとして正常に機能することで,脂質の生合成の制御をつうじエネルギー代謝のバランスを保っていることが明らかになった.
おわりに
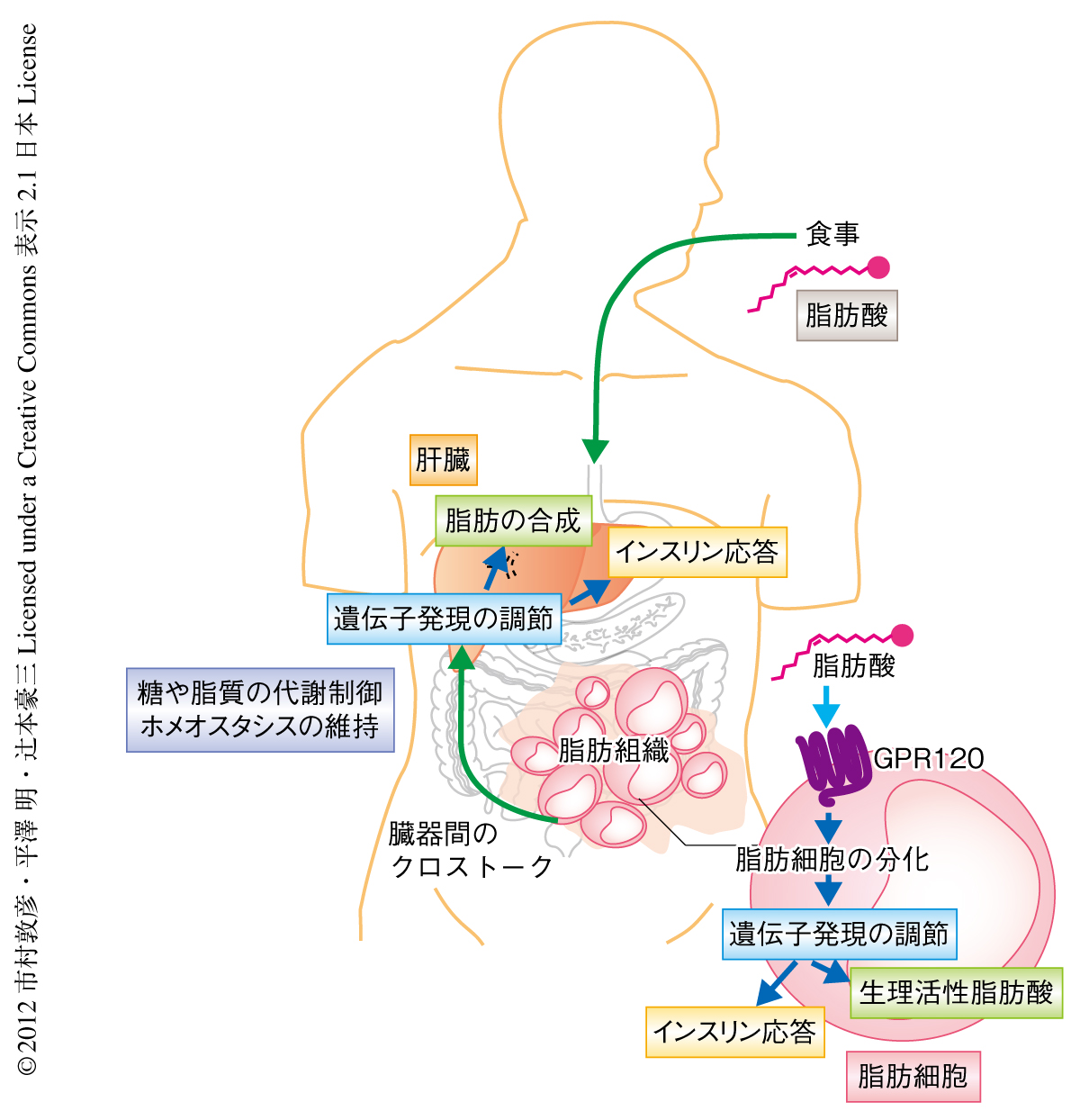
この研究により,Gタンパク質共役受容体GPR120が環境要因である食事に由来する脂肪を感知して全身代謝を調節する遺伝的な要因であることが明らかになった(図2).また,この研究の結果は,GPR120の機能不全がヒトにおいても肥満や糖尿病に代表されるメタボリックシンドロームのリスクとなることを示した.これらの知見は,食事に由来する栄養状態である外部環境と生体の内部のホメオスタシスとのコミュニケーションを担う分子機構の存在することを示していた.一方で,現時点では,GPR120における270番目のArg残基のHis残基への変異がどのような分子機構によりその活性を失わせているのか詳細は不明であり,さらなる解析が必要である.また,日本人におけるこの変異が西欧人と同様に肥満リスクとなるかという遺伝学的な解析も待たれる.これらさらに詳細な解析を進めることで,将来的には,あらかじめGPR120遺伝子の遺伝子型を知ることにより脂質の摂取量を考慮するといった遺伝子診断にもとづくテーラーメイド医療への応用や,GPR120を標的としてその機能を制御する薬剤を開発することにより,代謝性疾患の予防や治療を実現したいと考えている.
文 献
- Itoh, Y., Kawamata, Y., Harada, M. et al.: Free fatty acids regulate insulin secretion from pancreatic beta cells through GPR40. Nature, 422, 173-176 (2003)[PubMed]
- Hirasawa, A., Tsumaya, K., Awaji, T. et al.: Free fatty acids regulate gut incretin glucagon-like peptide-1 secretion through GPR120. Nat. Med., 11, 90-94 (2005)[PubMed]
- Ichimura, A., Hirasawa, A., Hara, T. et al.: Free fatty acid receptors act as nutrient sensors to regulate energy homeostasis. Prostaglandins Other Lipid Mediat., 89, 82-88 (2009)[PubMed]
- Kimura, I., Inoue, D., Maeda, T. et al.: Short-chain fatty acids and ketones directly regulate sympathetic nervous system via G protein-coupled receptor 41 (GPR41). Proc. Natl. Acad. Sci. USA, 108, 8030-8035 (2011)[PubMed]
- Oh D. Y., Talukdar, S., Bae, E. J. et al.: GPR120 is an omega-3 fatty acid receptor mediating potent anti-inflammatory and insulin-sensitizing effects. Cell, 142, 687-698 (2010)[PubMed]
- Tanaka, T., Katsuma, S., Adachi, T. et al.: Free fatty acids induce cholecystokinin secretion through GPR120. Naunyn Schmiedebergs Arch. Pharmacol., 377, 523-527 (2008)[PubMed]
- Gotoh, C., Hong, Y. H., Iga, T. et al.: The regulation of adipogenesis through GPR120. Biochem. Biophys. Res. Commun., 354, 591-597 (2007)[PubMed]
- Gutierrez-Juarez, R., Pocai, A., Mulas, C. et al.: Critical role of stearoyl-CoA desaturase-1 (SCD1) in the onset of diet-induced hepatic insulin resistance. J. Clin. Invest., 116, 1686-1695 (2006)[PubMed]
- Cao, H., Gerhold, K., Mayers, J. R. et al.: Identification of a lipokine, a lipid hormone linking adipose tissue to systemic metabolism. Cell, 134, 933-944 (2008)[PubMed]
著者プロフィール
略歴:2011年 京都大学大学院薬学研究科 修了,同年より東北大学大学院医学系研究科 助教.
研究テーマ:Gタンパク質共役受容体やプロテアーゼ阻害タンパク質を標的とする低分子化合物を用いた創薬の基礎研究.
抱負:新しい現象やこれまでになかった概念にもとづいた創薬に基礎研究により貢献したい.
平澤 明(Akira Hirasawa)
京都大学大学院薬学研究科 准教授.
辻本 豪三(Gozoh Tsujimoto)
京都大学大学院薬学研究科 教授.
研究室URL:http://gdds.pharm.kyoto-u.ac.jp/
© 2012 市村敦彦・平澤 明・辻本豪三 Licensed under CC 表示 2.1 日本