Foxp3陽性T細胞の不均一性と可塑性の起源
堀 昌平
(理化学研究所免疫・アレルギー科学総合研究センター 免疫恒常性研究ユニット)
email:堀 昌平
DOI: 10.7875/first.author.2012.033
Plasticity of Foxp3+ T cells reflects promiscuous Foxp3 expression in conventional T cells but not reprogramming of regulatory T cells.
Takahisa Miyao, Stefan Floess, Ruka Setoguchi, Hervé Luche, Hans Joerg Fehling, Herman Waldmann, Jochen Huehn, Shohei Hori
Immunity, 36, 262-275 (2012)
転写因子Foxp3を発現した制御性T細胞はさまざまな環境においてその分化した状態を安定に維持することで,免疫寛容と免疫の恒常性を維持している.最近,制御性T細胞が炎症など外因性のシグナルによりFoxp3発現を失いヘルパーT細胞へとリプログラミングされるという考えが提唱されたが,この制御性T細胞の可塑性という概念は大きな論争の的となっている.この研究で,筆者らは,可塑性を示すFoxp3発現T細胞の起源は制御性T細胞ではなく,活性化の過程において一過的かつ無差別にFoxp3を発現した非制御性のT細胞であることを明らかにした.一方,少数の制御性T細胞はFoxp3発現を一過的に失ったものの,その記憶を保持しており,活性化によりFoxp3と免疫応答の抑制機能を頑健に再発現した.そして,制御性T細胞の分化状態の安定性はFoxp3発現自体ではなく,Foxp3遺伝子座のDNA脱メチル化状態により保障されていることが明らかになった.
免疫系には免疫応答を抑制する機能を発現する制御性T細胞(regulatory T cell:Treg)とよばれるCD4陽性T細胞サブセットが内在し,自己免疫,炎症,アレルギーといったさまざまな病的な免疫応答を制御することで免疫寛容および免疫の恒常性の維持に必須の役割を担っている.制御性T細胞はおもに胸腺において自己抗原を強く認識することにより分化するが,一部は末梢においてナイーブCD4陽性T細胞がTGFβの存在のもと抗原による刺激をうけることにより分化する.従来,転写因子Foxp3が制御性T細胞に特異的に発現する分子マーカーであり,その分化や免疫応答の抑制機能をつかさどる“マスター転写因子”であると考えられてきた1,2).
制御性T細胞はCD4陽性のヘルパーT細胞やCD8陽性T細胞とは独立した細胞系列をなし,さまざまな環境変化に対し分化状態を安定に維持する.しかしながら近年,制御性T細胞の分化状態はこれまで考えられてきたほど安定ではなく,炎症など環境の変動に対しFoxp3発現および免疫応答の抑制機能を失い,さまざまなヘルパーT細胞へと“リプログラミング”されるという考えが提唱された3,4).このような“制御性T細胞の可塑性”という概念は,それに対する反証も提出され5),大きな論争の的となるとともに,制御性T細胞を用いた免疫疾患の治療の有効性と安全性に疑問を投げかけるものでもあった.
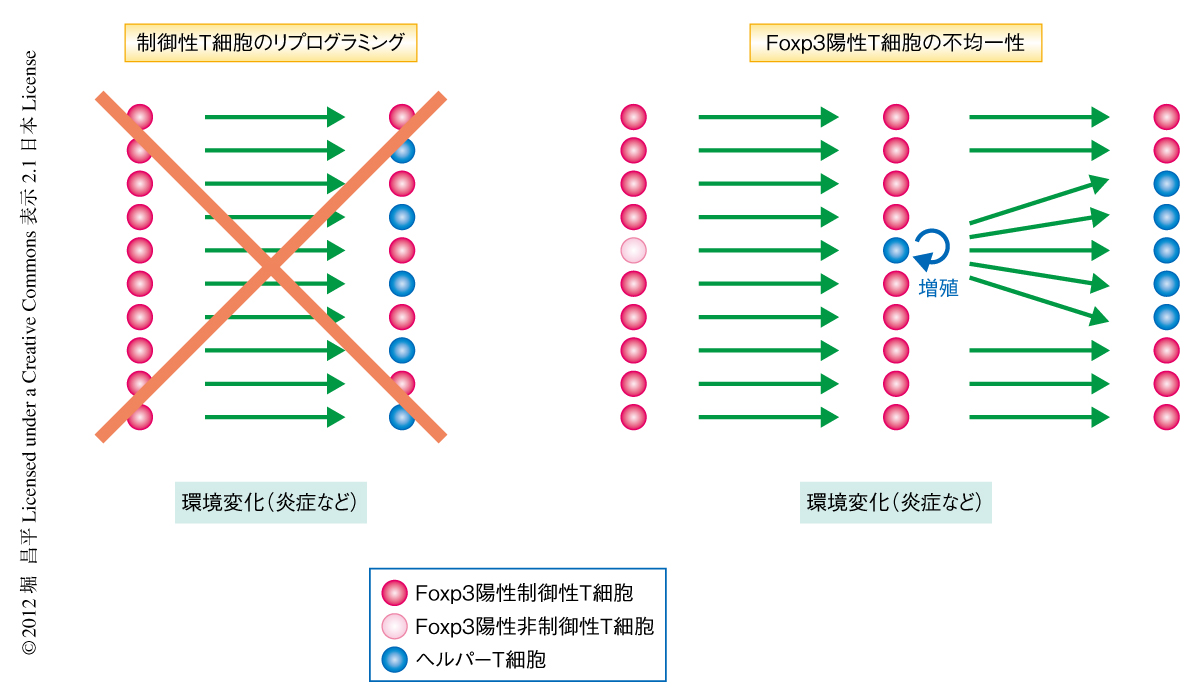
筆者らは,最近,この可塑性をめぐる論争はFoxp3陽性T細胞の不均一性を仮定することで解決できるのではないかと提案した6-8).すなわち,可塑性を示すFoxp3陽性T細胞は制御性T細胞へとコミットされていない細胞であり,制御性T細胞へ分化した細胞は安定な分化状態を示す,という考えである.そこでこの研究は,可塑性を示すFoxp3陽性T細胞の本態を明らかにし,この“可塑性の不均一性モデル”を実証することを目的とした.
正常な個体においてFoxp3発現を失ったヘルパーT細胞が分化するかどうかを明らかにするため,Foxp3陽性細胞においてGFP-Cre融合タンパク質が発現するノックインマウスを作製した.このノックインマウスをCreの活性によりRFPを発現するレポーターマウスと交配させ,Foxp3陽性細胞の運命マッピング解析を行った.この系では,解析の時点でFoxp3を発現している細胞はGFPで,以前にFoxp3を発現した歴史をもつ細胞はRFPで標識される.成体マウスにおいて,末梢の10~20%のRFP陽性CD4陽性T細胞はFoxp3陰性GFP陰性であり,また,T細胞系列以外の血球細胞および胸腺細胞においてFoxp3陰性RFP陽性の細胞は認められなかったことから,これらのT細胞は末梢においてFoxp3発現を失ったことがわかった.Foxp3陰性RFP陽性の細胞はCD25,CD103,GITR,OX40など制御性T細胞の分子マーカーを高発現せず,エフェクター形質およびメモリー形質を示しインターフェロンγ,インターロイキン2,インターロイキン4,インターロイキン17,インターロイキン21などヘルパーT細胞の分泌するさまざまなエフェクターサイトカインを発現した.
Foxp3レポーターマウスを解析する過程において,ナイーブFoxp3陰性CD4陽性T細胞をin vitroで活性化するとTGFβの非存在下においても約10%のT細胞がFoxp3を発現することが見い出された.しかしながら,このような活性化により誘導されるFoxp3陽性T細胞は,正常個体から単離したFoxp3陽性T細胞とは異なり活性化Foxp3陰性T細胞と同様の遺伝子発現プロファイルを示し,T細胞の増殖反応を抑制する活性をもたず,再刺激によりFoxp3発現を容易に失うことがわかった.さらに,正常な個体から単離したFoxp3陽性T細胞においてはFoxp3遺伝子座のTSDR(Treg-specific demethylation region,制御性T細胞特異的脱メチル化領域)とよばれる非翻訳領域9) がほぼ完全にDNA脱メチル化をうけているのに対し,活性化により誘導される一過的なFoxp3陽性T細胞においてはこのDNA脱メチル化が起こらないことがわかった.ヒトのナイーブT細胞においてはこのような活性化による一過的かつ“無差別”な(制御性T細胞への分化を誘導しない)Foxp3発現が報告されていたが10),以上の結果から,マウスのナイーブT細胞も一過的かつ無差別にFoxp3を発現しうることがわかった.
以上の結果から,Foxp3発現を失ったヘルパーT細胞は制御性T細胞ではなく,一過的かつ無差別にFoxp3を発現するT細胞に由来する可能性が考えられた.この可能性を検討するため,細胞移入実験を行った.Ly5.1陽性のFoxp3レポーターマウスからFoxp3陰性CD4陽性T細胞を単離し,Ly5.2陽性のFoxp3レポーターマウスに移入した.2週間後,末梢のFoxp3陽性CD4陽性T細胞(Ly5.2細胞,および,Foxp3発現を獲得した少数のLy5.1細胞)を純化してT細胞を欠損したマウスに移入すると,4週間後には約50%のLy5.2細胞がFoxp3陰性であったのに対し,ほとんどのLy5.1細胞はFoxp3陰性であり,これらLy5.1陽性のFoxp3発現を失ったT細胞は選択的に激しく増殖していた.ところが,Ly5.1陽性のFoxp3陰性CD4陽性T細胞を移入してから8週間後にFoxp3陽性CD4陽性T細胞を単離して同様の実験を行うと,誘導されたLy5.1陽性のFoxp3陽性CD4陽性T細胞はより安定なFoxp3発現を示し,Foxp3発現を失ったT細胞はそれほど増殖しないことがわかった.一方,Ly5.1陽性のFoxp3レポーターマウスからFoxp3陽性CD4陽性CD8陰性を示す胸腺細胞を単離してLy5.2陽性のFoxp3レポーターマウスに移入し同様の実験を行ったところ,Ly5.2陽性のFoxp3レポーターマウスでの滞在時間によらずほとんどの細胞はFoxp3発現を維持した.以上の結果は,T細胞を欠損した環境においては,Foxp3発現を失ったT細胞は末梢において一過的にFoxp3を発現した少数の細胞に由来し,それらが選択的に増殖し蓄積していることを示していた.
つぎに,炎症性サイトカインの存在する環境において分化する,Foxp3発現を失ったヘルパーT細胞の起源について調べた.Foxp3陽性T細胞をインターロイキン4,インターロイキン6,あるいは,TGFβ中和抗体の存在下においてT細胞受容体により刺激すると,一部はFoxp3発現を失いインターロイキン4やインターロイキン17などエフェクターサイトカインを産生するヘルパーT細胞に分化することが報告されている.さきに述べたように,Ly5.1陽性のFoxp3レポーターマウスから単離した末梢のFoxp3陰性CD4陽性T細胞,あるいは,Foxp3陽性CD4陽性CD8陰性の胸腺細胞をLy5.2陽性のFoxp3レポーターマウスに移入したのちFoxp3陽性CD4陽性T細胞を単離し,これらの炎症性サイトカインが存在する環境において活性化したところ,Foxp3発現を失ったヘルパーT細胞は末梢において一過的にFoxp3を発現する細胞から選択的に分化して増殖し,胸腺に由来する末梢のFoxp3陽性T細胞からは分化しないことがわかった.
以上の実験では,末梢において誘導されるFoxp3陽性T細胞は不均一な集団であり,一部は不安定なFoxp3発現を示してFoxp3発現を失ってヘルパーT細胞に分化するものの,一部は安定なFoxp3発現を示した.Ly5.1陽性のFoxp3レポーターマウスから得たFoxp3陰性CD4陽性T細胞をLy5.2陽性のFoxp3レポーターマウスに移入したのち,時間経過をおってFoxp3と制御性T細胞の代表的なマーカー分子であるCD25の発現を調べたところ,移入後初期にはCD25を低発現するFoxp3陽性細胞が多いものの,時間経過とともにCD25を高発現するFoxp3陽性細胞の割合が増加していった.さらに,この末梢で誘導されたCD25を低発現するFoxp3陽性細胞は不安定なFoxp3発現を示すのに対し,誘導されたCD25を高発現するFoxp3陽性細胞は安定なFoxp3発現を示した.したがって,CD25の発現により末梢において誘導される安定な集団と不安定な集団とを大まかに分けられることがわかった.
末梢において誘導されるFoxp3陽性T細胞の性状と機能を詳細に調べるため,さきに述べた運命マッピング解析の系を利用した.このマウスにおいては,Foxp3が誘導された直後はRFPがまだ十分に蓄積していないためRFP陰性またはRFP低発現となり,時間の経過とともにRFP高発現となる.この“分子タイマー”を利用することで,末梢において最近Foxp3を発現した細胞をFoxp3陽性RFP陰性/低発現の細胞として同定できる.実際に,さきに述べた細胞移入実験の結果と合致して,T細胞を欠損した環境あるいは炎症性サイトカインの存在する環境において,Foxp3陰性RFP陽性T細胞はFoxp3陽性RFP陰性/低発現の細胞から選択的に分化し,Foxp3陽性RFP高発現の細胞からは分化しないことがわかった.
さらに,これらFoxp3陽性RFP陰性/低発現T細胞はCD25低発現のT細胞とCD25高発現のT細胞とからなり,CD25低発現T細胞のサブセットは,制御性T細胞のマーカー分子の発現,免疫抑制活性,Foxp3発現の安定性,TSDRのDNA脱メチル化,という基準に照らしあわせて,制御性T細胞ではなく“無差別”なFoxp3発現を示す非制御性のT細胞であることがわかった.一方,Foxp3陽性RFP陰性/低発現T細胞のうちCD25高発現T細胞のサブセットは,Foxp3陽性RFP高発現T細胞のサブセットと同様に,制御性T細胞としての性状と機能を示すことがわかった.
さきに述べた運命マッピング解析の系を利用して,Foxp3陽性細胞においてFoxp3陰性RFP陽性CD4陽性T細胞を単離し抗原による刺激をくわえたところ,約30%の細胞がFoxp3を再発現し,また,免疫抑制活性を示すことを見い出した.そして,この再誘導されたFoxp3陽性T細胞においてはTSDRが完全にDNA脱メチル化されていた.一方,Foxp3を再発現しなかったFoxp3陰性RFP陽性T細胞は免疫抑制活性を示さず,エフェクターサイトカインを産生し,TSDRは完全にDNAメチル化されていた.以上の結果から,少数の制御性T細胞はFoxp3発現を一過的に失うものの,その発現を記憶していること,すなわち,制御性T細胞には“潜在型”が存在することが明らかになった.
この研究により,Foxp3陽性T細胞は不均一な集団であり制御性T細胞のほか少数の非制御性T細胞を含むこと,そして,ヘルパーT細胞に分化するのは制御性T細胞ではなく一過的かつ“無差別”にFoxp3を発現する非制御性T細胞であることが明らかとなり,“可塑性の不均一性モデル”に対する明確な証拠があたえられた(図1).一方,Foxp3発現を失ったT細胞もまた不均一な集団であり,無差別なFoxp3発現を反映するヘルパーT細胞にくわえ,一過的にFoxp3発現を失った“潜在型”制御性T細胞を含んでいた.このことは,制御性T細胞はさまざまな環境の変化に対し分化の状態を安定に維持する細胞系列であることを明確に証明するとともに,その安定性はTSDRのDNA脱メチル化というエピジェネティックな発現制御により成り立っていることを示唆していた.この研究で得られた知見は,“制御性T細胞の可塑性”をめぐる論争を解決する枠組みをあたえるとともに,安定な制御性T細胞をさまざまな免疫疾患の治療に用いる細胞療法にとっても励みとなるものである.今後の重要な課題は,制御性T細胞において記憶をともなったFoxp3発現を誘導するシグナルと,一過的なFoxp3発現を誘導するシグナルとでは何が異なるのか,という問題である.制御性T細胞への運命決定を制御する分子機構を解明してはじめて,制御性T細胞とは何かという問いに答えることになるだろう.
略歴:1998年 東京大学大学院薬学系研究科博士課程 修了,同年 ポルトガルInstituto Gulbenkian de Ciência博士研究員,2001年 京都大学再生医科学研究所 博士研究員,2002年 理化学研究所免疫・アレルギー科学総合研究センター 研究員を経て,2004年より同 ユニットリーダー.
研究テーマ:免疫寛容の分子機構.
関心事:生命システムの頑健性と適応性.
© 2012 堀 昌平 Licensed under CC 表示 2.1 日本
(理化学研究所免疫・アレルギー科学総合研究センター 免疫恒常性研究ユニット)
email:堀 昌平
DOI: 10.7875/first.author.2012.033
Plasticity of Foxp3+ T cells reflects promiscuous Foxp3 expression in conventional T cells but not reprogramming of regulatory T cells.
Takahisa Miyao, Stefan Floess, Ruka Setoguchi, Hervé Luche, Hans Joerg Fehling, Herman Waldmann, Jochen Huehn, Shohei Hori
Immunity, 36, 262-275 (2012)
要 約
転写因子Foxp3を発現した制御性T細胞はさまざまな環境においてその分化した状態を安定に維持することで,免疫寛容と免疫の恒常性を維持している.最近,制御性T細胞が炎症など外因性のシグナルによりFoxp3発現を失いヘルパーT細胞へとリプログラミングされるという考えが提唱されたが,この制御性T細胞の可塑性という概念は大きな論争の的となっている.この研究で,筆者らは,可塑性を示すFoxp3発現T細胞の起源は制御性T細胞ではなく,活性化の過程において一過的かつ無差別にFoxp3を発現した非制御性のT細胞であることを明らかにした.一方,少数の制御性T細胞はFoxp3発現を一過的に失ったものの,その記憶を保持しており,活性化によりFoxp3と免疫応答の抑制機能を頑健に再発現した.そして,制御性T細胞の分化状態の安定性はFoxp3発現自体ではなく,Foxp3遺伝子座のDNA脱メチル化状態により保障されていることが明らかになった.
はじめに
免疫系には免疫応答を抑制する機能を発現する制御性T細胞(regulatory T cell:Treg)とよばれるCD4陽性T細胞サブセットが内在し,自己免疫,炎症,アレルギーといったさまざまな病的な免疫応答を制御することで免疫寛容および免疫の恒常性の維持に必須の役割を担っている.制御性T細胞はおもに胸腺において自己抗原を強く認識することにより分化するが,一部は末梢においてナイーブCD4陽性T細胞がTGFβの存在のもと抗原による刺激をうけることにより分化する.従来,転写因子Foxp3が制御性T細胞に特異的に発現する分子マーカーであり,その分化や免疫応答の抑制機能をつかさどる“マスター転写因子”であると考えられてきた1,2).
制御性T細胞はCD4陽性のヘルパーT細胞やCD8陽性T細胞とは独立した細胞系列をなし,さまざまな環境変化に対し分化状態を安定に維持する.しかしながら近年,制御性T細胞の分化状態はこれまで考えられてきたほど安定ではなく,炎症など環境の変動に対しFoxp3発現および免疫応答の抑制機能を失い,さまざまなヘルパーT細胞へと“リプログラミング”されるという考えが提唱された3,4).このような“制御性T細胞の可塑性”という概念は,それに対する反証も提出され5),大きな論争の的となるとともに,制御性T細胞を用いた免疫疾患の治療の有効性と安全性に疑問を投げかけるものでもあった.
筆者らは,最近,この可塑性をめぐる論争はFoxp3陽性T細胞の不均一性を仮定することで解決できるのではないかと提案した6-8).すなわち,可塑性を示すFoxp3陽性T細胞は制御性T細胞へとコミットされていない細胞であり,制御性T細胞へ分化した細胞は安定な分化状態を示す,という考えである.そこでこの研究は,可塑性を示すFoxp3陽性T細胞の本態を明らかにし,この“可塑性の不均一性モデル”を実証することを目的とした.
1.正常個体にはFoxp3を発現した歴史をもつヘルパーT細胞が存在する
正常な個体においてFoxp3発現を失ったヘルパーT細胞が分化するかどうかを明らかにするため,Foxp3陽性細胞においてGFP-Cre融合タンパク質が発現するノックインマウスを作製した.このノックインマウスをCreの活性によりRFPを発現するレポーターマウスと交配させ,Foxp3陽性細胞の運命マッピング解析を行った.この系では,解析の時点でFoxp3を発現している細胞はGFPで,以前にFoxp3を発現した歴史をもつ細胞はRFPで標識される.成体マウスにおいて,末梢の10~20%のRFP陽性CD4陽性T細胞はFoxp3陰性GFP陰性であり,また,T細胞系列以外の血球細胞および胸腺細胞においてFoxp3陰性RFP陽性の細胞は認められなかったことから,これらのT細胞は末梢においてFoxp3発現を失ったことがわかった.Foxp3陰性RFP陽性の細胞はCD25,CD103,GITR,OX40など制御性T細胞の分子マーカーを高発現せず,エフェクター形質およびメモリー形質を示しインターフェロンγ,インターロイキン2,インターロイキン4,インターロイキン17,インターロイキン21などヘルパーT細胞の分泌するさまざまなエフェクターサイトカインを発現した.
2.活性化T細胞における一過的かつ無差別なFoxp3発現
Foxp3レポーターマウスを解析する過程において,ナイーブFoxp3陰性CD4陽性T細胞をin vitroで活性化するとTGFβの非存在下においても約10%のT細胞がFoxp3を発現することが見い出された.しかしながら,このような活性化により誘導されるFoxp3陽性T細胞は,正常個体から単離したFoxp3陽性T細胞とは異なり活性化Foxp3陰性T細胞と同様の遺伝子発現プロファイルを示し,T細胞の増殖反応を抑制する活性をもたず,再刺激によりFoxp3発現を容易に失うことがわかった.さらに,正常な個体から単離したFoxp3陽性T細胞においてはFoxp3遺伝子座のTSDR(Treg-specific demethylation region,制御性T細胞特異的脱メチル化領域)とよばれる非翻訳領域9) がほぼ完全にDNA脱メチル化をうけているのに対し,活性化により誘導される一過的なFoxp3陽性T細胞においてはこのDNA脱メチル化が起こらないことがわかった.ヒトのナイーブT細胞においてはこのような活性化による一過的かつ“無差別”な(制御性T細胞への分化を誘導しない)Foxp3発現が報告されていたが10),以上の結果から,マウスのナイーブT細胞も一過的かつ無差別にFoxp3を発現しうることがわかった.
3.Foxp3発現の歴史をもつヘルパーT細胞は末梢において一過的にFoxp3を発現する細胞に由来する
以上の結果から,Foxp3発現を失ったヘルパーT細胞は制御性T細胞ではなく,一過的かつ無差別にFoxp3を発現するT細胞に由来する可能性が考えられた.この可能性を検討するため,細胞移入実験を行った.Ly5.1陽性のFoxp3レポーターマウスからFoxp3陰性CD4陽性T細胞を単離し,Ly5.2陽性のFoxp3レポーターマウスに移入した.2週間後,末梢のFoxp3陽性CD4陽性T細胞(Ly5.2細胞,および,Foxp3発現を獲得した少数のLy5.1細胞)を純化してT細胞を欠損したマウスに移入すると,4週間後には約50%のLy5.2細胞がFoxp3陰性であったのに対し,ほとんどのLy5.1細胞はFoxp3陰性であり,これらLy5.1陽性のFoxp3発現を失ったT細胞は選択的に激しく増殖していた.ところが,Ly5.1陽性のFoxp3陰性CD4陽性T細胞を移入してから8週間後にFoxp3陽性CD4陽性T細胞を単離して同様の実験を行うと,誘導されたLy5.1陽性のFoxp3陽性CD4陽性T細胞はより安定なFoxp3発現を示し,Foxp3発現を失ったT細胞はそれほど増殖しないことがわかった.一方,Ly5.1陽性のFoxp3レポーターマウスからFoxp3陽性CD4陽性CD8陰性を示す胸腺細胞を単離してLy5.2陽性のFoxp3レポーターマウスに移入し同様の実験を行ったところ,Ly5.2陽性のFoxp3レポーターマウスでの滞在時間によらずほとんどの細胞はFoxp3発現を維持した.以上の結果は,T細胞を欠損した環境においては,Foxp3発現を失ったT細胞は末梢において一過的にFoxp3を発現した少数の細胞に由来し,それらが選択的に増殖し蓄積していることを示していた.
つぎに,炎症性サイトカインの存在する環境において分化する,Foxp3発現を失ったヘルパーT細胞の起源について調べた.Foxp3陽性T細胞をインターロイキン4,インターロイキン6,あるいは,TGFβ中和抗体の存在下においてT細胞受容体により刺激すると,一部はFoxp3発現を失いインターロイキン4やインターロイキン17などエフェクターサイトカインを産生するヘルパーT細胞に分化することが報告されている.さきに述べたように,Ly5.1陽性のFoxp3レポーターマウスから単離した末梢のFoxp3陰性CD4陽性T細胞,あるいは,Foxp3陽性CD4陽性CD8陰性の胸腺細胞をLy5.2陽性のFoxp3レポーターマウスに移入したのちFoxp3陽性CD4陽性T細胞を単離し,これらの炎症性サイトカインが存在する環境において活性化したところ,Foxp3発現を失ったヘルパーT細胞は末梢において一過的にFoxp3を発現する細胞から選択的に分化して増殖し,胸腺に由来する末梢のFoxp3陽性T細胞からは分化しないことがわかった.
4.末梢において誘導されるFoxp3陽性T細胞の不均一性
以上の実験では,末梢において誘導されるFoxp3陽性T細胞は不均一な集団であり,一部は不安定なFoxp3発現を示してFoxp3発現を失ってヘルパーT細胞に分化するものの,一部は安定なFoxp3発現を示した.Ly5.1陽性のFoxp3レポーターマウスから得たFoxp3陰性CD4陽性T細胞をLy5.2陽性のFoxp3レポーターマウスに移入したのち,時間経過をおってFoxp3と制御性T細胞の代表的なマーカー分子であるCD25の発現を調べたところ,移入後初期にはCD25を低発現するFoxp3陽性細胞が多いものの,時間経過とともにCD25を高発現するFoxp3陽性細胞の割合が増加していった.さらに,この末梢で誘導されたCD25を低発現するFoxp3陽性細胞は不安定なFoxp3発現を示すのに対し,誘導されたCD25を高発現するFoxp3陽性細胞は安定なFoxp3発現を示した.したがって,CD25の発現により末梢において誘導される安定な集団と不安定な集団とを大まかに分けられることがわかった.
5.一過的なFoxp3発現を示すFoxp3陽性T細胞は制御性T細胞ではない
末梢において誘導されるFoxp3陽性T細胞の性状と機能を詳細に調べるため,さきに述べた運命マッピング解析の系を利用した.このマウスにおいては,Foxp3が誘導された直後はRFPがまだ十分に蓄積していないためRFP陰性またはRFP低発現となり,時間の経過とともにRFP高発現となる.この“分子タイマー”を利用することで,末梢において最近Foxp3を発現した細胞をFoxp3陽性RFP陰性/低発現の細胞として同定できる.実際に,さきに述べた細胞移入実験の結果と合致して,T細胞を欠損した環境あるいは炎症性サイトカインの存在する環境において,Foxp3陰性RFP陽性T細胞はFoxp3陽性RFP陰性/低発現の細胞から選択的に分化し,Foxp3陽性RFP高発現の細胞からは分化しないことがわかった.
さらに,これらFoxp3陽性RFP陰性/低発現T細胞はCD25低発現のT細胞とCD25高発現のT細胞とからなり,CD25低発現T細胞のサブセットは,制御性T細胞のマーカー分子の発現,免疫抑制活性,Foxp3発現の安定性,TSDRのDNA脱メチル化,という基準に照らしあわせて,制御性T細胞ではなく“無差別”なFoxp3発現を示す非制御性のT細胞であることがわかった.一方,Foxp3陽性RFP陰性/低発現T細胞のうちCD25高発現T細胞のサブセットは,Foxp3陽性RFP高発現T細胞のサブセットと同様に,制御性T細胞としての性状と機能を示すことがわかった.
6.制御性T細胞はFoxp3発現を記憶する
さきに述べた運命マッピング解析の系を利用して,Foxp3陽性細胞においてFoxp3陰性RFP陽性CD4陽性T細胞を単離し抗原による刺激をくわえたところ,約30%の細胞がFoxp3を再発現し,また,免疫抑制活性を示すことを見い出した.そして,この再誘導されたFoxp3陽性T細胞においてはTSDRが完全にDNA脱メチル化されていた.一方,Foxp3を再発現しなかったFoxp3陰性RFP陽性T細胞は免疫抑制活性を示さず,エフェクターサイトカインを産生し,TSDRは完全にDNAメチル化されていた.以上の結果から,少数の制御性T細胞はFoxp3発現を一過的に失うものの,その発現を記憶していること,すなわち,制御性T細胞には“潜在型”が存在することが明らかになった.
おわりに
この研究により,Foxp3陽性T細胞は不均一な集団であり制御性T細胞のほか少数の非制御性T細胞を含むこと,そして,ヘルパーT細胞に分化するのは制御性T細胞ではなく一過的かつ“無差別”にFoxp3を発現する非制御性T細胞であることが明らかとなり,“可塑性の不均一性モデル”に対する明確な証拠があたえられた(図1).一方,Foxp3発現を失ったT細胞もまた不均一な集団であり,無差別なFoxp3発現を反映するヘルパーT細胞にくわえ,一過的にFoxp3発現を失った“潜在型”制御性T細胞を含んでいた.このことは,制御性T細胞はさまざまな環境の変化に対し分化の状態を安定に維持する細胞系列であることを明確に証明するとともに,その安定性はTSDRのDNA脱メチル化というエピジェネティックな発現制御により成り立っていることを示唆していた.この研究で得られた知見は,“制御性T細胞の可塑性”をめぐる論争を解決する枠組みをあたえるとともに,安定な制御性T細胞をさまざまな免疫疾患の治療に用いる細胞療法にとっても励みとなるものである.今後の重要な課題は,制御性T細胞において記憶をともなったFoxp3発現を誘導するシグナルと,一過的なFoxp3発現を誘導するシグナルとでは何が異なるのか,という問題である.制御性T細胞への運命決定を制御する分子機構を解明してはじめて,制御性T細胞とは何かという問いに答えることになるだろう.
文 献
- Hori, S., Nomura, T. & Sakaguchi, S.: Control of regulatory T cell development by the transcription factor Foxp3. Science, 299, 1057-1061 (2003)[PubMed]
- Zheng, Y. & Rudensky, A. Y.: Foxp3 in control of the regulatory T cell lineage. Nat. Immunol., 8, 457-462 (2007)[PubMed]
- Zhou, X., Bailey-Bucktrout, S. L., Jeker, L. T. et al.: Instability of the transcription factor Foxp3 leads to the generation of pathogenic memory T cells in vivo. Nat. Immunol., 10, 1000-1007 (2009)[PubMed]
- Bailey-Bucktrout, S. L. & Bluestone, J. A.: Regulatory T cells: stability revisited. Trends Immunol., 32, 301-306 (2011)[PubMed]
- Rubtsov, Y. P., Niec, R. E., Josefowicz, S. et al.: Stability of the regulatory T cell lineage in vivo. Science, 329, 1667-1671 (2010)[PubMed]
- Komatsu, N., Mariotti-Ferrandiz, M. E., Wang, Y. et al.: Heterogeneity of natural Foxp3+ T cells: a committed regulatory T-cell lineage and an uncommitted minor population retaining plasticity. Proc. Natl. Acad. Sci. USA, 106, 1903-1908 (2009)[PubMed]
- Hori, S.: Developmental plasticity of Foxp3+ regulatory T cells. Curr. Opin. Immunol., 22, 575-582 (2010)[PubMed]
- Hori, S.: Regulatory T cell plasticity: beyond the controversies. Trends Immunol., 32, 295-300 (2011)[PubMed]
- Huehn, J., Polansky, J. K. & Hamann, A.: Epigenetic control of FOXP3 expression: the key to a stable regulatory T-cell lineage? Nat. Rev. Immunol., 9, 83-89 (2009)[PubMed]
- Ziegler, S. F.: FOXP3: not just for regulatory T cells anymore. Eur. J. Immunol., 37, 21-23 (2007)[PubMed]
著者プロフィール
略歴:1998年 東京大学大学院薬学系研究科博士課程 修了,同年 ポルトガルInstituto Gulbenkian de Ciência博士研究員,2001年 京都大学再生医科学研究所 博士研究員,2002年 理化学研究所免疫・アレルギー科学総合研究センター 研究員を経て,2004年より同 ユニットリーダー.
研究テーマ:免疫寛容の分子機構.
関心事:生命システムの頑健性と適応性.
© 2012 堀 昌平 Licensed under CC 表示 2.1 日本