EBウイルス関連Bリンパ腫に対する免疫監視機構と新たな治療法
保田朋波流1・Baochun Zhang 2・Klaus Rajewsky 1
(1ドイツMax Delbrück Center for Molecular Medicine,Immune Regulation and Cancer,2米国Harvard Medical School,Immune Disease Institute)
email:保田朋波流
DOI: 10.7875/first.author.2012.035
Immune surveillance and therapy of lymphomas driven by Epstein-Barr virus protein LMP1 in a mouse model.
Baochun Zhang, Sven Kracker, Tomoharu Yasuda, Stefano Casola, Matthew Vanneman, Cornelia Hömig-Hölzel, Zhe Wang, Emmanuel Derudder, Shuang Li, Tirtha Chakraborty, Shane E. Cotter, Shohei Koyama, Treeve Currie, Gordon J. Freeman, Jeffery L. Kutok, Scott J. Rodig, Glenn Dranoff, Klaus Rajewsky
Cell, 148, 739-751 (2012)
EBウイルスはほとんどの成人が感染するがんウイルスの一種で,健常人ではウイルスおよびウイルス感染細胞は生体のもつ免疫機構により排除される.しかしながら,ごく少数のB細胞に潜伏感染することで完全には排除されず生体において維持されつづける.臓器移植やヒト免疫不全ウイルスの感染にともない免疫機能が抑制されると,EBウイルスの潜伏感染するB細胞は免疫監視機構による排除をまぬがれて増殖を開始しがん化する.今回,筆者らは,EBウイルスによるB細胞の不死化に必須なタンパク質LMP1をB細胞において特異的に発現するマウスを作製した.ヒトにおけるEBウイルス感染B細胞のように,このマウスにおいてもLMP1を発現するB細胞はT細胞により効率よく排除された.このマウスからT細胞を除去するとLMP1発現B細胞の異常な増殖がひき起こされ,最終的に致死性のリンパ腫を発症した.免疫抑制患者に発症するリンパ腫と同様に,LMP1陽性リンパ腫細胞はナチュラルキラー細胞の受容体であるNKG2Dに対するリガンドを高発現しており,NKG2Dと抗体のFcドメインとの融合タンパク質をマウスに投与することでリンパ腫細胞の増殖を阻害することができた.これらの結果より,LMP1の発現が免疫監視機構の発動に重要であり,また同時に,EBウイルス感染B細胞のがん化にも重要な役割をはたしていることが明らかになった.今回,作製されたマウスは免疫抑制患者におけるリンパ腫発症の前臨床試験マウスモデルとして有用であると考えられ,新規に開発した分子薬の有効性をマウスにおいて実証することに成功した.
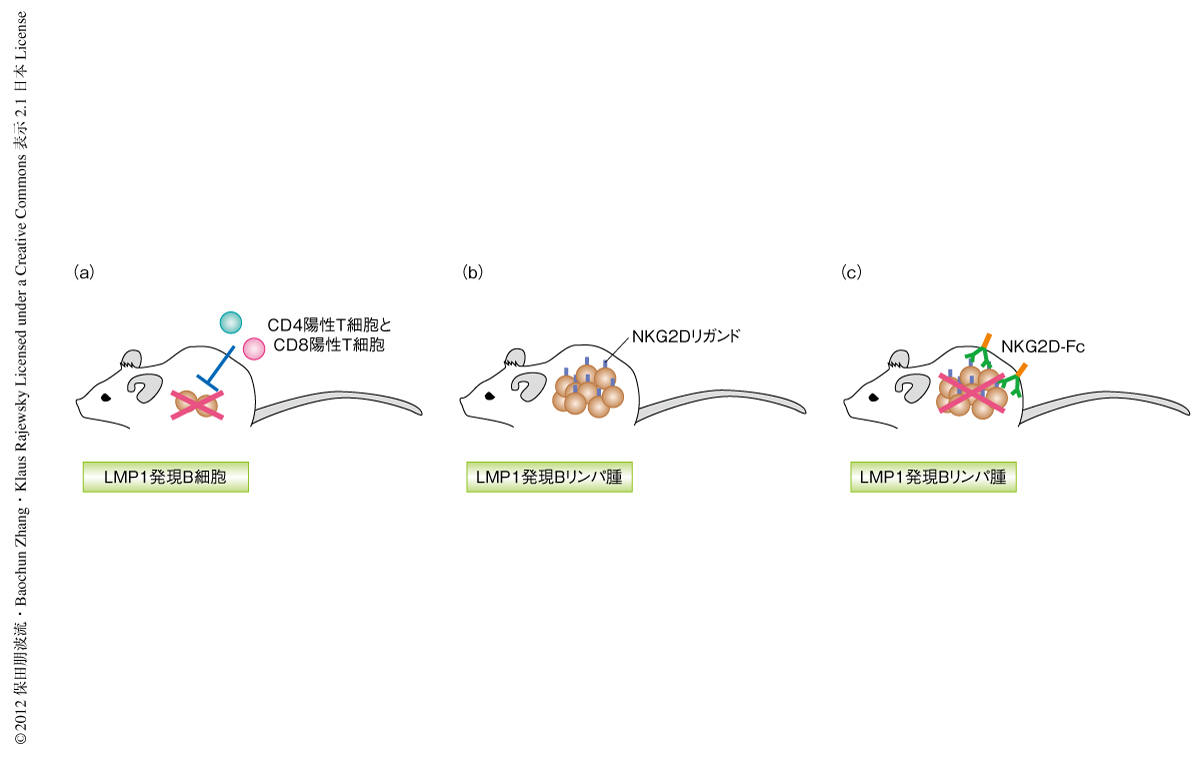
EBウイルス(Epstein-Barr virus:EBV)はわが国では90%以上,米国では95%もの成人が感染しているとされる非常に身近なウイルスである.幼小児での感染は明らかな症状をともなわない不顕性の感染であるが,成人期での感染では伝染性単核球症をひき起こす.感染ののち多くの場合は自然に治癒するが,まれに慢性的にEBウイルスの増殖する慢性活動性EBウイルス感染症をひき起こし,これはいまだ高い致死率を示す難病性の疾患である.初期の感染から自然治癒ののちにもEBウイルスはごく少数のB細胞に潜伏感染し維持される1).臓器移植ののちの拒絶反応を抑制する免疫抑制剤の使用による免疫機能の障害やヒト免疫不全ウイルスの感染によりCD4陽性T細胞の数の減少したEBウイルス保有者では,EBウイルス感染B細胞が増殖してがん化しリンパ腫を発症する.EBウイルスはホジキンリンパ腫,バーキットリンパ腫,上咽頭がん,T細胞リンパ腫などのリンパ腫の発症にも関与することが知られている2,3).EBウイルスは標的細胞であるヒトB細胞に感染するとLMP1など9種類のタンパク質を発現し,感染したB細胞は活発に増殖しはじめる2).ほどなくEBウイルスに特異的なエフェクターT細胞が誘導され,EBウイルスに由来するタンパク質を発現するB細胞は生体から除去される4).しかしながら,ごく一部のB細胞(メモリーB細胞)にはEBウイルスが潜伏感染し,EBウイルスの遺伝子発現をオフにすることで免疫細胞による監視をのがれ生体において長期的に存在しつづける1)(図1).EBウイルスがコードする遺伝子の産物のうちLMP1は細胞膜タンパク質であり,正常なB細胞が発現するCD40に類似したシグナルをリガンドに非依存的に伝達し,EBウイルスによる細胞のがん化において特に重要であることが知られている4).今回,筆者らは,B細胞においてLMP1を特異的に発現するコンディショナルトランスジェニックマウスを作製した.このマウスではLMP1を発現するB細胞は免疫細胞により排除されるが,生体からT細胞を除去すると迅速に増殖し,ヒトの移植後リンパ増殖性疾患に類似した病態とリンパ腫を発症することがわかった.
EBウイルス関連リンパ腫のマウスモデルの作製を目的として,ROSA26遺伝子座にloxP配列ではさまれた転写停止配列とともにLMP1遺伝子を挿入したマウスを作製した.このトランスジェニックマウスではCreリコンビナーゼを発現する細胞でのみ転写停止配列が除去されてLMP1遺伝子が発現する.このマウスからB細胞を単離し,in vitroにおいて細胞に組換えCreリコンビナーゼを導入することによりLMP1の発現を誘導した.その結果,LMP1陽性B細胞はin vitroにてリガンド非依存性の増殖が誘導されることがわかった.
LMP1をin vivoにおいてB細胞に特異的に発現させるため,さきのLMP1遺伝子トランスジェニックマウスとB細胞に特異的にCreリコンビナーゼを発現するトランスジェニックマウスとを交配した.ここで用いたCreトランスジェニックマウスでは,Creリコンビナーゼの発現がB細胞の初期分化の場である骨髄においてプレB細胞ステージから誘導される.交配により得られたマウスの脾臓におけるB細胞の数を調べたところ著しく減少しており,わずかに存在したB細胞は転写停止配列の除去されてないLMP1を発現しない細胞であることがわかった.骨髄を観察するとLMP1を発現する少数のB細胞が検出されたが,細胞の表面に免疫グロブリンMを発現する未熟B細胞が消失していた.これは骨髄にてLMP1陽性B細胞が除去されたものと予想された.実際に,骨髄ではCD4陽性T細胞とCD8陽性T細胞の両方の細胞の数が上昇しており,いずれも大部分の細胞が活性化マーカーを発現していた.このことから,B細胞特異的LMP1コンディショナルトランスジェニックマウスでは,CD4陽性T細胞とCD8陽性T細胞の両方が骨髄において活性化しLMP1陽性B細胞の排除に関与していることが示唆された.
活性化したT細胞が実際にLMP1陽性B細胞の排除に関与しているのかどうかを調べるため,B細胞特異的LMP1コンディショナルトランスジェニックマウスに抗CD4抗体,抗CD8抗体,抗Thy1抗体を投与することでT細胞を除去した.抗体の投与の開始から2週間後にはLMP1陽性B細胞の数が著しく増加し,死にいたることがわかった.LMP1陽性B細胞は活性化マーカーを発現して活発に分裂し,NF-κBシグナル伝達系,ERKシグナル伝達系,JNKシグナル伝達系などの恒常的な活性化が観察された.また,B細胞における遺伝子変異の導入に重要であるAIDの発現が誘導されていることがわかった.
CD4陽性T細胞とCD8陽性T細胞がB細胞特異的LMP1コンディショナルトランスジェニックマウスの骨髄において増加および活性化していたことから,αβT細胞がLMP1陽性B細胞の免疫監視に重要であることが予想された.このことを確認する目的で,このコンディショナルトランスジェニックマウスとT細胞受容体β鎖のノックアウトマウス,および,γδT細胞の分化に重要なT細胞受容体δ鎖のノックアウトマウスを交配した.交配により得られたγδT細胞を欠損するマウスではLMP1陽性B細胞の増殖を認めなかったが,αβT細胞を欠損するマウスではLMP1陽性B細胞が免疫系により排除されずに増殖していることがわかった.また,αβT細胞を欠損するマウスではγδT細胞の数が著しく増加し活性化していることがわかった.さらに,αβT細胞とγδT細胞の両方を欠損するマウスを観察したところLMP1陽性B細胞の増殖がより顕著であり,αβT細胞のみを欠損するマウスと比較して早期に死亡することが判明した.これらの実験事実より,LMP1を発現するB細胞の免疫監視機構はおもにαβT細胞により担われているが,αβT細胞を欠損する場合ではγδT細胞も重要な役割をはたしていることが明らかになった.
αβT細胞を欠損,もしくは,αβT細胞とγδT細胞とを欠損したB細胞特異的LMP1コンディショナルトランスジェニックマウスでは,LMP1陽性B細胞の異常な増殖に起因する脾臓の腫脹が例外なく観察された.これらのマウスで生じた腫瘍はびまん性大細胞型B細胞リンパ腫(9例中6例)と形質細胞腫(9例中3例)の2種類に分類された.リンパ腫細胞のクローン性を調べたところ,生後8週以内に発症したリンパ腫細胞は多クローン性であったが,それ以降に発症するリンパ腫はモノクローン性もしくはオリゴクローン性であった.興味深いことに,それらのリンパ腫ではαβT細胞を欠損しているにもかかわらず膜型免疫グロブリンGへのクラススイッチが生じており,AIDの異所性の発現がこれに関与しているものと予想された.しかしながら,やはりAIDに依存性である免疫グロブリン遺伝子座VDJ領域における体細胞変異を調べたところ,LMP1陽性Bリンパ腫細胞では変異が検出されなかった.
T細胞によるLMP1陽性B細胞の排除は,がん化のあとでも機能しうるのかどうか調べるため,T細胞を欠損したB細胞特異的LMP1コンディショナルトランスジェニックマウスに発症するリンパ腫から細胞株を樹立した.つぎに,B細胞特異的LMP1コンディショナルトランスジェニックマウスの骨髄から活性化したCD4陽性T細胞とCD8陽性T細胞を単離し,さきに樹立されたLMP1陽性Bリンパ腫細胞株に対するin vitroにおける細胞傷害活性の有無について検討した.その結果,CD8陽性T細胞はリンパ腫細胞に対しin vitroにおいて強い細胞傷害活性を示したが,CD4陽性T細胞はそのような活性をまったく示さないことがわかった.つづいて,in vivoにおける活性を免疫不全マウスにリンパ腫細胞を移植する系を用いて検討した.驚くべきことにさきの結果とは相反して,CD4陽性T細胞をリンパ腫細胞とともに移植した場合にはきわめて強いリンパ腫の排除活性を示す一方で,CD8陽性T細胞ではある程度の排除活性を示すもののCD4陽性T細胞ほどの強い活性はもたないことがわかった.また,CD4陽性T細胞から抗腫瘍活性をもつことが知られているナチュラルキラーT細胞を完全に除去した場合でも同様に強いリンパ腫の排除活性を示したことから,ナチュラルキラーT細胞はリンパ腫を排除する主要なサブセットではないことが示された.つぎに,CD4陽性T細胞とCD8陽性T細胞によるLMP1陽性B細胞の認識がT細胞受容体を介して行われているのかどうかを検討するため,MHCクラスIIもしくはMHCクラスIを欠損するB細胞にレトロウイルスを用いてLMP1を導入しT細胞の反応性を検討した.その結果,CD4陽性T細胞とCD8陽性T細胞のいずれもLMP1陽性B細胞の認識にMHCの発現を必要としたことから,T細胞によるリンパ腫細胞の認識は特異的なT細胞受容体を介して行われていることが明らかになった.
B細胞特異的LMP1コンディショナルトランスジェニックマウスの骨髄から単離されたナチュラルキラー細胞も,LMP1陽性Bリンパ腫細胞に対し細胞傷害活性を示した.そこで,ナチュラルキラー細胞の活性化受容体であるNKG2Dのリガンドの発現をLMP1陽性リンパ腫細胞について調べたところ,高い発現を示すことがわかった.さらに,移植後リンパ増殖性疾患の患者から単離されたリンパ腫細胞においてもNKG2Dリガンドがすべての組織試料において高い発現を示すことが明らかになった.このNKG2DリガンドはストレスやDNA損傷を生じた細胞およびウイルス感染細胞などでのみ発現するという事実から,NKG2Dリガンドは移植後リンパ増殖性疾患におけるリンパ腫治療の分子標的となりうるものと考えられた.
そこで,NKG2D受容体のリガンド結合ドメインと抗体Fcドメインとを融合したタンパク質を作製した.このNKG2D-Fc融合タンパク質はNKG2Dリガンドを発現する細胞を認識して結合すると,Fcドメインを介して補体系を活性化し結合したリンパ腫細胞を殺傷することが期待される.まず,NKG2D-Fc融合タンパク質がLMP1を発現するリンパ腫細胞を認識し殺傷しうるかどうかin vitroにおいて調べた結果,腫瘍細胞を特異的に認識し殺傷することがわかった.つぎに,LMP1陽性Bリンパ腫細胞を免疫不全マウスに移植し,NKG2D-Fc融合タンパク質の投与による効果を検討した.NKG2D-Fc融合タンパク質を投与されたマウスではリンパ腫の成長が著しく阻害され,かつ,生存期間が延長することが確認された(図2).今回,見い出されたNKG2D-Fc融合タンパク質を用いたin vivoでのリンパ腫の抑制は,移植後リンパ増殖性疾患の患者において発症するリンパ腫の新たな治療法として今後の進展が期待される.
LMP1はヒトにおいても強い抗原性がありT細胞により認識される主要なEBウイルス抗原のひとつである.また,B細胞の不死化にも必須であることが知られている.EBウイルス関連リンパ腫のマウスモデルはこれまで開発されていなかったが,今回,筆者らが作製したEBウイルスに由来するLMP1遺伝子を組み込んだコンディショナルトランスジェニックマウスはヒトの疾患に近い病態を示すものであり,非常に有用なモデルマウスとなるものと考えられた.このマウスの解析により,生体がLMP1を発現するB細胞を監視し排除する機構はおもにCD4陽性T細胞とCD8陽性T細胞により担われていることが明らかになった.さらに,従来はあまり重要視されていなかったCD4陽性T細胞が,LMP1陽性B細胞を排除する細胞として特に強い活性をもっていることが浮きぼりとなった.このCD4陽性T細胞がどのようにしてリンパ腫を認識し排除しているのか,現時点では不明であり,今後,明らかにすべき重要な点である.T細胞を欠損したB細胞特異的LMP1コンディショナルトランスジェニックマウスでは,早期に発症する腫瘍はポリクローン性を示すものの,後期に発症する腫瘍においてはモノクローン性のリンパ腫細胞が主となることが確認された.これは,クローン性のリンパ腫の発症には染色体の変異が関与する可能性を強く示唆していた.LMP1陽性リンパ腫細胞においてどのような変異が生じているのか興味深い.また,LMP1陽性B細胞ではリンパ腫細胞における染色体の転座に関与することが知られているAIDの発現を認めた5,6).AIDの発現とLMP1陽性B細胞における染色体の異常との関係についても興味深いところである.
今回,筆者らが見い出したNKG2Dリガンドを標的とするリンパ腫の治療法は,オフターゲット効果の少ない画期的な手法であるといえる.というのも,正常細胞において通常はNKG2Dリガンドは発現しないことから,リンパ腫に対してのみ特異的に作用して殺傷しうるものと考えられるからである.移植後リンパ増殖性疾患の患者に発症する腫瘍細胞のすべてにおいてNKG2Dリガンドが発現することが示されたが,NKG2DリガンドはLMP1によってのみ誘導されるわけではなく,DNA損傷やストレスによっても誘導されることから7),ほかのリンパ腫やがん細胞においてもNKG2Dリガンドが発現しているのかどうか興味深い.
略歴:2001年 東京医科歯科大学難治疾患研究所 助手,2003年 東京大学大学院医学系研究科にて博士号 取得,2005年 理化学研究所免疫・アレルギー科学総合研究センター 研究員,2008年 米国Harvard Medical SchoolにてResearch Fellowを経て,2011年よりドイツMax Delbrück Center for Molecular MedicineにてScientist.
研究テーマ:B細胞の分化,抗体の産生機構,Bリンパ腫,EBウイルス.
抱負:新しいパラダイムにつながる研究をする.
Baochun Zhang
米国Harvard Medical SchoolにてResearch Fellow.
Klaus Rajewsky
ドイツMax Delbrück Center for Molecular MedicineにてProfessor.
© 2012 保田朋波流・Baochun Zhang・Klaus Rajewsky Licensed under CC 表示 2.1 日本
(1ドイツMax Delbrück Center for Molecular Medicine,Immune Regulation and Cancer,2米国Harvard Medical School,Immune Disease Institute)
email:保田朋波流
DOI: 10.7875/first.author.2012.035
Immune surveillance and therapy of lymphomas driven by Epstein-Barr virus protein LMP1 in a mouse model.
Baochun Zhang, Sven Kracker, Tomoharu Yasuda, Stefano Casola, Matthew Vanneman, Cornelia Hömig-Hölzel, Zhe Wang, Emmanuel Derudder, Shuang Li, Tirtha Chakraborty, Shane E. Cotter, Shohei Koyama, Treeve Currie, Gordon J. Freeman, Jeffery L. Kutok, Scott J. Rodig, Glenn Dranoff, Klaus Rajewsky
Cell, 148, 739-751 (2012)
この論文に出現する遺伝子・タンパク質のUniprot ID
LMP1(P03230), NKG2D(O54709), CD4(P06332), CD40(P25942), 免疫グロブリンM, CD8, Thy1(P01831), NF-κB, ERK, JNK, AID(Q9WVE0), 免疫グロブリンG, NKG2D受容体(O54709), EBNA, LMP, EBNA1(P03211)
要 約
EBウイルスはほとんどの成人が感染するがんウイルスの一種で,健常人ではウイルスおよびウイルス感染細胞は生体のもつ免疫機構により排除される.しかしながら,ごく少数のB細胞に潜伏感染することで完全には排除されず生体において維持されつづける.臓器移植やヒト免疫不全ウイルスの感染にともない免疫機能が抑制されると,EBウイルスの潜伏感染するB細胞は免疫監視機構による排除をまぬがれて増殖を開始しがん化する.今回,筆者らは,EBウイルスによるB細胞の不死化に必須なタンパク質LMP1をB細胞において特異的に発現するマウスを作製した.ヒトにおけるEBウイルス感染B細胞のように,このマウスにおいてもLMP1を発現するB細胞はT細胞により効率よく排除された.このマウスからT細胞を除去するとLMP1発現B細胞の異常な増殖がひき起こされ,最終的に致死性のリンパ腫を発症した.免疫抑制患者に発症するリンパ腫と同様に,LMP1陽性リンパ腫細胞はナチュラルキラー細胞の受容体であるNKG2Dに対するリガンドを高発現しており,NKG2Dと抗体のFcドメインとの融合タンパク質をマウスに投与することでリンパ腫細胞の増殖を阻害することができた.これらの結果より,LMP1の発現が免疫監視機構の発動に重要であり,また同時に,EBウイルス感染B細胞のがん化にも重要な役割をはたしていることが明らかになった.今回,作製されたマウスは免疫抑制患者におけるリンパ腫発症の前臨床試験マウスモデルとして有用であると考えられ,新規に開発した分子薬の有効性をマウスにおいて実証することに成功した.
はじめに
EBウイルス(Epstein-Barr virus:EBV)はわが国では90%以上,米国では95%もの成人が感染しているとされる非常に身近なウイルスである.幼小児での感染は明らかな症状をともなわない不顕性の感染であるが,成人期での感染では伝染性単核球症をひき起こす.感染ののち多くの場合は自然に治癒するが,まれに慢性的にEBウイルスの増殖する慢性活動性EBウイルス感染症をひき起こし,これはいまだ高い致死率を示す難病性の疾患である.初期の感染から自然治癒ののちにもEBウイルスはごく少数のB細胞に潜伏感染し維持される1).臓器移植ののちの拒絶反応を抑制する免疫抑制剤の使用による免疫機能の障害やヒト免疫不全ウイルスの感染によりCD4陽性T細胞の数の減少したEBウイルス保有者では,EBウイルス感染B細胞が増殖してがん化しリンパ腫を発症する.EBウイルスはホジキンリンパ腫,バーキットリンパ腫,上咽頭がん,T細胞リンパ腫などのリンパ腫の発症にも関与することが知られている2,3).EBウイルスは標的細胞であるヒトB細胞に感染するとLMP1など9種類のタンパク質を発現し,感染したB細胞は活発に増殖しはじめる2).ほどなくEBウイルスに特異的なエフェクターT細胞が誘導され,EBウイルスに由来するタンパク質を発現するB細胞は生体から除去される4).しかしながら,ごく一部のB細胞(メモリーB細胞)にはEBウイルスが潜伏感染し,EBウイルスの遺伝子発現をオフにすることで免疫細胞による監視をのがれ生体において長期的に存在しつづける1)(図1).EBウイルスがコードする遺伝子の産物のうちLMP1は細胞膜タンパク質であり,正常なB細胞が発現するCD40に類似したシグナルをリガンドに非依存的に伝達し,EBウイルスによる細胞のがん化において特に重要であることが知られている4).今回,筆者らは,B細胞においてLMP1を特異的に発現するコンディショナルトランスジェニックマウスを作製した.このマウスではLMP1を発現するB細胞は免疫細胞により排除されるが,生体からT細胞を除去すると迅速に増殖し,ヒトの移植後リンパ増殖性疾患に類似した病態とリンパ腫を発症することがわかった.
1.LMP1の発現はin vitroにおいてB細胞の増殖を誘導する
EBウイルス関連リンパ腫のマウスモデルの作製を目的として,ROSA26遺伝子座にloxP配列ではさまれた転写停止配列とともにLMP1遺伝子を挿入したマウスを作製した.このトランスジェニックマウスではCreリコンビナーゼを発現する細胞でのみ転写停止配列が除去されてLMP1遺伝子が発現する.このマウスからB細胞を単離し,in vitroにおいて細胞に組換えCreリコンビナーゼを導入することによりLMP1の発現を誘導した.その結果,LMP1陽性B細胞はin vitroにてリガンド非依存性の増殖が誘導されることがわかった.
2.LMP1を発現するB細胞はin vivoにおいて排除される
LMP1をin vivoにおいてB細胞に特異的に発現させるため,さきのLMP1遺伝子トランスジェニックマウスとB細胞に特異的にCreリコンビナーゼを発現するトランスジェニックマウスとを交配した.ここで用いたCreトランスジェニックマウスでは,Creリコンビナーゼの発現がB細胞の初期分化の場である骨髄においてプレB細胞ステージから誘導される.交配により得られたマウスの脾臓におけるB細胞の数を調べたところ著しく減少しており,わずかに存在したB細胞は転写停止配列の除去されてないLMP1を発現しない細胞であることがわかった.骨髄を観察するとLMP1を発現する少数のB細胞が検出されたが,細胞の表面に免疫グロブリンMを発現する未熟B細胞が消失していた.これは骨髄にてLMP1陽性B細胞が除去されたものと予想された.実際に,骨髄ではCD4陽性T細胞とCD8陽性T細胞の両方の細胞の数が上昇しており,いずれも大部分の細胞が活性化マーカーを発現していた.このことから,B細胞特異的LMP1コンディショナルトランスジェニックマウスでは,CD4陽性T細胞とCD8陽性T細胞の両方が骨髄において活性化しLMP1陽性B細胞の排除に関与していることが示唆された.
3.LMP1陽性B細胞はT細胞を除去すると急速に増殖する
活性化したT細胞が実際にLMP1陽性B細胞の排除に関与しているのかどうかを調べるため,B細胞特異的LMP1コンディショナルトランスジェニックマウスに抗CD4抗体,抗CD8抗体,抗Thy1抗体を投与することでT細胞を除去した.抗体の投与の開始から2週間後にはLMP1陽性B細胞の数が著しく増加し,死にいたることがわかった.LMP1陽性B細胞は活性化マーカーを発現して活発に分裂し,NF-κBシグナル伝達系,ERKシグナル伝達系,JNKシグナル伝達系などの恒常的な活性化が観察された.また,B細胞における遺伝子変異の導入に重要であるAIDの発現が誘導されていることがわかった.
4.LMP1陽性B細胞を免疫監視する中心的な細胞はαβT細胞である
CD4陽性T細胞とCD8陽性T細胞がB細胞特異的LMP1コンディショナルトランスジェニックマウスの骨髄において増加および活性化していたことから,αβT細胞がLMP1陽性B細胞の免疫監視に重要であることが予想された.このことを確認する目的で,このコンディショナルトランスジェニックマウスとT細胞受容体β鎖のノックアウトマウス,および,γδT細胞の分化に重要なT細胞受容体δ鎖のノックアウトマウスを交配した.交配により得られたγδT細胞を欠損するマウスではLMP1陽性B細胞の増殖を認めなかったが,αβT細胞を欠損するマウスではLMP1陽性B細胞が免疫系により排除されずに増殖していることがわかった.また,αβT細胞を欠損するマウスではγδT細胞の数が著しく増加し活性化していることがわかった.さらに,αβT細胞とγδT細胞の両方を欠損するマウスを観察したところLMP1陽性B細胞の増殖がより顕著であり,αβT細胞のみを欠損するマウスと比較して早期に死亡することが判明した.これらの実験事実より,LMP1を発現するB細胞の免疫監視機構はおもにαβT細胞により担われているが,αβT細胞を欠損する場合ではγδT細胞も重要な役割をはたしていることが明らかになった.
5.B細胞特異的LMP1コンディショナルトランスジェニックマウスにてT細胞を欠損させるとLMP1陽性Bリンパ腫が発症する
αβT細胞を欠損,もしくは,αβT細胞とγδT細胞とを欠損したB細胞特異的LMP1コンディショナルトランスジェニックマウスでは,LMP1陽性B細胞の異常な増殖に起因する脾臓の腫脹が例外なく観察された.これらのマウスで生じた腫瘍はびまん性大細胞型B細胞リンパ腫(9例中6例)と形質細胞腫(9例中3例)の2種類に分類された.リンパ腫細胞のクローン性を調べたところ,生後8週以内に発症したリンパ腫細胞は多クローン性であったが,それ以降に発症するリンパ腫はモノクローン性もしくはオリゴクローン性であった.興味深いことに,それらのリンパ腫ではαβT細胞を欠損しているにもかかわらず膜型免疫グロブリンGへのクラススイッチが生じており,AIDの異所性の発現がこれに関与しているものと予想された.しかしながら,やはりAIDに依存性である免疫グロブリン遺伝子座VDJ領域における体細胞変異を調べたところ,LMP1陽性Bリンパ腫細胞では変異が検出されなかった.
6.LMP1陽性Bリンパ腫細胞に対する免疫監視機構
T細胞によるLMP1陽性B細胞の排除は,がん化のあとでも機能しうるのかどうか調べるため,T細胞を欠損したB細胞特異的LMP1コンディショナルトランスジェニックマウスに発症するリンパ腫から細胞株を樹立した.つぎに,B細胞特異的LMP1コンディショナルトランスジェニックマウスの骨髄から活性化したCD4陽性T細胞とCD8陽性T細胞を単離し,さきに樹立されたLMP1陽性Bリンパ腫細胞株に対するin vitroにおける細胞傷害活性の有無について検討した.その結果,CD8陽性T細胞はリンパ腫細胞に対しin vitroにおいて強い細胞傷害活性を示したが,CD4陽性T細胞はそのような活性をまったく示さないことがわかった.つづいて,in vivoにおける活性を免疫不全マウスにリンパ腫細胞を移植する系を用いて検討した.驚くべきことにさきの結果とは相反して,CD4陽性T細胞をリンパ腫細胞とともに移植した場合にはきわめて強いリンパ腫の排除活性を示す一方で,CD8陽性T細胞ではある程度の排除活性を示すもののCD4陽性T細胞ほどの強い活性はもたないことがわかった.また,CD4陽性T細胞から抗腫瘍活性をもつことが知られているナチュラルキラーT細胞を完全に除去した場合でも同様に強いリンパ腫の排除活性を示したことから,ナチュラルキラーT細胞はリンパ腫を排除する主要なサブセットではないことが示された.つぎに,CD4陽性T細胞とCD8陽性T細胞によるLMP1陽性B細胞の認識がT細胞受容体を介して行われているのかどうかを検討するため,MHCクラスIIもしくはMHCクラスIを欠損するB細胞にレトロウイルスを用いてLMP1を導入しT細胞の反応性を検討した.その結果,CD4陽性T細胞とCD8陽性T細胞のいずれもLMP1陽性B細胞の認識にMHCの発現を必要としたことから,T細胞によるリンパ腫細胞の認識は特異的なT細胞受容体を介して行われていることが明らかになった.
7.NKG2D受容体を用いたリンパ腫の免疫療法
B細胞特異的LMP1コンディショナルトランスジェニックマウスの骨髄から単離されたナチュラルキラー細胞も,LMP1陽性Bリンパ腫細胞に対し細胞傷害活性を示した.そこで,ナチュラルキラー細胞の活性化受容体であるNKG2Dのリガンドの発現をLMP1陽性リンパ腫細胞について調べたところ,高い発現を示すことがわかった.さらに,移植後リンパ増殖性疾患の患者から単離されたリンパ腫細胞においてもNKG2Dリガンドがすべての組織試料において高い発現を示すことが明らかになった.このNKG2DリガンドはストレスやDNA損傷を生じた細胞およびウイルス感染細胞などでのみ発現するという事実から,NKG2Dリガンドは移植後リンパ増殖性疾患におけるリンパ腫治療の分子標的となりうるものと考えられた.
そこで,NKG2D受容体のリガンド結合ドメインと抗体Fcドメインとを融合したタンパク質を作製した.このNKG2D-Fc融合タンパク質はNKG2Dリガンドを発現する細胞を認識して結合すると,Fcドメインを介して補体系を活性化し結合したリンパ腫細胞を殺傷することが期待される.まず,NKG2D-Fc融合タンパク質がLMP1を発現するリンパ腫細胞を認識し殺傷しうるかどうかin vitroにおいて調べた結果,腫瘍細胞を特異的に認識し殺傷することがわかった.つぎに,LMP1陽性Bリンパ腫細胞を免疫不全マウスに移植し,NKG2D-Fc融合タンパク質の投与による効果を検討した.NKG2D-Fc融合タンパク質を投与されたマウスではリンパ腫の成長が著しく阻害され,かつ,生存期間が延長することが確認された(図2).今回,見い出されたNKG2D-Fc融合タンパク質を用いたin vivoでのリンパ腫の抑制は,移植後リンパ増殖性疾患の患者において発症するリンパ腫の新たな治療法として今後の進展が期待される.
おわりに
LMP1はヒトにおいても強い抗原性がありT細胞により認識される主要なEBウイルス抗原のひとつである.また,B細胞の不死化にも必須であることが知られている.EBウイルス関連リンパ腫のマウスモデルはこれまで開発されていなかったが,今回,筆者らが作製したEBウイルスに由来するLMP1遺伝子を組み込んだコンディショナルトランスジェニックマウスはヒトの疾患に近い病態を示すものであり,非常に有用なモデルマウスとなるものと考えられた.このマウスの解析により,生体がLMP1を発現するB細胞を監視し排除する機構はおもにCD4陽性T細胞とCD8陽性T細胞により担われていることが明らかになった.さらに,従来はあまり重要視されていなかったCD4陽性T細胞が,LMP1陽性B細胞を排除する細胞として特に強い活性をもっていることが浮きぼりとなった.このCD4陽性T細胞がどのようにしてリンパ腫を認識し排除しているのか,現時点では不明であり,今後,明らかにすべき重要な点である.T細胞を欠損したB細胞特異的LMP1コンディショナルトランスジェニックマウスでは,早期に発症する腫瘍はポリクローン性を示すものの,後期に発症する腫瘍においてはモノクローン性のリンパ腫細胞が主となることが確認された.これは,クローン性のリンパ腫の発症には染色体の変異が関与する可能性を強く示唆していた.LMP1陽性リンパ腫細胞においてどのような変異が生じているのか興味深い.また,LMP1陽性B細胞ではリンパ腫細胞における染色体の転座に関与することが知られているAIDの発現を認めた5,6).AIDの発現とLMP1陽性B細胞における染色体の異常との関係についても興味深いところである.
今回,筆者らが見い出したNKG2Dリガンドを標的とするリンパ腫の治療法は,オフターゲット効果の少ない画期的な手法であるといえる.というのも,正常細胞において通常はNKG2Dリガンドは発現しないことから,リンパ腫に対してのみ特異的に作用して殺傷しうるものと考えられるからである.移植後リンパ増殖性疾患の患者に発症する腫瘍細胞のすべてにおいてNKG2Dリガンドが発現することが示されたが,NKG2DリガンドはLMP1によってのみ誘導されるわけではなく,DNA損傷やストレスによっても誘導されることから7),ほかのリンパ腫やがん細胞においてもNKG2Dリガンドが発現しているのかどうか興味深い.
文 献
- Thorley-Lawson, D. A. & Allday, M. J.: The curious case of the tumour virus: 50 years of Burkitt's lymphoma. Nat. Rev. Microbiol., 6, 913-924 (2008)[PubMed]
- Kuppers, R.: B cells under influence: transformation of B cells by Epstein-Barr virus. Nat. Rev. Immunol., 3, 801-812 (2003)[PubMed]
- Young, L. S. & Rickinson, A. B.: Epstein-Barr virus: 40 years on. Nat. Rev. Cancer, 4, 757-768 (2004)[PubMed]
- Thorley-Lawson, D. A.: Epstein-Barr virus: exploiting the immune system. Nat. Rev. Immunol., 1, 75-82 (2001)[PubMed]
- Ramiro, A. R., Jankovic, M., Eisenreich, T. et al.: AID is required for c-myc/IgH chromosome translocations in vivo. Cell, 118, 431-438 (2004)[PubMed]
- Pasqualucci, L., Bhagat, G., Jankovic, M. et al.: AID is required for germinal center-derived lymphomagenesis. Nat. Genet., 40, 108-112 (2008)[PubMed]
- Raulet, D. H.: Roles of the NKG2D immunoreceptor and its ligands. Nat. Rev. Immunol., 3, 781-790 (2003)[PubMed]
著者プロフィール
略歴:2001年 東京医科歯科大学難治疾患研究所 助手,2003年 東京大学大学院医学系研究科にて博士号 取得,2005年 理化学研究所免疫・アレルギー科学総合研究センター 研究員,2008年 米国Harvard Medical SchoolにてResearch Fellowを経て,2011年よりドイツMax Delbrück Center for Molecular MedicineにてScientist.
研究テーマ:B細胞の分化,抗体の産生機構,Bリンパ腫,EBウイルス.
抱負:新しいパラダイムにつながる研究をする.
Baochun Zhang
米国Harvard Medical SchoolにてResearch Fellow.
Klaus Rajewsky
ドイツMax Delbrück Center for Molecular MedicineにてProfessor.
© 2012 保田朋波流・Baochun Zhang・Klaus Rajewsky Licensed under CC 表示 2.1 日本