刺激の豊かな生育環境での記憶や学習の能力の向上にはモータータンパク質KIF1Aが必須である
近藤 誠・廣川信隆
(東京大学大学院医学系研究科 分子構造・動態学講座,細胞生物学・解剖学大講座)
email:廣川信隆
DOI: 10.7875/first.author.2012.030
Motor protein KIF1A is essential for hippocampal synaptogenesis and learning enhancement in an enriched environment.
Makoto Kondo, Yosuke Takei, Nobutaka Hirokawa
Neuron, 73, 743-757 (2012)
刺激の豊かな環境で育ったマウスの脳にはさまざまな影響のあることが報告されていたが,その詳細な機序は明らかではなかった.今回,筆者らは,キネシンスーパーファミリータンパク質に属するモータータンパク質KIF1Aの発現が刺激の豊かな環境で育ったマウスの海馬において増大していることを発見し,さらに,神経栄養因子BDNFがKIF1Aの発現を制御していることを見い出した.また,ノックアウトマウスの解析により,KIF1Aが刺激の豊かな環境で育ったマウスにみられる海馬におけるシナプスの形成,および,記憶や学習の能力の向上という形態的および行動的な可塑性に必須であることを明らかにした.この研究は,モータータンパク質が生育環境によりひき起こされる脳の形態的な変化や動物の行動の変化に重要な役割を担っていることをはじめて示すものである.また,これまで明らかではなかった,経験に依存的な脳の可塑性の基盤をなす前シナプスにおける機序の解明につながるもので,将来,脳神経疾患の病態の解明や治療法の開発にむけた新しいアプローチとなることが期待される.
刺激の豊かな環境(エンリッチな環境)とは,トンネル,イグルーなどの玩具や運動用の回転車輪をあたえたり,より大きなケージで多くの個体をいっしょに飼ったりすることにより,動物がより多くの感覚,運動,認知的かつ社会的な刺激をうける生育環境のことである1).これまでに,この刺激の豊かな環境によりマウスやラットの脳に対し分子,細胞さらには行動にいたるまで多くのレベルでさまざまな影響のあることや,脳神経疾患に対し有益な効果のあることが報告されていた2).また,刺激の豊かな環境がもたらすこれらの変化には脳由来神経栄養因子(brain-derived neurotrophic factor:BDNF)の関与していることが知られていたが3),その詳細な機序は明らかではなかった.
キネシンスーパーファミリータンパク質(kinesin superfamily protein:KIF)は細胞において微小管にそって膜オルガネラ,タンパク質複合体やmRNAを輸送するモータータンパク質であり,細胞の生存,形態形成および機能発現に非常に重要なはたらきをしている4,5).興味深いことに最近,キネシンスーパーファミリータンパク質が記憶や学習に関与していることが示された6).そこで筆者らは,刺激の豊かな環境で育ったマウスには海馬におけるシナプスの形成7),および,記憶や学習の能力の向上8) のみられることに着目し,マウスの海馬において刺激の豊かな環境によりキネシンスーパーファミリータンパク質の発現は変化するのか,そしてさらに,これらの形態的および行動的な変化とキネシンスーパーファミリータンパク質との関連性について調べた.
刺激の豊かな環境によりマウスの海馬においてキネシンスーパーファミリータンパク質の発現が変化するのかどうか調べた.離乳の直後の3週齢の雄マウスを,数種類の玩具や運動用の回転車輪のある大きなケージに15匹(刺激の豊かな環境),または,玩具などの存在しない通常のケージに3匹(通常の環境)入れて飼育し(図1),キネシンスーパーファミリータンパク質の発現量を比較した.すると,刺激の豊かな環境で育ったマウスの海馬では飼育して2週間後からKIF1Aの発現の著明な上昇がみられた.KIF1Aは神経組織に特異的なキネシンスーパーファミリータンパク質であり,ニューロンにおいてシナプトファイシン,シナプトタグミン,Rab3Aといったシナプス小胞タンパク質を含むシナプス小胞の前駆体を輸送していることが知られている9).さらにくわしく調べてみたところ,飼育して3週間後には通常の環境で育ったマウスと比べKIF1Aは約1.7倍もの発現上昇が認められた.また,mRNAレベルにおいてもKIF1AをコードするmRNAの発現の上昇がみられた.さらに,刺激の豊かな環境で育ったマウスの海馬においてはBDNFの発現の上昇も認められた.
つぎに,BDNFヘテロノックアウトマウスおよびKIF1Aヘテロノックアウトマウスを用いて,刺激の豊かな環境による海馬におけるタンパク質の発現の変化を調べたところ,BDNFヘテロノックアウトマウスの海馬においては刺激の豊かな環境によりBDNFの発現のわずかな上昇がみられたのに対し,KIF1Aの発現の有意な上昇は認められなかった.一方,KIF1Aヘテロノックアウトマウスの海馬においては刺激の豊かな環境によりKIF1Aの発現のわずかな上昇とBDNFの発現の中程度の上昇を認めた.これらの結果は,刺激の豊かな環境によりマウスの海馬においてKIF1Aの発現が増大し,この過程においてBDNFが重要なはたらきをしていることを示していた.
刺激の豊かな環境による記憶や学習の能力の向上8) に,海馬におけるKIF1Aの発現の上昇がどのように関与しているか調べた.まず,空間記憶能力を調べるため,Morris水迷路試験(円形のプールに放されたマウスやラットが水面下に沈んだプラットフォームを泳いで探し,そこに到達するまでの時間と軌跡を測定することで空間記憶能力を評価するもの)を行った.野生型マウスでは刺激の豊かな環境で育ったマウスのほうが通常の環境で育ったマウスと比べ回を重ねるほどより早くゴールにたどり着き,空間学習能力の向上が認められた.しかし,BDNFヘテロノックアウトマウスおよびKIF1Aヘテロノックアウトマウスではそのような向上はみられなかった.さらに,恐怖条件づけ文脈学習試験(電気刺激をあたえたマウスを一定時間ののち再び電気刺激をあたえた場所に置き,その際に観察される恐怖反応の時間を測定することで文脈学習能力を評価するもの)においても同様に,野生型マウスでは刺激の豊かな環境による文脈学習能力の向上が認められたのに対し,BDNFヘテロノックアウトマウスおよびKIF1Aヘテロノックアウトマウスではそのような向上はみられなかった.これらの結果は,刺激の豊かな環境による記憶や学習の能力の向上にはBDNFおよびKIF1Aの発現の上昇が重要であることを示していた.
刺激の豊かな環境による海馬におけるシナプスの形成7) に,KIF1Aの発現の上昇がどのように関与しているか調べた.刺激の豊かな環境で育ったマウスと通常の環境で育ったマウスについて,電子顕微鏡を用いて海馬CA1領域の放線状層(stratum radiatum)におけるシナプスの密度の定量的な解析を行った.野生型マウスでは通常の環境で育ったマウスと比べ刺激の豊かな環境で育ったマウスにおいてシナプスの密度の増大が認められたのに対し,BDNFヘテロノックアウトマウスおよびKIF1Aヘテロノックアウトマウスでは刺激の豊かな環境によるシナプスの密度の増大はみられなかった.さらに,シナプトファイシンとPSD-95の二重染色による免疫組織学的な手法を用いたシナプスの密度の定量的な解析でも同様の結果が得られた.これらの結果は,刺激の豊かな環境による海馬におけるシナプスの形成にはBDNFおよびKIF1Aの発現の上昇が重要であることを示していた.
海馬におけるBDNFに依存的なKIF1Aの発現の制御についてさらにくわしく検討した.まず,海馬培養ニューロンにおいてBDNFの投与によるKIF1Aの発現の変化を調べたところ,時間依存的かつ濃度依存的に発現の上昇が認められた.また,BDNFの受容体であるチロシンキナーゼTrkの阻害剤の投与によりKIF1Aの発現の上昇は阻害された.さらに,mRNAレベルにおいてもBDNFの投与によるKIF1AをコードするmRNAの発現の上昇がみられた.一方で,BDNFを投与してもKIF1AをコードするmRNAの安定性には影響はなかったことから,KIF1Aの発現の上昇には転写レベルでの制御がはたらいていることが考えられた.また,培養アストロサイトではBDNFの投与によるKIF1Aの発現の変化は認められなかった.
BDNFの投与によりKIF1Aによる軸索輸送にどのような影響があるか調べた.シナプトファイシンを含有する小胞の動態を生細胞イメージング法により経時的に観察したところ,BDNFを投与した海馬のニューロンの軸索では順行性輸送の頻度の増大を認めた.一方で,逆行性輸送や輸送の速度には影響はみられなかった.
これらの結果は,BDNFは海馬のニューロンにおいてKIF1Aの発現の上昇をもたらしKIF1Aによる軸索輸送を増大させていることを示していた.
BDNFはシナプスの可塑性を制御し,また,シナプスの形成を促進することが知られている10).そこで,BDNFによる海馬におけるシナプスの形成にKIF1Aがどのように関与しているのか調べた.野生型マウスに由来する海馬培養ニューロン,KIF1Aヘテロノックアウトマウスに由来する海馬培養ニューロンおよびKIF1Aホモノックアウトマウスに由来する海馬培養ニューロンについて,シナプトファイシンとPSD-95の二重染色による免疫細胞学的な手法を用いてBDNFを投与したときのシナプスの密度の定量的な解析を行った.BDNFの投与により野生型の海馬培養ニューロンではシナプスの密度の増大を認めたのに対し,KIF1Aヘテロノックアウト海馬培養ニューロンおよびKIF1Aホモノックアウト海馬培養ニューロンではシナプスの密度の増大はみられなかった.この結果は,BDNFによる海馬におけるシナプスの形成にKIF1Aが重要であることを示していた.
KIF1Aのシナプスの形成における役割を確認するため,海馬培養ニューロンにKIF1Aを過剰に発現させるとどうなるか調べた.すると,KIF1Aを過剰に発現させた海馬培養ニューロンではその前シナプス領域の数の増大と,さらには,シナプスの数の増大が認められた.この結果は,KIF1Aの過剰な発現はシナプスボタン(前シナプスの終末に形成されるふくらみ)の形成を促進し,さらに,シナプスの形成を促進することを示していた.
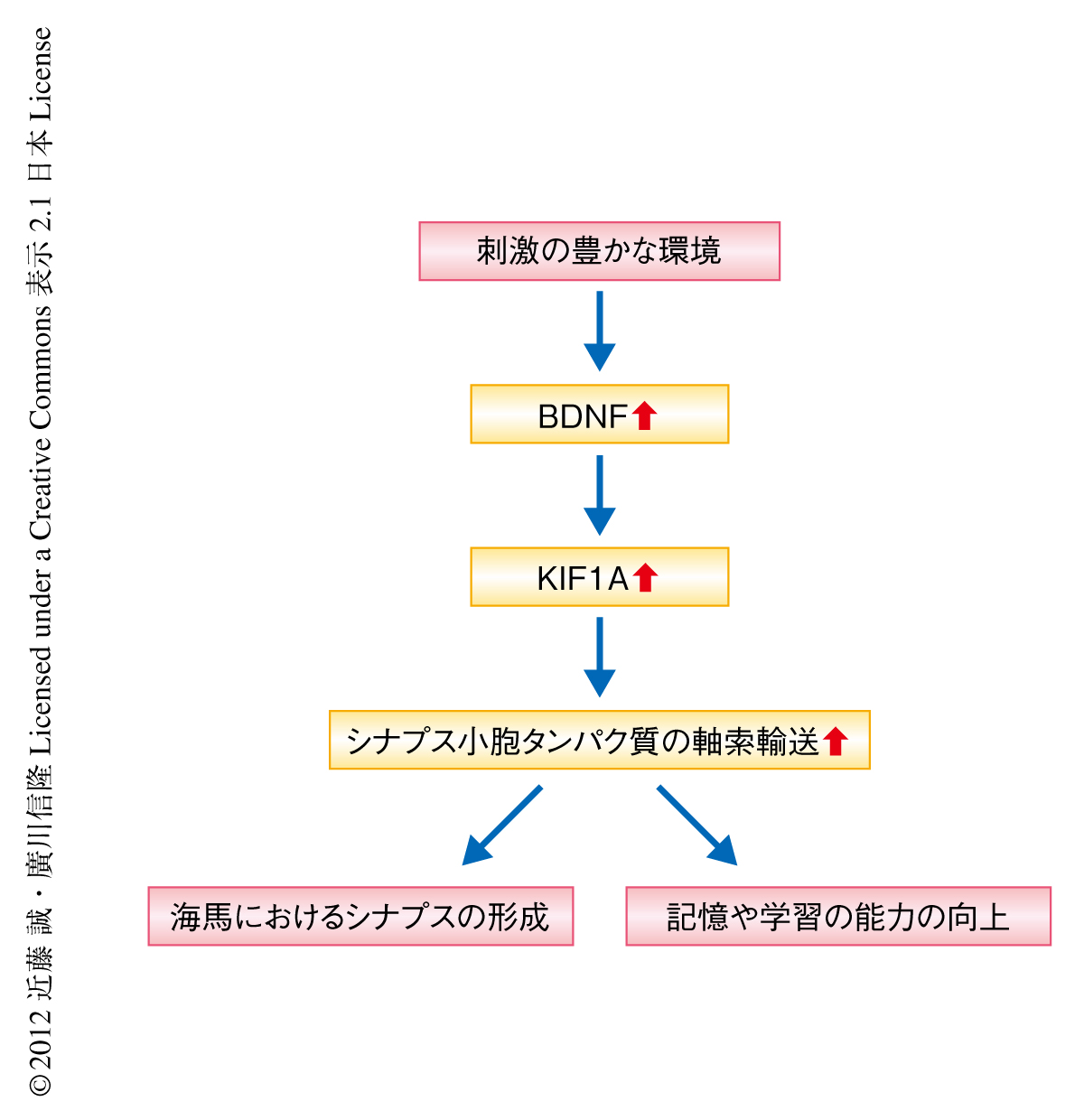
この研究において,筆者らは,刺激の豊かな環境で育ったマウスの海馬においてBDNFに依存的にキネシンスーパーファミリータンパク質KIF1Aの発現が増大することを発見し,また,このKIF1Aがシナプス小胞タンパク質を軸索輸送することで前シナプス側からのシナプスの形成,さらには,記憶や学習の能力の向上に寄与していることを明らかにした(図2).特筆すべきは,モータータンパク質が生育環境や経験によりひき起こされる脳の形態的な変化や動物の行動の変化に重要な役割を担っていることをはじめて示したことである.これにより,モータータンパク質がニューロンのネットワークをリモデリングすることで脳機能のファインチューニングに寄与していることが考えられ,モータータンパク質の新たな機能が明らかとなった.また,これまでの刺激の豊かな環境によりひき起こされる脳の形態的および機能的な変化についての研究は,NMDA受容体やAMPA受容体などによる後シナプスにおける機序に重点がおかれており,前シナプスにおける機序は明らかではなかった.したがって,この研究は,生育環境によりひき起こされる,いわば,経験に依存的な脳の可塑性の基盤をなす前シナプスにおける機序の解明につながるものであり,将来,脳神経疾患の病態の解明や治療法の開発にむけた新しいアプローチとなることが期待される.
東京大学大学院医学系研究科博士課程 在学中.
研究テーマ:キネシンスーパーファミリータンパク質の分子遺伝学的な解析.
廣川 信隆(Nobutaka Hirokawa)
東京大学大学院医学系研究科 特任教授.
© 2012 近藤 誠・廣川信隆 Licensed under CC 表示 2.1 日本
(東京大学大学院医学系研究科 分子構造・動態学講座,細胞生物学・解剖学大講座)
email:廣川信隆
DOI: 10.7875/first.author.2012.030
Motor protein KIF1A is essential for hippocampal synaptogenesis and learning enhancement in an enriched environment.
Makoto Kondo, Yosuke Takei, Nobutaka Hirokawa
Neuron, 73, 743-757 (2012)
要 約
刺激の豊かな環境で育ったマウスの脳にはさまざまな影響のあることが報告されていたが,その詳細な機序は明らかではなかった.今回,筆者らは,キネシンスーパーファミリータンパク質に属するモータータンパク質KIF1Aの発現が刺激の豊かな環境で育ったマウスの海馬において増大していることを発見し,さらに,神経栄養因子BDNFがKIF1Aの発現を制御していることを見い出した.また,ノックアウトマウスの解析により,KIF1Aが刺激の豊かな環境で育ったマウスにみられる海馬におけるシナプスの形成,および,記憶や学習の能力の向上という形態的および行動的な可塑性に必須であることを明らかにした.この研究は,モータータンパク質が生育環境によりひき起こされる脳の形態的な変化や動物の行動の変化に重要な役割を担っていることをはじめて示すものである.また,これまで明らかではなかった,経験に依存的な脳の可塑性の基盤をなす前シナプスにおける機序の解明につながるもので,将来,脳神経疾患の病態の解明や治療法の開発にむけた新しいアプローチとなることが期待される.
はじめに
刺激の豊かな環境(エンリッチな環境)とは,トンネル,イグルーなどの玩具や運動用の回転車輪をあたえたり,より大きなケージで多くの個体をいっしょに飼ったりすることにより,動物がより多くの感覚,運動,認知的かつ社会的な刺激をうける生育環境のことである1).これまでに,この刺激の豊かな環境によりマウスやラットの脳に対し分子,細胞さらには行動にいたるまで多くのレベルでさまざまな影響のあることや,脳神経疾患に対し有益な効果のあることが報告されていた2).また,刺激の豊かな環境がもたらすこれらの変化には脳由来神経栄養因子(brain-derived neurotrophic factor:BDNF)の関与していることが知られていたが3),その詳細な機序は明らかではなかった.
キネシンスーパーファミリータンパク質(kinesin superfamily protein:KIF)は細胞において微小管にそって膜オルガネラ,タンパク質複合体やmRNAを輸送するモータータンパク質であり,細胞の生存,形態形成および機能発現に非常に重要なはたらきをしている4,5).興味深いことに最近,キネシンスーパーファミリータンパク質が記憶や学習に関与していることが示された6).そこで筆者らは,刺激の豊かな環境で育ったマウスには海馬におけるシナプスの形成7),および,記憶や学習の能力の向上8) のみられることに着目し,マウスの海馬において刺激の豊かな環境によりキネシンスーパーファミリータンパク質の発現は変化するのか,そしてさらに,これらの形態的および行動的な変化とキネシンスーパーファミリータンパク質との関連性について調べた.
1.刺激の豊かな環境はマウスの海馬においてBDNFに依存的なKIF1Aの発現の上昇をもたらす
刺激の豊かな環境によりマウスの海馬においてキネシンスーパーファミリータンパク質の発現が変化するのかどうか調べた.離乳の直後の3週齢の雄マウスを,数種類の玩具や運動用の回転車輪のある大きなケージに15匹(刺激の豊かな環境),または,玩具などの存在しない通常のケージに3匹(通常の環境)入れて飼育し(図1),キネシンスーパーファミリータンパク質の発現量を比較した.すると,刺激の豊かな環境で育ったマウスの海馬では飼育して2週間後からKIF1Aの発現の著明な上昇がみられた.KIF1Aは神経組織に特異的なキネシンスーパーファミリータンパク質であり,ニューロンにおいてシナプトファイシン,シナプトタグミン,Rab3Aといったシナプス小胞タンパク質を含むシナプス小胞の前駆体を輸送していることが知られている9).さらにくわしく調べてみたところ,飼育して3週間後には通常の環境で育ったマウスと比べKIF1Aは約1.7倍もの発現上昇が認められた.また,mRNAレベルにおいてもKIF1AをコードするmRNAの発現の上昇がみられた.さらに,刺激の豊かな環境で育ったマウスの海馬においてはBDNFの発現の上昇も認められた.
つぎに,BDNFヘテロノックアウトマウスおよびKIF1Aヘテロノックアウトマウスを用いて,刺激の豊かな環境による海馬におけるタンパク質の発現の変化を調べたところ,BDNFヘテロノックアウトマウスの海馬においては刺激の豊かな環境によりBDNFの発現のわずかな上昇がみられたのに対し,KIF1Aの発現の有意な上昇は認められなかった.一方,KIF1Aヘテロノックアウトマウスの海馬においては刺激の豊かな環境によりKIF1Aの発現のわずかな上昇とBDNFの発現の中程度の上昇を認めた.これらの結果は,刺激の豊かな環境によりマウスの海馬においてKIF1Aの発現が増大し,この過程においてBDNFが重要なはたらきをしていることを示していた.
2.BDNFヘテロノックアウトマウスおよびKIF1Aヘテロノックアウトマウスでは刺激の豊かな環境による記憶や学習の能力の向上はみられない
刺激の豊かな環境による記憶や学習の能力の向上8) に,海馬におけるKIF1Aの発現の上昇がどのように関与しているか調べた.まず,空間記憶能力を調べるため,Morris水迷路試験(円形のプールに放されたマウスやラットが水面下に沈んだプラットフォームを泳いで探し,そこに到達するまでの時間と軌跡を測定することで空間記憶能力を評価するもの)を行った.野生型マウスでは刺激の豊かな環境で育ったマウスのほうが通常の環境で育ったマウスと比べ回を重ねるほどより早くゴールにたどり着き,空間学習能力の向上が認められた.しかし,BDNFヘテロノックアウトマウスおよびKIF1Aヘテロノックアウトマウスではそのような向上はみられなかった.さらに,恐怖条件づけ文脈学習試験(電気刺激をあたえたマウスを一定時間ののち再び電気刺激をあたえた場所に置き,その際に観察される恐怖反応の時間を測定することで文脈学習能力を評価するもの)においても同様に,野生型マウスでは刺激の豊かな環境による文脈学習能力の向上が認められたのに対し,BDNFヘテロノックアウトマウスおよびKIF1Aヘテロノックアウトマウスではそのような向上はみられなかった.これらの結果は,刺激の豊かな環境による記憶や学習の能力の向上にはBDNFおよびKIF1Aの発現の上昇が重要であることを示していた.
3.BDNFヘテロノックアウトマウスおよびKIF1Aヘテロノックアウトマウスでは刺激の豊かな環境による海馬におけるシナプスの形成はみられない
刺激の豊かな環境による海馬におけるシナプスの形成7) に,KIF1Aの発現の上昇がどのように関与しているか調べた.刺激の豊かな環境で育ったマウスと通常の環境で育ったマウスについて,電子顕微鏡を用いて海馬CA1領域の放線状層(stratum radiatum)におけるシナプスの密度の定量的な解析を行った.野生型マウスでは通常の環境で育ったマウスと比べ刺激の豊かな環境で育ったマウスにおいてシナプスの密度の増大が認められたのに対し,BDNFヘテロノックアウトマウスおよびKIF1Aヘテロノックアウトマウスでは刺激の豊かな環境によるシナプスの密度の増大はみられなかった.さらに,シナプトファイシンとPSD-95の二重染色による免疫組織学的な手法を用いたシナプスの密度の定量的な解析でも同様の結果が得られた.これらの結果は,刺激の豊かな環境による海馬におけるシナプスの形成にはBDNFおよびKIF1Aの発現の上昇が重要であることを示していた.
4.BDNFは海馬のニューロンにおいてKIF1Aの発現の上昇をもたらし軸索輸送を増大させる
海馬におけるBDNFに依存的なKIF1Aの発現の制御についてさらにくわしく検討した.まず,海馬培養ニューロンにおいてBDNFの投与によるKIF1Aの発現の変化を調べたところ,時間依存的かつ濃度依存的に発現の上昇が認められた.また,BDNFの受容体であるチロシンキナーゼTrkの阻害剤の投与によりKIF1Aの発現の上昇は阻害された.さらに,mRNAレベルにおいてもBDNFの投与によるKIF1AをコードするmRNAの発現の上昇がみられた.一方で,BDNFを投与してもKIF1AをコードするmRNAの安定性には影響はなかったことから,KIF1Aの発現の上昇には転写レベルでの制御がはたらいていることが考えられた.また,培養アストロサイトではBDNFの投与によるKIF1Aの発現の変化は認められなかった.
BDNFの投与によりKIF1Aによる軸索輸送にどのような影響があるか調べた.シナプトファイシンを含有する小胞の動態を生細胞イメージング法により経時的に観察したところ,BDNFを投与した海馬のニューロンの軸索では順行性輸送の頻度の増大を認めた.一方で,逆行性輸送や輸送の速度には影響はみられなかった.
これらの結果は,BDNFは海馬のニューロンにおいてKIF1Aの発現の上昇をもたらしKIF1Aによる軸索輸送を増大させていることを示していた.
5.KIF1AはBDNFによる海馬におけるシナプスの形成に必須である
BDNFはシナプスの可塑性を制御し,また,シナプスの形成を促進することが知られている10).そこで,BDNFによる海馬におけるシナプスの形成にKIF1Aがどのように関与しているのか調べた.野生型マウスに由来する海馬培養ニューロン,KIF1Aヘテロノックアウトマウスに由来する海馬培養ニューロンおよびKIF1Aホモノックアウトマウスに由来する海馬培養ニューロンについて,シナプトファイシンとPSD-95の二重染色による免疫細胞学的な手法を用いてBDNFを投与したときのシナプスの密度の定量的な解析を行った.BDNFの投与により野生型の海馬培養ニューロンではシナプスの密度の増大を認めたのに対し,KIF1Aヘテロノックアウト海馬培養ニューロンおよびKIF1Aホモノックアウト海馬培養ニューロンではシナプスの密度の増大はみられなかった.この結果は,BDNFによる海馬におけるシナプスの形成にKIF1Aが重要であることを示していた.
6.KIF1Aの過剰な発現は海馬におけるシナプスの形成を促進する
KIF1Aのシナプスの形成における役割を確認するため,海馬培養ニューロンにKIF1Aを過剰に発現させるとどうなるか調べた.すると,KIF1Aを過剰に発現させた海馬培養ニューロンではその前シナプス領域の数の増大と,さらには,シナプスの数の増大が認められた.この結果は,KIF1Aの過剰な発現はシナプスボタン(前シナプスの終末に形成されるふくらみ)の形成を促進し,さらに,シナプスの形成を促進することを示していた.
おわりに
この研究において,筆者らは,刺激の豊かな環境で育ったマウスの海馬においてBDNFに依存的にキネシンスーパーファミリータンパク質KIF1Aの発現が増大することを発見し,また,このKIF1Aがシナプス小胞タンパク質を軸索輸送することで前シナプス側からのシナプスの形成,さらには,記憶や学習の能力の向上に寄与していることを明らかにした(図2).特筆すべきは,モータータンパク質が生育環境や経験によりひき起こされる脳の形態的な変化や動物の行動の変化に重要な役割を担っていることをはじめて示したことである.これにより,モータータンパク質がニューロンのネットワークをリモデリングすることで脳機能のファインチューニングに寄与していることが考えられ,モータータンパク質の新たな機能が明らかとなった.また,これまでの刺激の豊かな環境によりひき起こされる脳の形態的および機能的な変化についての研究は,NMDA受容体やAMPA受容体などによる後シナプスにおける機序に重点がおかれており,前シナプスにおける機序は明らかではなかった.したがって,この研究は,生育環境によりひき起こされる,いわば,経験に依存的な脳の可塑性の基盤をなす前シナプスにおける機序の解明につながるものであり,将来,脳神経疾患の病態の解明や治療法の開発にむけた新しいアプローチとなることが期待される.
文 献
- van Praag, H., Kempermann, G. & Gage, F. H.: Neural consequences of environmental enrichment. Nat. Rev. Neurosci., 1, 191-198 (2000)[PubMed]
- Nithianantharajah, J. & Hannan, A. J.: Enriched environments, experience-dependent plasticity and disorders of the nervous system. Nat. Rev. Neurosci., 7, 697-709 (2006)[PubMed]
- Falkenberg, T., Mohammed, A. K., Henriksson, B. et al.: Increased expression of brain-derived neurotrophic factor mRNA in rat is associated with improved spatial memory and enriched environment. Neurosci. Lett., 138, 153-156 (1992)[PubMed]
- Hirokawa, N., Noda, Y., Tananka, Y. et al.: Kinesin superfamily motor proteins and intracellular transport. Nat. Rev. Mol. Cell Biol., 10, 682-696 (2009)[PubMed]
- Hirokawa, N., Niwa, S. & Tanaka, Y.: Molecular motors in neurons: transport mechanisms and roles in brain function, development, and disease. Neuron, 68, 610-638 (2010)[PubMed]
- Yin, X., Takei, Y., Kido, M. A. et al.: Molecular motor KIF17 is fundamental for memory and learning via differential support of synaptic NR2A/2B levels. Neuron, 70, 310-325 (2011)[PubMed]
- Rampon, C., Tang, Y. P., Goodhouse, J. et al.: Enrichment induces structural changes and recovery from nonspatial memory deficits in CA1 NMDAR1-kockout mice. Nat. Neurosci., 3, 238-244 (2000)[PubMed]
- Kempermann, G., Kuhn, H. G. & Gage, F. H.: More hippocampal neurons in adult mice living in an enriched environment. Nature, 386, 493-495 (1997)[PubMed]
- Okada, Y., Yamazaki, H., Sekine-Aizawa, Y. et al.: The neuron-specific kinesin superfamily protein KIF1A is a unique monomeric motor for anterograde axonal transport of synaptic vesicle precursors. Cell, 81, 769-780 (1995)[PubMed]
- Bramham, C. R. & Messaoudi, E.: BDNF function in adult synaptic plasticity: the synaptic consolidation hypothesis. Prog. Neurobiol., 76, 99-125 (2005)[PubMed]
著者プロフィール
東京大学大学院医学系研究科博士課程 在学中.
研究テーマ:キネシンスーパーファミリータンパク質の分子遺伝学的な解析.
廣川 信隆(Nobutaka Hirokawa)
東京大学大学院医学系研究科 特任教授.
© 2012 近藤 誠・廣川信隆 Licensed under CC 表示 2.1 日本