骨芽細胞系細胞と破骨細胞前駆細胞とのあいだのWnt5a-Ror2シグナル伝達系は破骨細胞の分化を亢進する
小林泰浩・高橋直之
(松本歯科大学総合歯科歯学研究所 硬組織機能解析学)
email:小林泰浩,高橋直之
DOI: 10.7875/first.author.2012.029
Wnt5a-Ror2 signaling between osteoblast-lineage cells and osteoclast precursors enhances osteoclastogenesis.
Kazuhiro Maeda, Yasuhiro Kobayashi, Nobuyuki Udagawa, Shunsuke Uehara, Akihiro Ishihara, Toshihide Mizoguchi, Yuichiro Kikuchi, Ichiro Takada, Shigeaki Kato, Shuichi Kani, Michiru Nishita, Keishi Marumo, T John Martin, Yasuhiro Minami, Naoyuki Takahashi
Nature Medicine, 18, 405-412 (2012)
シグナル伝達タンパク質Wntはβカテニンを介する古典経路と介さない非古典経路とを活性化し骨の恒常性を保っている.しかし,骨吸収におけるWnt非古典経路の役割は明らかではない.Wnt5aはその受容体であるRor2を介し非古典経路を活性化する.筆者らは,骨芽細胞系細胞に発現するWnt5aが破骨細胞前駆細胞に発現するRor2に結合すると,破骨細胞の分化誘導タンパク質RANKLの受容体であるRANKの発現が亢進することを示した.この分子機構によりWnt5aはRANKLによる破骨細胞の分化を亢進した.さらに,Wnt5aのデコイ受容体としてRor2の細胞外領域とグルタチオン-S-トランスフェラーゼとの融合タンパク質を作製し骨破壊を生じる関節炎モデルマウスに投与したところ骨破壊は抑制された.以上より,Wnt5a-Ror2シグナル伝達系は骨疾患の新たな治療標的となる可能性がある.
骨吸収をつかさどる破骨細胞は単球・マクロファージ系の前駆細胞が分化した多核巨細胞である.破骨細胞の分化は骨を形成する骨芽細胞系細胞が分泌するRANKLとCSF1により厳密に制御されている1,2).RANKLの発現は活性型ビタミンD3など骨吸収刺激因子により誘導される3).破骨細胞前駆細胞はRANKLの受容体RANKとCSF1受容体を発現する.RANKLとCSF1がこれらの受容体に結合すると破骨細胞への分化が誘導される(図1).また,骨芽細胞系細胞はRANKLのデコイ受容体であるオステオプロテゲリンを発現し,これはRANKLとRANKとの結合を阻害して破骨細胞の分化を阻害する.筆者らは,RANKを強く発現する破骨細胞前駆細胞が骨芽細胞の近傍に局在することを明らかにしている4).しかし,なぜ骨芽細胞の近傍の破骨細胞前駆細胞がRANKを強く発現するのか,その分子機構は明らかではない.
Wntはβカテニンを介する古典経路と介さない非古典経路を活性化する.Wnt古典経路の共受容体であるLRP5の機能喪失型変異体の解析から,Wnt古典経路は骨芽細胞の分化において重要であることが示されている5).また,骨芽細胞にβカテニンの恒常活性型変異体を発現させると,オステオプロテゲリンの発現が亢進し破骨細胞の分化が抑制されるため骨大理石病を呈することが明らかになっている6).このように,骨芽細胞におけるWnt古典経路は骨形成と骨吸収の両者を制御している.しかし,骨吸収におけるWnt非古典経路の役割は明らかではない.
はじめに,マウスの頭蓋冠に由来する骨芽細胞と骨髄に由来するマクロファージにおけるWntリガンドの発現を解析したところ,マクロファージと比較して骨芽細胞はWnt5aを強く発現した.さらに,免疫蛍光染色法によりWnt5aを発現する細胞は骨芽細胞のマーカーであるアルカリホスファターゼOsterixおよびRunx2を発現することを確認した.これらの結果は,骨組織において骨芽細胞はWnt5aを強く発現することを示していた.また,骨芽細胞から分泌されるWnt5aが骨吸収あるいは骨形成を制御する可能性が示唆された.
そこで,Wnt5aのノックアウトマウスおよびWnt5aの受容体であるRor2のノックアウトマウス7) の骨組織を解析した.Wnt5aノックアウトマウスおよびRor2ノックアウトマウスは周産期致死のため胎生18.5日齢のマウスを解析した.どちらのノックアウトマウスの骨組織においても破骨細胞の数の著しい減少が認められた.これらの結果は,生理的な状態においてWnt5aとRor2は破骨細胞の分化を制御していることを意味した.
破骨細胞の分化におけるWnt5aの作用を明らかにするため,つぎの実験を行った.破骨細胞の前駆細胞であるマクロファージをRANKLとCSF1の存在下で培養すると破骨細胞が形成される.この培養系にWnt5aを添加したところ,破骨細胞の形成の亢進が認められた.RANKLの非存在下ではWnt5aは破骨細胞の形成を誘導しなかった.また,破骨細胞前駆細胞はRor1ではなくRor2を発現していた.Ror2ノックアウトマウスに由来するマクロファージを用いた破骨細胞の形成の実験では,Wnt5aによる破骨細胞の形成の促進作用はまったく認められなかった.この結果は,Wnt5aはRor2を介しRANKLによる破骨細胞の形成を亢進していることを意味した.
破骨細胞の分化におけるRor2の役割を明らかにするため,破骨細胞前駆細胞に特異的なRor2ノックアウトマウスを作製した.8週齢の破骨細胞前駆細胞に特異的なRor2ノックアウトマウスにおいて,大腿骨の長さは対照のマウスと差が認められなかったが,マイクロX線CT解析により海綿骨量の増加が認められた.組織学的な解析の結果,破骨細胞前駆細胞に特異的なRor2ノックアウトマウスでは破骨細胞の数が有意に減少していた.
破骨細胞の分化において骨芽細胞から分泌されるWnt5aの役割を明らかにするため,骨芽細胞系細胞に特異的なWnt5aノックアウトマウスを作製した.組織学的な解析の結果,8週齢の骨芽細胞系細胞に特異的なWnt5aノックアウトマウスは破骨細胞前駆細胞に特異的なRor2ノックアウトマウスと同様に,破骨細胞の数の顕著な低下を示した.
Wnt5が破骨細胞の形成を亢進する分子機構を明らかにするため,破骨細胞前駆細胞に特異的なRor2ノックアウトマウスの骨組織における破骨細胞関連遺伝子の発現を解析した.破骨細胞前駆細胞に特異的なRor2ノックアウトマウスでは,Ctsk遺伝子(カテプシンK),Calcr遺伝子(カルシトニン受容体),Acp5遺伝子(酒石酸耐性酸ホスファターゼ)の発現の低下にくわえ,RANK遺伝子の発現の低下を認めた.また,RANKを発現する細胞で蛍光を発するRANK-EGFPマウスに由来する骨髄マクロファージの培養においてWnt5aを添加すると,RANKを発現する細胞の著明な増加が認められた.これらの結果は,Wnt5aはRANKの発現を正に制御している可能性を示唆した.
そこで,2 kbの長さをもつRANK遺伝子のプロモーター領域を解析した.さまざまな長さのプロモーター領域を含むルシフェラーゼベクターを発現させたRAW264.7細胞をWnt5aの存在下で培養しルシフェラーゼ活性を測定した.その結果,転写開始点の5’側の近傍にあるSp1結合領域がWnt5aによるRANK遺伝子のプロモーター活性の誘導に重要であることが明らかになった.この領域を欠失したベクターを発現した細胞ではWnt5aによるプロモーター活性の上昇は認められなかった.さらに,破骨細胞前駆細胞に特異的なRor2ノックアウトマウスに由来するマクロファージにおいてWnt5aによるRANK遺伝子のプロモーター活性の上昇は認められないことを確認した.Wnt5aはRor2を介してc-JunのキナーゼであるJNKを活性化することが報告されている8).また,Sp1とc-Junとが結合すると転写活性が増強されることも明らかになっている9).そこで,RANK遺伝子プロモーターのSp1結合領域にSp1およびc-Junがリクルートされているかどうかをクロマチン免疫沈降法により解析したところ,Wnt5aの刺激によりc-JunがSp1結合領域にリクルートされることが明らかになった.以上より,Wnt5aは破骨細胞前駆細胞においてRor2に結合してJNKを活性化し,JNKはc-JunをRANK遺伝子プロモーターのSp1結合領域にリクルートすることでRANKの発現を上昇させていることが明らかになった.
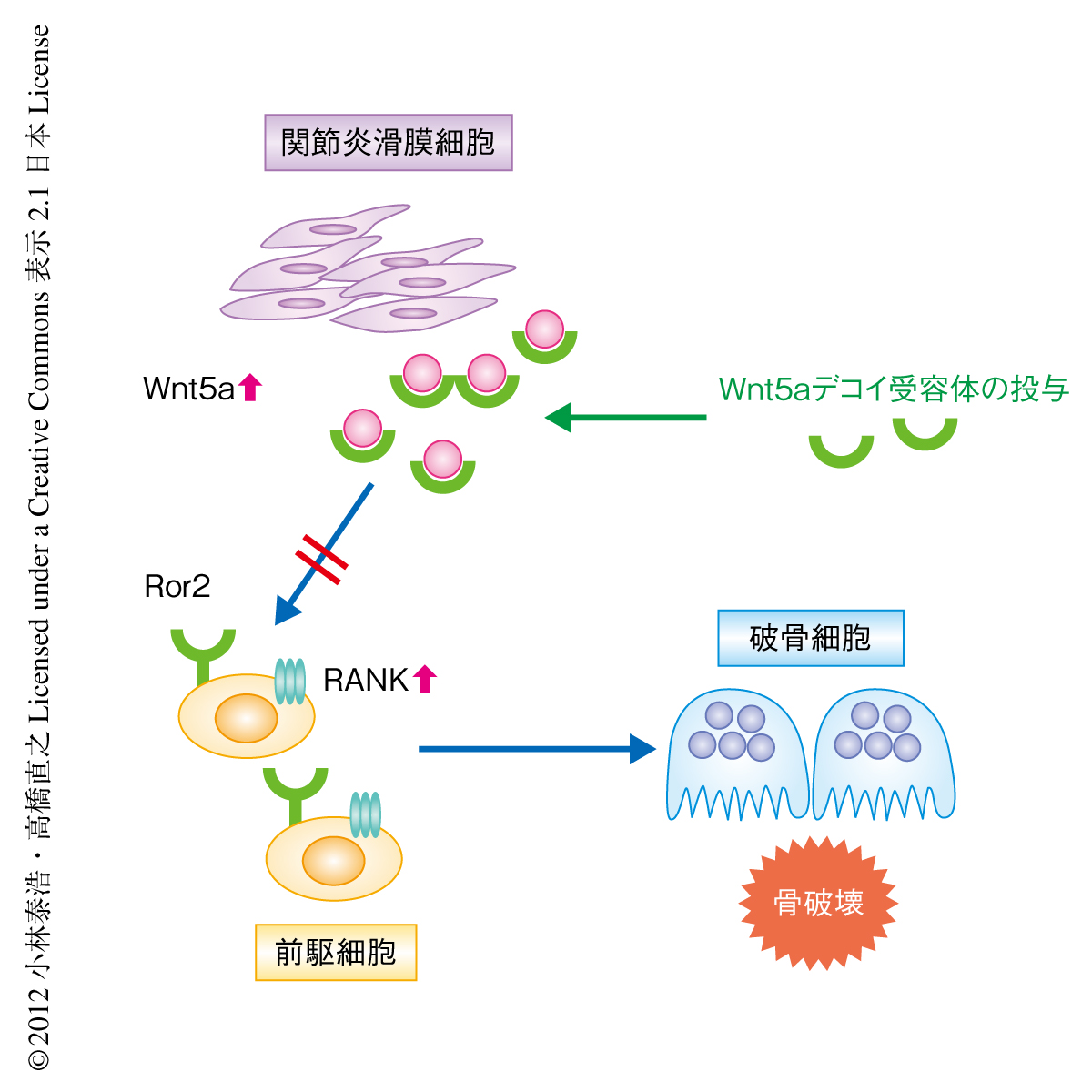
関節リウマチの滑膜細胞はWnt5aを強く発現することが報告されている10).関節リウマチにおけるWnt5aの役割を明らかにするため,Wnt5aのデコイ受容体として,Ror2の細胞外領域とグルタチオン-S-トランスフェラーゼとの融合タンパク質を作製した.この融合タンパク質はグルタチオン-S-トランスフェラーゼによるプルダウンアッセイにおいてWnt5aと強く結合し,また,Wnt5aによるRANKL誘導性の破骨細胞の形成の促進作用を抑制した.また,RANK遺伝子のプロモーターアッセイにおいてもWnt5aによる転写活性の誘導を抑制した.つまり,このRor2の細胞外領域とグルタチオン-S-トランスフェラーゼとの融合タンパク質はWnt5aのデコイ受容体として機能することが確認された.そこで,II型コラーゲン誘発性の関節炎モデルマウスにこのWnt5aデコイ受容体を19日間投与した.足背の厚さおよび組織学的な解析において,Wnt5aデコイ受容体を投与した関節炎モデルマウスの炎症の程度は対照と比較して差を認めなかった.しかし,マイクロX線CT解析の結果,Wnt5aデコイ受容体を投与した関節炎モデルマウスでは関節骨の破壊が顕著に抑制されていることが明らかになった.また,Wnt5aデコイ受容体を投与した関節炎モデルマウスの関節ではRANKを発現した細胞の数が有意に減少し,破骨細胞の数が有意に減少することが明らかになった(図2).
生理的な骨形成と骨吸収の過程において,骨芽細胞系細胞と破骨細胞前駆細胞とのあいだのWnt5a-Ror2シグナル伝達系は破骨細胞前駆細胞におけるRANKの発現を上昇させ破骨細胞への分化を促進させた.Wnt5a-Ror2シグナル伝達系だけでは破骨細胞の分化を誘導できなかったことから,Wnt5aは破骨細胞の分化における新しい共刺激タンパク質であると考えられた.また,関節リウマチにおいて滑膜細胞に発現するWnt5aは過剰な破骨細胞の形成を誘導し関節を破壊する.すなわち,Wnt5a-Ror2シグナル伝達系は関節リウマチや閉経後骨粗鬆症など骨吸収が過剰に進行する疾患の新たな治療標的となるであろう.
略歴:1994年 長崎大学大学院歯学研究科 修了,同年 同 助手を経て,2002年より松本歯科大学総合歯科医学研究所 准教授.
研究テーマ:マウスの遺伝学を用いた破骨細胞の分化および活性化の機構の解明.
抱負:Wnt5aあるいはRor2を標的とした創薬をめざしたい.
高橋 直之(Naoyuki Takahashi)
松本歯科大学総合歯科医学研究所 教授.
© 2012 小林泰浩・高橋直之 Licensed under CC 表示 2.1 日本
(松本歯科大学総合歯科歯学研究所 硬組織機能解析学)
email:小林泰浩,高橋直之
DOI: 10.7875/first.author.2012.029
Wnt5a-Ror2 signaling between osteoblast-lineage cells and osteoclast precursors enhances osteoclastogenesis.
Kazuhiro Maeda, Yasuhiro Kobayashi, Nobuyuki Udagawa, Shunsuke Uehara, Akihiro Ishihara, Toshihide Mizoguchi, Yuichiro Kikuchi, Ichiro Takada, Shigeaki Kato, Shuichi Kani, Michiru Nishita, Keishi Marumo, T John Martin, Yasuhiro Minami, Naoyuki Takahashi
Nature Medicine, 18, 405-412 (2012)
この論文に出現する遺伝子・タンパク質のUniprot ID
Wnt5a(P22725), Ror2(Q9Z138), Wnt, βカテニン, RANKL(O35235), RANK(O35305), デコイ受容体, グルタチオン-S-トランスフェラーゼ, CSF1(P07141), オステオプロテゲリン(O00300), LRP5(Q91VN0), Osterix(Q8VI67), Runx2(Q08775), Ror1(Q9Z139), JNK, Wnt5, Ctsk(P55097), カテプシンK(P55097), Calcr(Q60755), カルシトニン受容体(Q60755), Acp5(Q05117), 酒石酸耐性酸ホスファターゼ(Q05117), Sp1(O89090), c-Jun(P05627), II型コラーゲン
要 約
シグナル伝達タンパク質Wntはβカテニンを介する古典経路と介さない非古典経路とを活性化し骨の恒常性を保っている.しかし,骨吸収におけるWnt非古典経路の役割は明らかではない.Wnt5aはその受容体であるRor2を介し非古典経路を活性化する.筆者らは,骨芽細胞系細胞に発現するWnt5aが破骨細胞前駆細胞に発現するRor2に結合すると,破骨細胞の分化誘導タンパク質RANKLの受容体であるRANKの発現が亢進することを示した.この分子機構によりWnt5aはRANKLによる破骨細胞の分化を亢進した.さらに,Wnt5aのデコイ受容体としてRor2の細胞外領域とグルタチオン-S-トランスフェラーゼとの融合タンパク質を作製し骨破壊を生じる関節炎モデルマウスに投与したところ骨破壊は抑制された.以上より,Wnt5a-Ror2シグナル伝達系は骨疾患の新たな治療標的となる可能性がある.
はじめに
骨吸収をつかさどる破骨細胞は単球・マクロファージ系の前駆細胞が分化した多核巨細胞である.破骨細胞の分化は骨を形成する骨芽細胞系細胞が分泌するRANKLとCSF1により厳密に制御されている1,2).RANKLの発現は活性型ビタミンD3など骨吸収刺激因子により誘導される3).破骨細胞前駆細胞はRANKLの受容体RANKとCSF1受容体を発現する.RANKLとCSF1がこれらの受容体に結合すると破骨細胞への分化が誘導される(図1).また,骨芽細胞系細胞はRANKLのデコイ受容体であるオステオプロテゲリンを発現し,これはRANKLとRANKとの結合を阻害して破骨細胞の分化を阻害する.筆者らは,RANKを強く発現する破骨細胞前駆細胞が骨芽細胞の近傍に局在することを明らかにしている4).しかし,なぜ骨芽細胞の近傍の破骨細胞前駆細胞がRANKを強く発現するのか,その分子機構は明らかではない.
Wntはβカテニンを介する古典経路と介さない非古典経路を活性化する.Wnt古典経路の共受容体であるLRP5の機能喪失型変異体の解析から,Wnt古典経路は骨芽細胞の分化において重要であることが示されている5).また,骨芽細胞にβカテニンの恒常活性型変異体を発現させると,オステオプロテゲリンの発現が亢進し破骨細胞の分化が抑制されるため骨大理石病を呈することが明らかになっている6).このように,骨芽細胞におけるWnt古典経路は骨形成と骨吸収の両者を制御している.しかし,骨吸収におけるWnt非古典経路の役割は明らかではない.
1.骨芽細胞に発現するWnt5aはRANKLによる破骨細胞の分化を亢進する
はじめに,マウスの頭蓋冠に由来する骨芽細胞と骨髄に由来するマクロファージにおけるWntリガンドの発現を解析したところ,マクロファージと比較して骨芽細胞はWnt5aを強く発現した.さらに,免疫蛍光染色法によりWnt5aを発現する細胞は骨芽細胞のマーカーであるアルカリホスファターゼOsterixおよびRunx2を発現することを確認した.これらの結果は,骨組織において骨芽細胞はWnt5aを強く発現することを示していた.また,骨芽細胞から分泌されるWnt5aが骨吸収あるいは骨形成を制御する可能性が示唆された.
そこで,Wnt5aのノックアウトマウスおよびWnt5aの受容体であるRor2のノックアウトマウス7) の骨組織を解析した.Wnt5aノックアウトマウスおよびRor2ノックアウトマウスは周産期致死のため胎生18.5日齢のマウスを解析した.どちらのノックアウトマウスの骨組織においても破骨細胞の数の著しい減少が認められた.これらの結果は,生理的な状態においてWnt5aとRor2は破骨細胞の分化を制御していることを意味した.
破骨細胞の分化におけるWnt5aの作用を明らかにするため,つぎの実験を行った.破骨細胞の前駆細胞であるマクロファージをRANKLとCSF1の存在下で培養すると破骨細胞が形成される.この培養系にWnt5aを添加したところ,破骨細胞の形成の亢進が認められた.RANKLの非存在下ではWnt5aは破骨細胞の形成を誘導しなかった.また,破骨細胞前駆細胞はRor1ではなくRor2を発現していた.Ror2ノックアウトマウスに由来するマクロファージを用いた破骨細胞の形成の実験では,Wnt5aによる破骨細胞の形成の促進作用はまったく認められなかった.この結果は,Wnt5aはRor2を介しRANKLによる破骨細胞の形成を亢進していることを意味した.
2.破骨細胞前駆細胞に特異的なRor2ノックアウトマウスおよび骨芽細胞系細胞に特異的なWnt5aノックアウトマウスは破骨細胞の減少を呈する
破骨細胞の分化におけるRor2の役割を明らかにするため,破骨細胞前駆細胞に特異的なRor2ノックアウトマウスを作製した.8週齢の破骨細胞前駆細胞に特異的なRor2ノックアウトマウスにおいて,大腿骨の長さは対照のマウスと差が認められなかったが,マイクロX線CT解析により海綿骨量の増加が認められた.組織学的な解析の結果,破骨細胞前駆細胞に特異的なRor2ノックアウトマウスでは破骨細胞の数が有意に減少していた.
破骨細胞の分化において骨芽細胞から分泌されるWnt5aの役割を明らかにするため,骨芽細胞系細胞に特異的なWnt5aノックアウトマウスを作製した.組織学的な解析の結果,8週齢の骨芽細胞系細胞に特異的なWnt5aノックアウトマウスは破骨細胞前駆細胞に特異的なRor2ノックアウトマウスと同様に,破骨細胞の数の顕著な低下を示した.
3.Wnt5aはJNKを活性化しRANKの発現を増強する
Wnt5が破骨細胞の形成を亢進する分子機構を明らかにするため,破骨細胞前駆細胞に特異的なRor2ノックアウトマウスの骨組織における破骨細胞関連遺伝子の発現を解析した.破骨細胞前駆細胞に特異的なRor2ノックアウトマウスでは,Ctsk遺伝子(カテプシンK),Calcr遺伝子(カルシトニン受容体),Acp5遺伝子(酒石酸耐性酸ホスファターゼ)の発現の低下にくわえ,RANK遺伝子の発現の低下を認めた.また,RANKを発現する細胞で蛍光を発するRANK-EGFPマウスに由来する骨髄マクロファージの培養においてWnt5aを添加すると,RANKを発現する細胞の著明な増加が認められた.これらの結果は,Wnt5aはRANKの発現を正に制御している可能性を示唆した.
そこで,2 kbの長さをもつRANK遺伝子のプロモーター領域を解析した.さまざまな長さのプロモーター領域を含むルシフェラーゼベクターを発現させたRAW264.7細胞をWnt5aの存在下で培養しルシフェラーゼ活性を測定した.その結果,転写開始点の5’側の近傍にあるSp1結合領域がWnt5aによるRANK遺伝子のプロモーター活性の誘導に重要であることが明らかになった.この領域を欠失したベクターを発現した細胞ではWnt5aによるプロモーター活性の上昇は認められなかった.さらに,破骨細胞前駆細胞に特異的なRor2ノックアウトマウスに由来するマクロファージにおいてWnt5aによるRANK遺伝子のプロモーター活性の上昇は認められないことを確認した.Wnt5aはRor2を介してc-JunのキナーゼであるJNKを活性化することが報告されている8).また,Sp1とc-Junとが結合すると転写活性が増強されることも明らかになっている9).そこで,RANK遺伝子プロモーターのSp1結合領域にSp1およびc-Junがリクルートされているかどうかをクロマチン免疫沈降法により解析したところ,Wnt5aの刺激によりc-JunがSp1結合領域にリクルートされることが明らかになった.以上より,Wnt5aは破骨細胞前駆細胞においてRor2に結合してJNKを活性化し,JNKはc-JunをRANK遺伝子プロモーターのSp1結合領域にリクルートすることでRANKの発現を上昇させていることが明らかになった.
4.Wnt5aのデコイ受容体は関節炎による骨破壊を抑制する
関節リウマチの滑膜細胞はWnt5aを強く発現することが報告されている10).関節リウマチにおけるWnt5aの役割を明らかにするため,Wnt5aのデコイ受容体として,Ror2の細胞外領域とグルタチオン-S-トランスフェラーゼとの融合タンパク質を作製した.この融合タンパク質はグルタチオン-S-トランスフェラーゼによるプルダウンアッセイにおいてWnt5aと強く結合し,また,Wnt5aによるRANKL誘導性の破骨細胞の形成の促進作用を抑制した.また,RANK遺伝子のプロモーターアッセイにおいてもWnt5aによる転写活性の誘導を抑制した.つまり,このRor2の細胞外領域とグルタチオン-S-トランスフェラーゼとの融合タンパク質はWnt5aのデコイ受容体として機能することが確認された.そこで,II型コラーゲン誘発性の関節炎モデルマウスにこのWnt5aデコイ受容体を19日間投与した.足背の厚さおよび組織学的な解析において,Wnt5aデコイ受容体を投与した関節炎モデルマウスの炎症の程度は対照と比較して差を認めなかった.しかし,マイクロX線CT解析の結果,Wnt5aデコイ受容体を投与した関節炎モデルマウスでは関節骨の破壊が顕著に抑制されていることが明らかになった.また,Wnt5aデコイ受容体を投与した関節炎モデルマウスの関節ではRANKを発現した細胞の数が有意に減少し,破骨細胞の数が有意に減少することが明らかになった(図2).
おわりに
生理的な骨形成と骨吸収の過程において,骨芽細胞系細胞と破骨細胞前駆細胞とのあいだのWnt5a-Ror2シグナル伝達系は破骨細胞前駆細胞におけるRANKの発現を上昇させ破骨細胞への分化を促進させた.Wnt5a-Ror2シグナル伝達系だけでは破骨細胞の分化を誘導できなかったことから,Wnt5aは破骨細胞の分化における新しい共刺激タンパク質であると考えられた.また,関節リウマチにおいて滑膜細胞に発現するWnt5aは過剰な破骨細胞の形成を誘導し関節を破壊する.すなわち,Wnt5a-Ror2シグナル伝達系は関節リウマチや閉経後骨粗鬆症など骨吸収が過剰に進行する疾患の新たな治療標的となるであろう.
文 献
- Takahashi, N., Akatsu, T., Udagawa, N. et al.: Osteoblastic cells are involved in osteoclast formation. Endocrinology, 123, 2600-2602 (1988)[PubMed]
- Suda, T., Takahashi, N., Udagawa, N. et al.: Modulation of osteoclast differentiation and function by the new members of the tumor necrosis factor receptor and ligand families. Endocr. Rev., 20, 345-357 (1999)[PubMed]
- Yasuda, H., Shima, N., Nakagawa, N. et al.: Osteoclast differentiation factor is a ligand for osteoprotegerin/osteoclastogenesis-inhibitory factor and is identical to TRANCE/RANKL. Proc. Natl. Acad. Sci. USA, 95, 3597-3602 (1998)[PubMed]
- Mizoguchi, T., Muto, A., Udagawa, N. et al.: Identification of cell cycle-arrested quiescent osteoclast precursors in vivo. J. Cell Biol., 184, 541-554 (2009)[PubMed]
- Gong, Y., Slee, R. B., Fukai, N. et al.: LDL receptor-related protein 5 (LRP5) affects bone accrual and eye development. Cell, 107, 513-523 (2001)[PubMed]
- Glass, D. A. 2nd, Bialek, P., Ahn, J. D. et al.: Canonical Wnt signaling in differentiated osteoblasts controls osteoclast differentiation. Dev. Cell, 8, 751-764 (2005)[PubMed]
- Takeuchi, S., Takeda, K., Oishi, I. et al.: Mouse Ror2 receptor tyrosine kinase is required for the heart development and limb formation. Genes Cells, 5, 71-78 (2000)[PubMed]
- Oishi, I., Suzuki, H., Onishi, N. et al.: The receptor tyrosine kinase Ror2 is involved in non-canonical Wnt5a/JNK signalling pathway. Genes Cells, 8, 645-654 (2003)[PubMed]
- Kardassis, D., Papakosta, P., Pardali, K. et al.: c-Jun transactivates the promoter of the human p21WAF1/Cip1 gene by acting as a superactivator of the ubiquitous transcription factor Sp1. J. Biol. Chem., 274, 29572-29581 (1999)[PubMed]
- Sen, M., Lauterbach, K., El-Gabalawy, H. et al.: Expression and function of wingless and frizzled homologs in rheumatoid arthritis. Proc. Natl. Acad. Sci. USA, 97, 2791-2796 (2000)[PubMed]
著者プロフィール
略歴:1994年 長崎大学大学院歯学研究科 修了,同年 同 助手を経て,2002年より松本歯科大学総合歯科医学研究所 准教授.
研究テーマ:マウスの遺伝学を用いた破骨細胞の分化および活性化の機構の解明.
抱負:Wnt5aあるいはRor2を標的とした創薬をめざしたい.
高橋 直之(Naoyuki Takahashi)
松本歯科大学総合歯科医学研究所 教授.
© 2012 小林泰浩・高橋直之 Licensed under CC 表示 2.1 日本