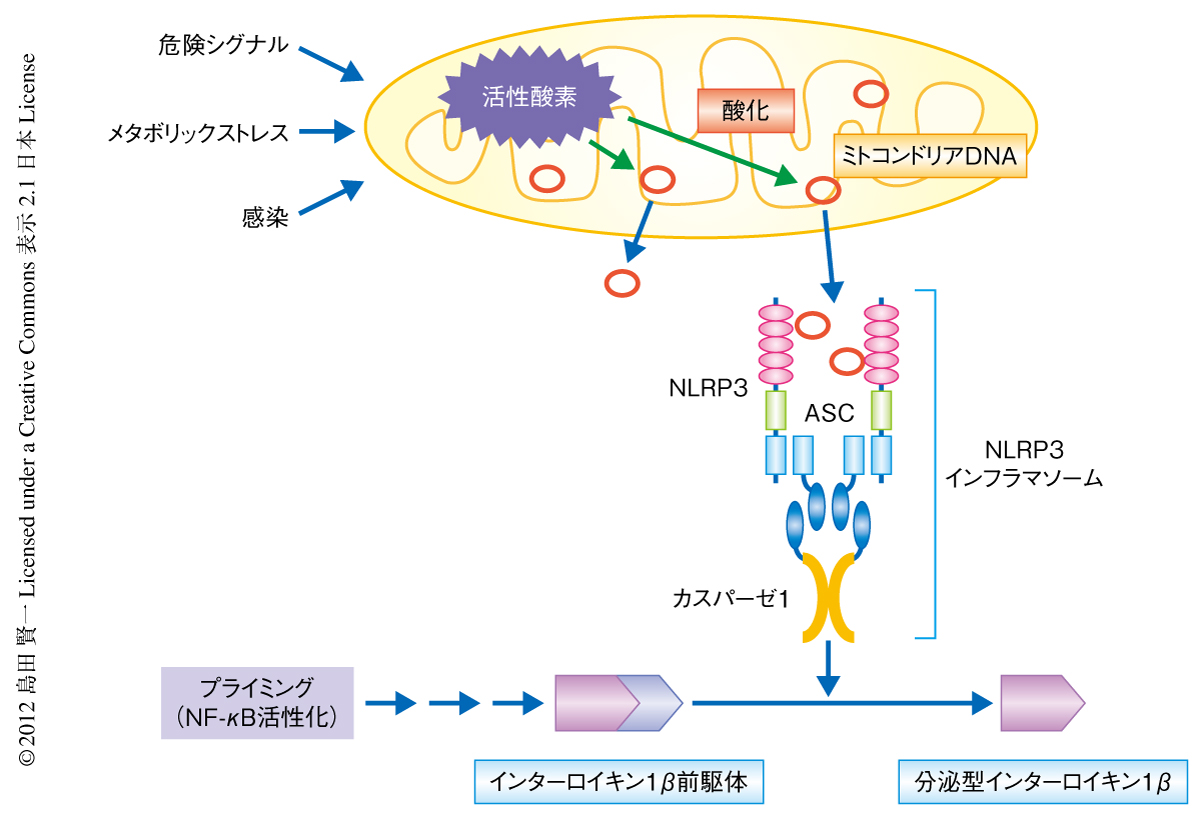
アポトーシスにより生じた酸化ミトコンドリアDNAがNLRP3インフラマソームを活性化する
島田 賢一
(米国Cedars-Sinai Medical Center,Division of Pediatrics Infectious Disease and Immunology)
email:島田賢一
DOI: 10.7875/first.author.2012.026
Oxidized mitochondrial DNA activates the NLRP3 inflammasome during apoptosis.
Kenichi Shimada, Timothy R. Crother, Justin Karlin, Jargalsaikhan Dagvadorj, Norika Chiba, Shuang Chen, V. Krishnan Ramanujan, Andrea J. Wolf, Laurent Vergnes, David M. Ojcius, Altan Rentsendorj, Mario Vargas, Candace Guerrero, Yinsheng Wang, Katherine A. Fitzgerald, David M. Underhill, Terrence Town, Moshe Arditi
Immunity, 36, 401-414 (2012)
炎症性サイトカインであるインターロイキン1βはインフラマソームとよばれるタンパク複合体によりその分泌が制御されている.NLRP3インフラマソームは細菌やウイルスなどの病原体をパターン認識して感染に対する防御応答を担っているものと考えられていたが,のちにATPなど非感染性の刺激によっても活性化されることがわかり,その活性化の分子機構は不明であった.この研究では,プライミングされたマクロファージがATPにより2次刺激をうける際,ミトコンドリアは損傷をうけ細胞はアポトーシスへといたるが,そのときミトコンドリアにおいて活性酸素が生じミトコンドリアDNAが酸化され,この酸化ミトコンドリアDNAが細胞質に移行しNLRP3と結合することでNLRP3インフラマソームを活性化していることを解明した.
炎症性サイトカインであるインターロイキン1βの分泌は細胞質にあるインフラマソームとよばれるタンパク質複合体により制御されている.インターロイキン1β前駆体はToll様受容体などからのNF-κBシグナルにより合成される(プライミング)が,カスパーゼ1が活性化しないと分泌型インターロイキン1βへの変換は行われず分泌はされない.カスパーゼ1はNLRP3とアダプタータンパク質であるASCにより活性化されるが,このカスパーゼ1の活性化に必要となるタンパク質複合体を総称してNLRP3インフラマソームとよぶ.NLRP3インフラマソームの活性化はβアミロイド結晶,尿酸結晶,細胞外のATP,細菌性毒素により誘導されることから,さまざまなストレス性のシグナルを認識しているとされていたが,その分子機構は明らかにされていなかった.
これまでNLRP3インフラマソームの活性化においてもっとも有力だったのは,活性酸素によるという説,細胞からのK+の流出によるという説,リソソームの崩壊による分解酵素流出によるという説であったが,どの仮説にも反証が報告され未解明のままであった.2011年,ミトコンドリアとミトコンドリアにおける活性酸素がNLRP3インフラマソームの活性化に重要であると報告されたが1,2),やはり,その分子機構まではつきとめられずにおわっていた.筆者らも,別の角度からミトコンドリアが重要であることをつきとめており,さらなる真相究明に邁進した.そして,ミトコンドリアに損傷をあたえるアポトーシス誘導の条件において,ミトコンドリアが活性酸素を生じミトコンドリアDNAが酸化され,これが細胞質に移行してNLRP3と結合していること,酸化ヌクレオチドを前処理することでNLRP3が酸化ミトコンドリアDNAと結合できなくなりインフラマソームを活性化できなくなることを解明した.
筆者らはさきの研究において,クラミジアがマクロファージに感染するとNLRP3インフラマソームが活性化されることを報告した3).そして,抗生物質のひとつクロラムフェニコールがクラミジアの増殖を抑制し,クラミジアが誘導するインフラマソームの活性化を阻害することを認めた.しかしながら驚くべきことに,エンドトキシンのプライミングおよびATPの刺激によるNLRP3インフラマソーム活性化の誘導もクロラムフェニコールにより阻害をうけることを見い出した.クロラムフェニコールは細菌のもつリボソームに作用してタンパク質の合成を阻害しその増殖を防ぐわけだが,このエンドトキシンとATPによる刺激においては細菌に由来するリボソームなど存在していないにもかかわらず,クロラムフェニコールによる阻害をうけたのである.そこで,ミトコンドリアのリボソームに対するクロラムフェニコールの作用に気づいた.細胞はタンパク質合成の場として細胞質にリボソームをもつほか,ミトコンドリアにも異なるリボソームをもちミトコンドリアに独自のタンパク質合成を行っている.ミトコンドリアのリボソームは原核生物のリボソームにより相同性が高いため,ミトコンドリアのリボソームも細菌のもつリボソームと同様にクロラムフェニコールによる影響をうける.そこで,この発見をもとにNLRP3インフラマソームとミトコンドリアの機能との相互関係を調べることにした.既知のさまざまなNLRP3インフラマソーム活性化の誘導条件では,みごとにミトコンドリアの機能低下(ミトコンドリアの膜電位の低下,および,ミトコンドリアの呼吸の低下)が認められた.細胞へのK+流入の阻害がNLRP3インフラマソームの活性化を阻害することが報告されていたが,これもミトコンドリアの機能低下とかかわっていることを認めた.以上から,ミトコンドリアの機能低下がNLRP3インフラマソームの活性化に密接にかかわっていることが明らかになった.
ミトコンドリアに損傷が認められたのであれば,アポトーシスにつながるであろうと考えた.ミトコンドリアは細胞の生命活動に必須なエネルギーを生み出すほか,アポトーシスにも重要な役割を担っているからである.NLRP3インフラマソーム活性化の誘導条件では乳酸脱水素酵素の遊離や細胞核の凝集といったアポトーシスの特徴が認められた.そこで,アポトーシスの誘導剤として広く知られるスタウロスポリンについて調べたところ,NLRP3インフラマソームの活性化を誘導することが見い出された.
根本的なことであるが,このエンドトキシンによるプライミングとATPというNLRP3インフラマソームの2段階の刺激は,そもそも,なぜ2次的な刺激でなければならないのだろうか.細胞にATPやスタウロスポリンをエンドトキシンと同時にくわえてみたが,やはりインターロイキン1βは分泌されなかった.これは,2次刺激は細胞死を誘導することにほかならないからであろうと考えられた.インフラマソームの誘導する刺激に対して危険シグナル(danger signal)というあいまいな表現が定着しつつあるが,これは死のシグナルというべきだろうことが示唆された.
ミトコンドリアの機能低下とアポトーシスによりNLRP3インフラマソームの活性化が誘導されることが明らかになったが,さらなる確信を得るため,抗アポトーシスタンパク質の代表としてもっとも知られるBcl-2の過剰発現を試みた.Bcl-2を過剰に発現した細胞ではインターロイキン1βの分泌阻害にともない,ミトコンドリア膜電位の低下の阻害およびアポトーシスの阻害が認められ,反対に,Bcl-2の発現が低下した細胞においてはインターロイキン1βの分泌亢進およびアポトーシスの亢進が認められた.以上の結果から,Bcl-2によりアポトーシスを阻害するとNLRP3インフラマソーム活性化の誘導も阻害されることが明らかになった.
ミトコンドリアは原核生物に近い環状の独自のDNAをもつこと,ある種のアポトーシスではミトコンドリアDNAが細胞質に移行することが報告されていたこと,また,NLRP3がヌクレオチド結合部位をもつことから,ミトコンドリアDNAはNLRP3に結合しているのではないかと考えた.そこで,マクロファージをエチジウムブロミドの存在下で培養することでミトコンドリアDNAの著しく欠失したマイクロファージを樹立した.分子生物学の実験においてエチジウムブロミドは2本鎖DNAにはまり込む性質を利用してDNA染色に広く用いられているが,培養している細胞にくわえると核のDNAとミトコンドリアDNAの両方にはまり込む.核はDNA修復能が高いため核DNAは大きな影響をうけないが,DNA修復能が低いミトコンドリアではDNAはもろに影響をうけるためミトコンドリアDNAだけが減少していく.ひとつのミトコンドリアには数コピーのミトコンドリアDNAが存在しているため,これが完全に消失しないかぎりミトコンドリアの機能は維持される.樹立されたミトコンドリアDNA欠失マイクロファージでは明らかにNLRP3インフラマソーム活性化の誘導能が欠損していた.また,NLRP3インフラマソーム活性化を誘導するATPやナイジェリシン(K+チャネル阻害剤)の刺激によりミトコンドリアDNAが細胞質へと遊離することを認めた.HEK293T細胞にNLRP3を強制安定発現させ,あらかじめ標識したミトコンドリアDNAを細胞に導入すると,NLRP3とミトコンドリアDNAとの共局在が認められた.同じ条件において免疫沈降法によりNLRP3とミトコンドリアDNAとが共沈することも明らかになった.ここまで,ミトコンドリアDNAがNLRP3と結合していることが示唆されたが,しかしながら,マクロファージにおいて外来性のミトコンドリアDNAはNLRP3インフラマソームではなくAIM2インフラマソームという別のタンパク質複合体により認識され,そのためインターロイキン1βの分泌が優勢的に誘導されてしまい,マクロファージではミトコンドリアDNAがNLRP3に結合することは証明できなかった.別の報告では,DNA分解酵素を細胞に導入することでNLRP3インフラマソーム活性化が阻害されたことが示されているが2),マクロファージにおいてミトコンドリアDNAがNLRP3インフラマソームの活性化を誘導するという直接的なデータは得られていない.
内在性のミトコンドリアDNAとNLRP3とのかかわりを調べるため,マクロファージにブロモウリジンを取り込ませてミトコンドリアDNAを標識し,免疫沈降によりNLRP3インフラマソームを沈降したのち,ドットブロットを用い抗ブロモウリジン抗体によりDNAの検出を試みた.その結果,NLRP3インフラマソームの活性化ののちミトコンドリアDNAがNLRP3と結合しているという直接的なデータが得られた.筆者らはすでに,細胞質に由来する活性酸素はNLRP3インフラマソームの活性化にはまったく関与していないというデータを得ていたが,ミトコンドリアに由来する活性酸素の関与は謎であった.これまで,ミトコンドリアに特異的とされる活性酸素阻害剤を用いてミトコンドリアに由来する活性酸素が重要であることが示されていたが1),筆者らは,この阻害剤がNF-κBの活性に影響しインフラマソームの活性化だけでなくインターロイキン1β前駆体自体をも阻害してしまっていることをつきとめていた.そこで,特異性の低い阻害剤によるアプローチではなく,“測定”を用いてこれを証明することを試みた.その結果,NLRP3インフラマソームの活性化を誘導するATPの刺激ののち,ミトコンドリアに由来する活性酸素が顕著に増加するのを生細胞イメージングにより示すことができた.さらに,このミトコンドリアに由来する活性酸素がミトコンドリアDNAとNLRP3との結合に関与しているかどうか,その直接的なデータを得るよう試みたところ,NLRP3に結合していたミトコンドリアDNAは酸化による損傷をうけていることが明らかになった.また,酸化ヌクレオシドによる前処理は酸化されたミトコンドリアDNAがNLRP3に結合するのを防ぎ,インターロイキン1βの分泌を阻害することを見い出した.以上のことから,アポトーシスによるミトコンドリアの損傷によりミトコンドリアから活性酸素が生じ,これにより酸化されたミトコンドリアDNAが細胞質に遊離し,NLRP3と結合してインフラマソームを活性化していることが明らかになった(図1).
この研究において学術的に重要な概念が提唱された.インターロイキン1βの分泌は“ダイイングメッセージ”として炎症の惹起をつかさどること,アポトーシスはネクローシスとは異なり炎症をともなわない細胞死と考えられていたが,細菌の感染や微生物の菌体成分などプライミングの起こる条件では炎症を誘導しうること,自然免疫はDNAの損傷や変異を認識する機構を備えていること,インフラマソームが感染防御だけでなくアルツハイマー病,2型糖尿病,動脈硬化といった慢性型の疾患の炎症にかかわっていたのも,加齢にともないミトコンドリアDNAの酸化による損傷が蓄積して“インフラマソーム高リスク”であった可能性があったこと,である.
現在すでに,インターロイキン1受容体の拮抗阻害剤はリウマチ患者に対し認可されており,ヒト抗インターロイキン1β抗体は糖尿病と動脈硬化の両方を対象に臨床試験が行われている.カスパーゼ1阻害剤はインターロイキン1βとインターロイキン18の両方を阻害することからより高い効果が期待され米国において臨床試験が行われていたが,第2相で肝臓への副作用が認められ中止に終わった.筆者らは,酸化ヌクレオシドを用いたまったく新しいNLRP3インフラマソームの阻害剤の開発の可能性に期待をよせている.
略歴:2006年 北里大学大学院基礎生命科学研究科博士課程 修了,同年 米国Cedars-Sinai Medical CenterにてPost Doctoral Fellow,2009年 同Research Scientistを経て,2012年より同Assistant Professor.
研究テーマ:感染免疫,アレルギー,動脈硬化.
© 2012 島田 賢一 Licensed under CC 表示 2.1 日本
(米国Cedars-Sinai Medical Center,Division of Pediatrics Infectious Disease and Immunology)
email:島田賢一
DOI: 10.7875/first.author.2012.026
Oxidized mitochondrial DNA activates the NLRP3 inflammasome during apoptosis.
Kenichi Shimada, Timothy R. Crother, Justin Karlin, Jargalsaikhan Dagvadorj, Norika Chiba, Shuang Chen, V. Krishnan Ramanujan, Andrea J. Wolf, Laurent Vergnes, David M. Ojcius, Altan Rentsendorj, Mario Vargas, Candace Guerrero, Yinsheng Wang, Katherine A. Fitzgerald, David M. Underhill, Terrence Town, Moshe Arditi
Immunity, 36, 401-414 (2012)
要 約
炎症性サイトカインであるインターロイキン1βはインフラマソームとよばれるタンパク複合体によりその分泌が制御されている.NLRP3インフラマソームは細菌やウイルスなどの病原体をパターン認識して感染に対する防御応答を担っているものと考えられていたが,のちにATPなど非感染性の刺激によっても活性化されることがわかり,その活性化の分子機構は不明であった.この研究では,プライミングされたマクロファージがATPにより2次刺激をうける際,ミトコンドリアは損傷をうけ細胞はアポトーシスへといたるが,そのときミトコンドリアにおいて活性酸素が生じミトコンドリアDNAが酸化され,この酸化ミトコンドリアDNAが細胞質に移行しNLRP3と結合することでNLRP3インフラマソームを活性化していることを解明した.
はじめに
炎症性サイトカインであるインターロイキン1βの分泌は細胞質にあるインフラマソームとよばれるタンパク質複合体により制御されている.インターロイキン1β前駆体はToll様受容体などからのNF-κBシグナルにより合成される(プライミング)が,カスパーゼ1が活性化しないと分泌型インターロイキン1βへの変換は行われず分泌はされない.カスパーゼ1はNLRP3とアダプタータンパク質であるASCにより活性化されるが,このカスパーゼ1の活性化に必要となるタンパク質複合体を総称してNLRP3インフラマソームとよぶ.NLRP3インフラマソームの活性化はβアミロイド結晶,尿酸結晶,細胞外のATP,細菌性毒素により誘導されることから,さまざまなストレス性のシグナルを認識しているとされていたが,その分子機構は明らかにされていなかった.
これまでNLRP3インフラマソームの活性化においてもっとも有力だったのは,活性酸素によるという説,細胞からのK+の流出によるという説,リソソームの崩壊による分解酵素流出によるという説であったが,どの仮説にも反証が報告され未解明のままであった.2011年,ミトコンドリアとミトコンドリアにおける活性酸素がNLRP3インフラマソームの活性化に重要であると報告されたが1,2),やはり,その分子機構まではつきとめられずにおわっていた.筆者らも,別の角度からミトコンドリアが重要であることをつきとめており,さらなる真相究明に邁進した.そして,ミトコンドリアに損傷をあたえるアポトーシス誘導の条件において,ミトコンドリアが活性酸素を生じミトコンドリアDNAが酸化され,これが細胞質に移行してNLRP3と結合していること,酸化ヌクレオチドを前処理することでNLRP3が酸化ミトコンドリアDNAと結合できなくなりインフラマソームを活性化できなくなることを解明した.
1.ミトコンドリアの機能低下がインターロイキン1βの分泌を促す
筆者らはさきの研究において,クラミジアがマクロファージに感染するとNLRP3インフラマソームが活性化されることを報告した3).そして,抗生物質のひとつクロラムフェニコールがクラミジアの増殖を抑制し,クラミジアが誘導するインフラマソームの活性化を阻害することを認めた.しかしながら驚くべきことに,エンドトキシンのプライミングおよびATPの刺激によるNLRP3インフラマソーム活性化の誘導もクロラムフェニコールにより阻害をうけることを見い出した.クロラムフェニコールは細菌のもつリボソームに作用してタンパク質の合成を阻害しその増殖を防ぐわけだが,このエンドトキシンとATPによる刺激においては細菌に由来するリボソームなど存在していないにもかかわらず,クロラムフェニコールによる阻害をうけたのである.そこで,ミトコンドリアのリボソームに対するクロラムフェニコールの作用に気づいた.細胞はタンパク質合成の場として細胞質にリボソームをもつほか,ミトコンドリアにも異なるリボソームをもちミトコンドリアに独自のタンパク質合成を行っている.ミトコンドリアのリボソームは原核生物のリボソームにより相同性が高いため,ミトコンドリアのリボソームも細菌のもつリボソームと同様にクロラムフェニコールによる影響をうける.そこで,この発見をもとにNLRP3インフラマソームとミトコンドリアの機能との相互関係を調べることにした.既知のさまざまなNLRP3インフラマソーム活性化の誘導条件では,みごとにミトコンドリアの機能低下(ミトコンドリアの膜電位の低下,および,ミトコンドリアの呼吸の低下)が認められた.細胞へのK+流入の阻害がNLRP3インフラマソームの活性化を阻害することが報告されていたが,これもミトコンドリアの機能低下とかかわっていることを認めた.以上から,ミトコンドリアの機能低下がNLRP3インフラマソームの活性化に密接にかかわっていることが明らかになった.
2.ミトコンドリアの損傷によるアポトーシスがNLRP3インフラマソームを活性化する
ミトコンドリアに損傷が認められたのであれば,アポトーシスにつながるであろうと考えた.ミトコンドリアは細胞の生命活動に必須なエネルギーを生み出すほか,アポトーシスにも重要な役割を担っているからである.NLRP3インフラマソーム活性化の誘導条件では乳酸脱水素酵素の遊離や細胞核の凝集といったアポトーシスの特徴が認められた.そこで,アポトーシスの誘導剤として広く知られるスタウロスポリンについて調べたところ,NLRP3インフラマソームの活性化を誘導することが見い出された.
根本的なことであるが,このエンドトキシンによるプライミングとATPというNLRP3インフラマソームの2段階の刺激は,そもそも,なぜ2次的な刺激でなければならないのだろうか.細胞にATPやスタウロスポリンをエンドトキシンと同時にくわえてみたが,やはりインターロイキン1βは分泌されなかった.これは,2次刺激は細胞死を誘導することにほかならないからであろうと考えられた.インフラマソームの誘導する刺激に対して危険シグナル(danger signal)というあいまいな表現が定着しつつあるが,これは死のシグナルというべきだろうことが示唆された.
3.Bcl-2はNLRP3インフラマソームの活性化を阻害する
ミトコンドリアの機能低下とアポトーシスによりNLRP3インフラマソームの活性化が誘導されることが明らかになったが,さらなる確信を得るため,抗アポトーシスタンパク質の代表としてもっとも知られるBcl-2の過剰発現を試みた.Bcl-2を過剰に発現した細胞ではインターロイキン1βの分泌阻害にともない,ミトコンドリア膜電位の低下の阻害およびアポトーシスの阻害が認められ,反対に,Bcl-2の発現が低下した細胞においてはインターロイキン1βの分泌亢進およびアポトーシスの亢進が認められた.以上の結果から,Bcl-2によりアポトーシスを阻害するとNLRP3インフラマソーム活性化の誘導も阻害されることが明らかになった.
4.ミトコンドリアDNAのNLRP3インフラマソーム活性化への関与
ミトコンドリアは原核生物に近い環状の独自のDNAをもつこと,ある種のアポトーシスではミトコンドリアDNAが細胞質に移行することが報告されていたこと,また,NLRP3がヌクレオチド結合部位をもつことから,ミトコンドリアDNAはNLRP3に結合しているのではないかと考えた.そこで,マクロファージをエチジウムブロミドの存在下で培養することでミトコンドリアDNAの著しく欠失したマイクロファージを樹立した.分子生物学の実験においてエチジウムブロミドは2本鎖DNAにはまり込む性質を利用してDNA染色に広く用いられているが,培養している細胞にくわえると核のDNAとミトコンドリアDNAの両方にはまり込む.核はDNA修復能が高いため核DNAは大きな影響をうけないが,DNA修復能が低いミトコンドリアではDNAはもろに影響をうけるためミトコンドリアDNAだけが減少していく.ひとつのミトコンドリアには数コピーのミトコンドリアDNAが存在しているため,これが完全に消失しないかぎりミトコンドリアの機能は維持される.樹立されたミトコンドリアDNA欠失マイクロファージでは明らかにNLRP3インフラマソーム活性化の誘導能が欠損していた.また,NLRP3インフラマソーム活性化を誘導するATPやナイジェリシン(K+チャネル阻害剤)の刺激によりミトコンドリアDNAが細胞質へと遊離することを認めた.HEK293T細胞にNLRP3を強制安定発現させ,あらかじめ標識したミトコンドリアDNAを細胞に導入すると,NLRP3とミトコンドリアDNAとの共局在が認められた.同じ条件において免疫沈降法によりNLRP3とミトコンドリアDNAとが共沈することも明らかになった.ここまで,ミトコンドリアDNAがNLRP3と結合していることが示唆されたが,しかしながら,マクロファージにおいて外来性のミトコンドリアDNAはNLRP3インフラマソームではなくAIM2インフラマソームという別のタンパク質複合体により認識され,そのためインターロイキン1βの分泌が優勢的に誘導されてしまい,マクロファージではミトコンドリアDNAがNLRP3に結合することは証明できなかった.別の報告では,DNA分解酵素を細胞に導入することでNLRP3インフラマソーム活性化が阻害されたことが示されているが2),マクロファージにおいてミトコンドリアDNAがNLRP3インフラマソームの活性化を誘導するという直接的なデータは得られていない.
5.酸化ミトコンドリアDNAによるNLRP3インフラマソーム活性化の誘導
内在性のミトコンドリアDNAとNLRP3とのかかわりを調べるため,マクロファージにブロモウリジンを取り込ませてミトコンドリアDNAを標識し,免疫沈降によりNLRP3インフラマソームを沈降したのち,ドットブロットを用い抗ブロモウリジン抗体によりDNAの検出を試みた.その結果,NLRP3インフラマソームの活性化ののちミトコンドリアDNAがNLRP3と結合しているという直接的なデータが得られた.筆者らはすでに,細胞質に由来する活性酸素はNLRP3インフラマソームの活性化にはまったく関与していないというデータを得ていたが,ミトコンドリアに由来する活性酸素の関与は謎であった.これまで,ミトコンドリアに特異的とされる活性酸素阻害剤を用いてミトコンドリアに由来する活性酸素が重要であることが示されていたが1),筆者らは,この阻害剤がNF-κBの活性に影響しインフラマソームの活性化だけでなくインターロイキン1β前駆体自体をも阻害してしまっていることをつきとめていた.そこで,特異性の低い阻害剤によるアプローチではなく,“測定”を用いてこれを証明することを試みた.その結果,NLRP3インフラマソームの活性化を誘導するATPの刺激ののち,ミトコンドリアに由来する活性酸素が顕著に増加するのを生細胞イメージングにより示すことができた.さらに,このミトコンドリアに由来する活性酸素がミトコンドリアDNAとNLRP3との結合に関与しているかどうか,その直接的なデータを得るよう試みたところ,NLRP3に結合していたミトコンドリアDNAは酸化による損傷をうけていることが明らかになった.また,酸化ヌクレオシドによる前処理は酸化されたミトコンドリアDNAがNLRP3に結合するのを防ぎ,インターロイキン1βの分泌を阻害することを見い出した.以上のことから,アポトーシスによるミトコンドリアの損傷によりミトコンドリアから活性酸素が生じ,これにより酸化されたミトコンドリアDNAが細胞質に遊離し,NLRP3と結合してインフラマソームを活性化していることが明らかになった(図1).
おわりに
この研究において学術的に重要な概念が提唱された.インターロイキン1βの分泌は“ダイイングメッセージ”として炎症の惹起をつかさどること,アポトーシスはネクローシスとは異なり炎症をともなわない細胞死と考えられていたが,細菌の感染や微生物の菌体成分などプライミングの起こる条件では炎症を誘導しうること,自然免疫はDNAの損傷や変異を認識する機構を備えていること,インフラマソームが感染防御だけでなくアルツハイマー病,2型糖尿病,動脈硬化といった慢性型の疾患の炎症にかかわっていたのも,加齢にともないミトコンドリアDNAの酸化による損傷が蓄積して“インフラマソーム高リスク”であった可能性があったこと,である.
現在すでに,インターロイキン1受容体の拮抗阻害剤はリウマチ患者に対し認可されており,ヒト抗インターロイキン1β抗体は糖尿病と動脈硬化の両方を対象に臨床試験が行われている.カスパーゼ1阻害剤はインターロイキン1βとインターロイキン18の両方を阻害することからより高い効果が期待され米国において臨床試験が行われていたが,第2相で肝臓への副作用が認められ中止に終わった.筆者らは,酸化ヌクレオシドを用いたまったく新しいNLRP3インフラマソームの阻害剤の開発の可能性に期待をよせている.
文 献
- Zhou, R., Yazdi, A. S., Menu, P. et al.: A role for mitochondria in NLRP3 inflammasome activation. Nature, 469, 221-225 (2011)[PubMed]
- Nakahira, K., Haspel, J. A., Rathinam, V. A. et al.: Autophagy proteins regulate innate immune responses by inhibiting the release of mitochondrial DNA mediated by the NALP3 inflammasome. Nat. Immunol., 12, 222-230 (2011)[PubMed]
- Shimada, K., Crother, T. R., Karlin, J. et al.: Caspase-1 dependent IL-1β secretion is critical for host defense in a mouse model of Chlamydia pneumoniae lung infection. PLoS One, 6, e21477 (2011)[PubMed]
著者プロフィール
略歴:2006年 北里大学大学院基礎生命科学研究科博士課程 修了,同年 米国Cedars-Sinai Medical CenterにてPost Doctoral Fellow,2009年 同Research Scientistを経て,2012年より同Assistant Professor.
研究テーマ:感染免疫,アレルギー,動脈硬化.
© 2012 島田 賢一 Licensed under CC 表示 2.1 日本