セントロメアにおける新しいヒストン様の構造
西野達哉・深川竜郎
(国立遺伝学研究所 分子遺伝研究部門)
email:西野達哉,深川竜郎
DOI: 10.7875/first.author.2012.021
CENP-T-W-S-X forms a unique centromeric chromatin structure with a histone-like fold.
Tatsuya Nishino, Kozo Takeuchi, Karen E. Gascoigne, Aussie Suzuki, Tetsuya Hori, Takuji Oyama, Kosuke Morikawa, Iain M. Cheeseman, Tatsuo Fukagawa
Cell, 148, 487-501 (2012)
染色体が娘細胞へ正確に分配されるためには,複数のタンパク質複合体がセントロメアとよばれるゲノムDNA領域に集合しキネトコアという構造をつくらなければならない.このキネトコア構造が形成されるため,どのようなタンパク質がどのように集合してセントロメアDNAと結合しているのかという分子機構に関しては不明な点が多い.この研究では,高等動物のキネトコアに局在するCENP-T-W複合体とCENP-S-X複合体に注目し,構造生物学的,生化学的,細胞生物学的な解析を行った.その結果,試験管内で再構成したニワトリのCENP-T-W複合体とCENP-S-X複合体は,結合してCENP-T-W-S-X複合体という安定なヘテロ四量体を形成することが明らかになった.X線結晶構造解析により明らかにされたCENP-T-W複合体,CENP-S-X複合体,および,CENP-T-W-S-X複合体の構造はヒストンと類似していた.CENP-T-W-S-X複合体はDNAに超らせんを導入する活性を示し,ヒストンと似たDNAとの結合特性のあることも明らかになった.さらに,DNAとの結合にかかわるアミノ酸残基およびヘテロ四量体の形成に必要なアミノ酸残基に変異を導入したCENP-T-W-S-X複合体を発現するニワトリDT40細胞では,正常なキネトコアが形成されないことがわかった.以上の結果から,CENP-T-W-S-X複合体が通常のヒストンのようにDNAと結合しヌクレオソームと似た構造をセントロメア領域において形成することが,キネトコア構造の構築に必須であると結論した.
生物の全ゲノム情報を担う染色体は細胞周期の過程をつうじ正確に複製され分配される.染色体の複製機構や分配機構の異常は遺伝情報の不正確な伝達につながり,その結果,がん化をはじめとする細胞への悪影響が生じる.したがって,染色体の複製や分配の分子機構を解明することは基礎生物学および医科学の両面から大切である.細胞周期のS期において複製された染色体は,M期になると両極から延びた紡錘体にとらえられて娘細胞へと分配される.この染色体分配の際に紡錘体が結合する染色体の特殊な構造がキネトコア(動原体)である.このキネトコアはセントロメアとよばれるゲノムDNA領域に形成される.興味深いことに,キネトコアが形成されるセントロメア領域のDNA配列に特異性はなく,セントロメア領域はエピジェネティックな機構により決定されている.つまり,どのような配列をもつDNA領域もセントロメアになりうるが,いったん,その領域がセントロメアになると次世代の細胞にもその情報が受け継がれる.これまでの多くの研究から,セントロメア領域の決定に関与するエピジェネティックマーカーとしてはヒストンH3のバリアントであるCENP-Aが有力候補であると考えられている1,2).どのようなDNA配列をもつセントロメアにもCENP-Aが存在するのでCENP-Aがセントロメアの形成において重要なはたらきを担っていることはまちがいないが,CENP-Aのみで機能的なキネトコア構造をつくることはできない2).したがって,CENP-Aとともにキネトコアの形成に関与するタンパク質の役割を解明することが必須である.
キネトコアはセンロメアDNA上に形成されるので,キネトコア形成の基礎となるタンパク質はDNAと直接に結合している可能性が高い.筆者らの研究室では,キネトコアに存在するDNA結合タンパク質としてCENP-T-W複合体を同定している3).さらに最近,CENP-Tを非セントロメア領域に異所局在化させると,その領域にキネトコア様の構造が形成されることも報告している4).これらの事実はCENP-T-W複合体がキネトコア形成の基盤として機能している可能性を示唆している.しかしながら,CENP-T-W複合体がどのようにセントロメア領域を認識してセントロメアDNAと結合しキネトコアの形成に関与しているのかについては不明な点が多い.CENP-Tがキネトコアの形成にどのようにかかわっているのかを明らかにする目的で,構造生物学的,生化学的,細胞生物学的な手法を駆使して研究を行った.その結果,CENP-T-W複合体はCENP-S-X複合体というほかのキネトコアタンパク質複合体とヘテロ四量体を形成していることが明らかになった.また,CENP-T-W-S-X複合体はヒストンに類似した構造をとり,通常のヒストンのようにDNAと結合し,セントロメア領域においてヌクレオソームに似た構造を形成している可能性を示した.
CENP-T-W複合体のDNAへの結合様式を理解する目的で,ニワトリのCENP-TのDNA結合にかかわるC末端側の領域と完全長のCENP-Wを大腸菌において発現させ,精製ののち再構成した.得られたCENP-T-W複合体を結晶化しX線構造解析した結果,分解能2.2Åで構造決定に成功した(PDB ID:3B0C,3B0D).決定された結晶構造から,二量体からなるCENP-T-W複合体の構造はヌクレオソームにおけるヒストン5) の二量体の部分の構造と類似していることが明らかになった.ヒストンとの構造の類似性,および,ヒストンのDNAとの結合に重要な領域を参考にして,CENP-TおよびCENP-WのDNAとの結合にかかわる領域を予想した.この領域のアミノ酸残基に変異を導入したCENP-T-W複合体を精製してDNA結合活性を解析した結果,活性の低下が確認された.また,ニワトリDT40細胞を用いて野生型CENP-WとこのDNA結合活性が低下したCENP-W変異体とを置換したところ,このCENP-W変異体は機能しないことが明らかになった.以上の結果から,ヒストンに類似したCENP-T-W複合体のDNA結合活性はキネトコアの形成に必須であると結論した.
筆者らは,以前の研究において,CENP-T-W複合体と関連するタンパク質複合体としてCENP-S-X複合体を同定していた6).CENP-T-W複合体の機能を理解するにはCENP-S-X複合体との関連をより詳細に解析する必要性があると考え,ニワトリCENP-S-X複合体を大腸菌で発現し精製したのち構造生物学的な解析を行った.精製したCENP-S-X複合体のゲルろ過パターンからCENP-S-X複合体は四量体を形成することが示唆されたが,実際に分解能2.15Åで結晶構造を決定したCENP-S-X複合体は四量体の構造をとっていた(PDB ID:3B0B).CENP-S-X複合体の構造はヒストンと類似しており,CENP-T-W複合体とも類似していた.CENP-S-X複合体はCENP-T-W複合体と同様にDNA結合活性をもっており,やはり,ヒストンとの構造の類似性からDNA結合に関与する領域を予想した.この領域のアミノ酸残基に変異を導入しDNAへの結合性を低下させた変異型のCENP-S-X複合体はキネトコアに局在したが,ほかのキネトコアタンパク質の集合が不全になっていた.したがって,DNA結合活性はCENP-S-X複合体の機能に重要であると考えられた.
CENP-S-X複合体とCENP-T-W複合体の構造は全体的には類似していたものの,CENP-SのC末端側に存在する伸びたαヘリックス(α4ヘリックスとよぶ)はCENP-Tには存在せず,2つのαヘリックス構造が折り返したかたちで存在していた(α4ヘリックスおよびα5ヘリックスとよぶ).この構造の違いがCENP-Tの機能に重要である可能性を考え,α4ヘリックスおよびα5ヘリックスを欠失させたCENP-T変異体をニワトリDT40細胞において発現させた結果,このCENP-T変異体はキネトコアへは局在しないことがわかった.したがって,CENP-TのC末端側にある2つのαヘリックス領域がCENP-T-W複合体のキネトコアへの局在に必須であると結論された.
CENP-T-W複合体の構造とCENP-S-X複合体の構造には部分的に違いはみられるものの全体的な構造は類似している.機能的にも構造的にも両者が類似していることから,これらが協調して機能している可能性が考えられた.そこで,CENP-T-W複合体とCENP-S-X複合体とが物理的に結合する可能性を考え,両者を混合してゲルろ過解析を行った.CENP-T-W複合体は二量体の構造を,CENP-S-X複合体は四量体の構造をとるので,当初,両者が結合するのであればより分子量の大きい場所に新しいゲルろ過ピークが検出されるものと予想した.しかし意外なことに,1本のピークがCENP-S-X複合体のピークより分子量のやや小さい場所に検出された.このピークに含まれるタンパク質をSDS-ポリアクリルアミドゲル電気泳動により解析するとCENP-T,CENP-W,CENP-S,CENP-Xがほぼ同じ量ずつ検出された.これらの結果より,CENP-S-X複合体とCENP-T-W複合体とを混合するとCENP-S-X四量体の一部がCENP-T-W二量体と交換しCENP-T-W-S-Xヘテロ四量体が形成されることが示唆された.
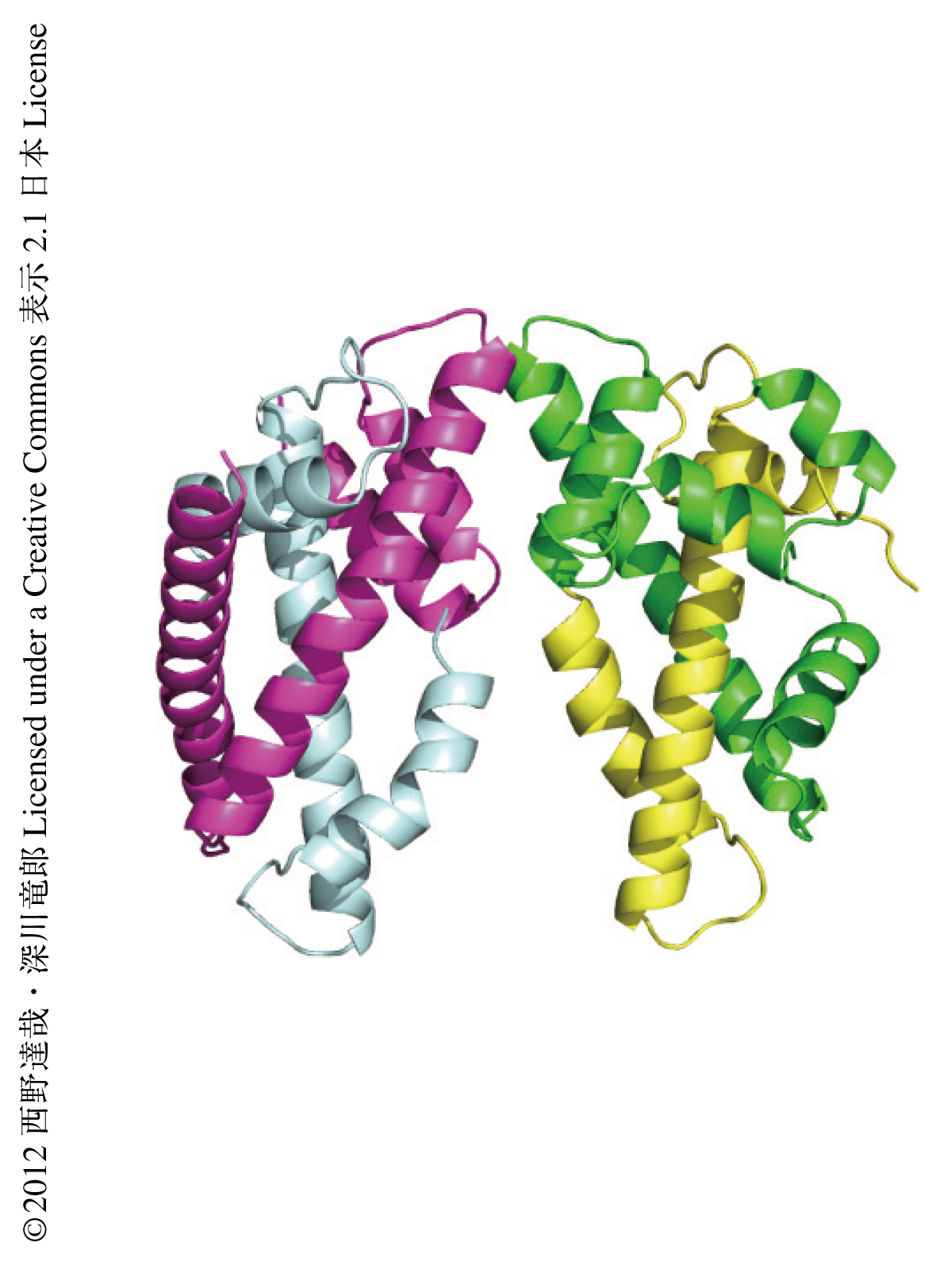
このCENP-T-W-S-X複合体の構造をより詳細に知るためにその構造解析を試み,分解能2.4Åで結晶構造を決定した(図1,PDB ID:3VH5,3VH6).構造解析の結果,CENP-T-W-S-X複合体はCENP-S-X複合体よりも四量体の形成に必要な自由エネルギーが低く,より安定な構造をとることがわかった.さらに,ヘテロ四量体の形成にかかわる領域を詳細に解析した結果,その形成に必須なCENP-SおよびCENP-Tのアミノ酸残基を同定した.これらのアミノ酸残基に変異を導入したCENP-S変異体あるいはCENP-T変異体は,それぞれ野生型CENP-Xあるいは野生型CENP-Wと二量体を形成するものの,CENP-T-W-S-Xヘテロ四量体を形成しないことが示された.
組換えタンパク質を用いた構造生物学的および生化学的な解析からCENP-T-W-S-X複合体がヘテロ四量体を形成することが示されたが,このヘテロ四量体の形成が細胞内におけるキネトコアの構築にどのようにかかわっているかを明らかにすることが重要であった.そこで,ヘテロ四量体が形成されないような変異体を細胞内で発現させてその意義について解析を行った.はじめに,ヘテロ四量体が形成されないCENP-S変異体をニワトリDT40細胞において発現させると核に拡散した局在を示し,キネトコアには局在しなかった.これは,CENP-T-W-S-X複合体のヘテロ四量体の構造の形成がCENP-Sのキネトコアへの局在に必須であること意味していた.つぎに,ヘテロ四量体が形成されないCENP-T変異体をCENP-Tノックアウト細胞へ導入した.野生型CENP-Tの発現がCENP-T変異体の発現に置き換わったこの細胞において,キネトコアにおけるCENP-Tのシグナルは観察されたものの,本来の20%程度の強さであった.また,Ndc80という微小管と結合するキネトコアタンパク質の局在も大きく失われていた.これらのタンパク質の局在性の異常にともない,分裂期に異常を示す多数の細胞が存在しこれらの細胞は死滅した.以上のニワトリDT40細胞を用いた研究から,CENP-T-W-S-X複合体のヘテロ四量体の構造はキネトコアの形成に必須であることが明確に示された.
CENP-T-W複合体もCENP-S-X複合体もそれぞれの複合体のみでDNA結合活性を示すが,タンパク質-DNA複合体をゲル電気泳動により解析したところそれぞれ異なる泳動パターンが得られた.DNA-CENP-T-W複合体は巨大な複合体をつくりやすくゲルの内部に入らないような巨大な複合体が形成された.一方,DNA-CENP-S-X複合体では複数のバンドがラダー状に観察され,これは,DNAに一定の間隔で複数個のCENP-S-X複合体が結合していることを意味していた.そこで,CENP-T-W-S-X複合体とDNAとの結合様式を解析した結果,等量のDNAとCENP-T-W-S-X複合体とが結合したと考えられる1本のバンドが検出された.このことは,DNA-CENP-T-W-S-X複合体が安定な複合体を形成していることを示唆していた.
DNAはヒストンのまわりにまきついてヌクレオソームという構造をとることが知られている5).CENP-T-W-S-X複合体もヒストンと構造が類似しており,また,DNA結合部位が類似していることから,DNAがCENP-T-W-S-X複合体の周辺を巻くように結合する可能性が考えられた.その点を明らかにするためDNA超らせん化アッセイを行った.このアッセイは,環状DNAをトポイソメラーゼIにより弛緩型に変換させたのち,タンパク質とともに反応させDNAのトポロジーの変化をアガロース電気泳動により検出する方法である.ヒストンを用いてこのアッセイを行うと,ヌクレオソームの形成に準じて環状DNAのトポアイソマーが検出される.CENP-T-W-S-X複合体を用いてDNA超らせん化アッセイを行った結果,ヒストンより活性は弱いもののトポアイソマーが検出され,この複合体がDNAに超らせんを導入する活性をもつことが明らかになった.DNA結合部位に変異を導入した変異型のCENP-T-W-S-X複合体では超らせん化活性が減少したこともあわせて,DNAはCENP-T-W-S-X複合体のまわりを巻くように結合していると結論した.
つぎに,長さの異なるDNAとCENP-T-W-S-X複合体との結合実験を行ったところ,この複合体は100 bpの長さのDNAともっとも効率よく1本のバンドを形成した.また,100 bpより長いDNAとCENP-T-W-S-X複合体を結合させたのちこのDNA-タンパク質複合体をマイクロコッカルヌクレアーゼで消化した結果,約100 bpのDNAがヌクレアーゼによる消化から保護された.この消化実験およびDNA超らせん化アッセイの結果を総合的に考察すると,約100 bpのDNAがCENP-T-W-S-X複合体の周辺を巻くように結合しヌクレオソーム様の構造を形成していると考えられた(図2).
この研究では,キネトコア形成の足場となることが予想されたCENP-Tが3,4),セントロメアのクロマチンにおいてCENP-T-W-S-X複合体というユニークなヒストン様の構造を形成していることを示した.これまで,セントロメアのクロマチンに関する研究というとセントロメアに特異的なヒストンのバリアントであるCENP-Aの機能1,2) と構造7) が中心であったが,CENP-Aの存在だけでは説明できない点が多くあった.この研究により提唱されたCENP-T-W-S-X複合体を含むクロマチン構造は,今後,セントロメアの機能を解析するうえで重要な方向性をあたえており,学問的な意義は高いと考えられた.さらに,ヒストンと類似したタンパク質がヌクレオソーム様の構造をとる可能性を示した点は,セントロメアだけでなくクロマチンのかかわる生物学の全体に大きなインパクトをあたえた.ヒストンには多くのバリアントが存在し,クロマチンはこのバリアントの組合せにより独自の機能をはたすことが知られている.たとえば,転写の活発なクロマチン領域と活発でないクロマチン領域とでヒストンの構成が異なっていることはよく知られており,近年,ヒストンのコードする遺伝情報として注目されている.今回の研究は,ヒストンと類似したタンパク質の組合せによってもクロマチンは独自の機能をはたす可能性を示唆した.CENP-S-X複合体はセントロメア領域にくわえDNA損傷部位にも存在することが知られている8,9).DNA損傷部位にはCENP-T-W複合体は存在しないことから,そこではCENP-S-X複合体が単独あるいはほかのタンパク質と結合してDNAと結合している可能性が考えられる.しかしながら,CENP-S-X複合体がCENP-T-W複合体と結合するとセントロメアに局在し独自のクロマチン構造を形成するようになる(図2).ヒストンと類似したタンパク質の組合せで独自の機能を発揮するというモデルは,通常のヒストンのバリアントの組合せからなる,いわゆる“ヒストンコード”を広げた新しいクロマチンコードといえる10).
略歴:2001年 大阪大学大学院医学系研究科 修了,2003年 オーストリアResearch Institute of Molecular Pathology研究員,2006年 英国Oxford大学 研究員,2008年 大阪大学蛋白質研究所 招聘研究員を経て,2009年より国立遺伝学研究所 助教.
研究テーマ:真核生物の染色体分配装置の構造生物学.
深川 竜郎(Tatsuo Fukagawa)
国立遺伝学研究所 教授.
研究室URL:http://www.nig.ac.jp/labs/MolGene/index_j.html
© 2012 西野達哉・深川竜郎 Licensed under CC 表示 2.1 日本
(国立遺伝学研究所 分子遺伝研究部門)
email:西野達哉,深川竜郎
DOI: 10.7875/first.author.2012.021
CENP-T-W-S-X forms a unique centromeric chromatin structure with a histone-like fold.
Tatsuya Nishino, Kozo Takeuchi, Karen E. Gascoigne, Aussie Suzuki, Tetsuya Hori, Takuji Oyama, Kosuke Morikawa, Iain M. Cheeseman, Tatsuo Fukagawa
Cell, 148, 487-501 (2012)
要 約
染色体が娘細胞へ正確に分配されるためには,複数のタンパク質複合体がセントロメアとよばれるゲノムDNA領域に集合しキネトコアという構造をつくらなければならない.このキネトコア構造が形成されるため,どのようなタンパク質がどのように集合してセントロメアDNAと結合しているのかという分子機構に関しては不明な点が多い.この研究では,高等動物のキネトコアに局在するCENP-T-W複合体とCENP-S-X複合体に注目し,構造生物学的,生化学的,細胞生物学的な解析を行った.その結果,試験管内で再構成したニワトリのCENP-T-W複合体とCENP-S-X複合体は,結合してCENP-T-W-S-X複合体という安定なヘテロ四量体を形成することが明らかになった.X線結晶構造解析により明らかにされたCENP-T-W複合体,CENP-S-X複合体,および,CENP-T-W-S-X複合体の構造はヒストンと類似していた.CENP-T-W-S-X複合体はDNAに超らせんを導入する活性を示し,ヒストンと似たDNAとの結合特性のあることも明らかになった.さらに,DNAとの結合にかかわるアミノ酸残基およびヘテロ四量体の形成に必要なアミノ酸残基に変異を導入したCENP-T-W-S-X複合体を発現するニワトリDT40細胞では,正常なキネトコアが形成されないことがわかった.以上の結果から,CENP-T-W-S-X複合体が通常のヒストンのようにDNAと結合しヌクレオソームと似た構造をセントロメア領域において形成することが,キネトコア構造の構築に必須であると結論した.
はじめに
生物の全ゲノム情報を担う染色体は細胞周期の過程をつうじ正確に複製され分配される.染色体の複製機構や分配機構の異常は遺伝情報の不正確な伝達につながり,その結果,がん化をはじめとする細胞への悪影響が生じる.したがって,染色体の複製や分配の分子機構を解明することは基礎生物学および医科学の両面から大切である.細胞周期のS期において複製された染色体は,M期になると両極から延びた紡錘体にとらえられて娘細胞へと分配される.この染色体分配の際に紡錘体が結合する染色体の特殊な構造がキネトコア(動原体)である.このキネトコアはセントロメアとよばれるゲノムDNA領域に形成される.興味深いことに,キネトコアが形成されるセントロメア領域のDNA配列に特異性はなく,セントロメア領域はエピジェネティックな機構により決定されている.つまり,どのような配列をもつDNA領域もセントロメアになりうるが,いったん,その領域がセントロメアになると次世代の細胞にもその情報が受け継がれる.これまでの多くの研究から,セントロメア領域の決定に関与するエピジェネティックマーカーとしてはヒストンH3のバリアントであるCENP-Aが有力候補であると考えられている1,2).どのようなDNA配列をもつセントロメアにもCENP-Aが存在するのでCENP-Aがセントロメアの形成において重要なはたらきを担っていることはまちがいないが,CENP-Aのみで機能的なキネトコア構造をつくることはできない2).したがって,CENP-Aとともにキネトコアの形成に関与するタンパク質の役割を解明することが必須である.
キネトコアはセンロメアDNA上に形成されるので,キネトコア形成の基礎となるタンパク質はDNAと直接に結合している可能性が高い.筆者らの研究室では,キネトコアに存在するDNA結合タンパク質としてCENP-T-W複合体を同定している3).さらに最近,CENP-Tを非セントロメア領域に異所局在化させると,その領域にキネトコア様の構造が形成されることも報告している4).これらの事実はCENP-T-W複合体がキネトコア形成の基盤として機能している可能性を示唆している.しかしながら,CENP-T-W複合体がどのようにセントロメア領域を認識してセントロメアDNAと結合しキネトコアの形成に関与しているのかについては不明な点が多い.CENP-Tがキネトコアの形成にどのようにかかわっているのかを明らかにする目的で,構造生物学的,生化学的,細胞生物学的な手法を駆使して研究を行った.その結果,CENP-T-W複合体はCENP-S-X複合体というほかのキネトコアタンパク質複合体とヘテロ四量体を形成していることが明らかになった.また,CENP-T-W-S-X複合体はヒストンに類似した構造をとり,通常のヒストンのようにDNAと結合し,セントロメア領域においてヌクレオソームに似た構造を形成している可能性を示した.
1.CENP-T-W複合体はヒストンに構造が類似した二量体からなる複合体である
CENP-T-W複合体のDNAへの結合様式を理解する目的で,ニワトリのCENP-TのDNA結合にかかわるC末端側の領域と完全長のCENP-Wを大腸菌において発現させ,精製ののち再構成した.得られたCENP-T-W複合体を結晶化しX線構造解析した結果,分解能2.2Åで構造決定に成功した(PDB ID:3B0C,3B0D).決定された結晶構造から,二量体からなるCENP-T-W複合体の構造はヌクレオソームにおけるヒストン5) の二量体の部分の構造と類似していることが明らかになった.ヒストンとの構造の類似性,および,ヒストンのDNAとの結合に重要な領域を参考にして,CENP-TおよびCENP-WのDNAとの結合にかかわる領域を予想した.この領域のアミノ酸残基に変異を導入したCENP-T-W複合体を精製してDNA結合活性を解析した結果,活性の低下が確認された.また,ニワトリDT40細胞を用いて野生型CENP-WとこのDNA結合活性が低下したCENP-W変異体とを置換したところ,このCENP-W変異体は機能しないことが明らかになった.以上の結果から,ヒストンに類似したCENP-T-W複合体のDNA結合活性はキネトコアの形成に必須であると結論した.
2.CENP-S-X複合体もヒストンと類似しDNA結合活性を示す四量体を形成する
筆者らは,以前の研究において,CENP-T-W複合体と関連するタンパク質複合体としてCENP-S-X複合体を同定していた6).CENP-T-W複合体の機能を理解するにはCENP-S-X複合体との関連をより詳細に解析する必要性があると考え,ニワトリCENP-S-X複合体を大腸菌で発現し精製したのち構造生物学的な解析を行った.精製したCENP-S-X複合体のゲルろ過パターンからCENP-S-X複合体は四量体を形成することが示唆されたが,実際に分解能2.15Åで結晶構造を決定したCENP-S-X複合体は四量体の構造をとっていた(PDB ID:3B0B).CENP-S-X複合体の構造はヒストンと類似しており,CENP-T-W複合体とも類似していた.CENP-S-X複合体はCENP-T-W複合体と同様にDNA結合活性をもっており,やはり,ヒストンとの構造の類似性からDNA結合に関与する領域を予想した.この領域のアミノ酸残基に変異を導入しDNAへの結合性を低下させた変異型のCENP-S-X複合体はキネトコアに局在したが,ほかのキネトコアタンパク質の集合が不全になっていた.したがって,DNA結合活性はCENP-S-X複合体の機能に重要であると考えられた.
CENP-S-X複合体とCENP-T-W複合体の構造は全体的には類似していたものの,CENP-SのC末端側に存在する伸びたαヘリックス(α4ヘリックスとよぶ)はCENP-Tには存在せず,2つのαヘリックス構造が折り返したかたちで存在していた(α4ヘリックスおよびα5ヘリックスとよぶ).この構造の違いがCENP-Tの機能に重要である可能性を考え,α4ヘリックスおよびα5ヘリックスを欠失させたCENP-T変異体をニワトリDT40細胞において発現させた結果,このCENP-T変異体はキネトコアへは局在しないことがわかった.したがって,CENP-TのC末端側にある2つのαヘリックス領域がCENP-T-W複合体のキネトコアへの局在に必須であると結論された.
3.CENP-T-W複合体とCENP-S-X複合体は結合してヘテロ四量体を形成する
CENP-T-W複合体の構造とCENP-S-X複合体の構造には部分的に違いはみられるものの全体的な構造は類似している.機能的にも構造的にも両者が類似していることから,これらが協調して機能している可能性が考えられた.そこで,CENP-T-W複合体とCENP-S-X複合体とが物理的に結合する可能性を考え,両者を混合してゲルろ過解析を行った.CENP-T-W複合体は二量体の構造を,CENP-S-X複合体は四量体の構造をとるので,当初,両者が結合するのであればより分子量の大きい場所に新しいゲルろ過ピークが検出されるものと予想した.しかし意外なことに,1本のピークがCENP-S-X複合体のピークより分子量のやや小さい場所に検出された.このピークに含まれるタンパク質をSDS-ポリアクリルアミドゲル電気泳動により解析するとCENP-T,CENP-W,CENP-S,CENP-Xがほぼ同じ量ずつ検出された.これらの結果より,CENP-S-X複合体とCENP-T-W複合体とを混合するとCENP-S-X四量体の一部がCENP-T-W二量体と交換しCENP-T-W-S-Xヘテロ四量体が形成されることが示唆された.
このCENP-T-W-S-X複合体の構造をより詳細に知るためにその構造解析を試み,分解能2.4Åで結晶構造を決定した(図1,PDB ID:3VH5,3VH6).構造解析の結果,CENP-T-W-S-X複合体はCENP-S-X複合体よりも四量体の形成に必要な自由エネルギーが低く,より安定な構造をとることがわかった.さらに,ヘテロ四量体の形成にかかわる領域を詳細に解析した結果,その形成に必須なCENP-SおよびCENP-Tのアミノ酸残基を同定した.これらのアミノ酸残基に変異を導入したCENP-S変異体あるいはCENP-T変異体は,それぞれ野生型CENP-Xあるいは野生型CENP-Wと二量体を形成するものの,CENP-T-W-S-Xヘテロ四量体を形成しないことが示された.
4.CENP-T-W-S-X複合体のヘテロ四量体の構造はキネトコアの形成に必須である
組換えタンパク質を用いた構造生物学的および生化学的な解析からCENP-T-W-S-X複合体がヘテロ四量体を形成することが示されたが,このヘテロ四量体の形成が細胞内におけるキネトコアの構築にどのようにかかわっているかを明らかにすることが重要であった.そこで,ヘテロ四量体が形成されないような変異体を細胞内で発現させてその意義について解析を行った.はじめに,ヘテロ四量体が形成されないCENP-S変異体をニワトリDT40細胞において発現させると核に拡散した局在を示し,キネトコアには局在しなかった.これは,CENP-T-W-S-X複合体のヘテロ四量体の構造の形成がCENP-Sのキネトコアへの局在に必須であること意味していた.つぎに,ヘテロ四量体が形成されないCENP-T変異体をCENP-Tノックアウト細胞へ導入した.野生型CENP-Tの発現がCENP-T変異体の発現に置き換わったこの細胞において,キネトコアにおけるCENP-Tのシグナルは観察されたものの,本来の20%程度の強さであった.また,Ndc80という微小管と結合するキネトコアタンパク質の局在も大きく失われていた.これらのタンパク質の局在性の異常にともない,分裂期に異常を示す多数の細胞が存在しこれらの細胞は死滅した.以上のニワトリDT40細胞を用いた研究から,CENP-T-W-S-X複合体のヘテロ四量体の構造はキネトコアの形成に必須であることが明確に示された.
5.DNA-CENP-T-W-S-X複合体はヌクレオソームに似た特性をもつ
CENP-T-W複合体もCENP-S-X複合体もそれぞれの複合体のみでDNA結合活性を示すが,タンパク質-DNA複合体をゲル電気泳動により解析したところそれぞれ異なる泳動パターンが得られた.DNA-CENP-T-W複合体は巨大な複合体をつくりやすくゲルの内部に入らないような巨大な複合体が形成された.一方,DNA-CENP-S-X複合体では複数のバンドがラダー状に観察され,これは,DNAに一定の間隔で複数個のCENP-S-X複合体が結合していることを意味していた.そこで,CENP-T-W-S-X複合体とDNAとの結合様式を解析した結果,等量のDNAとCENP-T-W-S-X複合体とが結合したと考えられる1本のバンドが検出された.このことは,DNA-CENP-T-W-S-X複合体が安定な複合体を形成していることを示唆していた.
DNAはヒストンのまわりにまきついてヌクレオソームという構造をとることが知られている5).CENP-T-W-S-X複合体もヒストンと構造が類似しており,また,DNA結合部位が類似していることから,DNAがCENP-T-W-S-X複合体の周辺を巻くように結合する可能性が考えられた.その点を明らかにするためDNA超らせん化アッセイを行った.このアッセイは,環状DNAをトポイソメラーゼIにより弛緩型に変換させたのち,タンパク質とともに反応させDNAのトポロジーの変化をアガロース電気泳動により検出する方法である.ヒストンを用いてこのアッセイを行うと,ヌクレオソームの形成に準じて環状DNAのトポアイソマーが検出される.CENP-T-W-S-X複合体を用いてDNA超らせん化アッセイを行った結果,ヒストンより活性は弱いもののトポアイソマーが検出され,この複合体がDNAに超らせんを導入する活性をもつことが明らかになった.DNA結合部位に変異を導入した変異型のCENP-T-W-S-X複合体では超らせん化活性が減少したこともあわせて,DNAはCENP-T-W-S-X複合体のまわりを巻くように結合していると結論した.
つぎに,長さの異なるDNAとCENP-T-W-S-X複合体との結合実験を行ったところ,この複合体は100 bpの長さのDNAともっとも効率よく1本のバンドを形成した.また,100 bpより長いDNAとCENP-T-W-S-X複合体を結合させたのちこのDNA-タンパク質複合体をマイクロコッカルヌクレアーゼで消化した結果,約100 bpのDNAがヌクレアーゼによる消化から保護された.この消化実験およびDNA超らせん化アッセイの結果を総合的に考察すると,約100 bpのDNAがCENP-T-W-S-X複合体の周辺を巻くように結合しヌクレオソーム様の構造を形成していると考えられた(図2).
おわりに
この研究では,キネトコア形成の足場となることが予想されたCENP-Tが3,4),セントロメアのクロマチンにおいてCENP-T-W-S-X複合体というユニークなヒストン様の構造を形成していることを示した.これまで,セントロメアのクロマチンに関する研究というとセントロメアに特異的なヒストンのバリアントであるCENP-Aの機能1,2) と構造7) が中心であったが,CENP-Aの存在だけでは説明できない点が多くあった.この研究により提唱されたCENP-T-W-S-X複合体を含むクロマチン構造は,今後,セントロメアの機能を解析するうえで重要な方向性をあたえており,学問的な意義は高いと考えられた.さらに,ヒストンと類似したタンパク質がヌクレオソーム様の構造をとる可能性を示した点は,セントロメアだけでなくクロマチンのかかわる生物学の全体に大きなインパクトをあたえた.ヒストンには多くのバリアントが存在し,クロマチンはこのバリアントの組合せにより独自の機能をはたすことが知られている.たとえば,転写の活発なクロマチン領域と活発でないクロマチン領域とでヒストンの構成が異なっていることはよく知られており,近年,ヒストンのコードする遺伝情報として注目されている.今回の研究は,ヒストンと類似したタンパク質の組合せによってもクロマチンは独自の機能をはたす可能性を示唆した.CENP-S-X複合体はセントロメア領域にくわえDNA損傷部位にも存在することが知られている8,9).DNA損傷部位にはCENP-T-W複合体は存在しないことから,そこではCENP-S-X複合体が単独あるいはほかのタンパク質と結合してDNAと結合している可能性が考えられる.しかしながら,CENP-S-X複合体がCENP-T-W複合体と結合するとセントロメアに局在し独自のクロマチン構造を形成するようになる(図2).ヒストンと類似したタンパク質の組合せで独自の機能を発揮するというモデルは,通常のヒストンのバリアントの組合せからなる,いわゆる“ヒストンコード”を広げた新しいクロマチンコードといえる10).
文 献
- Black, B.E. & Cleveland, D.W.: Epigenetic centromere propagation and the nature of CENP-A nucleosomes. Cell, 144, 471-479 (2011)[PubMed]
- Perpelescu, M. & Fukagawa, T.: The ABCs of CENPs. Chromosoma, 120, 425-446 (2011)[PubMed]
- Hori, T., Amano, M., Suzuki, A. et al.: CCAN makes multiple contacts with centromeric DNA to provide distinct pathways to the outer kinetochore. Cell, 135, 1039-1052 (2008)[PubMed]
- Gascoigne, K. E., Takeuchi, K., Suzuki, A. et al.: Induced ectopic kinetochore assembly bypasses the requirement for CENP-A nucleosomes. Cell, 145, 410-422 (2011)[PubMed]
- Luger, K., Mader, A. W., Richmond, R. K. et al.: Crystal structure of the nucleosome core particle at 2.8Å resolution. Nature, 389, 251-260 (1997)[PubMed]
- Amano, M., Suzuki, A., Hori, T. et al.: The CENP-S complex is essential for the stable assembly of outer kinetochore structure. J. Cell Biol., 186, 173-182 (2009)[PubMed]
- Tachiwana, H., Kagawa, W., Shiga, T. et al.: Crystal structure of the human centromeric nucleosome containing CENP-A. Nature, 476, 232-235 (2011)[PubMed]
- Singh, T. R., Saro, D., Ali, A. M. et al.: MHF1-MHF2, a histone-fold-containing protein complex, participates in the Fanconi anemia pathway via FANCM. Mol. Cell, 37, 879-886 (2010)[PubMed]
- Yan, Z., Delannoy, M., Ling, C. et al.: A histone-fold complex and FANCM form a conserved DNA-remodeling complex to maintain genome stability. Mol. Cell, 37, 865-878 (2010)[PubMed]
- Foltz, D. R. & Stukenberg, P. T.: A new histone at the centromere? Cell, 148, 394-396 (2012)[PubMed]
著者プロフィール
略歴:2001年 大阪大学大学院医学系研究科 修了,2003年 オーストリアResearch Institute of Molecular Pathology研究員,2006年 英国Oxford大学 研究員,2008年 大阪大学蛋白質研究所 招聘研究員を経て,2009年より国立遺伝学研究所 助教.
研究テーマ:真核生物の染色体分配装置の構造生物学.
深川 竜郎(Tatsuo Fukagawa)
国立遺伝学研究所 教授.
研究室URL:http://www.nig.ac.jp/labs/MolGene/index_j.html
© 2012 西野達哉・深川竜郎 Licensed under CC 表示 2.1 日本