網膜変性に対するアミン製剤を用いた新規の薬物治療
前田亜希子・Krzysztof Palczewski
(米国Case Western Reserve大学,Department of Ophthalmology and Visual Sciences)
email:前田亜希子
DOI: 10.7875/first.author.2012.011
Primary amines protect against retinal degeneration in mouse models of retinopathies.
Akiko Maeda, Marcin Golczak, Yu Chen, Kiichiro Okano, Hideo Kohno, Satomi Shiose, Kaede Ishikawa, William Harte, Grazyna Palczewska, Tadao Maeda, Krzysztof Palczewski
Nature Chemical Biology, 8, 170-178 (2012)
視物質cis-レチナールがtrans-レチナールへと光異性化することが視覚の初現象であり,この視物質の構造変化が連続する生化学反応よりなる視覚伝達を惹起する.ビタミンAの誘導体であるcis-レチナールは視覚に不可欠であり,眼においてはレチノイド回路により再生し再利用される.レチノイド回路の最初の反応はtrans-レチナールの還元で,この還元反応の遅延は視細胞死と直結している.レチノイド回路は視覚の維持に必須である視物質の供給と,網膜に毒性のある光異性化した視物質のすみやかな排除という2つの役割を担っている.この論文では,アミン製剤の投与が光により産生されるアルデヒド基をもつtrans-レチナールの毒性を可逆性のシッフ塩基の合成により中和し,網膜変性の進行を緩和することを動物実験と生化学的な見地から証明した.この結果は,新規の治療につながる網膜変性の病態の理解と,レチノイドを標的とした薬物治療のしくみを明らかにした.
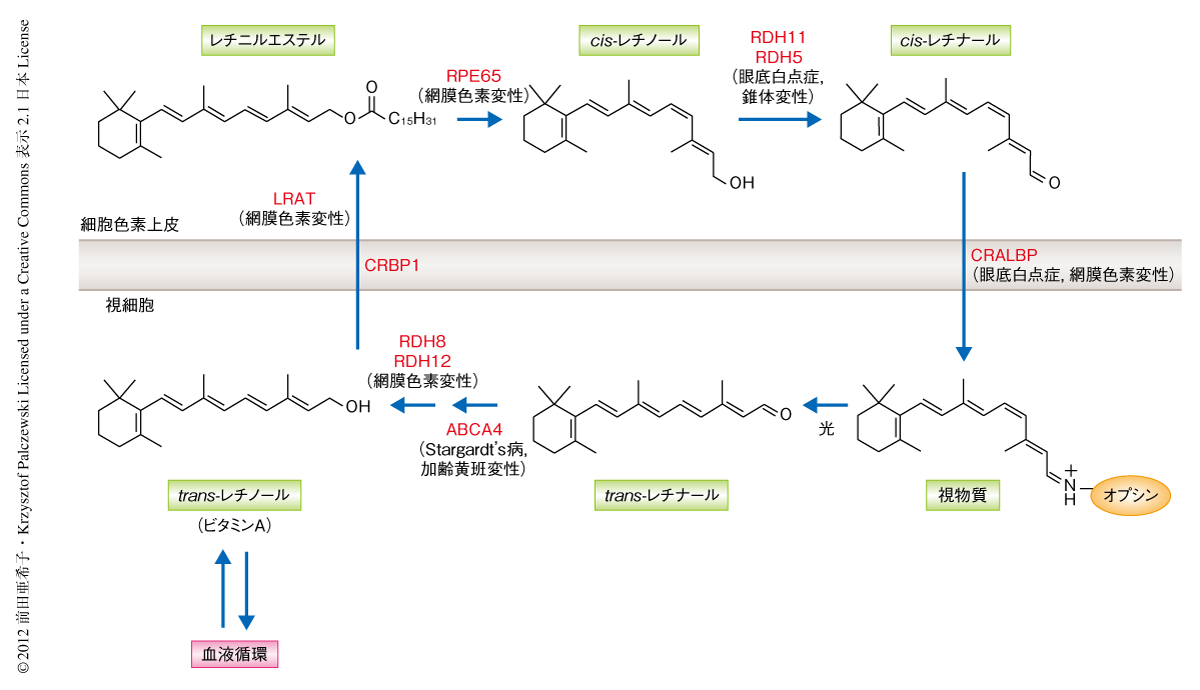
光は網膜の視細胞により電気シグナルに変換され,視覚として大脳視覚野において認識される.視覚の最初の反応はビタミンAの誘導体である視物質cis-レチナールがtrans-レチナールへと光異性化することである.連続する光刺激に備えるためにはcis-レチナールの安定した供給が不可欠で,脊椎動物では光異性化した視物質をcis-レチナールに再生することで効率的に再利用している.このcis-レチナールの再生のための系がレチノイド回路であり,視細胞とそれに隣接する網膜色素上皮細胞における多段階の酵素反応により構成されている1)(図1).レチノイド回路の異常による視物質cis-レチナールの供給の低下が網膜変性の原因となる一方,光異性化した視物質trans-レチナールの代謝の遅延も視細胞変性に関与することが知られている.
trans-レチナールの代謝は視細胞の円盤膜内から膜外への輸送と還元反応からなっており,ATP結合トランスポーターABCA4とレチノール脱水酵素RDH8がそれぞれ重要な役割を担っている2).ABCA4の異常はStargardt’s病(若年性黄斑変性の一型)の原因であり,また,加齢黄斑変性にかかわることが報告されている3,4).筆者らの研究により,マウスにおいてABCA4とRDH8を同時にノックアウトするとStargardt’s病や加齢黄斑変性に似た網膜臨床像を呈することが明らかにされ5),trans-レチナールの代謝の遅延が網膜変性にかかわることが直接的に証明された.trans-レチナールの網膜に対する毒性は培養細胞においても確認されている6).視細胞は視覚伝達のため高度に分化した細胞であり,視物質の0.5%が光異性化するのみで網膜に障害を起こすのに十分なtrans-レチナールが産生される.過度の光刺激や加齢変化が視細胞におけるtrans-レチナールの濃度上昇に寄与しており,この網膜への毒性を制御することは網膜の恒常性の維持に重要である.
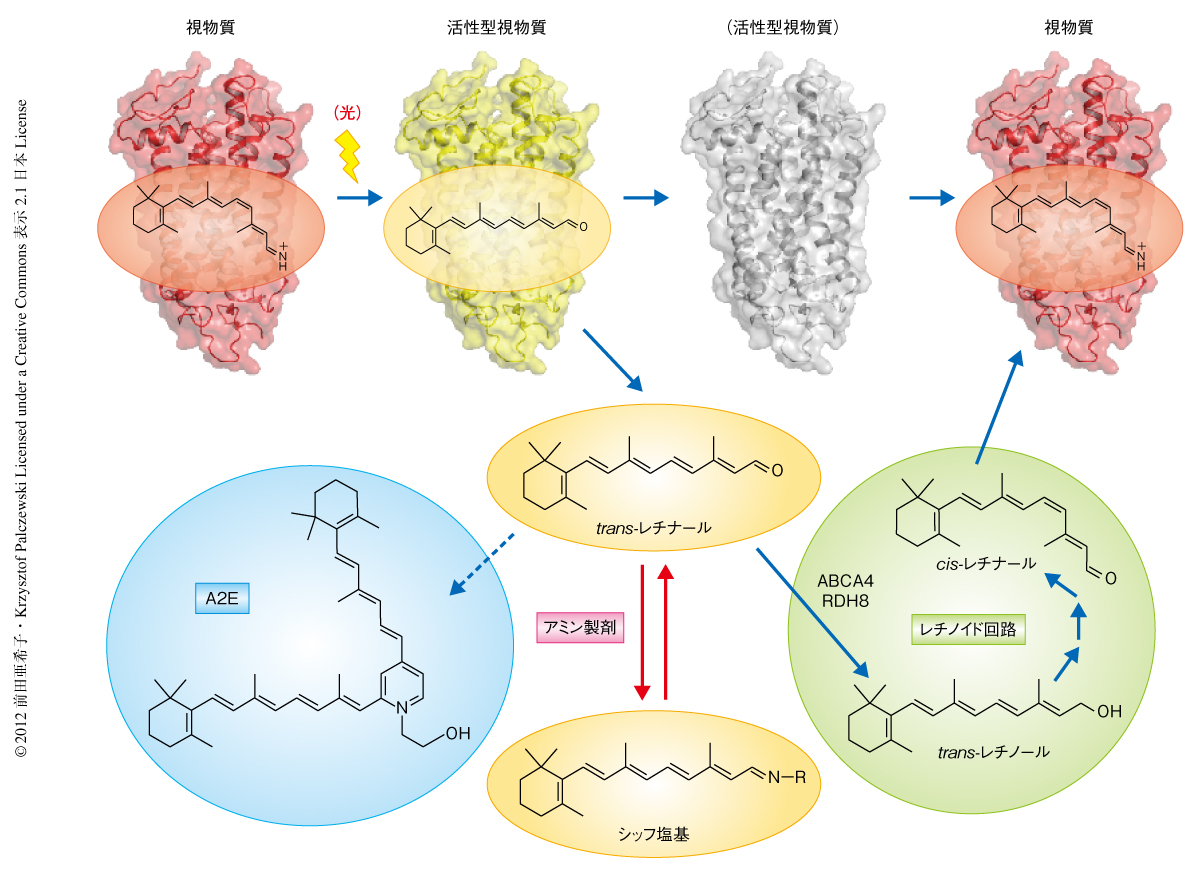
trans-レチナールは視物質cis-レチナールの光異性化により産生され,ATP結合トランスポーターABCA4とレチノール脱水酵素RDH8によりすみやかに代謝される.trans-レチナールの産生がこれら酵素の処理能力をこえる場合や,これら酵素に異常が生じた場合には視細胞におけるtrans-レチナールの濃度上昇がひき起こされる.trans-レチナールは反応性の高いアルデヒド基をもつことから網膜への毒性に関与する可能性が示唆されており,RDH8によるアルデヒド基からアルコール基(trans-レチノールまたはビタミンA)への還元反応は網膜の恒常性の維持に重要である.実際に,生体はtrans-レチノールのかたちでビタミンAの輸送を行っている.このことから,網膜光障害におけるtrans-レチナールの役割は長く示唆されていたが,生体でのtrans-レチナールの濃度が網膜において障害を誘発するのに十分なだけ上昇するのかどうかが問題とされていた.筆者らの研究により,ABCA4とRDH8は網膜におけるtrans-レチナールの代謝に重要な役割を担うことが示唆され,また,光に誘発される網膜変性がABCA4とRDH8のダブルノックアウトマウスにおいて確認された5).室内光のもとでは数カ月かけて進行するStargardt’s病や加齢黄斑変性に似た所見を,また,強度光のもとでは24時間後に大量の視細胞死をともなう急性の網膜光障害が観察された.trans-レチナールの代謝の遅延もこのダブルノックアウトマウスで検出された.trans-レチナールの代謝の遅延は同時にそのエタノールアミンとの付加物A2Eを産生することが知られており,Stargardt’s病や加齢黄斑変性でもA2Eの蓄積が報告されている7,8).このA2Eの蓄積もABCA4とRDH8のダブルノックアウトマウスにおいて観察された.trans-レチナールによる網膜に対する毒性の機序もその一部が解明され,細胞膜におけるGタンパク質の活性,イノシトールリン酸に由来する細胞内Ca2+濃度の上昇,NADPH酸化酵素の活性化にともなう活性酸素の濃度の上昇,ミトコンドリアに由来するさらなるアポトーシスが視細胞の障害における分子機構であることが明らかにされている6,9).
視細胞におけるtrans-レチナールの濃度上昇が網膜変性の誘引となることが解明され,そのアルデヒド基の活性の抑制が視細胞死を減少させる可能性が示唆された.しかし,trans-レチナールは視覚に必須な視物質の再生に使われる重要な中間産物としての役割もあり1),trans-レチナールを取り除くことは視機能の維持のため回避しなくてはならない.そこで,アミン製剤との可逆性シッフ塩基の産生により光照射ののちに一時的に高くなるtrans-レチナールの濃度を下げ,trans-レチナールの代謝速度に歩調を合わせたシッフ塩基からのtrans-レチナールの遊離,レチノイド回路への供給が生体において可能であるかどうかを検討した(図2).まず,ABCA4とRDH8のダブルノックアウトマウスにみられる急性の光障害にアミン製剤が有効であるかどうかを試し,24のアミン製剤のうち67%が網膜においてシッフ塩基を形成しこの網膜症を軽症化することを明らかにした.
trans-レチナールはレチノイド回路における重要な中間産物としての役割があり1),アミン製剤によるtrans-レチナール濃度の低下が視物質cis-レチナールの産生に影響することが懸念された.実際に,レチノイド回路を制御する薬剤はtrans-レチナールによる網膜への毒性を軽減することが知られているが5,10),同時に,cis-レチナールの産生を抑制することから夜盲を呈し,極端な場合には視覚に必須な視物質の供給が絶たれ薬剤性の視覚障害あるいは網膜変性を誘発する危険をともなう.そこで,急性の光障害を軽症化したアミン製剤が,cis-レチナールの産生にどのような影響をあたえるかを検討した.マウスにおいてレチノイド回路を制御する薬剤が著しいcis-レチナールの産生抑制をみせたことと比較して,アミン製剤は正常なcis-レチナールの産生にまったく影響を及ぼさなかった.cis-レチナールの産生に直接にかかわる酵素RPE65の活性実験においてもアミン製剤の酵素活性に対する抑制効果は観察されなかった.さらに,アミン製剤のRDH8の酵素活性に対する影響もみられず,アミン製剤の存在下においてもtrans-レチナールからtrans-レチノールへの還元反応はアミン製剤の非存在下と同様の反応速度を示した.
マウスの網膜においてアミン製剤の投与が,シッフ塩基の産生によりtrans-レチナールの濃度を低下させること,視物質cis-レチナールの産生抑制を示さないこと,ABCA4とRDH8のダブルノックアウトマウスにみられる急性の光障害を軽症化させることから,さらにアミン製剤の有効性をABCA4とRDH8のダブルノックアウトマウスにみられる室内光のもとで進行するStargardt’s病や加齢黄斑変性に似た経時性の網膜変性において検討した.生後1カ月齢から4カ月齢まで3カ月のあいだアミン製剤の投与を行い,網膜変性に対する影響を観察した.アミン製剤を投与したダブルノックアウトマウスでは対照に比べて網膜変性の軽症化がみられ,trans-レチナールの濃度を反映するA2Eの蓄積量も減少していた.アミン製剤の長期投与において懸念される網膜の機能の異常も観察されなかった.以上より,アミン製剤によるtrans-レチナールの濃度の低下が網膜症に対する新たな治療戦略となりうることが示唆された.
また,野生型マウスにおける網膜光障害に対するアミン製剤の影響についても検討したところ,野生型マウスでみられる過剰な光刺激により誘発される視細胞死が,アミン製剤の投与により軽減されることが明らかになった.この結果は,正常な個体における網膜光障害の原因のひとつとしてtrans-レチナールが重要な役割を担っていることを示唆した.
この研究においては,構造の類似性が乏しいアミン製剤24種についてその網膜変性に対する治療効果を検討し,24種のうち16種(67%)のアミン製剤が,シッフ塩基を形成することによりtrans-レチナールの濃度を一時的に低下させ網膜症を軽症化することを明らかにした.通常の薬物治療における標的分子は酵素や受容体をはじめとするタンパク質であることが一般的だが,ここでの標的分子は低分子であるレチノイドであり視物質の産生抑制を回避することが可能であった.また,加齢変化にともなう神経変性疾患に属する網膜症において,適切な病態の理解とマウスモデルの作製により1週間という短時間での薬剤スクリーニングが可能となることも示された.正常な網膜の機能を損なうことなく,毒性物質を一時的に抱合し隔離してその網膜への傷害性を抑制し,視覚に必要な中間産物として生体にもどすことのできるこの方法は,新規の薬物治療の可能性を示唆するものであり,今後の網膜変性疾患に対する治療の開発および発展に役立てられることが期待される.
略歴:2001年 札幌医科大学大学院医学研究科 修了,同年 米国Washington大学Senior Research Fellow,2005年 米国Case Western Reserve大学Research Associate,2008年 同Senior Instructorを経て,2010年より同Assistant Professor.
研究テーマ:網膜変性の分子病態.
抱負:網膜変性に対する新しい治療法を提案したい.
Krzysztof Palczewski
米国Case Western Reserve大学Professor.
研究室URL:
http://pharmacology.case.edu/department/faculty/primary/labs/Palczewski/thelab.aspx
© 2012 前田亜希子・Krzysztof Palczewski Licensed under CC 表示 2.1 日本
(米国Case Western Reserve大学,Department of Ophthalmology and Visual Sciences)
email:前田亜希子
DOI: 10.7875/first.author.2012.011
Primary amines protect against retinal degeneration in mouse models of retinopathies.
Akiko Maeda, Marcin Golczak, Yu Chen, Kiichiro Okano, Hideo Kohno, Satomi Shiose, Kaede Ishikawa, William Harte, Grazyna Palczewska, Tadao Maeda, Krzysztof Palczewski
Nature Chemical Biology, 8, 170-178 (2012)
要 約
視物質cis-レチナールがtrans-レチナールへと光異性化することが視覚の初現象であり,この視物質の構造変化が連続する生化学反応よりなる視覚伝達を惹起する.ビタミンAの誘導体であるcis-レチナールは視覚に不可欠であり,眼においてはレチノイド回路により再生し再利用される.レチノイド回路の最初の反応はtrans-レチナールの還元で,この還元反応の遅延は視細胞死と直結している.レチノイド回路は視覚の維持に必須である視物質の供給と,網膜に毒性のある光異性化した視物質のすみやかな排除という2つの役割を担っている.この論文では,アミン製剤の投与が光により産生されるアルデヒド基をもつtrans-レチナールの毒性を可逆性のシッフ塩基の合成により中和し,網膜変性の進行を緩和することを動物実験と生化学的な見地から証明した.この結果は,新規の治療につながる網膜変性の病態の理解と,レチノイドを標的とした薬物治療のしくみを明らかにした.
はじめに
光は網膜の視細胞により電気シグナルに変換され,視覚として大脳視覚野において認識される.視覚の最初の反応はビタミンAの誘導体である視物質cis-レチナールがtrans-レチナールへと光異性化することである.連続する光刺激に備えるためにはcis-レチナールの安定した供給が不可欠で,脊椎動物では光異性化した視物質をcis-レチナールに再生することで効率的に再利用している.このcis-レチナールの再生のための系がレチノイド回路であり,視細胞とそれに隣接する網膜色素上皮細胞における多段階の酵素反応により構成されている1)(図1).レチノイド回路の異常による視物質cis-レチナールの供給の低下が網膜変性の原因となる一方,光異性化した視物質trans-レチナールの代謝の遅延も視細胞変性に関与することが知られている.
trans-レチナールの代謝は視細胞の円盤膜内から膜外への輸送と還元反応からなっており,ATP結合トランスポーターABCA4とレチノール脱水酵素RDH8がそれぞれ重要な役割を担っている2).ABCA4の異常はStargardt’s病(若年性黄斑変性の一型)の原因であり,また,加齢黄斑変性にかかわることが報告されている3,4).筆者らの研究により,マウスにおいてABCA4とRDH8を同時にノックアウトするとStargardt’s病や加齢黄斑変性に似た網膜臨床像を呈することが明らかにされ5),trans-レチナールの代謝の遅延が網膜変性にかかわることが直接的に証明された.trans-レチナールの網膜に対する毒性は培養細胞においても確認されている6).視細胞は視覚伝達のため高度に分化した細胞であり,視物質の0.5%が光異性化するのみで網膜に障害を起こすのに十分なtrans-レチナールが産生される.過度の光刺激や加齢変化が視細胞におけるtrans-レチナールの濃度上昇に寄与しており,この網膜への毒性を制御することは網膜の恒常性の維持に重要である.
1.trans-レチナールの代謝の遅延は網膜における障害を誘発する
trans-レチナールは視物質cis-レチナールの光異性化により産生され,ATP結合トランスポーターABCA4とレチノール脱水酵素RDH8によりすみやかに代謝される.trans-レチナールの産生がこれら酵素の処理能力をこえる場合や,これら酵素に異常が生じた場合には視細胞におけるtrans-レチナールの濃度上昇がひき起こされる.trans-レチナールは反応性の高いアルデヒド基をもつことから網膜への毒性に関与する可能性が示唆されており,RDH8によるアルデヒド基からアルコール基(trans-レチノールまたはビタミンA)への還元反応は網膜の恒常性の維持に重要である.実際に,生体はtrans-レチノールのかたちでビタミンAの輸送を行っている.このことから,網膜光障害におけるtrans-レチナールの役割は長く示唆されていたが,生体でのtrans-レチナールの濃度が網膜において障害を誘発するのに十分なだけ上昇するのかどうかが問題とされていた.筆者らの研究により,ABCA4とRDH8は網膜におけるtrans-レチナールの代謝に重要な役割を担うことが示唆され,また,光に誘発される網膜変性がABCA4とRDH8のダブルノックアウトマウスにおいて確認された5).室内光のもとでは数カ月かけて進行するStargardt’s病や加齢黄斑変性に似た所見を,また,強度光のもとでは24時間後に大量の視細胞死をともなう急性の網膜光障害が観察された.trans-レチナールの代謝の遅延もこのダブルノックアウトマウスで検出された.trans-レチナールの代謝の遅延は同時にそのエタノールアミンとの付加物A2Eを産生することが知られており,Stargardt’s病や加齢黄斑変性でもA2Eの蓄積が報告されている7,8).このA2Eの蓄積もABCA4とRDH8のダブルノックアウトマウスにおいて観察された.trans-レチナールによる網膜に対する毒性の機序もその一部が解明され,細胞膜におけるGタンパク質の活性,イノシトールリン酸に由来する細胞内Ca2+濃度の上昇,NADPH酸化酵素の活性化にともなう活性酸素の濃度の上昇,ミトコンドリアに由来するさらなるアポトーシスが視細胞の障害における分子機構であることが明らかにされている6,9).
2.trans-レチナールはアミン製剤と可逆性のシッフ塩基を産生する
視細胞におけるtrans-レチナールの濃度上昇が網膜変性の誘引となることが解明され,そのアルデヒド基の活性の抑制が視細胞死を減少させる可能性が示唆された.しかし,trans-レチナールは視覚に必須な視物質の再生に使われる重要な中間産物としての役割もあり1),trans-レチナールを取り除くことは視機能の維持のため回避しなくてはならない.そこで,アミン製剤との可逆性シッフ塩基の産生により光照射ののちに一時的に高くなるtrans-レチナールの濃度を下げ,trans-レチナールの代謝速度に歩調を合わせたシッフ塩基からのtrans-レチナールの遊離,レチノイド回路への供給が生体において可能であるかどうかを検討した(図2).まず,ABCA4とRDH8のダブルノックアウトマウスにみられる急性の光障害にアミン製剤が有効であるかどうかを試し,24のアミン製剤のうち67%が網膜においてシッフ塩基を形成しこの網膜症を軽症化することを明らかにした.
3.アミン製剤は視物質の産生を阻害しない
trans-レチナールはレチノイド回路における重要な中間産物としての役割があり1),アミン製剤によるtrans-レチナール濃度の低下が視物質cis-レチナールの産生に影響することが懸念された.実際に,レチノイド回路を制御する薬剤はtrans-レチナールによる網膜への毒性を軽減することが知られているが5,10),同時に,cis-レチナールの産生を抑制することから夜盲を呈し,極端な場合には視覚に必須な視物質の供給が絶たれ薬剤性の視覚障害あるいは網膜変性を誘発する危険をともなう.そこで,急性の光障害を軽症化したアミン製剤が,cis-レチナールの産生にどのような影響をあたえるかを検討した.マウスにおいてレチノイド回路を制御する薬剤が著しいcis-レチナールの産生抑制をみせたことと比較して,アミン製剤は正常なcis-レチナールの産生にまったく影響を及ぼさなかった.cis-レチナールの産生に直接にかかわる酵素RPE65の活性実験においてもアミン製剤の酵素活性に対する抑制効果は観察されなかった.さらに,アミン製剤のRDH8の酵素活性に対する影響もみられず,アミン製剤の存在下においてもtrans-レチナールからtrans-レチノールへの還元反応はアミン製剤の非存在下と同様の反応速度を示した.
4.アミン製剤はtrans-レチナールに関連する網膜症を軽減する
マウスの網膜においてアミン製剤の投与が,シッフ塩基の産生によりtrans-レチナールの濃度を低下させること,視物質cis-レチナールの産生抑制を示さないこと,ABCA4とRDH8のダブルノックアウトマウスにみられる急性の光障害を軽症化させることから,さらにアミン製剤の有効性をABCA4とRDH8のダブルノックアウトマウスにみられる室内光のもとで進行するStargardt’s病や加齢黄斑変性に似た経時性の網膜変性において検討した.生後1カ月齢から4カ月齢まで3カ月のあいだアミン製剤の投与を行い,網膜変性に対する影響を観察した.アミン製剤を投与したダブルノックアウトマウスでは対照に比べて網膜変性の軽症化がみられ,trans-レチナールの濃度を反映するA2Eの蓄積量も減少していた.アミン製剤の長期投与において懸念される網膜の機能の異常も観察されなかった.以上より,アミン製剤によるtrans-レチナールの濃度の低下が網膜症に対する新たな治療戦略となりうることが示唆された.
また,野生型マウスにおける網膜光障害に対するアミン製剤の影響についても検討したところ,野生型マウスでみられる過剰な光刺激により誘発される視細胞死が,アミン製剤の投与により軽減されることが明らかになった.この結果は,正常な個体における網膜光障害の原因のひとつとしてtrans-レチナールが重要な役割を担っていることを示唆した.
おわりに
この研究においては,構造の類似性が乏しいアミン製剤24種についてその網膜変性に対する治療効果を検討し,24種のうち16種(67%)のアミン製剤が,シッフ塩基を形成することによりtrans-レチナールの濃度を一時的に低下させ網膜症を軽症化することを明らかにした.通常の薬物治療における標的分子は酵素や受容体をはじめとするタンパク質であることが一般的だが,ここでの標的分子は低分子であるレチノイドであり視物質の産生抑制を回避することが可能であった.また,加齢変化にともなう神経変性疾患に属する網膜症において,適切な病態の理解とマウスモデルの作製により1週間という短時間での薬剤スクリーニングが可能となることも示された.正常な網膜の機能を損なうことなく,毒性物質を一時的に抱合し隔離してその網膜への傷害性を抑制し,視覚に必要な中間産物として生体にもどすことのできるこの方法は,新規の薬物治療の可能性を示唆するものであり,今後の網膜変性疾患に対する治療の開発および発展に役立てられることが期待される.
文 献
- Kiser, P. D., Golczak, M., Maeda, A. et al.: Key enzymes of the retinoid (visual) cycle in vertebrate retina. Biochem. Biophys. Acta, 1821, 137-151 (2012)[PubMed]
- Maeda, A., Maeda, T., Sun, W. et al.: Redundant and unique roles of retinol dehydrogenases in the mouse retina. Proc. Natl. Acad. Sci. USA, 104, 19565-19570 (2007)[PubMed]
- Allikmets, R., Singh, N., Sun, H. et al.: A photoreceptor cell-specific ATP-binding transporter gene (ABCR) is mutated in recessive Stargardt macular dystrophy. Nat. Genet., 15, 236-246 (1997)[PubMed]
- Allikmets, R., Shroyer, N. F., Singh, N. et al.: Mutation of the Stargardt disease gene (ABCR) in age-related macular degeneration. Science, 277, 1805-1807 (1997)[PubMed]
- Maeda, A., Maeda, T., Golczak, M. et al.: Retinophathy in mice induced by disrupted all-trans-retinal clearance. J. Biol. Chem., 283, 26684-23393 (2008)[PubMed]
- Maeda, A., Maeda, T., Golczak, M. et al.: Involvement of all-trans-retinal in acute light-induced retinophathy of mice. J. Biol. Chem., 284, 15173-15187 (2009)[PubMed]
- Delori, F. C., Staurenghi, G., Arend, O. et al.: In vivo measurement of lipofuscin in Stargardt’s disease: Fundus flavimaculatus. Invest. Ophthalmol. Vis. Sci., 36, 2327-2331 (1995)[PubMed]
- Dorey, C. K., Staurenghi, G. & Delori, F. C.: Lipofuscin in aged and AMD eyes. in Retinal Regeneration (Holyfield, J. G., Anderson, R. E. & LaVail, M. M. eds.), pp. 3-14, Prenum Press, New York (1993)
- Chen, Y., Okano, K., Maeda, T. et al.: Mechanism of all-trans-retinal toxicity: implications for Stargardt’s disease and age-related macular degeneration. J. Biol. Chem., 287, 5059-5069 (2011)[PubMed]
- Golczak, M., Kuksa, V., Maeda, T. et al.: Positively charged retinoids are potent and selective inhibitors of the trans-cis isomerization in the retinoid (visual) cycle. Proc. Natl. Acad. Sci. USA, 102, 8162-8167 (2005)[PubMed]
著者プロフィール
略歴:2001年 札幌医科大学大学院医学研究科 修了,同年 米国Washington大学Senior Research Fellow,2005年 米国Case Western Reserve大学Research Associate,2008年 同Senior Instructorを経て,2010年より同Assistant Professor.
研究テーマ:網膜変性の分子病態.
抱負:網膜変性に対する新しい治療法を提案したい.
Krzysztof Palczewski
米国Case Western Reserve大学Professor.
研究室URL:
http://pharmacology.case.edu/department/faculty/primary/labs/Palczewski/thelab.aspx
© 2012 前田亜希子・Krzysztof Palczewski Licensed under CC 表示 2.1 日本