全身性炎症反応症候群の致死性はRIPキナーゼに依存性のネクローシスにより決定される
高橋のぞみ・Peter Vandenabeele
(ベルギーVIB-Ghent大学,Department of Biomedical Molecular Biology)
email:高橋のぞみ
DOI: 10.7875/first.author.2012.010
RIP kinase-dependent necrosis drives lethal systemic inflammatory response syndrome.
Linde Duprez, Nozomi Takahashi, Filip Van Hauwermeiren, Benjamin Vandendriessche, Vera Goossens, Tom Vanden Berghe, Wim Declercq, Claude Libert, Anje Cauwels, Peter Vandenabeele
Immunity, 35, 908-918 (2011)
TNF受容体の活性化は細胞死および細胞生存という相互に排他的な2つのシグナル伝達経路を誘発する.前者はさらに,カスパーゼに依存性のアポトーシスとRIPキナーゼに依存性のネクローシスという2つの形態の細胞死につながるシグナル伝達経路に分岐する.筆者らは,TNFにより誘発される全身性炎症反応症候群とこの2つの細胞死の形態とのかかわりを探った.アポトーシスを仲介する執行型カスパーゼまたは炎症性カスパーゼのノックアウトマウスにおいて全身性炎症反応症候群の致死性に影響はなかったが,ネクローシスを仲介するRIPキナーゼ3のノックアウトマウスにおいては全身性炎症反応症候群の致死性は完全に抑制されるとともに,血清における内在性の損傷関連分子パターンおよび炎症性サイトカインの濃度が減少した.また,RIPキナーゼ1の阻害剤の投与によっても同様の結果が得られた.したがって,RIPキナーゼに依存性のネクローシスが全身性炎症反応症候群の致死性を決定していると結論した.RIPキナーゼ3のノックアウトマウスにおいては腹膜炎性敗血症のモデルである盲腸結紮穿刺の致死性も抑制された.RIPキナーゼ依存性のネクローシスは全身性炎症反応症候群および敗血症の治療標的となることを提案する.
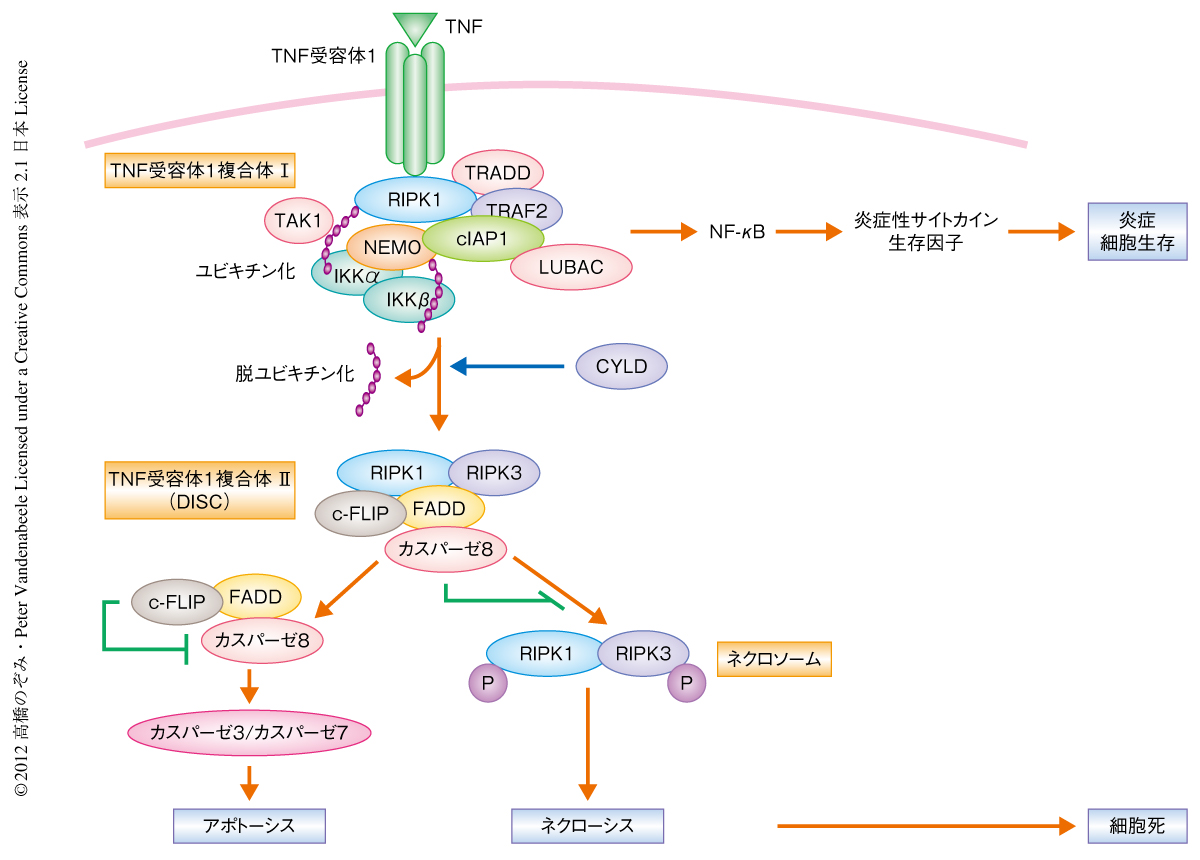
これまで,細胞死は形態学的にアポトーシスとネクローシスに区別されてきた.そして,カスパーゼを介するアポトーシスが分子生物学的および生化学的に解明されてきたのに比べ,ネクローシスは偶発的なものと考えられてきた.筆者らのこれまでの研究は,TNF(tumor necrosis factor,腫瘍壊死因子)はアポトーシスだけでなく,細胞の環境によってはネクローシスを誘発することを明示したが,近年,その分子機作が解明されるまでには15年もの年月がかかった1).RIPキナーゼ1およびRIPキナーゼ3(RIP:receptor-interacting protein,受容体相互作用タンパク質)の発見はこれまでのネクローシスの概念をくつがえし,ネクローシスもアポトーシスと同様に高度に制御された過程であることを証明しネクロトーシス(necroptosis)という新しい用語を生むにいたった2-5).現在までのところ,TNF受容体1の活性化により誘発されるネクローシスがもっともよく研究されている.TNF受容体1の活性化は,一方で細胞膜の近傍にTNF受容体1複合体Iを形成しその複合体に含まれるRIPキナーゼ1の63番目のリジン残基のユビキチン化を促し,TAK1を介したIκBキナーゼ複合体の活性化によりIκBの分解とNF-κBの活性化を導くことで,生存因子および炎症性サイトカインの遺伝子の発現を促す.他方,CYLDなどによるRIPキナーゼ1の脱ユビキチン化は細胞質におけるTNF受容体1複合体II(DISC:death-inducing signaling complex,細胞死誘導性シグナル伝達複合体ともよばれる)の形成を促し,アポトーシスあるいはネクローシスによる細胞死にいたる.カスパーゼの活性化はアポトーシスをひき起こし,その活性が阻害された場合にはネクローシスが誘導される1)(図1).したがって,細胞生存とアポトーシスあるいはネクローシスへのシグナル伝達経路は相互に排他的であるものと考えられる.最近の研究は,アポトーシスを誘導する複合体DISCを構成するタンパク質,カスパーゼ8,FADD,cFLIP-Lによるネクローシスの制御が胚発生および生体の恒常性の維持に大きな役割をはたすことを示唆している6-8).これらのネクローシス抑制タンパク質が排除された場合,RIPキナーゼ1とRIPキナーゼ3とが近接することによりリン酸化反応を介してネクローシスが導かれるものと考えられている.RIPキナーゼ1とRIPキナーゼ3を含む複合体はネクロソーム(necrosome)ともよばれている.
全身性炎症反応症候群(systemic inflammatory response syndrome:SIRS)は感染性の疾患に由来する敗血症や重篤な熱傷や外傷によりひき起こされる,きわめて致死性の高い全身性の炎症であり,現在のところ決定的な治療法はない.これまで,TNFをはじめとするサイトカインが関係するものと考えられてきたが,それらを標的とする生物学的製剤を使った実験的な抗炎症治療はこれまでほぼすべてが失敗におわっている.全身性炎症反応症候群および敗血症が“バイオテク企業の墓場”とよばれるゆえんである.筆者らは,TNFが炎症性サイトカインの発現だけでなく細胞死にいたるシグナル伝達経路を誘導することから,全身性炎症反応症候群および敗血症における2つの細胞死の形態,カスパーゼ依存性のアポトーシスとRIPキナーゼ依存性のネクローシスの役割を遺伝学的アプローチおよび薬理学的アプローチにより探った.過去の研究において,広範なカスパーゼ阻害剤zVAD-fmkの投与がTNFによる全身性炎症反応症候群の致死性を促進したことから9),アポトーシスは全身性炎症反応症候群に対し保護的な役割をはたしていることがと示唆された.
TNFの投与はL929線維芽細胞においてネクローシスを誘発する.このネクローシスはカスパーゼ阻害剤zVAD-fmkにより促進されることから,カスパーゼがネクローシスを制御しているものと考えられた.ネクローシスの制御にかかわるカスパーゼを同定するため,siRNAによるノックダウンを試みた.炎症型カスパーゼであるカスパーゼ1,および,執行型カスパーゼ(executioner caspase)であるカスパーゼ3あるいはカスパーゼ7のノックダウンではTNFによるネクローシスになんらの影響はなかったが,イニシエーターカスパーゼであるカスパーゼ8のノックダウンではzVAD-fmkと同様のネクローシスの促進がみられた.また,カスパーゼ8のノックダウンにおいてはzVAD-fmkによるネクローシスの促進作用が失われた.したがって,zVAD-fmkによるネクローシスの促進はカスパーゼ8を介しているものと結論された.カスパーゼ8はアポトーシスを誘導する複合体DISCの構成タンパク質のひとつであり,この複合体におけるカスパーゼ8の活性化によりRIPキナーゼ1およびRIPキナーゼ3の分解をひき起こしネクローシスを阻害するものと考えられた(図1).一方で,RIPキナーゼ3のノックダウンではTNFによるネクローシスからの保護作用がみられ,また,RIPキナーゼ1の選択的な阻害剤であるネクロスタチン1による前処置によっても同様の効果が得られた.
このような細胞レベルでの結果にもとづき,マウス個体におけるTNFのひき起こす細胞死の役割を探った.マウスへのTNFの投与は全身性炎症反応症候群を誘発し,敗血症および敗血症ショックのモデルとして使用されてきた.執行型カスパーゼであるカスパーゼ3およびカスパーゼ7,および,炎症性カスパーゼであるカスパーゼ1の関与を調べるためこれらのノックアウトマウスを使用した.なお,カスパーゼ8のノックアウトマウスは胎生致死のため実験は不可能であった.執行型カスパーゼについてはカスパーゼ3あるいはカスパーゼ7のいずれのノックアウトマウスにおいてもTNF投与ののちの全身性炎症反応症候群の致死性および敗血症ショックにともなう不可逆的な低体温に対し大きな影響はみられなかった.しかし,カスパーゼ3のノックアウトマウスではTNF投与ののち小腸炎および小腸上皮細胞のアポトーシスが減少した.したがって,小腸上皮細胞のアポトーシスとそれに由来する小腸炎はカスパーゼ3を介してはいるが全身性炎症反応症候群の致死性には関与していないと結論された.
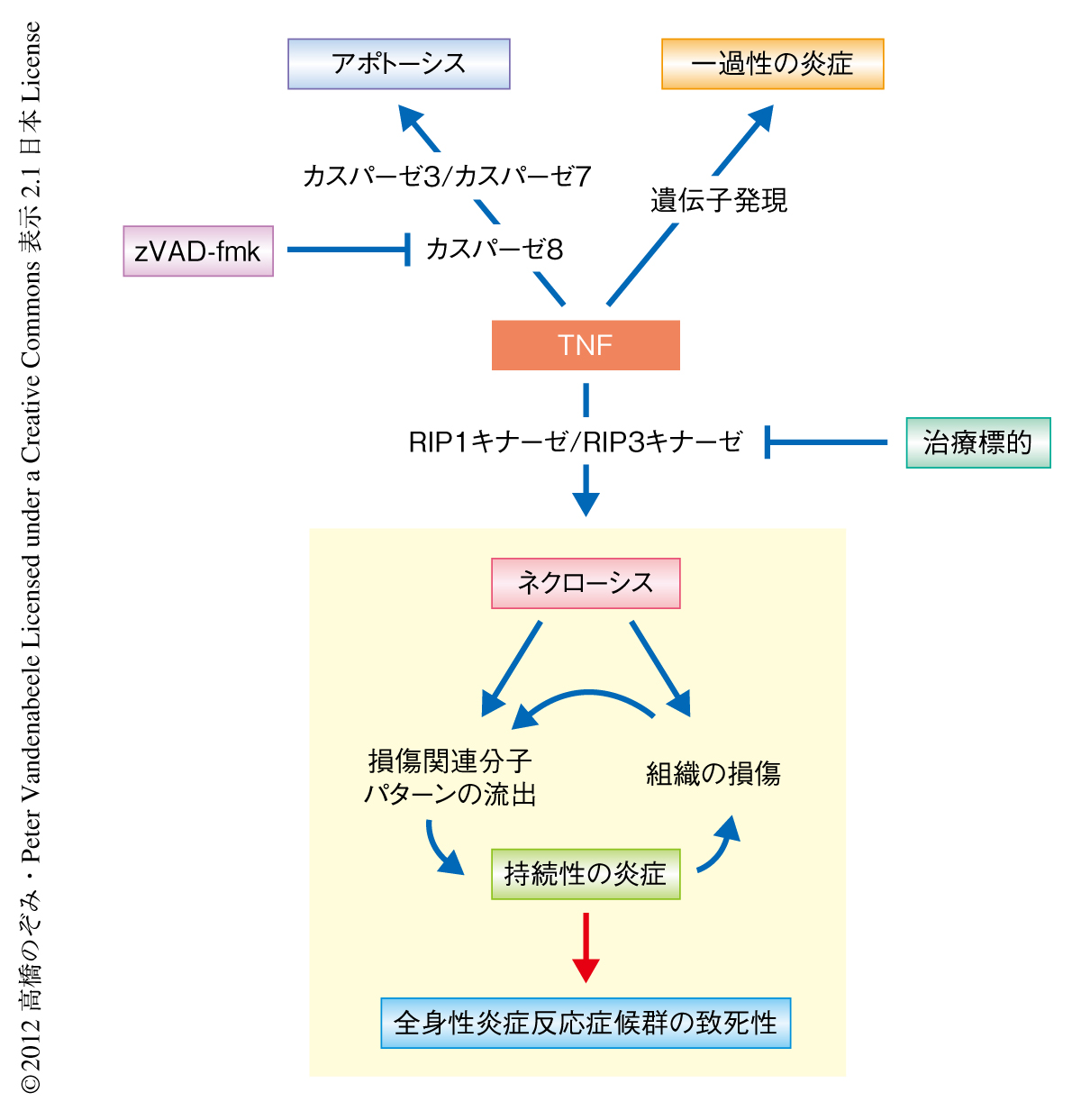
これとは対照的に,RIPキナーゼ3のノックアウトマウスではTNF投与ののちの全身性炎症反応症候群の致死性および敗血症ショックにともなう不可逆的な低体温に対し完全な保護作用がみられた.また,zVAD-fmkの前投与による感作化モデルにおいても統計的に有意な致死性の減少がみられた.この致死性に対する保護作用の効果にもかかわらず小腸炎および小腸上皮細胞のアポトーシスには変化がみられなかったが,肝臓におけるネクローシスは減少した.ネクローシスによる細胞死は細胞内物質の流出をまねき,これらの細胞内物質は内在性の損傷関連分子パターン(damage-associated molecular pattern:DAMP)として機能する可能性がある.リソソーム酵素であるヘキソサミニダーゼ,乳酸デヒドロゲナーゼ,肝臓傷害マーカーであるアスパラギン酸アミノトランスフェラーゼおよびアラニンアミノトランスフェラーゼ,心筋傷害マーカーであるクレアチンキナーゼおよびミトコンドリアDNAなどの血清における濃度は,TNFの投与ののち野生型マウスにおいては上昇したが,RIPキナーゼ3のノックアウトマウスにおいては上昇が抑制された.一方,サイトカインの血清における濃度は早期の一過性の反応(2時間後)では変化がみられなかったが,後期の持続性の反応(6時間後)ではRIPキナーゼ3のノックアウトマウスにおいて減少していた.一過性の反応により発現するサイトカインはTNFによるNF-κBを介した直接の応答により産生されるが(図1),持続性の反応により発現するサイトカインはミトコンドリアDNAなど損傷関連分子パターンの流出による二次的な応答により発現するものと考えられた(図2).また,RIPキナーゼ1の阻害剤であるネクロスタチン1の前投与によってもRIPキナーゼ3のノックアウトマウスと同様の結果が得られた.
TNFの投与による全身性炎症反応症候群が感染症を含まない敗血症のモデルであるのに対し,盲腸結紮穿刺はもっとも臨床に類似したモデルであると考えられている.このモデルでは盲腸結紮穿刺により組織の損傷および盲腸内の細菌の局所および全身的な感染を促す.盲腸結紮穿刺は臨床的な腹膜炎性敗血症と高度な類似がみられることから,盲腸結紮穿刺におけるRIPキナーゼ3に依存性のネクローシスの役割を探った.この場合においても,RIPキナーゼ3のノックアウトマウスでは致死性に対する有意な保護作用がみられた.TNFにより誘発される全身性炎症反応症候群と同様に,血清における細胞内物質,損傷関連分子パターン,サイトカインの濃度の上昇もRIPキナーゼ3のノックアウトマウスにおいては減少していた.また,盲腸結紮穿刺ののちの血中における細菌の濃度はRIPキナーゼ3のノックアウトマウスでも野生型マウスと同様であった.したがって,ネクローシスを抑制することにより盲腸結紮穿刺により誘発された敗血症ショックを減少させた場合にも,生体における先天的な免疫防御反応の低下を導くおそれはないものと考えられた.
この研究により,筆者らは,TNFにより誘発される細胞レベルでのネクローシスの制御にカスパーゼ8がかかわっていることを示し,これまでの仮説(図1)を証明するとともに,カスパーゼ8の発生における役割とネクローシスとの関連についての最近の報告6,7) を確認した.生体レベルではTNFにより誘発される全身性炎症反応症候群および盲腸結紮穿刺による腹膜炎性敗血症においてネクローシスによる細胞死が決定的に関与していることを証明した.これまで,全身性炎症反応症候群および敗血症では炎症性サイトカインによる“サイトカインストーム”がその重篤性と致死性をあおるものと考えられてきたが10),今回の発見から,ネクローシスによる細胞死が一次的な役割をはたし,それに付随する内在性の損傷関連分子パターンの流出が二次的な炎症性サイトカインの持続的な応答を誘発しているという説を提案する.これまでの全身性炎症反応症候群および敗血症におけるTNFなど炎症性サイトカインを標的とした抗炎症治療の臨床実験は,炎症性サイトカインを仲介した先天的な免疫反応の低下により感染症による敗血症の悪化をまねく危険性を含み,これがこれまでの失敗の大きな原因と考えられる.したがって,ネクローシスを選択的な標的とすることで,これまでの抗炎症治療の難点を回避することができると考える.将来,RIPキナーゼ1およびRIPキナーゼ3を標的としたネクローシスの選択的な阻害が全身性炎症反応症候群および敗血症の新しい治療法の開発につながることを期待する.
略歴:1994年 ベルギーVIB-Ghent大学にて博士号取得,現在,同 研究員.
研究テーマ:細胞死の機構とその生体における恒常性および病理機作における役割.
Peter Vandenabeele
ベルギーVIB-Ghent大学 教授.
研究室URL:http://www.dmbr.ugent.be/index.php?id=petervandenabeelehome
© 2012 高橋のぞみ・Peter Vandenabeele Licensed under CC 表示 2.1 日本
(ベルギーVIB-Ghent大学,Department of Biomedical Molecular Biology)
email:高橋のぞみ
DOI: 10.7875/first.author.2012.010
RIP kinase-dependent necrosis drives lethal systemic inflammatory response syndrome.
Linde Duprez, Nozomi Takahashi, Filip Van Hauwermeiren, Benjamin Vandendriessche, Vera Goossens, Tom Vanden Berghe, Wim Declercq, Claude Libert, Anje Cauwels, Peter Vandenabeele
Immunity, 35, 908-918 (2011)
要 約
TNF受容体の活性化は細胞死および細胞生存という相互に排他的な2つのシグナル伝達経路を誘発する.前者はさらに,カスパーゼに依存性のアポトーシスとRIPキナーゼに依存性のネクローシスという2つの形態の細胞死につながるシグナル伝達経路に分岐する.筆者らは,TNFにより誘発される全身性炎症反応症候群とこの2つの細胞死の形態とのかかわりを探った.アポトーシスを仲介する執行型カスパーゼまたは炎症性カスパーゼのノックアウトマウスにおいて全身性炎症反応症候群の致死性に影響はなかったが,ネクローシスを仲介するRIPキナーゼ3のノックアウトマウスにおいては全身性炎症反応症候群の致死性は完全に抑制されるとともに,血清における内在性の損傷関連分子パターンおよび炎症性サイトカインの濃度が減少した.また,RIPキナーゼ1の阻害剤の投与によっても同様の結果が得られた.したがって,RIPキナーゼに依存性のネクローシスが全身性炎症反応症候群の致死性を決定していると結論した.RIPキナーゼ3のノックアウトマウスにおいては腹膜炎性敗血症のモデルである盲腸結紮穿刺の致死性も抑制された.RIPキナーゼ依存性のネクローシスは全身性炎症反応症候群および敗血症の治療標的となることを提案する.
はじめに
これまで,細胞死は形態学的にアポトーシスとネクローシスに区別されてきた.そして,カスパーゼを介するアポトーシスが分子生物学的および生化学的に解明されてきたのに比べ,ネクローシスは偶発的なものと考えられてきた.筆者らのこれまでの研究は,TNF(tumor necrosis factor,腫瘍壊死因子)はアポトーシスだけでなく,細胞の環境によってはネクローシスを誘発することを明示したが,近年,その分子機作が解明されるまでには15年もの年月がかかった1).RIPキナーゼ1およびRIPキナーゼ3(RIP:receptor-interacting protein,受容体相互作用タンパク質)の発見はこれまでのネクローシスの概念をくつがえし,ネクローシスもアポトーシスと同様に高度に制御された過程であることを証明しネクロトーシス(necroptosis)という新しい用語を生むにいたった2-5).現在までのところ,TNF受容体1の活性化により誘発されるネクローシスがもっともよく研究されている.TNF受容体1の活性化は,一方で細胞膜の近傍にTNF受容体1複合体Iを形成しその複合体に含まれるRIPキナーゼ1の63番目のリジン残基のユビキチン化を促し,TAK1を介したIκBキナーゼ複合体の活性化によりIκBの分解とNF-κBの活性化を導くことで,生存因子および炎症性サイトカインの遺伝子の発現を促す.他方,CYLDなどによるRIPキナーゼ1の脱ユビキチン化は細胞質におけるTNF受容体1複合体II(DISC:death-inducing signaling complex,細胞死誘導性シグナル伝達複合体ともよばれる)の形成を促し,アポトーシスあるいはネクローシスによる細胞死にいたる.カスパーゼの活性化はアポトーシスをひき起こし,その活性が阻害された場合にはネクローシスが誘導される1)(図1).したがって,細胞生存とアポトーシスあるいはネクローシスへのシグナル伝達経路は相互に排他的であるものと考えられる.最近の研究は,アポトーシスを誘導する複合体DISCを構成するタンパク質,カスパーゼ8,FADD,cFLIP-Lによるネクローシスの制御が胚発生および生体の恒常性の維持に大きな役割をはたすことを示唆している6-8).これらのネクローシス抑制タンパク質が排除された場合,RIPキナーゼ1とRIPキナーゼ3とが近接することによりリン酸化反応を介してネクローシスが導かれるものと考えられている.RIPキナーゼ1とRIPキナーゼ3を含む複合体はネクロソーム(necrosome)ともよばれている.
全身性炎症反応症候群(systemic inflammatory response syndrome:SIRS)は感染性の疾患に由来する敗血症や重篤な熱傷や外傷によりひき起こされる,きわめて致死性の高い全身性の炎症であり,現在のところ決定的な治療法はない.これまで,TNFをはじめとするサイトカインが関係するものと考えられてきたが,それらを標的とする生物学的製剤を使った実験的な抗炎症治療はこれまでほぼすべてが失敗におわっている.全身性炎症反応症候群および敗血症が“バイオテク企業の墓場”とよばれるゆえんである.筆者らは,TNFが炎症性サイトカインの発現だけでなく細胞死にいたるシグナル伝達経路を誘導することから,全身性炎症反応症候群および敗血症における2つの細胞死の形態,カスパーゼ依存性のアポトーシスとRIPキナーゼ依存性のネクローシスの役割を遺伝学的アプローチおよび薬理学的アプローチにより探った.過去の研究において,広範なカスパーゼ阻害剤zVAD-fmkの投与がTNFによる全身性炎症反応症候群の致死性を促進したことから9),アポトーシスは全身性炎症反応症候群に対し保護的な役割をはたしていることがと示唆された.
1.カスパーゼ阻害剤zVAD-fmkによるネクローシス促進の標的はカスパーゼ8である
TNFの投与はL929線維芽細胞においてネクローシスを誘発する.このネクローシスはカスパーゼ阻害剤zVAD-fmkにより促進されることから,カスパーゼがネクローシスを制御しているものと考えられた.ネクローシスの制御にかかわるカスパーゼを同定するため,siRNAによるノックダウンを試みた.炎症型カスパーゼであるカスパーゼ1,および,執行型カスパーゼ(executioner caspase)であるカスパーゼ3あるいはカスパーゼ7のノックダウンではTNFによるネクローシスになんらの影響はなかったが,イニシエーターカスパーゼであるカスパーゼ8のノックダウンではzVAD-fmkと同様のネクローシスの促進がみられた.また,カスパーゼ8のノックダウンにおいてはzVAD-fmkによるネクローシスの促進作用が失われた.したがって,zVAD-fmkによるネクローシスの促進はカスパーゼ8を介しているものと結論された.カスパーゼ8はアポトーシスを誘導する複合体DISCの構成タンパク質のひとつであり,この複合体におけるカスパーゼ8の活性化によりRIPキナーゼ1およびRIPキナーゼ3の分解をひき起こしネクローシスを阻害するものと考えられた(図1).一方で,RIPキナーゼ3のノックダウンではTNFによるネクローシスからの保護作用がみられ,また,RIPキナーゼ1の選択的な阻害剤であるネクロスタチン1による前処置によっても同様の効果が得られた.
2.執行型カスパーゼと炎症性カスパーゼはTNFのひき起こす全身性炎症反応症候群の致死性には関与しない
このような細胞レベルでの結果にもとづき,マウス個体におけるTNFのひき起こす細胞死の役割を探った.マウスへのTNFの投与は全身性炎症反応症候群を誘発し,敗血症および敗血症ショックのモデルとして使用されてきた.執行型カスパーゼであるカスパーゼ3およびカスパーゼ7,および,炎症性カスパーゼであるカスパーゼ1の関与を調べるためこれらのノックアウトマウスを使用した.なお,カスパーゼ8のノックアウトマウスは胎生致死のため実験は不可能であった.執行型カスパーゼについてはカスパーゼ3あるいはカスパーゼ7のいずれのノックアウトマウスにおいてもTNF投与ののちの全身性炎症反応症候群の致死性および敗血症ショックにともなう不可逆的な低体温に対し大きな影響はみられなかった.しかし,カスパーゼ3のノックアウトマウスではTNF投与ののち小腸炎および小腸上皮細胞のアポトーシスが減少した.したがって,小腸上皮細胞のアポトーシスとそれに由来する小腸炎はカスパーゼ3を介してはいるが全身性炎症反応症候群の致死性には関与していないと結論された.
3.全身性炎症反応症候群の致死性はRIPキナーゼ3に依存性のネクローシスが関与する
これとは対照的に,RIPキナーゼ3のノックアウトマウスではTNF投与ののちの全身性炎症反応症候群の致死性および敗血症ショックにともなう不可逆的な低体温に対し完全な保護作用がみられた.また,zVAD-fmkの前投与による感作化モデルにおいても統計的に有意な致死性の減少がみられた.この致死性に対する保護作用の効果にもかかわらず小腸炎および小腸上皮細胞のアポトーシスには変化がみられなかったが,肝臓におけるネクローシスは減少した.ネクローシスによる細胞死は細胞内物質の流出をまねき,これらの細胞内物質は内在性の損傷関連分子パターン(damage-associated molecular pattern:DAMP)として機能する可能性がある.リソソーム酵素であるヘキソサミニダーゼ,乳酸デヒドロゲナーゼ,肝臓傷害マーカーであるアスパラギン酸アミノトランスフェラーゼおよびアラニンアミノトランスフェラーゼ,心筋傷害マーカーであるクレアチンキナーゼおよびミトコンドリアDNAなどの血清における濃度は,TNFの投与ののち野生型マウスにおいては上昇したが,RIPキナーゼ3のノックアウトマウスにおいては上昇が抑制された.一方,サイトカインの血清における濃度は早期の一過性の反応(2時間後)では変化がみられなかったが,後期の持続性の反応(6時間後)ではRIPキナーゼ3のノックアウトマウスにおいて減少していた.一過性の反応により発現するサイトカインはTNFによるNF-κBを介した直接の応答により産生されるが(図1),持続性の反応により発現するサイトカインはミトコンドリアDNAなど損傷関連分子パターンの流出による二次的な応答により発現するものと考えられた(図2).また,RIPキナーゼ1の阻害剤であるネクロスタチン1の前投与によってもRIPキナーゼ3のノックアウトマウスと同様の結果が得られた.
4.腹膜炎性敗血症モデルの致死性にもRIPキナーゼ3に依存性のネクローシスが関与する
TNFの投与による全身性炎症反応症候群が感染症を含まない敗血症のモデルであるのに対し,盲腸結紮穿刺はもっとも臨床に類似したモデルであると考えられている.このモデルでは盲腸結紮穿刺により組織の損傷および盲腸内の細菌の局所および全身的な感染を促す.盲腸結紮穿刺は臨床的な腹膜炎性敗血症と高度な類似がみられることから,盲腸結紮穿刺におけるRIPキナーゼ3に依存性のネクローシスの役割を探った.この場合においても,RIPキナーゼ3のノックアウトマウスでは致死性に対する有意な保護作用がみられた.TNFにより誘発される全身性炎症反応症候群と同様に,血清における細胞内物質,損傷関連分子パターン,サイトカインの濃度の上昇もRIPキナーゼ3のノックアウトマウスにおいては減少していた.また,盲腸結紮穿刺ののちの血中における細菌の濃度はRIPキナーゼ3のノックアウトマウスでも野生型マウスと同様であった.したがって,ネクローシスを抑制することにより盲腸結紮穿刺により誘発された敗血症ショックを減少させた場合にも,生体における先天的な免疫防御反応の低下を導くおそれはないものと考えられた.
おわりに
この研究により,筆者らは,TNFにより誘発される細胞レベルでのネクローシスの制御にカスパーゼ8がかかわっていることを示し,これまでの仮説(図1)を証明するとともに,カスパーゼ8の発生における役割とネクローシスとの関連についての最近の報告6,7) を確認した.生体レベルではTNFにより誘発される全身性炎症反応症候群および盲腸結紮穿刺による腹膜炎性敗血症においてネクローシスによる細胞死が決定的に関与していることを証明した.これまで,全身性炎症反応症候群および敗血症では炎症性サイトカインによる“サイトカインストーム”がその重篤性と致死性をあおるものと考えられてきたが10),今回の発見から,ネクローシスによる細胞死が一次的な役割をはたし,それに付随する内在性の損傷関連分子パターンの流出が二次的な炎症性サイトカインの持続的な応答を誘発しているという説を提案する.これまでの全身性炎症反応症候群および敗血症におけるTNFなど炎症性サイトカインを標的とした抗炎症治療の臨床実験は,炎症性サイトカインを仲介した先天的な免疫反応の低下により感染症による敗血症の悪化をまねく危険性を含み,これがこれまでの失敗の大きな原因と考えられる.したがって,ネクローシスを選択的な標的とすることで,これまでの抗炎症治療の難点を回避することができると考える.将来,RIPキナーゼ1およびRIPキナーゼ3を標的としたネクローシスの選択的な阻害が全身性炎症反応症候群および敗血症の新しい治療法の開発につながることを期待する.
文 献
- Vandenabeele, P., Galluzzi, L., Vanden Berghe, T. et al.: Molecular mechanisms of necroptosis: an ordered cellular explosion. Nat. Rev. Mol. Cell Biol., 11, 700-714 (2010)[PubMed]
- Degterev, A., Hitomi, J., Germscheid, M. et al.: Identification of RIP1 kinase as a specific cellular target of necrostatins. Nat. Chem. Biol., 4, 313-321 (2008)[PubMed]
- Cho, Y. S., Challa, S., Moquin, D. et al.: Phosphorylation-driven assembly of the RIP1-RIP3 complex regulates programmed necrosis and virus-induced inflammation. Cell, 137, 1112-1123 (2009)[PubMed]
- He, S., Wang, L., Miao, L. et al.: Receptor interacting protein kinase-3 determines cellular necrotic response to TNF-α. Cell, 137, 1100-1111 (2009)[PubMed]
- Zhang, D. W., Shao, J., Lin, J. et al.: RIP3, an energy metabolism regulator that switches TNF-induced cell death from apoptosis to necrosis. Science, 325, 332-336 (2009)[PubMed]
- Kaiser, W. J., Upton, J. W., Long, A. B. et al.: RIP3 mediates the embryonic lethality of caspase-8-deficient mice. Nature, 471, 368-372 (2011)[PubMed]
- Oberst, A., Dillon, C. P., Weinlich, R. et al.: Catalytic activity of the caspase-8-FLIPL complex inhibits RIPK3-dependent necrosis. Nature, 471, 363-367 (2011)[PubMed]
- Zhang, H., Zhou, X., McQuade, T. et al.: Functional complementation between FADD and RIP1 in embryos and lymphocytes. Nature, 471, 373-376 (2011)[PubMed]
- Cauwels, A., Janssen, B., Waeytens, A. et al.: Caspase inhibition causes hyperacute tumor necrosis factor-induced shock via oxidative stress and phospholipase A2. Nat. Immunol., 4, 387-393 (2003)[PubMed]
- Hotchkiss, R. S. & Nicholson, D. W.: Apoptosis and caspases regulate death and inflammation in sepsis. Nat. Rev. Immunol., 6, 813-822 (2006)[PubMed]
著者プロフィール
略歴:1994年 ベルギーVIB-Ghent大学にて博士号取得,現在,同 研究員.
研究テーマ:細胞死の機構とその生体における恒常性および病理機作における役割.
Peter Vandenabeele
ベルギーVIB-Ghent大学 教授.
研究室URL:http://www.dmbr.ugent.be/index.php?id=petervandenabeelehome
© 2012 高橋のぞみ・Peter Vandenabeele Licensed under CC 表示 2.1 日本