Th1細胞の分化の過程における濾胞性ヘルパーT細胞様の表現型への移行とその分子制御機構
中山田 真吾
(米国NIH National Institute of Arthritis and Musculoskeletal and Skin Diseases,Molecular Immunology and Inflammation Branch)
email:中山田真吾
DOI: 10.7875/first.author.2012.007
Early Th1 cell differentiation is marked by a Tfh cell-like transition.
Shingo Nakayamada, Yuka Kanno, Hayato Takahashi, Dragana Jankovic, Kristina T. Lu, Thomas A. Johnson, Hong-wei Sun, Golnaz Vahedi, Ofir Hakim, Robin Handon, Pamela L. Schwartzberg, Gordon L. Hager, John J. O'Shea
Immunity, 35, 919-931 (2011)
濾胞性ヘルパーT細胞は胚中心におけるB細胞の機能と抗体反応を制御する新規のヘルパーT細胞だが,その分化やほかのヘルパーT細胞との関連性は不詳である.今回,筆者らは,古典的なヘルパーT細胞のサブセットであるTh1細胞が分化の過程で濾胞性ヘルパーT細胞とその表現型を共有すること,最終分化が細胞内でのマスター転写因子のバランスにより規定されていることを報告した.すなわち,インターロイキン12を介した転写因子STAT4の活性化はナイーブT細胞に対し,Th1細胞の表現型にくわえインターロイキン21の産生やBcl6の発現など濾胞性ヘルパーT細胞様の表現型を誘導した.しかし,STAT4はさらに別の転写因子T-betを誘導し,T-betの定常的な発現は分化の後期でのTh1細胞への偏向をもたらした.その機序として,クロマチン免疫沈降-シークエンス法を用いたゲノムワイド解析により,T-betがBcl6遺伝子座をはじめとする濾胞性ヘルパーT細胞の関連遺伝子座に直接に結合してその転写を阻害することを見い出した.さらに,トキソプラズマを用いたin vivoでのTh1細胞の誘導系において,T-betが感染の初期に認められる濾胞性ヘルパーT細胞様の細胞の分化とB細胞の機能を抑制してTh1細胞への分化を促進することを示した.以上の結果は,Th1細胞の分化におけるSTAT4とT-betの相違的な役割による多段階の分化プロセスを提唱すると同時に,異なったヘルパー機能をもつTh1細胞と濾胞性ヘルパーT細胞とのあいだの柔軟かつダイナミックな運命決定機構の存在を示唆しており,ヘルパーT細胞を中心とする免疫応答の基礎的な理解を助けるものである.
免疫系はさまざまな病原体を効率的に排除するため備わった生体防御反応である.T細胞は免疫応答の根幹であり,そのなかでもヘルパーT細胞は各種のサイトカインを産生し周囲の免疫反応を調整する司令塔的な役割を担う.ヘルパーT細胞は外来抗原と出会ったことのないナイーブT細胞が抗原による刺激と特定のサイトカイン環境にさらされることで分化成熟し,特異的なサイトカインの分泌と転写因子の発現パターンにより,Th1細胞,Th2細胞,Th17細胞などのさらなるサブセットに分類される.たとえば,Th1細胞はインターロイキン12による転写因子STAT4の活性化により誘導され,インターフェロンγを特異的に産生しマスター転写因子T-betを発現することで最終分化をとげる.Th1細胞は主として細胞内の寄生体の排除など細胞性免疫を担当するが,ほかのサブセットとのバランスの破綻は自己免疫疾患を誘発する.
一方,濾胞性ヘルパーT細胞はリンパ濾胞における胚中心の形成,B細胞の親和性成熟など液性免疫に特化した機能をもつ新規のヘルパーT細胞であり,ケモカイン受容体CXCR5,共刺激タンパク質ICOS,PD-1などの発現とインターロイキン21の産生を特徴とする1).濾胞性ヘルパーT細胞は生体における適切な抗体反応の維持に重要であるが,実際に,その活性の低下は免疫不全症をひき起こし,逆に,その過剰は自己抗体の産生を介した自己免疫疾患を誘発する2,3).したがって,濾胞性ヘルパーT細胞の分化および機能の制御機構を明らかにすることは基礎的な免疫系の理解のみならず免疫病態の解明につながるはずである.これまで,濾胞性ヘルパーT細胞の分化はインターロイキン6およびインターロイキン21を介した転写因子STAT3の活性化により誘導されるとされ,転写因子Bcl6がマスター転写因子として同定された.Bcl6は濾胞性ヘルパーT細胞の分化と胚中心の形成に必要十分であるとともに,ほかのヘルパーT細胞サブセットに関連するサイトカインや転写因子の発現に対し抑制的に作用することから,濾胞性ヘルパーT細胞はほかとは独立したサブセットとして提唱された4-6).
しかしその反面,1)インターロイキン6,インターロイキン21あるいはSTAT3に非依存的に分化する濾胞性ヘルパーT細胞の存在7,8),2)Bcl6やインターロイキン21が濾胞性ヘルパーT細胞のみならずTh2細胞やTh17細胞などほかの活性化ヘルパーT細胞サブセットにも発現すること9,10),3)パイエル板における制御性T細胞から濾胞性ヘルパーT細胞への移行11),などの例が報告されており,濾胞性ヘルパーT細胞の分化における起源,とくに,ほかのヘルパーT細胞サブセットとの関連性に関してはいまなお未解決のままである.今回,筆者らは,濾胞性ヘルパーT細胞とほかのヘルパーT細胞サブセットの分化の過程の関連性,とくに,Th1細胞との相同性に着目し,さらに,その分子制御機構の解明を試みた.
以前に筆者らは,抗STAT4抗体を使ったクロマチン免疫沈降-シークエンス(chromatin immunoprecipitation sequence:ChIP-seq)法によりインターロイキン21遺伝子がSTAT4の標的遺伝子であることを見い出しており,さらに,ヒトT細胞ではインターロイキン12がインターロイキン21を誘導することが報告されている12,13).まず,インターロイキン12を介したSTAT4の活性化がインターロイキン21およびほかの濾胞性ヘルパーT細胞の特異タンパク質を誘導するのかどうか検討した.試験管内での標準的なTh1細胞の分化培養条件である抗CD3+CD28抗体によるT細胞受容体とインターロイキン12による刺激をナイーブT細胞にくわえたところ,インターフェロンγ,T-betなどのTh1細胞のマーカーのみならず,インターロイキン21,CXCR5,PD-1,ICOS,さらに,Bcl6といった濾胞性ヘルパーT細胞のマーカーの発現が誘導された.興味深いことに,インターロイキン6による刺激はインターロイキン21およびBcl6を誘導したものの,CXCR5やICOSは誘導しなかった.また,各種のSTATのノックアウトマウスを用いた実験においてインターロイキン6によるインターロイキン21およびBcl6の誘導はSTAT3に依存的であったのに対し,インターロイキン12により誘導されるTh1細胞および濾胞性ヘルパーT細胞の表現型はいずれもSTAT4に依存的であった.したがって,従来はTh1細胞を誘導すると考えられていたインターロイキン12の刺激は,STAT4を介してTh1細胞と濾胞性ヘルパーT細胞の両者の表現型を同時に誘導していることがわかった.また,このSTAT4に依存性の濾胞性ヘルパーT細胞の存在は,これまで指摘されていたSTAT3に非依存性の濾胞性ヘルパーT細胞の分化の一因と考えられた.
つぎに,Th1細胞の分化する条件で細胞培養を継続してTh1細胞と濾胞性ヘルパーT細胞の表現型の経時的な変化を観察した.分化の開始ののち,インターロイキン21およびBcl6はインターフェロンγおよびT-betと酷似した発現の増加を示したが,培養5日目以降はインターフェロンγおよびT-betが維持されたのに対し,インターロイキン21およびBcl6はしだいに減弱し,培養8日目にはTh1細胞への分化が完遂された.さらに,T-betおよびBcl6の相対的な発現量と表現型との関連性を解析した結果,T-betの発現量はインターフェロンγと正の相関,CXCR5と負の相関を示し,逆に,Bcl6の発現量はインターフェロンγと負の相関,CXCR5と正の相関を示した.すなわち,Th1細胞への最終分化はT-betの発現上昇とBcl6の発現減弱に相関していることが示唆された.
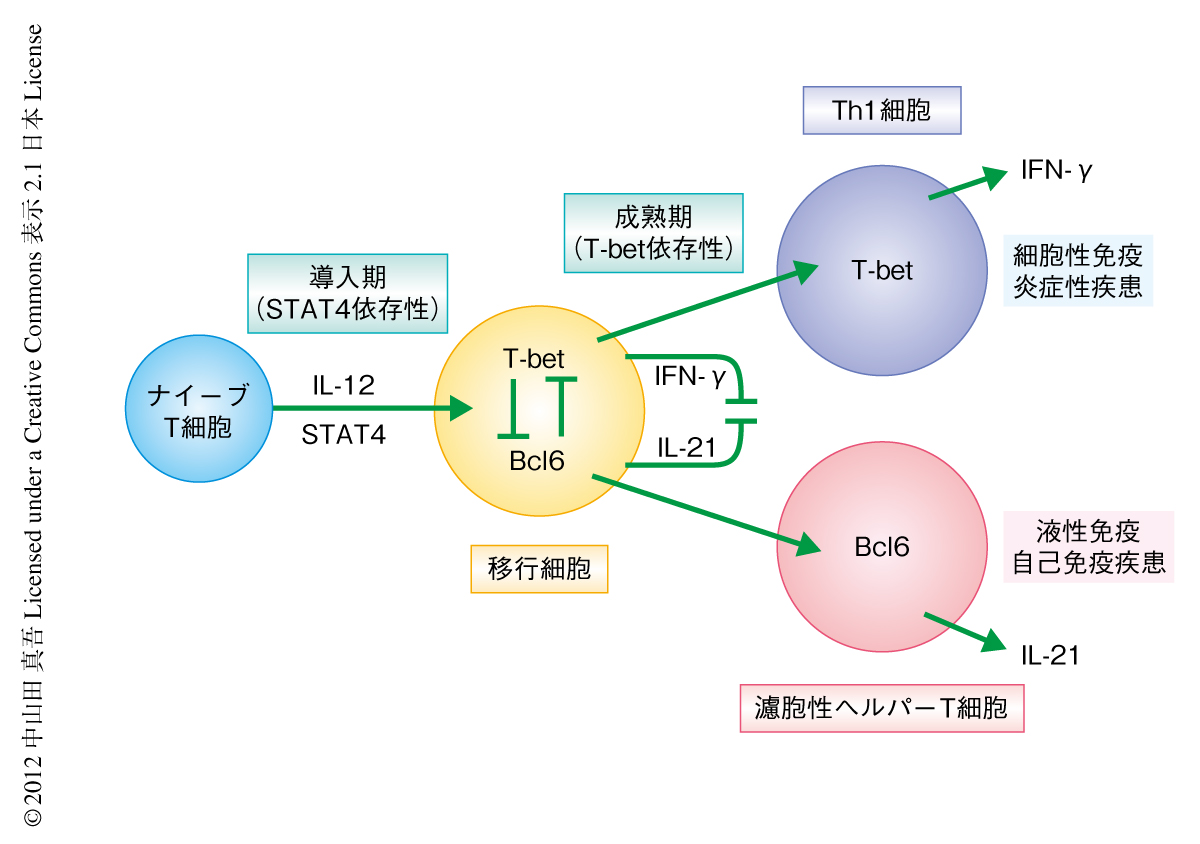
これらの結果は,Th1細胞における濾胞性ヘルパーT細胞様の表現型の出現が一過性であり,その分化の過程で濾胞性ヘルパーT細胞様の表現型を抑制する因子が出現することを示唆していた.T-bet自体がその抑制因子であると想定し,T-betノックアウトマウスに由来するナイーブT細胞を使い同様の実験を行った.その結果,T-betを欠損した細胞ではインターロイキン12の刺激によるインターフェロンγの産生は低下したが,インターロイキン21の産生とBcl6の発現は顕著に増加し,濾胞性ヘルパーT細胞様の細胞への分化が促進された.逆に,レトロウイルスを用いてT細胞にT-betを過剰発現させるとインターロイキン21とBcl6の発現は著明に抑制された.さらに,培養液にインターフェロンγを過剰にくわえT-betの発現を増強させると濾胞性ヘルパーT細胞様の細胞への分化は抑制され,逆に,インターフェロンγの中和抗体の投与により濾胞性ヘルパーT細胞様の細胞への分化は促進された.すなわち,T-betの発現は濾胞性ヘルパーT細胞の分化の抑制に必要かつ十分であると考えられた.さらに,T細胞へのBcl6の過剰発現またはインターロイキン21の過剰投与がインターロイキン12により誘導されるインターフェロンγおよびT-betの発現を抑制してTh1細胞の分化阻害と濾胞性ヘルパーT細胞への分化の偏向をもたらすことを確認した.以上より,インターロイキン12によるプライミングはナイーブT細胞に対しSTAT4に依存性にT-betおよびBcl6,インターフェロンγおよびインターロイキン21を共発現するTh1細胞と濾胞性ヘルパーT細胞の移行細胞様の細胞を導入するが,T-betとBcl6およびインターフェロンγとインターロイキン21とのあいだに拮抗作用が存在しており,細胞内外のシグナルによる両者の優劣関係が細胞の運命決定に重要である可能性が示唆された(図1).また,とりわけin vitroの培養系ではインターフェロンγとT-betの優位性がTh1細胞への分化の偏向をもたらすものと思われた.
これまでの結果は,Th1細胞の分化の過程においてSTAT4とT-betが濾胞性ヘルパーT細胞に関連する遺伝子座を相反的に制御することを示唆していた.その詳細な分子機構を明らかにするため,DNase高感受性部位のシークエンスによるゲノムワイド解析,および,ChIP-seq法による転写因子の結合部位およびヒストンのメチル化修飾の解析により,Th1細胞におけるクロマチン制御機構を検討した.その結果,Th1細胞ではインターフェロンγ遺伝子座にくわえインターロイキン21遺伝子座やBcl6遺伝子座など濾胞性ヘルパーT細胞の関連遺伝子座において,多くのDNase高感受性部位により標識される遺伝子制御領域と発現活性型のヒストンメチル化修飾が認められ,この遺伝子座での転写の活性化がうかがえた.さらに,濾胞性ヘルパーT細胞の関連遺伝子座およびその近傍にはSTAT4およびT-betの直接的な結合が確認され,STAT4欠損細胞ではこの領域での発現活性型のヒストンメチル化修飾が消失しT-bet欠損細胞では逆に増加した.すなわち,STAT4およびT-betは濾胞性ヘルパーT細胞の関連遺伝子座に直接に結合し,かつ,対立的に遺伝子発現を制御している可能性が示唆された.興味深いことに,Bcl6遺伝子座におけるDNase高感受性部位や発現活性型のヒストンメチル化修飾はTh1細胞のみならずBcl6を発現しないナイーブT細胞にも普遍的に認められ,このことは発現の有無にかかわらずBcl6の転写が潜在的に準備状態にあることを示唆しており,最近,報告された濾胞性ヘルパーT細胞の可塑性を支持していた14).
最後に,これらの制御機構の生体内での意義を明らかにするため,Th1細胞の免疫反応を強力に誘導することで知られるトキソプラズマ感染モデルを用いて検証を行った.その結果,野生型の感染マウスから採取したヘルパーT細胞はTh1細胞の表現型と濾胞性ヘルパーT細胞様の表現型の両方を示したのに対し,T-betノックアウトマウスの感染マウスでの表現型は濾胞性ヘルパーT細胞様の表現型が優位であった.胚中心B細胞の形成やトキソプラズマ抗体の産生などの液性免疫反応は野生型マウスに比べT-betノックアウトマウスにおいて顕著であった.さらに,ヘルパーT細胞における内因性のT-betの役割を明らかにするため,野生型マウスに由来するナイーブT細胞とT-betノックアウトマウスに由来するナイーブT細胞の両方を,T細胞を欠くRag2ノックアウトマウスヘ移入したのちトキソプラズマを感染させた混合キメラマウスを作製し解析を行った.すなわち,T-betをもつ,あるいは,もたないナイーブT細胞においてTh1細胞への分化ののちの表現型の変化を同一の生体内で評価した.in vitroの結果と同様に,感染の初期である感染7日目ではTh1細胞と濾胞性ヘルパーT細胞の両方の表現型をもつ移行細胞が認められたが,感染15日目にはT-betをもつ野生型の細胞ではそれらの移行細胞は減少しTh1細胞様の細胞の割合が増加した.一方,T-bet欠損細胞は野生型の細胞に比べ濾胞性ヘルパーT細胞様の細胞の割合が有意に多く,感染15日目まで濾胞性ヘルパーT細胞様の細胞の増加が維持された.以上より,T-betは生体内でT細胞について内因性に濾胞性ヘルパーT細胞の分化と液性免疫反応を抑制することがわかった.
最近,これらの結果に関連する興味深い結果が報告された.以前より,リンパ球性脈絡髄膜炎ウイルスの感染によるTh1細胞への分化誘導系においてT-betおよびBcl6を共発現する濾胞性ヘルパーT細胞の存在が知られていたが4),リンパ球性脈絡髄膜炎ウイルスへの急性感染時に出現するTh1細胞様の細胞が慢性感染時に濾胞性ヘルパーT細胞様の細胞へと形質転換することが明らかになった15).すなわち,Th1細胞主体の急性炎症反応と濾胞性ヘルパーT細胞主体の慢性抗体反応においてT-betとBcl6のダイナミックな制御機能が存在していると予想され,筆者らの結果とあわせると,抗原刺激の反復によるBcl6の発現の維持がT-betを抑制することでTh1細胞から濾胞性ヘルパーT細胞への形質転換をもたらし,逆に,T-betを維持する環境ではBcl6の抑制にともなうTh1細胞への分化をもたらす可能性が推察された.
この研究から,ヘルパーT細胞の分化の過程でTh1細胞と濾胞性ヘルパーT細胞に表現型の多様性が存在すること,また,STAT4に依存性に誘導されるTh1細胞と濾胞性ヘルパーT細胞の両方の表現型をもつ移行細胞と,T-betに依存性に誘導される終末Th1細胞からなるTh1細胞の分化における多段階のプロセスが明らかになった.さらに,Th1細胞と濾胞性ヘルパーT細胞の移行細胞に認められる可塑性はT-betとBcl6のダイナミックなバランスにより制御されることが示唆された.
従来,ヘルパーT細胞は限定的なサイトカインの産生とマスター転写因子の発現により独立した機能をもつ安定的なサブセットで構成されると考えられており,このようなシンプルなモデルはわれわれの免疫系への理解を容易にした.しかし,最近の報告は,すべてのCD4陽性T細胞サブセットにおいて複数のマスター転写因子を同時に発現する細胞の存在することが明らかになっており,そのような可塑性をもつ細胞が機能的に重要であると考えられつつある16).今回,筆者らが示したTh1細胞と濾胞性ヘルパーT細胞の移行細胞を含め,このような分化転換の容易な“柔軟”な細胞が存在することは,実際に,さまざまな病原体に対抗するため生体にとり理にかなったしくみのように思われる.今後,濾胞性ヘルパーT細胞の分化機構のさらなる解明が効果的なワクチン開発,自己免疫疾患の治療に貢献するものと期待される.
略歴:2004年 産業医科大学大学院医学研究科 修了,同年 産業医科大学医学部 助手,2007年 神戸大学大学院医学系研究科 医学研究員を経て,2009年より米国NIH National institute of Arthritis and Musculoskeletal and Skin Diseases訪問研究員.
研究テーマ:濾胞性ヘルパーT細胞の分化制御機構と自己免疫病態への関与.
© 2012 中山田 真吾 Licensed under CC 表示 2.1 日本
(米国NIH National Institute of Arthritis and Musculoskeletal and Skin Diseases,Molecular Immunology and Inflammation Branch)
email:中山田真吾
DOI: 10.7875/first.author.2012.007
Early Th1 cell differentiation is marked by a Tfh cell-like transition.
Shingo Nakayamada, Yuka Kanno, Hayato Takahashi, Dragana Jankovic, Kristina T. Lu, Thomas A. Johnson, Hong-wei Sun, Golnaz Vahedi, Ofir Hakim, Robin Handon, Pamela L. Schwartzberg, Gordon L. Hager, John J. O'Shea
Immunity, 35, 919-931 (2011)
この論文に出現する遺伝子・タンパク質のUniprot ID
インターロイキン12, STAT4(P42228), インターロイキン21(Q9ES17), Bcl6(P41183), T-bet(Q9JKD8), サイトカイン, インターフェロンγ(P01580), ケモカイン受容体CXCR5(Q04683), ICOS(Q9WVS0), PD-1(Q02242), インターロイキン6(P08505), STAT3(P42227), CD3, CD28(P31041), CXCR5(Q04683), STAT, ヒストン, Rag2(P21784), CD4(P06332), IL-12, IFN-γ(P01580), IL-21(Q9ES17)
要 約
濾胞性ヘルパーT細胞は胚中心におけるB細胞の機能と抗体反応を制御する新規のヘルパーT細胞だが,その分化やほかのヘルパーT細胞との関連性は不詳である.今回,筆者らは,古典的なヘルパーT細胞のサブセットであるTh1細胞が分化の過程で濾胞性ヘルパーT細胞とその表現型を共有すること,最終分化が細胞内でのマスター転写因子のバランスにより規定されていることを報告した.すなわち,インターロイキン12を介した転写因子STAT4の活性化はナイーブT細胞に対し,Th1細胞の表現型にくわえインターロイキン21の産生やBcl6の発現など濾胞性ヘルパーT細胞様の表現型を誘導した.しかし,STAT4はさらに別の転写因子T-betを誘導し,T-betの定常的な発現は分化の後期でのTh1細胞への偏向をもたらした.その機序として,クロマチン免疫沈降-シークエンス法を用いたゲノムワイド解析により,T-betがBcl6遺伝子座をはじめとする濾胞性ヘルパーT細胞の関連遺伝子座に直接に結合してその転写を阻害することを見い出した.さらに,トキソプラズマを用いたin vivoでのTh1細胞の誘導系において,T-betが感染の初期に認められる濾胞性ヘルパーT細胞様の細胞の分化とB細胞の機能を抑制してTh1細胞への分化を促進することを示した.以上の結果は,Th1細胞の分化におけるSTAT4とT-betの相違的な役割による多段階の分化プロセスを提唱すると同時に,異なったヘルパー機能をもつTh1細胞と濾胞性ヘルパーT細胞とのあいだの柔軟かつダイナミックな運命決定機構の存在を示唆しており,ヘルパーT細胞を中心とする免疫応答の基礎的な理解を助けるものである.
はじめに
免疫系はさまざまな病原体を効率的に排除するため備わった生体防御反応である.T細胞は免疫応答の根幹であり,そのなかでもヘルパーT細胞は各種のサイトカインを産生し周囲の免疫反応を調整する司令塔的な役割を担う.ヘルパーT細胞は外来抗原と出会ったことのないナイーブT細胞が抗原による刺激と特定のサイトカイン環境にさらされることで分化成熟し,特異的なサイトカインの分泌と転写因子の発現パターンにより,Th1細胞,Th2細胞,Th17細胞などのさらなるサブセットに分類される.たとえば,Th1細胞はインターロイキン12による転写因子STAT4の活性化により誘導され,インターフェロンγを特異的に産生しマスター転写因子T-betを発現することで最終分化をとげる.Th1細胞は主として細胞内の寄生体の排除など細胞性免疫を担当するが,ほかのサブセットとのバランスの破綻は自己免疫疾患を誘発する.
一方,濾胞性ヘルパーT細胞はリンパ濾胞における胚中心の形成,B細胞の親和性成熟など液性免疫に特化した機能をもつ新規のヘルパーT細胞であり,ケモカイン受容体CXCR5,共刺激タンパク質ICOS,PD-1などの発現とインターロイキン21の産生を特徴とする1).濾胞性ヘルパーT細胞は生体における適切な抗体反応の維持に重要であるが,実際に,その活性の低下は免疫不全症をひき起こし,逆に,その過剰は自己抗体の産生を介した自己免疫疾患を誘発する2,3).したがって,濾胞性ヘルパーT細胞の分化および機能の制御機構を明らかにすることは基礎的な免疫系の理解のみならず免疫病態の解明につながるはずである.これまで,濾胞性ヘルパーT細胞の分化はインターロイキン6およびインターロイキン21を介した転写因子STAT3の活性化により誘導されるとされ,転写因子Bcl6がマスター転写因子として同定された.Bcl6は濾胞性ヘルパーT細胞の分化と胚中心の形成に必要十分であるとともに,ほかのヘルパーT細胞サブセットに関連するサイトカインや転写因子の発現に対し抑制的に作用することから,濾胞性ヘルパーT細胞はほかとは独立したサブセットとして提唱された4-6).
しかしその反面,1)インターロイキン6,インターロイキン21あるいはSTAT3に非依存的に分化する濾胞性ヘルパーT細胞の存在7,8),2)Bcl6やインターロイキン21が濾胞性ヘルパーT細胞のみならずTh2細胞やTh17細胞などほかの活性化ヘルパーT細胞サブセットにも発現すること9,10),3)パイエル板における制御性T細胞から濾胞性ヘルパーT細胞への移行11),などの例が報告されており,濾胞性ヘルパーT細胞の分化における起源,とくに,ほかのヘルパーT細胞サブセットとの関連性に関してはいまなお未解決のままである.今回,筆者らは,濾胞性ヘルパーT細胞とほかのヘルパーT細胞サブセットの分化の過程の関連性,とくに,Th1細胞との相同性に着目し,さらに,その分子制御機構の解明を試みた.
1.インターロイキン12はSTAT4を介しTh1細胞と濾胞性ヘルパーT細胞の2つの表現型を同時に誘導する
以前に筆者らは,抗STAT4抗体を使ったクロマチン免疫沈降-シークエンス(chromatin immunoprecipitation sequence:ChIP-seq)法によりインターロイキン21遺伝子がSTAT4の標的遺伝子であることを見い出しており,さらに,ヒトT細胞ではインターロイキン12がインターロイキン21を誘導することが報告されている12,13).まず,インターロイキン12を介したSTAT4の活性化がインターロイキン21およびほかの濾胞性ヘルパーT細胞の特異タンパク質を誘導するのかどうか検討した.試験管内での標準的なTh1細胞の分化培養条件である抗CD3+CD28抗体によるT細胞受容体とインターロイキン12による刺激をナイーブT細胞にくわえたところ,インターフェロンγ,T-betなどのTh1細胞のマーカーのみならず,インターロイキン21,CXCR5,PD-1,ICOS,さらに,Bcl6といった濾胞性ヘルパーT細胞のマーカーの発現が誘導された.興味深いことに,インターロイキン6による刺激はインターロイキン21およびBcl6を誘導したものの,CXCR5やICOSは誘導しなかった.また,各種のSTATのノックアウトマウスを用いた実験においてインターロイキン6によるインターロイキン21およびBcl6の誘導はSTAT3に依存的であったのに対し,インターロイキン12により誘導されるTh1細胞および濾胞性ヘルパーT細胞の表現型はいずれもSTAT4に依存的であった.したがって,従来はTh1細胞を誘導すると考えられていたインターロイキン12の刺激は,STAT4を介してTh1細胞と濾胞性ヘルパーT細胞の両者の表現型を同時に誘導していることがわかった.また,このSTAT4に依存性の濾胞性ヘルパーT細胞の存在は,これまで指摘されていたSTAT3に非依存性の濾胞性ヘルパーT細胞の分化の一因と考えられた.
2.T-betは濾胞性ヘルパーT細胞様の表現型を抑制しTh1細胞の最終分化に寄与する
つぎに,Th1細胞の分化する条件で細胞培養を継続してTh1細胞と濾胞性ヘルパーT細胞の表現型の経時的な変化を観察した.分化の開始ののち,インターロイキン21およびBcl6はインターフェロンγおよびT-betと酷似した発現の増加を示したが,培養5日目以降はインターフェロンγおよびT-betが維持されたのに対し,インターロイキン21およびBcl6はしだいに減弱し,培養8日目にはTh1細胞への分化が完遂された.さらに,T-betおよびBcl6の相対的な発現量と表現型との関連性を解析した結果,T-betの発現量はインターフェロンγと正の相関,CXCR5と負の相関を示し,逆に,Bcl6の発現量はインターフェロンγと負の相関,CXCR5と正の相関を示した.すなわち,Th1細胞への最終分化はT-betの発現上昇とBcl6の発現減弱に相関していることが示唆された.
これらの結果は,Th1細胞における濾胞性ヘルパーT細胞様の表現型の出現が一過性であり,その分化の過程で濾胞性ヘルパーT細胞様の表現型を抑制する因子が出現することを示唆していた.T-bet自体がその抑制因子であると想定し,T-betノックアウトマウスに由来するナイーブT細胞を使い同様の実験を行った.その結果,T-betを欠損した細胞ではインターロイキン12の刺激によるインターフェロンγの産生は低下したが,インターロイキン21の産生とBcl6の発現は顕著に増加し,濾胞性ヘルパーT細胞様の細胞への分化が促進された.逆に,レトロウイルスを用いてT細胞にT-betを過剰発現させるとインターロイキン21とBcl6の発現は著明に抑制された.さらに,培養液にインターフェロンγを過剰にくわえT-betの発現を増強させると濾胞性ヘルパーT細胞様の細胞への分化は抑制され,逆に,インターフェロンγの中和抗体の投与により濾胞性ヘルパーT細胞様の細胞への分化は促進された.すなわち,T-betの発現は濾胞性ヘルパーT細胞の分化の抑制に必要かつ十分であると考えられた.さらに,T細胞へのBcl6の過剰発現またはインターロイキン21の過剰投与がインターロイキン12により誘導されるインターフェロンγおよびT-betの発現を抑制してTh1細胞の分化阻害と濾胞性ヘルパーT細胞への分化の偏向をもたらすことを確認した.以上より,インターロイキン12によるプライミングはナイーブT細胞に対しSTAT4に依存性にT-betおよびBcl6,インターフェロンγおよびインターロイキン21を共発現するTh1細胞と濾胞性ヘルパーT細胞の移行細胞様の細胞を導入するが,T-betとBcl6およびインターフェロンγとインターロイキン21とのあいだに拮抗作用が存在しており,細胞内外のシグナルによる両者の優劣関係が細胞の運命決定に重要である可能性が示唆された(図1).また,とりわけin vitroの培養系ではインターフェロンγとT-betの優位性がTh1細胞への分化の偏向をもたらすものと思われた.
3.濾胞性ヘルパーT細胞の関連遺伝子座はSTAT4とT-betによる対立的な直接作用で制御される
これまでの結果は,Th1細胞の分化の過程においてSTAT4とT-betが濾胞性ヘルパーT細胞に関連する遺伝子座を相反的に制御することを示唆していた.その詳細な分子機構を明らかにするため,DNase高感受性部位のシークエンスによるゲノムワイド解析,および,ChIP-seq法による転写因子の結合部位およびヒストンのメチル化修飾の解析により,Th1細胞におけるクロマチン制御機構を検討した.その結果,Th1細胞ではインターフェロンγ遺伝子座にくわえインターロイキン21遺伝子座やBcl6遺伝子座など濾胞性ヘルパーT細胞の関連遺伝子座において,多くのDNase高感受性部位により標識される遺伝子制御領域と発現活性型のヒストンメチル化修飾が認められ,この遺伝子座での転写の活性化がうかがえた.さらに,濾胞性ヘルパーT細胞の関連遺伝子座およびその近傍にはSTAT4およびT-betの直接的な結合が確認され,STAT4欠損細胞ではこの領域での発現活性型のヒストンメチル化修飾が消失しT-bet欠損細胞では逆に増加した.すなわち,STAT4およびT-betは濾胞性ヘルパーT細胞の関連遺伝子座に直接に結合し,かつ,対立的に遺伝子発現を制御している可能性が示唆された.興味深いことに,Bcl6遺伝子座におけるDNase高感受性部位や発現活性型のヒストンメチル化修飾はTh1細胞のみならずBcl6を発現しないナイーブT細胞にも普遍的に認められ,このことは発現の有無にかかわらずBcl6の転写が潜在的に準備状態にあることを示唆しており,最近,報告された濾胞性ヘルパーT細胞の可塑性を支持していた14).
4.T-betはin vivoにおける濾胞性ヘルパーT細胞の分化と液性免疫反応を抑制する
最後に,これらの制御機構の生体内での意義を明らかにするため,Th1細胞の免疫反応を強力に誘導することで知られるトキソプラズマ感染モデルを用いて検証を行った.その結果,野生型の感染マウスから採取したヘルパーT細胞はTh1細胞の表現型と濾胞性ヘルパーT細胞様の表現型の両方を示したのに対し,T-betノックアウトマウスの感染マウスでの表現型は濾胞性ヘルパーT細胞様の表現型が優位であった.胚中心B細胞の形成やトキソプラズマ抗体の産生などの液性免疫反応は野生型マウスに比べT-betノックアウトマウスにおいて顕著であった.さらに,ヘルパーT細胞における内因性のT-betの役割を明らかにするため,野生型マウスに由来するナイーブT細胞とT-betノックアウトマウスに由来するナイーブT細胞の両方を,T細胞を欠くRag2ノックアウトマウスヘ移入したのちトキソプラズマを感染させた混合キメラマウスを作製し解析を行った.すなわち,T-betをもつ,あるいは,もたないナイーブT細胞においてTh1細胞への分化ののちの表現型の変化を同一の生体内で評価した.in vitroの結果と同様に,感染の初期である感染7日目ではTh1細胞と濾胞性ヘルパーT細胞の両方の表現型をもつ移行細胞が認められたが,感染15日目にはT-betをもつ野生型の細胞ではそれらの移行細胞は減少しTh1細胞様の細胞の割合が増加した.一方,T-bet欠損細胞は野生型の細胞に比べ濾胞性ヘルパーT細胞様の細胞の割合が有意に多く,感染15日目まで濾胞性ヘルパーT細胞様の細胞の増加が維持された.以上より,T-betは生体内でT細胞について内因性に濾胞性ヘルパーT細胞の分化と液性免疫反応を抑制することがわかった.
最近,これらの結果に関連する興味深い結果が報告された.以前より,リンパ球性脈絡髄膜炎ウイルスの感染によるTh1細胞への分化誘導系においてT-betおよびBcl6を共発現する濾胞性ヘルパーT細胞の存在が知られていたが4),リンパ球性脈絡髄膜炎ウイルスへの急性感染時に出現するTh1細胞様の細胞が慢性感染時に濾胞性ヘルパーT細胞様の細胞へと形質転換することが明らかになった15).すなわち,Th1細胞主体の急性炎症反応と濾胞性ヘルパーT細胞主体の慢性抗体反応においてT-betとBcl6のダイナミックな制御機能が存在していると予想され,筆者らの結果とあわせると,抗原刺激の反復によるBcl6の発現の維持がT-betを抑制することでTh1細胞から濾胞性ヘルパーT細胞への形質転換をもたらし,逆に,T-betを維持する環境ではBcl6の抑制にともなうTh1細胞への分化をもたらす可能性が推察された.
おわりに
この研究から,ヘルパーT細胞の分化の過程でTh1細胞と濾胞性ヘルパーT細胞に表現型の多様性が存在すること,また,STAT4に依存性に誘導されるTh1細胞と濾胞性ヘルパーT細胞の両方の表現型をもつ移行細胞と,T-betに依存性に誘導される終末Th1細胞からなるTh1細胞の分化における多段階のプロセスが明らかになった.さらに,Th1細胞と濾胞性ヘルパーT細胞の移行細胞に認められる可塑性はT-betとBcl6のダイナミックなバランスにより制御されることが示唆された.
従来,ヘルパーT細胞は限定的なサイトカインの産生とマスター転写因子の発現により独立した機能をもつ安定的なサブセットで構成されると考えられており,このようなシンプルなモデルはわれわれの免疫系への理解を容易にした.しかし,最近の報告は,すべてのCD4陽性T細胞サブセットにおいて複数のマスター転写因子を同時に発現する細胞の存在することが明らかになっており,そのような可塑性をもつ細胞が機能的に重要であると考えられつつある16).今回,筆者らが示したTh1細胞と濾胞性ヘルパーT細胞の移行細胞を含め,このような分化転換の容易な“柔軟”な細胞が存在することは,実際に,さまざまな病原体に対抗するため生体にとり理にかなったしくみのように思われる.今後,濾胞性ヘルパーT細胞の分化機構のさらなる解明が効果的なワクチン開発,自己免疫疾患の治療に貢献するものと期待される.
文 献
- Crotty, S.: Follicular helper CD4 T cells (TFH). Annu. Rev. Immunol., 29, 621-663 (2011)[PubMed]
- Warnatz, K., Bossaller, L., Salzer, U. et al.: Human ICOS deficiency abrogates the germinal center reaction and provides a monogenic model for common variable immunodeficiency. Blood, 107, 3045-3052 (2006)[PubMed]
- Linterman, M., Rigby, R., Wong, R. et al.: Follicular helper T cells are required for systemic autoimmunity. J. Exp. Med., 206, 561-576 (2009)[PubMed]
- Johnston, R. J., Poholek, A. C., DiToro, D. et al.: Bcl6 and Blimp-1 are reciprocal and antagonistic regulators of T follicular helper cell differentiation. Science, 325, 1006-1010 (2009)[PubMed]
- Nurieva, R. I., Chung, Y., Martinez, G. J. et al.: Bcl6 mediates the development of T follicular helper cells. Science, 325, 1001-1005 (2009)[PubMed]
- Yu, D., Rao, S., Tsai, L. M. et al.: The transcriptional repressor Bcl-6 directs T follicular helper cell lineage commitment. Immunity, 31, 457-446 (2009)[PubMed]
- Eddahri, F., Denanglaire, S., Bureau, F. et al.: Interleukin-6/STAT3 signaling regulates the ability of naive T cells to acquire B-cell help capacities. Blood, 113, 2426-2433 (2009)[PubMed]
- Poholek, A. C., Hansen, K., Hernandez, S. G. et al.: In vivo regulation of Bcl6 and T follicular helper cell development. J. Immunol., 185, 313-326 (2010)[PubMed]
- Mehta, D.S., Wurster, A.L., Weinmann, A.S. et al.: NFATc2 and T-bet contribute to T-helper-cell-subset-specific regulation of IL-21 expression. Proc. Natl. Acad. Sci. USA, 102, 2016-2021 (2005)[PubMed]
- Suto, A., Kashiwakuma, D., Kagami, S. et al.: Development and characterization of IL-21-producing CD4+ T cells. J. Exp. Med., 205, 1369-1379 (2008)[PubMed]
- Tsuji, M., Komatsu, N., Kawamoto, S. et al.: Preferential generation of follicular B helper T cells from Foxp3+ T cells in gut Peyer's patches. Science, 323, 1488-1492 (2009)[PubMed]
- Wei, L., Vahedi, G., Sun, H. W. et al.: Discrete roles of STAT4 and STAT6 transcription factors in tuning epigenetic modifications and transcription during T helper cell differentiation. Immunity, 32, 840-851 (2010)[PubMed]
- Schmitt, N., Morita, R., Bourdery, L. et al.: Human dendritic cells induce the differentiation of interleukin-21-producing T follicular helper-like cells through interleukin-12. Immunity, 31, 158-169 (2009)[PubMed]
- Lu, K. T., Kanno, Y., Cannons, J. L. et al.: Functional and epigenetic studies reveal multistep differentiation and plasticity of in vitro-generated and in vivo-derived follicular T helper cells. Immunity, 35, 622-632 (2011)[PubMed]
- Fahey, L. M., Wilson, E. B., Elsaesser, H. et al.: Viral persistence redirects CD4 T cell differentiation toward T follicular helper cells. J. Exp. Med., 208, 987-999 (2011)[PubMed]
- O'Shea, J. J. & Paul, W. E.: Mechanisms underlying lineage commitment and plasticity of helper CD4+ T cells. Science, 327, 1098-1102 (2010)[PubMed]
著者プロフィール
略歴:2004年 産業医科大学大学院医学研究科 修了,同年 産業医科大学医学部 助手,2007年 神戸大学大学院医学系研究科 医学研究員を経て,2009年より米国NIH National institute of Arthritis and Musculoskeletal and Skin Diseases訪問研究員.
研究テーマ:濾胞性ヘルパーT細胞の分化制御機構と自己免疫病態への関与.
© 2012 中山田 真吾 Licensed under CC 表示 2.1 日本