RhoAのグアニンヌクレオチド交換因子であるEct2による細胞質分裂における分裂溝の形成の制御機構
高木 亨・Mark Petronczki
(英国Cancer Research UK London Research Institute,Cell Division and Aneuploidy Laboratory)
email:高木 亨
DOI: 10.7875/first.author.2012.004
Targeting of the RhoGEF Ect2 to the equatorial membrane controls cleavage furrow formation during cytokinesis.
Kuan-Chung Su, Tohru Takaki, Mark Petronczki
Developmental Cell, 21, 1104-1115 (2011)
動物細胞の細胞質分裂においてはGTP加水分解酵素であるRhoAの活性化が重要な役割をはたしている.RhoAの活性化はグアニンヌクレオチド交換因子であるEct2により行われると考えられている.RhoAは分裂初期に分裂溝の周辺において局所的に活性化されることが知られているが,その詳細な機構は明らかになっていない.この論文では,Ect2は分裂後期の開始ののちPHドメインおよびPBCドメインを介して細胞膜の赤道面に局在することを示した.また,細胞質分裂においてEct2のグアニンヌクレオチド交換活性と細胞膜への局在能がRhoAの局所的な活性化に必要であることを示した.さらに,Ect2の局在の制御において,セントラルスピンドリン複合体による局在の空間的な制御,および,Cdk1による局在の時間的な制御が必要である可能性を提唱した.
細胞分裂は,染色体の複製,分離,分配,それにつづく細胞質分裂,という複数の段階をへることにより行われる.相同な2つの細胞を生み出すため,これらの機構は厳密に制御されている.分裂後期から分裂終期にかけて,細胞膜の赤道面で局所的に活性化されたRhoAによるアクチン繊維とミオシン繊維からなる収縮環の形成およびその収縮により,分裂溝の侵入(くぼみ)がひき起こされる.そののち,分裂溝は完全にくびれて2つの娘細胞が生まれる.分裂溝の形成は分裂後期に起こる染色体の分離と協調し,2つの細胞に正確に染色体を分配するため赤道面において起こる必要がある1,2).これまで,分裂溝の形成が赤道面で起こること,また,RhoAの局所的な活性化が細胞質分裂に必要なことが示されていたが3),細胞分裂において後期の開始ののちのRhoAの詳細な活性化機構は明らかではなかった.筆者らは,グアニンヌクレオチド交換因子(guanine nucleotide exchange factor:GEF)であるEct2(Epithelial cell transforming sequence 2 oncogene)に焦点をあて,細胞質分裂におけるRhoAの活性化機構の解明を行った.
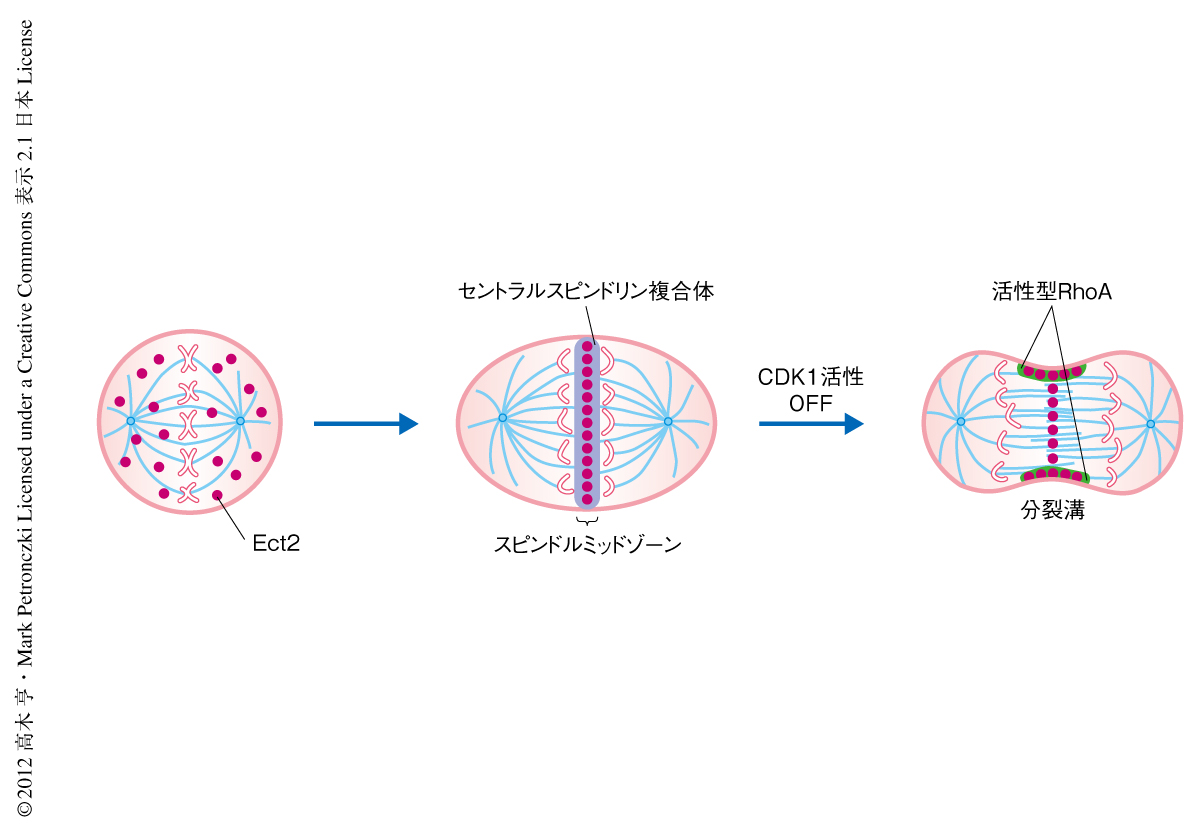
Ect2はRhoAの活性化および細胞質分裂に必須なタンパク質であることがさまざまな生物種で示されてきた.しかし,Ect2がどのようにRhoAを局所的に活性化するのかは明らかではなかった.筆者らは,Ect2の細胞質分裂期における細胞内での局在を調べるため,緑色蛍光タンパク質であるAcGFPを融合したEct2を発現する細胞を作製し,蛍光シグナルを観察することによりEct2の局在の変化を経時的に観察した.その結果,Ect2は分裂中期から分裂後期までは細胞質に局在するが,後期の開始ののちスピンドルミッドゾーンにおいて局在がみられた.そののち,分裂溝の侵入の直前には分裂溝への局在が確認された(図1).このEct2の局在の変化は,分裂後期における分裂溝の形成と空間的および時間的に相関がみられた.これらの結果は,分裂後期の開始ののちのEct2の細胞膜への局在がRhoAの局所的な活性化と細胞質分裂の開始において重要な役割をもつ可能性を示していた.
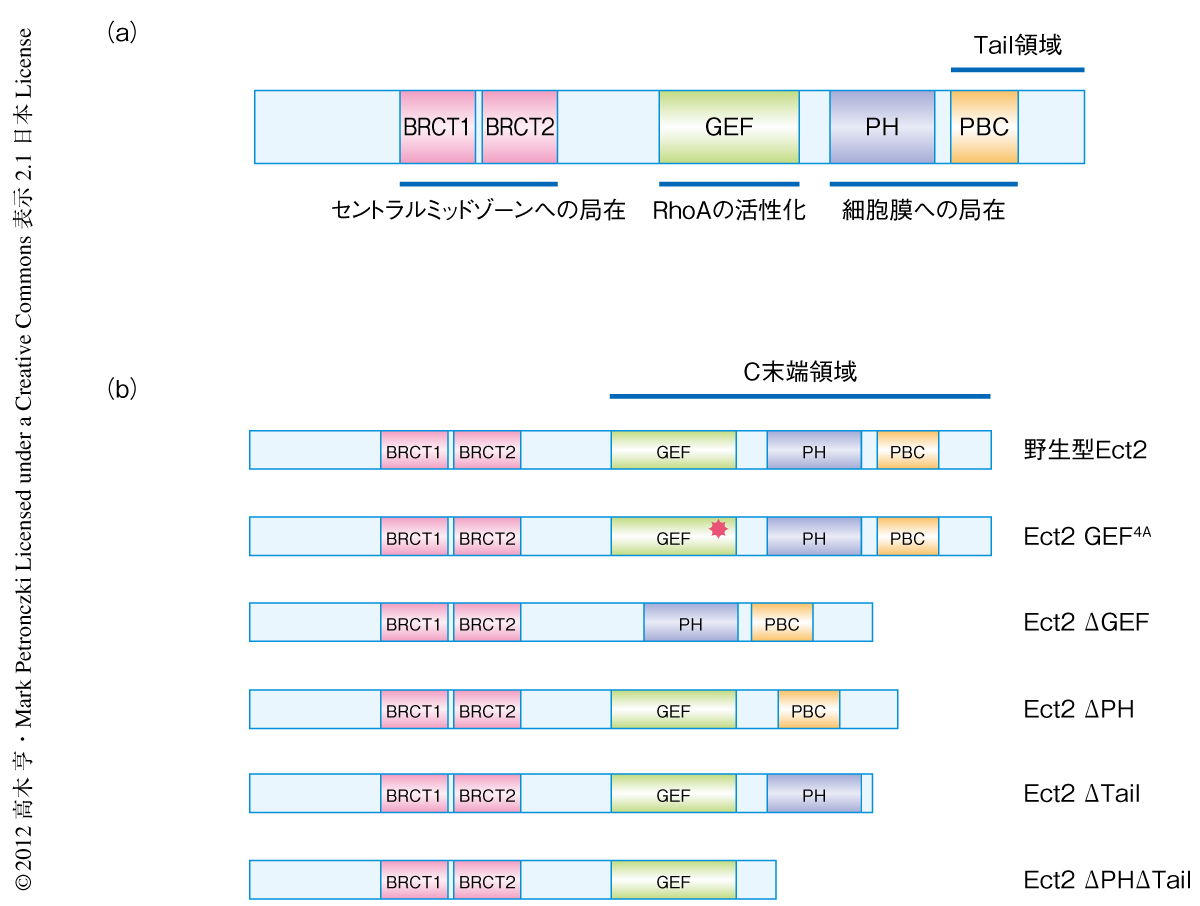
Ect2はいくつかの機能ドメインをもつタンパク質である(図2a).これまで,BRCTドメインはスピンドルミッドゾーンへの局在には必要であるが細胞膜への局在には必要ないことが報告されている4).そこで,Ect2の細胞膜への局在の機構を詳細に解明するため,BRCTドメインを欠失するEct2のC末端領域についてそのさまざまな変異体(図2b)を用いて細胞内での局在を調べた.野生型Ect2およびGEFドメインに不活性型の点変異をもつEct2 GEF4Aは分裂後期の開始ののち細胞膜への局在がみられた.この結果は,Ect2の細胞膜への局在にGEF活性は必要のないことを示していた.これに対し,細胞膜の脂質との結合活性をもつ多くのタンパク質で保存されているPHドメインを欠失したEct2ΔPHには細胞膜への局在がわずかながら認められた.この結果は,Ect2のPHドメインは細胞膜への結合に重要ではあるが,ほかにも細胞膜への結合に関与する領域のあることを示唆した.事実,C末端領域に存在し塩基性アミノ酸の集合するPBCドメインを含むTail領域を欠失したEct2ΔTail,および,PHドメインとTail領域を欠失したEct2ΔPHΔTailには細胞膜への局在がみられなかった.また,この細胞膜への局在はアクチン重合阻害剤であるサイトカラシンDによる処理ののちにも観察されたことから,Ect2の細胞膜への局在はアクチンではなく細胞膜の脂質への結合を介して行われているものと考えられた.
精製したEct2のin vitroにおける細胞膜の脂質への結合活性とその特異性を調べた結果,全長のEct2およびBRCTドメインを欠失するEct2のC末端領域にはイノシトールリン脂質への結合能がみられたが,Ect2ΔPHΔTailにはイノシトールリン脂質への結合能がみられなかった.この結果から,Ect2はPHドメインおよびPBCドメインを含むTail領域を介した細胞膜の脂質への結合により細胞膜へ局在することが示唆された.
Ect2のGEF活性および細胞膜への結合能の細胞質分裂における役割を調べるため,siRNAに耐性なEct2を定常的に発現する細胞株を作製した.Ect2に対するsiRNAを導入した細胞では多核化した細胞の割合が著しく上昇したのに対し,siRNAに耐性のEct2を発現する細胞では多核化が抑制された.この結果は,Ect2が細胞質分裂において重要な役割をはたしており,また,外部から導入したEct2は内在性のEct2の機能を相補できることを示していた.
この機能相補実験系を用い,さまざまな変異型Ect2(図2b)を定常的に発現する細胞株を作製しそれらの細胞内での機能を解析した.まず,GEF活性の必要性を調べるため,GEFドメインをもたないEct2ΔGEFおよびGEFドメインに不活性型の点変異をもつEct2 GEF4Aを定常的に発現する細胞株を作製し機能相補実験を行った.その結果,これらの変異型Ect2を発現する細胞ではEct2に対するsiRNAの導入に依存的に多核化した細胞の割合が上昇した.これらの変異Ect2がGEF活性をもたないことは精製されたEct2を用いたin vitroアッセイにより確認した.つぎに,細胞膜への結合能を欠く変異型Ect2を発現する細胞を用いて同様の実験を行った.その結果,Ect2ΔPHおよびEct2ΔPHΔTailを発現する細胞ではEct2に対するsiRNAの導入に依存的に多核化した細胞の割合の著しい上昇がみられた.また,Ect2ΔTailでは弱いながらも相補活性が認められたが,多核化した細胞の割合は上昇した.これらの細胞膜への結合能を欠く変異型Ect2はin vitroにおけるGEF活性をもっていたことから,細胞質分裂期のEct2の機能にはGEF活性と細胞膜への結合能という2つの独立した活性が必要であることが示唆された.
Ect2の分裂後期の開始ののちの細胞膜の赤道面への局在の機構を調べるため,さまざまな変異型Ect2(図2b)を定常的に発現する細胞株を用いてEct2の局在の変化を経時的に観察した.野生型Ect2およびGEF活性を欠くEct2ΔGEFとEct2 GEF4Aは,分裂後期にスピンドルミッドゾーン,分裂後期の開始ののち細胞膜の赤道面の周辺への局在がみられた.これに対し,細胞膜への結合能を欠くEct2ΔPHとEct2ΔPHΔTailでは,分裂後期にスピンドルミッドゾーンへの局在はみられたが,分裂後期の開始ののち細胞膜の赤道面の周辺への局在はみられなかった.これらの結果は,分裂後期から分裂終期にかけてのEct2の細胞膜の赤道面の周辺への集合においては細胞膜への結合能のみが不可欠でありGEF活性は必要でないことを示していた.
ここまで,Ect2のGEF活性および細胞膜への結合能が細胞質分裂に必須であることが示されたので,つぎに,細胞質分裂のどの段階でEct2が機能しているかを詳細に検討した.はじめに,細胞質分裂に必要なセントラルスピンドリン複合体のスピンドルミッドゾーンへの局在におけるEct2の影響を調べた.セントラルスピンドリン複合体の局在を調べるため,その構成タンパク質のひとつであるMKLP1を間接蛍光法により観察した.その結果,siRNAによりEct2を除去した細胞においてMKLP1のスピンドルミッドゾーンへの局在がみられた.同様に,GEF活性を欠くEct2ΔGEFおよびEct2 GEF4A,または,細胞膜への結合能を欠くEct2ΔPHおよびEct2ΔPHΔTailでも,同様にMKLP1のスピンドルミッドゾーンへの局在がみられた.この結果は,セントラルスピンドリン複合体のスピンドルミッドゾーンへの局在はEct2の上流に位置することを示していた.
Ect2の下流に位置することが予想されるRhoAおよび収縮環の構成タンパク質であるAnillinは分裂終期に分裂溝の周辺への局在がみられるが,これらのタンパク質の局在はsiRNAによる内在性Ect2の除去により阻害された.また,siRNAに耐性の野生型Ect2の発現によりRhoAおよびAnillinの分裂溝への局在は回復したが,すべての変異型Ect2(Ect2ΔGEF,Ect2 GEF4A,Ect2ΔPH,Ect2ΔPHΔTail)ではその回復はみられなかった.このことは,RhoAの活性化および分裂溝の形成にはEct2のGEF活性のみでなく細胞膜への局在能が必要であることを示していた.
分裂後期の開始ののちEct2は細胞膜の赤道面の周辺に局在する.しかし,BRCTドメインを欠失するEct2のC末端領域は分裂後期の開始ののち細胞膜への移行はみられるが細胞膜の赤道面への集合はみられない.このことは,Ect2の細胞膜の赤道面への局在は細胞膜における脂質の分布の変化により起こるのではなく,別の機構の存在することを示唆していた.Ect2は分裂後期の開始の際にセントラルスピンドリン複合体と結合しスピンドルミッドゾーンに局在する5).このスピンドルミッドゾーンへの局在が細胞膜の赤道面への集合に重要な役割をはたしているものと考えた.そこで,Ect2のスピンドルミッドゾーンへの局在を抑制するため,細胞にセントラルスピンドリン複合体を形成するMKLP1およびMgcRacGAPに対するsiRNAを導入し,分裂後期の開始ののちのEct2の局在の変化を調べた.その結果,MgcRacGAPまたはMKLP1に対するsiRNAを導入した細胞では分裂後期の開始の際のEct2のスピンドルミッドゾーンへの局在が抑制され,さらに,分裂後期の開始ののちにEct2の細胞膜への移行はみられたが細胞膜の赤道面への集合はみられなかった.また,Ect2のスピンドルミッドゾーンへの局在はPLK1によるMgcRacGAPのリン酸化に依存することが報告されている6,7).そこで,PLK1の特異的な阻害剤であるBI2536を用いEct2の細胞膜の赤道面への局在の有無を調べた.その結果,siRNAによるセントラルスピンドリン複合体の除去の実験と同様にEct2の細胞膜の赤道面への局在はみられなかった.これらの結果は,分裂後期の開始ののちのEct2の細胞膜の赤道面への集合にはセントラルスピンドリン複合体との結合を介したEct2のスピンドルミッドゾーンへの局在が必要であることを示していた.
ここまで,Ect2はPHドメインおよびTail領域を介して細胞膜に結合することが示された.しかし,Ect2は分裂中期には細胞質に局在し,分裂後期にセントラルミッドゾーン,分裂後期の開始の直後に細胞膜へと移行する(図1).この変化は何がもたらすのであろうか.分裂後期の開始の重要なシグナルとして,サイクリンBの分解にともなうCdk1活性の低下があげられる8).in vitroにおいてEct2の815番目のスレオニン残基がCdk1によりリン酸化されること,また,このスレオニン残基は細胞質分裂期の細胞内においてリン酸化されていることが報告されている9,10).さらに,このスレオニン残基は細胞膜への結合に重要なPBCドメインに位置していることから,Cdk1活性によるEct2の細胞膜への移行の制御に関与している可能性を検証した.はじめに,この815番目のスレオニン残基をアラニン残基に置換した変異型Ect2を用い,その分裂後期の開始ののちの局在の変化を調べた.その結果,野生型Ect2では分裂後期の開始と同時に細胞膜へ移行がみられたのに対し,この変異型Ect2では分裂後期の開始の以前に細胞膜へ移行がみられた.つぎに,この細胞膜へ移行がCdk1により制御されていることを確認するため,紡錘体の損傷剤であるノコダゾールで細胞を細胞質分裂期に同調し,CDK阻害剤であるフラボピリドールによりCdk1活性を阻害してEct2の局在の変化を調べた.その結果,ノコダゾール処理した細胞においてEct2は細胞質に局在がみられたが,フラボピリドールの添加の直後にEct2は細胞膜へと移行した.これらの結果は,分裂後期の開始におけるCdk1活性の変化がEct2の局在の変化を制御していることを示唆した.
この論文では,細胞質分裂において分裂溝の形成およびRhoAの活性化にEct2のGEF活性と細胞膜への結合能が必要であること,Ect2の細胞内での局在がセントラルスピンドリン複合体との結合およびCdk1活性により制御されていることを明らかにした.セントラルスピンドリン複合体によるEct2のスピンドルミッドゾーンへの局在が分裂溝への局在に必要であることが明らかになったが,どのような機構によりEct2がスピンドルミッドゾーンから分裂溝へと移行するのか,また,そのときにどのようなタンパク質が関与しているのかについては明らかになっていない.また,セントラルスピンドリン複合体の構成タンパク質であるMgcRacGAPはGTP加水分解促進タンパク質であり活性型RhoA(GTP結合型)の不活性型RhoA(GDP結合型)への変換を促進すると考えられている.Ect2は逆に不活性型RhoAを活性型RhoAへと変換する.なぜ,Ect2とMgcRacGAPという相反する活性をもつタンパク質が複合体を形成するのか,そして,どのようにして細胞質分裂期のRhoAの活性制御を行っているのかを明らかにすることが,今後に残された課題である.
略歴:2001年 九州大学大学院薬学研究科博士課程 修了,万有製薬つくば研究所,東京大学大学院薬学研究科を経て,2005年より英国Cancer Research UK London Research Institute研究員.
研究テーマ:細胞質分裂機構の解明.
Mark Petronczki
英国Cancer Research UK London Research InstituteにてPrincipal Investigator.
研究室URL:http://www.london-research-institute.org.uk/research/150
© 2012 高木 亨・Mark Petronczki Licensed under CC 表示 2.1 日本
(英国Cancer Research UK London Research Institute,Cell Division and Aneuploidy Laboratory)
email:高木 亨
DOI: 10.7875/first.author.2012.004
Targeting of the RhoGEF Ect2 to the equatorial membrane controls cleavage furrow formation during cytokinesis.
Kuan-Chung Su, Tohru Takaki, Mark Petronczki
Developmental Cell, 21, 1104-1115 (2011)
要 約
動物細胞の細胞質分裂においてはGTP加水分解酵素であるRhoAの活性化が重要な役割をはたしている.RhoAの活性化はグアニンヌクレオチド交換因子であるEct2により行われると考えられている.RhoAは分裂初期に分裂溝の周辺において局所的に活性化されることが知られているが,その詳細な機構は明らかになっていない.この論文では,Ect2は分裂後期の開始ののちPHドメインおよびPBCドメインを介して細胞膜の赤道面に局在することを示した.また,細胞質分裂においてEct2のグアニンヌクレオチド交換活性と細胞膜への局在能がRhoAの局所的な活性化に必要であることを示した.さらに,Ect2の局在の制御において,セントラルスピンドリン複合体による局在の空間的な制御,および,Cdk1による局在の時間的な制御が必要である可能性を提唱した.
はじめに
細胞分裂は,染色体の複製,分離,分配,それにつづく細胞質分裂,という複数の段階をへることにより行われる.相同な2つの細胞を生み出すため,これらの機構は厳密に制御されている.分裂後期から分裂終期にかけて,細胞膜の赤道面で局所的に活性化されたRhoAによるアクチン繊維とミオシン繊維からなる収縮環の形成およびその収縮により,分裂溝の侵入(くぼみ)がひき起こされる.そののち,分裂溝は完全にくびれて2つの娘細胞が生まれる.分裂溝の形成は分裂後期に起こる染色体の分離と協調し,2つの細胞に正確に染色体を分配するため赤道面において起こる必要がある1,2).これまで,分裂溝の形成が赤道面で起こること,また,RhoAの局所的な活性化が細胞質分裂に必要なことが示されていたが3),細胞分裂において後期の開始ののちのRhoAの詳細な活性化機構は明らかではなかった.筆者らは,グアニンヌクレオチド交換因子(guanine nucleotide exchange factor:GEF)であるEct2(Epithelial cell transforming sequence 2 oncogene)に焦点をあて,細胞質分裂におけるRhoAの活性化機構の解明を行った.
1.細胞質分裂の際のEct2の局在の変化
Ect2はRhoAの活性化および細胞質分裂に必須なタンパク質であることがさまざまな生物種で示されてきた.しかし,Ect2がどのようにRhoAを局所的に活性化するのかは明らかではなかった.筆者らは,Ect2の細胞質分裂期における細胞内での局在を調べるため,緑色蛍光タンパク質であるAcGFPを融合したEct2を発現する細胞を作製し,蛍光シグナルを観察することによりEct2の局在の変化を経時的に観察した.その結果,Ect2は分裂中期から分裂後期までは細胞質に局在するが,後期の開始ののちスピンドルミッドゾーンにおいて局在がみられた.そののち,分裂溝の侵入の直前には分裂溝への局在が確認された(図1).このEct2の局在の変化は,分裂後期における分裂溝の形成と空間的および時間的に相関がみられた.これらの結果は,分裂後期の開始ののちのEct2の細胞膜への局在がRhoAの局所的な活性化と細胞質分裂の開始において重要な役割をもつ可能性を示していた.
2.Ect2の細胞膜への局在の機構
Ect2はいくつかの機能ドメインをもつタンパク質である(図2a).これまで,BRCTドメインはスピンドルミッドゾーンへの局在には必要であるが細胞膜への局在には必要ないことが報告されている4).そこで,Ect2の細胞膜への局在の機構を詳細に解明するため,BRCTドメインを欠失するEct2のC末端領域についてそのさまざまな変異体(図2b)を用いて細胞内での局在を調べた.野生型Ect2およびGEFドメインに不活性型の点変異をもつEct2 GEF4Aは分裂後期の開始ののち細胞膜への局在がみられた.この結果は,Ect2の細胞膜への局在にGEF活性は必要のないことを示していた.これに対し,細胞膜の脂質との結合活性をもつ多くのタンパク質で保存されているPHドメインを欠失したEct2ΔPHには細胞膜への局在がわずかながら認められた.この結果は,Ect2のPHドメインは細胞膜への結合に重要ではあるが,ほかにも細胞膜への結合に関与する領域のあることを示唆した.事実,C末端領域に存在し塩基性アミノ酸の集合するPBCドメインを含むTail領域を欠失したEct2ΔTail,および,PHドメインとTail領域を欠失したEct2ΔPHΔTailには細胞膜への局在がみられなかった.また,この細胞膜への局在はアクチン重合阻害剤であるサイトカラシンDによる処理ののちにも観察されたことから,Ect2の細胞膜への局在はアクチンではなく細胞膜の脂質への結合を介して行われているものと考えられた.
精製したEct2のin vitroにおける細胞膜の脂質への結合活性とその特異性を調べた結果,全長のEct2およびBRCTドメインを欠失するEct2のC末端領域にはイノシトールリン脂質への結合能がみられたが,Ect2ΔPHΔTailにはイノシトールリン脂質への結合能がみられなかった.この結果から,Ect2はPHドメインおよびPBCドメインを含むTail領域を介した細胞膜の脂質への結合により細胞膜へ局在することが示唆された.
3.Ect2のGEF活性および細胞膜への結合能の細胞質分裂における必要性
Ect2のGEF活性および細胞膜への結合能の細胞質分裂における役割を調べるため,siRNAに耐性なEct2を定常的に発現する細胞株を作製した.Ect2に対するsiRNAを導入した細胞では多核化した細胞の割合が著しく上昇したのに対し,siRNAに耐性のEct2を発現する細胞では多核化が抑制された.この結果は,Ect2が細胞質分裂において重要な役割をはたしており,また,外部から導入したEct2は内在性のEct2の機能を相補できることを示していた.
この機能相補実験系を用い,さまざまな変異型Ect2(図2b)を定常的に発現する細胞株を作製しそれらの細胞内での機能を解析した.まず,GEF活性の必要性を調べるため,GEFドメインをもたないEct2ΔGEFおよびGEFドメインに不活性型の点変異をもつEct2 GEF4Aを定常的に発現する細胞株を作製し機能相補実験を行った.その結果,これらの変異型Ect2を発現する細胞ではEct2に対するsiRNAの導入に依存的に多核化した細胞の割合が上昇した.これらの変異Ect2がGEF活性をもたないことは精製されたEct2を用いたin vitroアッセイにより確認した.つぎに,細胞膜への結合能を欠く変異型Ect2を発現する細胞を用いて同様の実験を行った.その結果,Ect2ΔPHおよびEct2ΔPHΔTailを発現する細胞ではEct2に対するsiRNAの導入に依存的に多核化した細胞の割合の著しい上昇がみられた.また,Ect2ΔTailでは弱いながらも相補活性が認められたが,多核化した細胞の割合は上昇した.これらの細胞膜への結合能を欠く変異型Ect2はin vitroにおけるGEF活性をもっていたことから,細胞質分裂期のEct2の機能にはGEF活性と細胞膜への結合能という2つの独立した活性が必要であることが示唆された.
4.細胞質分裂期のEct2の赤道面への局在における細胞膜への結合能の必要性
Ect2の分裂後期の開始ののちの細胞膜の赤道面への局在の機構を調べるため,さまざまな変異型Ect2(図2b)を定常的に発現する細胞株を用いてEct2の局在の変化を経時的に観察した.野生型Ect2およびGEF活性を欠くEct2ΔGEFとEct2 GEF4Aは,分裂後期にスピンドルミッドゾーン,分裂後期の開始ののち細胞膜の赤道面の周辺への局在がみられた.これに対し,細胞膜への結合能を欠くEct2ΔPHとEct2ΔPHΔTailでは,分裂後期にスピンドルミッドゾーンへの局在はみられたが,分裂後期の開始ののち細胞膜の赤道面の周辺への局在はみられなかった.これらの結果は,分裂後期から分裂終期にかけてのEct2の細胞膜の赤道面の周辺への集合においては細胞膜への結合能のみが不可欠でありGEF活性は必要でないことを示していた.
5.RhoAの活性化と分裂溝の形成におけるGEF活性と細胞膜への結合能の役割
ここまで,Ect2のGEF活性および細胞膜への結合能が細胞質分裂に必須であることが示されたので,つぎに,細胞質分裂のどの段階でEct2が機能しているかを詳細に検討した.はじめに,細胞質分裂に必要なセントラルスピンドリン複合体のスピンドルミッドゾーンへの局在におけるEct2の影響を調べた.セントラルスピンドリン複合体の局在を調べるため,その構成タンパク質のひとつであるMKLP1を間接蛍光法により観察した.その結果,siRNAによりEct2を除去した細胞においてMKLP1のスピンドルミッドゾーンへの局在がみられた.同様に,GEF活性を欠くEct2ΔGEFおよびEct2 GEF4A,または,細胞膜への結合能を欠くEct2ΔPHおよびEct2ΔPHΔTailでも,同様にMKLP1のスピンドルミッドゾーンへの局在がみられた.この結果は,セントラルスピンドリン複合体のスピンドルミッドゾーンへの局在はEct2の上流に位置することを示していた.
Ect2の下流に位置することが予想されるRhoAおよび収縮環の構成タンパク質であるAnillinは分裂終期に分裂溝の周辺への局在がみられるが,これらのタンパク質の局在はsiRNAによる内在性Ect2の除去により阻害された.また,siRNAに耐性の野生型Ect2の発現によりRhoAおよびAnillinの分裂溝への局在は回復したが,すべての変異型Ect2(Ect2ΔGEF,Ect2 GEF4A,Ect2ΔPH,Ect2ΔPHΔTail)ではその回復はみられなかった.このことは,RhoAの活性化および分裂溝の形成にはEct2のGEF活性のみでなく細胞膜への局在能が必要であることを示していた.
6.Ect2の赤道面への局在におけるセントラルスピンドリン複合体の必要性
分裂後期の開始ののちEct2は細胞膜の赤道面の周辺に局在する.しかし,BRCTドメインを欠失するEct2のC末端領域は分裂後期の開始ののち細胞膜への移行はみられるが細胞膜の赤道面への集合はみられない.このことは,Ect2の細胞膜の赤道面への局在は細胞膜における脂質の分布の変化により起こるのではなく,別の機構の存在することを示唆していた.Ect2は分裂後期の開始の際にセントラルスピンドリン複合体と結合しスピンドルミッドゾーンに局在する5).このスピンドルミッドゾーンへの局在が細胞膜の赤道面への集合に重要な役割をはたしているものと考えた.そこで,Ect2のスピンドルミッドゾーンへの局在を抑制するため,細胞にセントラルスピンドリン複合体を形成するMKLP1およびMgcRacGAPに対するsiRNAを導入し,分裂後期の開始ののちのEct2の局在の変化を調べた.その結果,MgcRacGAPまたはMKLP1に対するsiRNAを導入した細胞では分裂後期の開始の際のEct2のスピンドルミッドゾーンへの局在が抑制され,さらに,分裂後期の開始ののちにEct2の細胞膜への移行はみられたが細胞膜の赤道面への集合はみられなかった.また,Ect2のスピンドルミッドゾーンへの局在はPLK1によるMgcRacGAPのリン酸化に依存することが報告されている6,7).そこで,PLK1の特異的な阻害剤であるBI2536を用いEct2の細胞膜の赤道面への局在の有無を調べた.その結果,siRNAによるセントラルスピンドリン複合体の除去の実験と同様にEct2の細胞膜の赤道面への局在はみられなかった.これらの結果は,分裂後期の開始ののちのEct2の細胞膜の赤道面への集合にはセントラルスピンドリン複合体との結合を介したEct2のスピンドルミッドゾーンへの局在が必要であることを示していた.
7.Cdk1活性によるEct2の細胞膜への局在の制御
ここまで,Ect2はPHドメインおよびTail領域を介して細胞膜に結合することが示された.しかし,Ect2は分裂中期には細胞質に局在し,分裂後期にセントラルミッドゾーン,分裂後期の開始の直後に細胞膜へと移行する(図1).この変化は何がもたらすのであろうか.分裂後期の開始の重要なシグナルとして,サイクリンBの分解にともなうCdk1活性の低下があげられる8).in vitroにおいてEct2の815番目のスレオニン残基がCdk1によりリン酸化されること,また,このスレオニン残基は細胞質分裂期の細胞内においてリン酸化されていることが報告されている9,10).さらに,このスレオニン残基は細胞膜への結合に重要なPBCドメインに位置していることから,Cdk1活性によるEct2の細胞膜への移行の制御に関与している可能性を検証した.はじめに,この815番目のスレオニン残基をアラニン残基に置換した変異型Ect2を用い,その分裂後期の開始ののちの局在の変化を調べた.その結果,野生型Ect2では分裂後期の開始と同時に細胞膜へ移行がみられたのに対し,この変異型Ect2では分裂後期の開始の以前に細胞膜へ移行がみられた.つぎに,この細胞膜へ移行がCdk1により制御されていることを確認するため,紡錘体の損傷剤であるノコダゾールで細胞を細胞質分裂期に同調し,CDK阻害剤であるフラボピリドールによりCdk1活性を阻害してEct2の局在の変化を調べた.その結果,ノコダゾール処理した細胞においてEct2は細胞質に局在がみられたが,フラボピリドールの添加の直後にEct2は細胞膜へと移行した.これらの結果は,分裂後期の開始におけるCdk1活性の変化がEct2の局在の変化を制御していることを示唆した.
おわりに
この論文では,細胞質分裂において分裂溝の形成およびRhoAの活性化にEct2のGEF活性と細胞膜への結合能が必要であること,Ect2の細胞内での局在がセントラルスピンドリン複合体との結合およびCdk1活性により制御されていることを明らかにした.セントラルスピンドリン複合体によるEct2のスピンドルミッドゾーンへの局在が分裂溝への局在に必要であることが明らかになったが,どのような機構によりEct2がスピンドルミッドゾーンから分裂溝へと移行するのか,また,そのときにどのようなタンパク質が関与しているのかについては明らかになっていない.また,セントラルスピンドリン複合体の構成タンパク質であるMgcRacGAPはGTP加水分解促進タンパク質であり活性型RhoA(GTP結合型)の不活性型RhoA(GDP結合型)への変換を促進すると考えられている.Ect2は逆に不活性型RhoAを活性型RhoAへと変換する.なぜ,Ect2とMgcRacGAPという相反する活性をもつタンパク質が複合体を形成するのか,そして,どのようにして細胞質分裂期のRhoAの活性制御を行っているのかを明らかにすることが,今後に残された課題である.
文 献
- Barr, F. A. & Gruneberg, U.: Cytokinesis: placing and making the final cut. Cell, 131, 847-860 (2007)[PubMed]
- Eggert, U. S., Mitchison, T. J. & Field, C. M.: Animal cytokinesis: from parts list to mechanisms. Annu. Rev. Biochem., 75, 543-566 (2006)[PubMed]
- Piekny, A., Werner, M. & Glotzer, M.: Cytokinesis: welcome to the Rho zone. Trends Cell Biol., 15, 651-658 (2005)[PubMed]
- Chalamalasetty, R. B., Hummer, S., Nigg, E. A. et al.: Influence of human Ect2 depletion and overexpression on cleavage furrow formation and abscission. J. Cell Sci., 119, 3008-3019 (2006)[PubMed]
- Glotzer, M.: The 3Ms of central spindle assembly: microtubules, motors and MAPs. Nat. Rev. Mol. Cell Biol., 10, 9-20 (2009)[PubMed]
- Burkard, M. E., Maciejowski, J., Rodriguez-Bravo, V. et al.: Plk1 self-organization and priming phosphorylation of HsCyk-4 at the spindle midzone regulate the onset of division in human cells. PLoS Biol., 7, e1000111 (2009)[PubMed]
- Wolfe, B. A., Takaki, T., Petronczki, M. et al.: Polo-like kinase 1 directs assembly of HsCyk-4 RhoGAP/Ect2 RhoGEF complex to initiate cleavage furrow formation. PLoS Biol., 7, e1000110 (2009)[PubMed]
- Hochegger, H., Takeda, S. & Hunt, T.: Cyclin-dependent kinases and cell cycle transition: does one fit all? Nat. Rev. Mol. Cell Biol., 9, 910-916 (2008)[PubMed]
- Niiya, F., Tatsumoto, T., Lee, K. S. et al.: Phosphorylation of the cytokinesis regulator Ect2 at G2/M phase stimulates association of the mitotic kinase PLK1 and accumulation of GTP-bound RhoA. Oncogene, 25, 827-837 (2006)[PubMed]
- Dephoure, N., Zhou, C., Villen, J. et al.: A quantitative atlas of mitotic phosphorylation. Proc. Natl. Acad. Sci. USA, 105, 10762-10767 (2008)[PubMed]
著者プロフィール
略歴:2001年 九州大学大学院薬学研究科博士課程 修了,万有製薬つくば研究所,東京大学大学院薬学研究科を経て,2005年より英国Cancer Research UK London Research Institute研究員.
研究テーマ:細胞質分裂機構の解明.
Mark Petronczki
英国Cancer Research UK London Research InstituteにてPrincipal Investigator.
研究室URL:http://www.london-research-institute.org.uk/research/150
© 2012 高木 亨・Mark Petronczki Licensed under CC 表示 2.1 日本