ヒストンH2BのN-アセチルグルコサミン化はそのユビキチン化を促進する
藤木亮次・加藤茂明
(東京大学分子細胞生物学研究所 核内情報研究分野)
email:加藤茂明
DOI: 10.7875/first.author.2011.183
GlcNAcylation of histone H2B facilitates its monoubiquitination.
Ryoji Fujiki, Waka Hashiba, Hiroki Sekine, Atsushi Yokoyama, Toshihiro Chikanishi, Saya Ito, Yuuki Imai, Jaehoon Kim, Housheng Hansen He, Katsuhide Igarashi, Jun Kanno, Fumiaki Ohtake, Hirochika Kitagawa, Robert G. Roeder, Myles Brown, Shigeaki Kato
Nature, 480, 557-560 (2011)
エピゲノムとはクロマチンに存在する化学修飾の総称である.ポストゲノム時代に突入した現在,エピゲノムは遺伝子発現の多様性にかかわる第2の遺伝暗号として注目をあつめるようになった.この論文では,染色体においてヒストンH2Bの112番目のセリン残基がN-アセチルグルコサミンにより修飾されることを報告した.この新しいエピゲノム修飾は細胞外のグルコース濃度と連動しており,標的遺伝子の発現を正の方向に制御した.また,この分子機構にはヒストンH2Bのユビキチン修飾が関与していることも見い出された.このグルコース応答性のヒストン修飾は代謝に関連するさまざまな遺伝子を標的としており,なかには,糖尿病に関連するものも多く含まれていた.グルコースは微生物から高等真核生物にいたるまで,もっとも重要な栄養素のひとつとして利用されてきた.当然,細胞におけるグルコースのレベルはほとんどすべての細胞内プロセスを制限している.このような糖応答性のN-アセチルグルコサミン修飾とユビキチン修飾との新しいクロストークの発見はエピジェネティクス制御に新しい概念をもたらすと同時に,細胞が栄養を感知して遺伝子発現を誘導するしくみについての基礎的な理解を助けるものである.
“われわれの個性はゲノムのみにより決定されるのか?”という命題について古くから多くの議論がなされてきた.ヒトのゲノムが解読され,おおかたの予想を裏切りヒトの遺伝子は極端に少ないことがわかり,その答えは“ノー”というのが定説になっている.実際にこのことは,一卵性双生児が異なる個性を獲得したり,生活習慣の違いからさまざまな疾患を患ったりすることからも容易に想像できる.それでは,遺伝子の発現を後天的に多様化させる要因は何であるのか,これを明らかにしていくことがポストゲノム時代における次なる課題となっている.
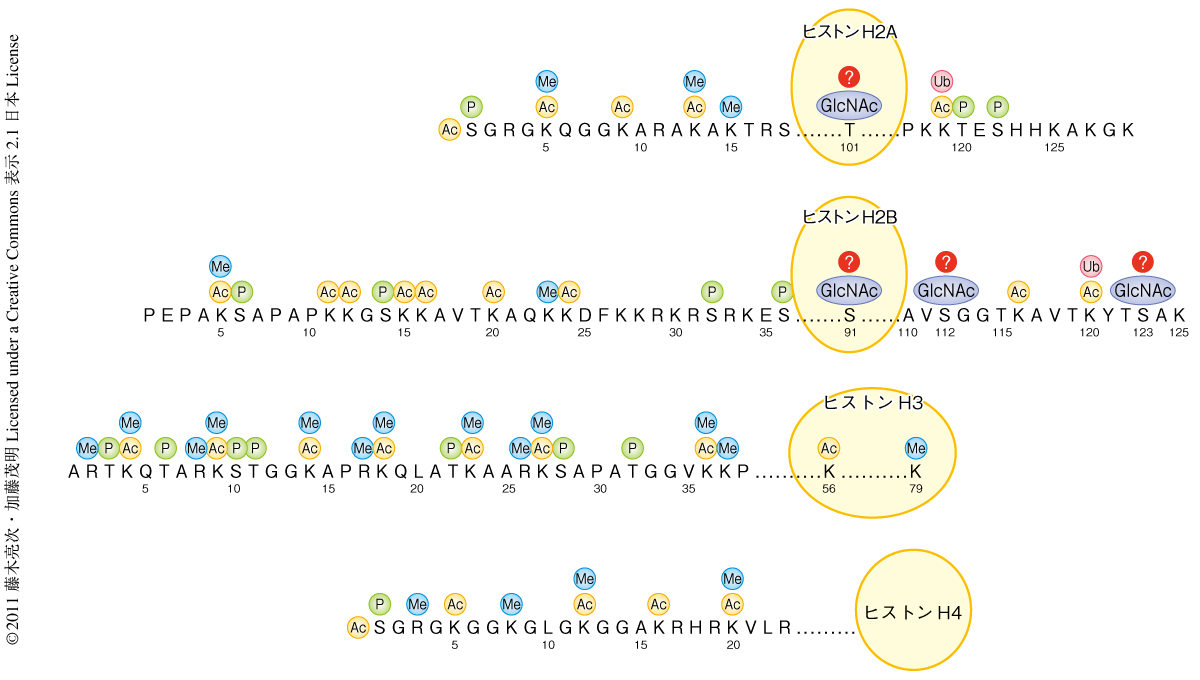
そのひとつとして,クロマチンを構成するDNAやヒストンの化学修飾が注目をあつめている.これらはエピゲノムと称され,DNAに対してはメチル化が知られるのみであるが,ヒストンに対しては,リジン残基に対するメチル化やアセチル化,ユビキチン化,あるいは,セリン残基・スレオニン残基・チロシン残基に対するリン酸化など,大きく9種類の化学修飾が知られている1,2).ヒストンにおけるアミノ酸残基の位置の違いまで数えればすでに100種をこえる修飾が発見されており(図1),われわれ高等真核生物の複雑な遺伝子発現のプロセスを説明するのに十分なバリエーションをかねそろえていることがわかってきた.逆をいえば,これら新しいエピゲノムの発見はそれまでのバイオロジーの概念に対してつねに新しいブレークスルーをもたらしてきたという経緯がある.今回,筆者らは,ヒストンH2Bの112番目のセリン残基がN-アセチルグルコサミンにより修飾されることを発見し,そのクロマチン制御における役割について解析を行った.
以前に筆者らは,N-アセチルグルコサミン転移酵素であるOGTが転写の促進と血球の分化に重要であることを報告した3).これまで,1000種近くもの細胞質あるいは核のタンパク質がN-アセチルグルコサミンにより修飾されることが報告されている4).しかし,クロマチンにおけるN-アセチルグルコサミン修飾基質やエピジェネティクス制御に関する役割についてはいまだ不明な点が多く残されていた.そこで今回,先行研究をきっかけとし,OGTの基質をHeLa細胞のクロマチン成分から探索した.HeLa細胞のクロマチン抽出液からN-アセチルグルコサミン化タンパク質をWGAレクチンカラムにより濃縮し,さらに抗N-アセチルグルコサミン化セリン残基/スレオニン残基認識抗体により精製した.得られた画分を銀染色した結果,ヒストン自体が検出され,ヒストンがOGTの基質である可能性が見い出された.
そこで,OGTとヒストンを放射能で標識したUDP-N-アセチルグルコサミンとともに反応させ,反応物のオートラジオグラフを調べた.その結果,エピゲノム修飾の場としてよく知られているヒストンH3やヒストンH4はまったく修飾されず,むしろ,ヒストンH2AとヒストンH2Bがその基質となることがわかった.ヒストン八量体を基質とした評価ではヒストンH2Bのみに反応性がみられた.さらに,どのアミノ酸残基がこの修飾をうけるのかを明らかにする目的でN-アセチルグルコサミン修飾されたヒストンH2Bについて電子イオン解離法を用いた液体クロマトグラフィー-タンデム質量分析による解析を行った.その結果,ヒストンH2Bは91番目のセリン残基,112番目のセリン残基,123番目のセリン残基の3種の修飾部位をもつことがわかった.さらに,これらセリン残基をアラニン残基に置換した変異体のうち,112番目のセリン残基の変異体においてはN-アセチルグルコサミン修飾がほとんど観察されなかった.したがって,ヒストンH2Bにおいては112番目のセリン残基がもっとも強くOGTによるN-アセチルグルコサミン修飾をうけていることがわかった.
一般に,N-アセチルグルコサミン修飾は細胞外のグルコース濃度の変化と連動することが知られている4).これは,グルコースの流入レベルがN-アセチルグルコサミン転移酵素OGTの基質であるUDP-N-アセチルグルコサミンの産生に直結しているためと考えられている.反対に,細胞外のグルコース濃度の低下にともないUDP-N-アセチルグルコサミンの量は減少し,N-アセチルグルコサミン修飾は強力な脱N-アセチルグルコサミン化酵素であるOGAによりすみやかに除去される.この研究において,ヒストンH2Bの112番目のセリン残基のN-アセチルグルコサミン修飾を認識するモノクローナル抗体を作出することにより,このことがヒストンに対してもあてはまることが明らかにされた.すなわち,ヒストンH2Bの112番目のセリン残基のN-アセチルグルコサミン修飾は細胞外のグルコースの除去ののち約24時間で減少し,これはグルコースやグルコサミンの再負荷により定常状態にまで回復した.
このヒストンH2Bの112番目のセリン残基のN-アセチルグルコサミン修飾についてクロマチン制御における役割を明らかにする目的で,ショウジョウバエ唾液腺のもつ多糸染色体の古典的な免疫染色を行った.その結果,この修飾はDAPI染色液により強く染色されるヘテロクロマチン領域ではなく,DAPI染色液では染色されないユークロマチン領域に豊富に存在することがわかった.同様に,活性化されたクロマチンに多く存在するヒストンH3の4番目のリジン残基のメチル化修飾とは共局在し,不活性化されたクロマチンに多くみられるヒストンH3の9番目のリジン残基のメチル化修飾や27番目のリジン残基のメチル化修飾とは排他的であった.以上の結果から,この修飾はクロマチンの活性化に寄与する可能性が示唆された.
ゲノムにおけるより詳細な位置情報を得る目的で,ヒストンH2Bの112番目のセリン残基のN-アセチルグルコサミン修飾についてクロマチン免疫沈降-シークエンシング解析を行った.その結果,HeLa細胞のゲノムから47,375箇所のピークを認め,そのうち2048箇所のピークは参照配列の遺伝子における転写開始点から±2 kbの位置に存在することがわかった.マイクロアレイ解析と組み合わせることにより,これらヒストンH2Bの112番目のセリン残基のN-アセチルグルコサミン修飾の標的のうち1299遺伝子については転写活性の評価が可能であった.その結果,じつに78.6%にあたる1021遺伝子が比較的高いレベルで転写されていることがわかった.これら2048遺伝子をGene Ontology解析ツールにより検索した結果,これらの多くが細胞内代謝と深い関連をもつ遺伝子であった.以上の結果から,N-アセチルグルコサミン転移酵素OGTは細胞外グルコース濃度の上昇にともなってヒストンH2Bの112番目のセリン残基をN-アセチルグルコサミン修飾し,とくに,代謝に関連する遺伝子を活性化させているといった,魅力的なモデルを予想することができた.
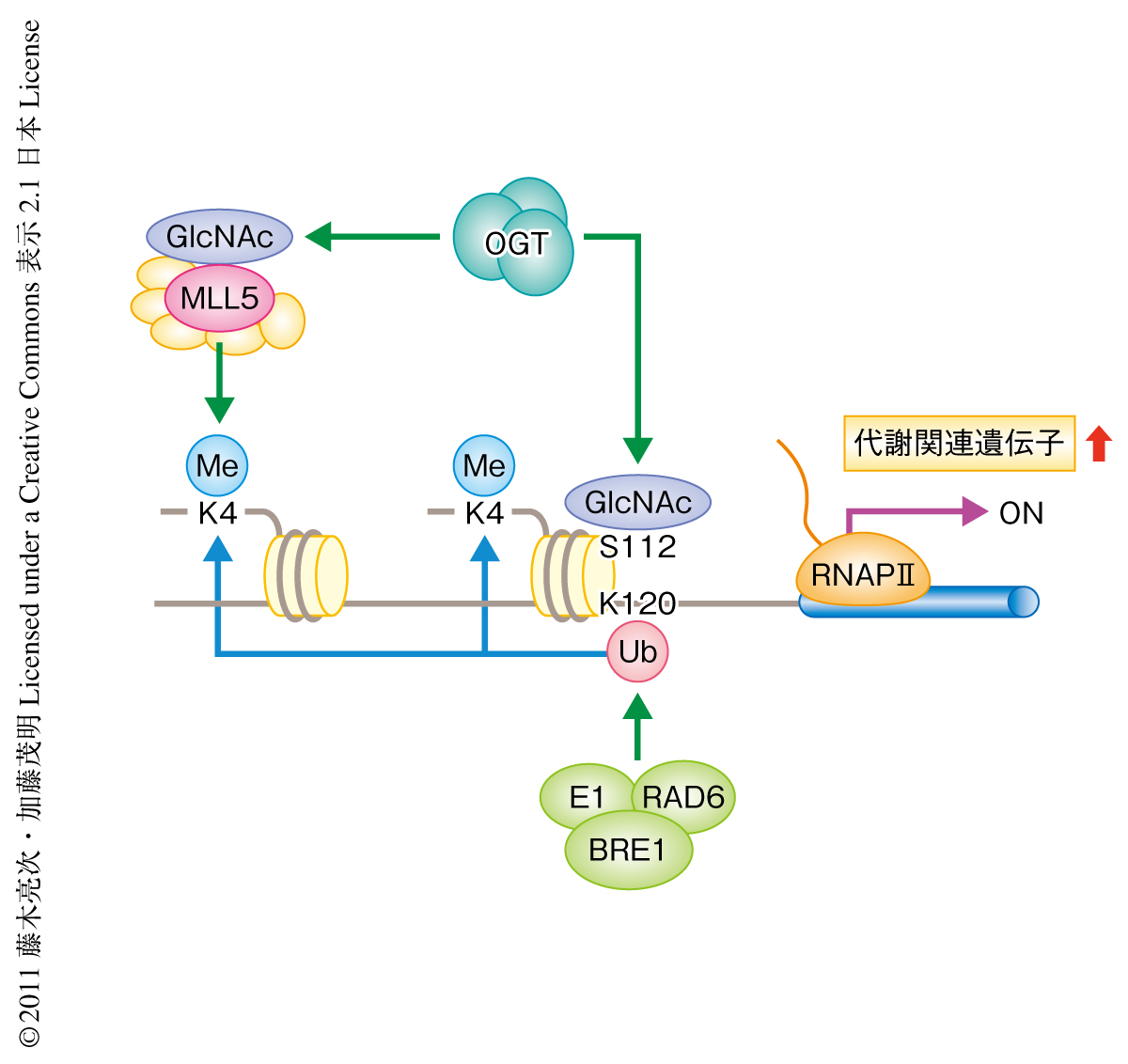
最近の研究結果から,ヒストンの修飾は単一の状態ではなく複数の修飾が組み合わさった形態で存在することがわかっており1,2),これらエピゲノム修飾のクロストークは高等真核生物の複雑な細胞内プロセス制御を説明するうえで欠くことのできない重要な機構となっている.そこで,ヒストンH2Bの112番目のセリン残基のすぐ近傍に存在する120番目のリジン残基のユビキチン修飾に注目し5),N-アセチルグルコサミン修飾がユビキチン修飾にあたえる影響についてさらなる解析を行った.試験管内反応によりN-アセチルグルコサミン修飾をうけたヒストンH2Bを調製し,ヒストンH2Bの120番目のリジン残基のユビキチンリガーゼであるE1,RAD6,BRE1A/1Bと反応させた.その結果,N-アセチルグルコサミン修飾によりユビキチン修飾が部分的に亢進することがわかった.また,112番目のセリン残基をアラニン残基に置換したヒストンH2Bの変異体を細胞に導入した結果,このヒストンH2Bはユビキチン修飾をうけないことがわかった.ヒストンH2BのN-アセチルグルコサミン修飾にくわえユビキチン修飾もまた転写反応の促進に寄与することが知られていることから,このことは,これらヒストンH2Bにおいて生じる2つの修飾のクロストークが転写制御にはたらく可能性を示していた(図2).
特筆すべき点として,プロモーター領域にN-アセチルグルコサミン修飾とユビキチン修飾の2つをもつ標的遺伝子にはやはり代謝に関連する遺伝子が多くみられ,それらのなかには糖尿病の発症リスクや病態に関係する遺伝子も多く含まれていた.そこで,インスリンのはたらきに不可欠なGSK3β遺伝子を解析モデルとし6),プロモーター領域における経時的なエピゲノム解析を試みた.クロマチン免疫沈降-定量PCR法により評価した結果,グルコースを除いた状態ではN-アセチルグルコサミン修飾とユビキチン修飾はともに低い状態となっていた.グルコースの再負荷ののち,N-アセチルグルコサミン修飾はすぐに上昇し,ユビキチン修飾はやや遅れて蓄積がみられた.また,N-アセチルグルコサミン転移酵素OGTはグルコースの状態にかかわらずヒストンH2Bへの結合がみられたため,ヒストンH2BにおけるN-アセチルグルコサミン修飾の位置特異性にはおそらくOGTによるクロマチン認識が関係しているものと予想された.
グルコースは細菌から高等真核生物にいたるまで,もっとも原初的な栄養素のひとつである.当然,グルコースはほとんどすべての細胞内プロセスに制限をくわえているものと予想され,クロマチン制御もその例外ではない.この研究における糖応答性のN-アセチルグルコサミン修飾とユビキチン修飾の新しいクロストークの発見はエピジェネティクス制御に新しい概念をもたらすと同時に,細胞が栄養を感知して遺伝子発現を誘導するしくみについて基礎的な理解を助けるものである.
また,ゲノムDNAがタンパク質のアミノ酸配列をコードしているのに対し,エピゲノム修飾は近傍の遺伝子の発現量を規定している.したがって,DNAの変異と同様に,エピゲノム修飾の破綻もまた細胞に大きな障害をもたらす結果となる.最近では,エピゲノム研究にもとづく診断,創薬,治療などさまざまな試みがなされており,ヒストンのアセチル化など一部の修飾を標的とした薬剤の開発も成果をあげてきた7).このような現状を鑑みれば,この研究の成果もまた,メタボリックシンドロームを標的としたエピゲノム診断あるいは医療などに役立てられていく可能性が期待できる.
略歴:2007年 東京大学農学生命科学研究科博士課程 修了,同年 科学技術振興機構ERATO加藤核内複合体プロジェクト 博士研究員を経て,2009年より東京大学分子細胞生物学研究所 助教,2011年より科学技術振興機構 さきがけ研究員を兼任.
研究テーマ:核における糖修飾を介するクロマチン制御機構の解明.
抱負:精製による新規因子の取得と質量分析計を使った同定に関する技術をさらに磨いていきたい.
加藤 茂明(Shigeaki Kato)
東京大学分子細胞生物学研究所 教授.
研究室URL:http://www.iam.u-tokyo.ac.jp/bnsikato/
© 2011 藤木亮次・加藤茂明 Licensed under CC 表示 2.1 日本
(東京大学分子細胞生物学研究所 核内情報研究分野)
email:加藤茂明
DOI: 10.7875/first.author.2011.183
GlcNAcylation of histone H2B facilitates its monoubiquitination.
Ryoji Fujiki, Waka Hashiba, Hiroki Sekine, Atsushi Yokoyama, Toshihiro Chikanishi, Saya Ito, Yuuki Imai, Jaehoon Kim, Housheng Hansen He, Katsuhide Igarashi, Jun Kanno, Fumiaki Ohtake, Hirochika Kitagawa, Robert G. Roeder, Myles Brown, Shigeaki Kato
Nature, 480, 557-560 (2011)
要 約
エピゲノムとはクロマチンに存在する化学修飾の総称である.ポストゲノム時代に突入した現在,エピゲノムは遺伝子発現の多様性にかかわる第2の遺伝暗号として注目をあつめるようになった.この論文では,染色体においてヒストンH2Bの112番目のセリン残基がN-アセチルグルコサミンにより修飾されることを報告した.この新しいエピゲノム修飾は細胞外のグルコース濃度と連動しており,標的遺伝子の発現を正の方向に制御した.また,この分子機構にはヒストンH2Bのユビキチン修飾が関与していることも見い出された.このグルコース応答性のヒストン修飾は代謝に関連するさまざまな遺伝子を標的としており,なかには,糖尿病に関連するものも多く含まれていた.グルコースは微生物から高等真核生物にいたるまで,もっとも重要な栄養素のひとつとして利用されてきた.当然,細胞におけるグルコースのレベルはほとんどすべての細胞内プロセスを制限している.このような糖応答性のN-アセチルグルコサミン修飾とユビキチン修飾との新しいクロストークの発見はエピジェネティクス制御に新しい概念をもたらすと同時に,細胞が栄養を感知して遺伝子発現を誘導するしくみについての基礎的な理解を助けるものである.
はじめに
“われわれの個性はゲノムのみにより決定されるのか?”という命題について古くから多くの議論がなされてきた.ヒトのゲノムが解読され,おおかたの予想を裏切りヒトの遺伝子は極端に少ないことがわかり,その答えは“ノー”というのが定説になっている.実際にこのことは,一卵性双生児が異なる個性を獲得したり,生活習慣の違いからさまざまな疾患を患ったりすることからも容易に想像できる.それでは,遺伝子の発現を後天的に多様化させる要因は何であるのか,これを明らかにしていくことがポストゲノム時代における次なる課題となっている.
そのひとつとして,クロマチンを構成するDNAやヒストンの化学修飾が注目をあつめている.これらはエピゲノムと称され,DNAに対してはメチル化が知られるのみであるが,ヒストンに対しては,リジン残基に対するメチル化やアセチル化,ユビキチン化,あるいは,セリン残基・スレオニン残基・チロシン残基に対するリン酸化など,大きく9種類の化学修飾が知られている1,2).ヒストンにおけるアミノ酸残基の位置の違いまで数えればすでに100種をこえる修飾が発見されており(図1),われわれ高等真核生物の複雑な遺伝子発現のプロセスを説明するのに十分なバリエーションをかねそろえていることがわかってきた.逆をいえば,これら新しいエピゲノムの発見はそれまでのバイオロジーの概念に対してつねに新しいブレークスルーをもたらしてきたという経緯がある.今回,筆者らは,ヒストンH2Bの112番目のセリン残基がN-アセチルグルコサミンにより修飾されることを発見し,そのクロマチン制御における役割について解析を行った.
1.ヒストンのN-アセチルグルコサミンによる修飾の発見
以前に筆者らは,N-アセチルグルコサミン転移酵素であるOGTが転写の促進と血球の分化に重要であることを報告した3).これまで,1000種近くもの細胞質あるいは核のタンパク質がN-アセチルグルコサミンにより修飾されることが報告されている4).しかし,クロマチンにおけるN-アセチルグルコサミン修飾基質やエピジェネティクス制御に関する役割についてはいまだ不明な点が多く残されていた.そこで今回,先行研究をきっかけとし,OGTの基質をHeLa細胞のクロマチン成分から探索した.HeLa細胞のクロマチン抽出液からN-アセチルグルコサミン化タンパク質をWGAレクチンカラムにより濃縮し,さらに抗N-アセチルグルコサミン化セリン残基/スレオニン残基認識抗体により精製した.得られた画分を銀染色した結果,ヒストン自体が検出され,ヒストンがOGTの基質である可能性が見い出された.
そこで,OGTとヒストンを放射能で標識したUDP-N-アセチルグルコサミンとともに反応させ,反応物のオートラジオグラフを調べた.その結果,エピゲノム修飾の場としてよく知られているヒストンH3やヒストンH4はまったく修飾されず,むしろ,ヒストンH2AとヒストンH2Bがその基質となることがわかった.ヒストン八量体を基質とした評価ではヒストンH2Bのみに反応性がみられた.さらに,どのアミノ酸残基がこの修飾をうけるのかを明らかにする目的でN-アセチルグルコサミン修飾されたヒストンH2Bについて電子イオン解離法を用いた液体クロマトグラフィー-タンデム質量分析による解析を行った.その結果,ヒストンH2Bは91番目のセリン残基,112番目のセリン残基,123番目のセリン残基の3種の修飾部位をもつことがわかった.さらに,これらセリン残基をアラニン残基に置換した変異体のうち,112番目のセリン残基の変異体においてはN-アセチルグルコサミン修飾がほとんど観察されなかった.したがって,ヒストンH2Bにおいては112番目のセリン残基がもっとも強くOGTによるN-アセチルグルコサミン修飾をうけていることがわかった.
2.ヒストンH2BのN-アセチルグルコサミン修飾はグルコース応答性である
一般に,N-アセチルグルコサミン修飾は細胞外のグルコース濃度の変化と連動することが知られている4).これは,グルコースの流入レベルがN-アセチルグルコサミン転移酵素OGTの基質であるUDP-N-アセチルグルコサミンの産生に直結しているためと考えられている.反対に,細胞外のグルコース濃度の低下にともないUDP-N-アセチルグルコサミンの量は減少し,N-アセチルグルコサミン修飾は強力な脱N-アセチルグルコサミン化酵素であるOGAによりすみやかに除去される.この研究において,ヒストンH2Bの112番目のセリン残基のN-アセチルグルコサミン修飾を認識するモノクローナル抗体を作出することにより,このことがヒストンに対してもあてはまることが明らかにされた.すなわち,ヒストンH2Bの112番目のセリン残基のN-アセチルグルコサミン修飾は細胞外のグルコースの除去ののち約24時間で減少し,これはグルコースやグルコサミンの再負荷により定常状態にまで回復した.
3.ヒストンH2BのN-アセチルグルコサミン修飾は代謝関連遺伝子の活性化に寄与する
このヒストンH2Bの112番目のセリン残基のN-アセチルグルコサミン修飾についてクロマチン制御における役割を明らかにする目的で,ショウジョウバエ唾液腺のもつ多糸染色体の古典的な免疫染色を行った.その結果,この修飾はDAPI染色液により強く染色されるヘテロクロマチン領域ではなく,DAPI染色液では染色されないユークロマチン領域に豊富に存在することがわかった.同様に,活性化されたクロマチンに多く存在するヒストンH3の4番目のリジン残基のメチル化修飾とは共局在し,不活性化されたクロマチンに多くみられるヒストンH3の9番目のリジン残基のメチル化修飾や27番目のリジン残基のメチル化修飾とは排他的であった.以上の結果から,この修飾はクロマチンの活性化に寄与する可能性が示唆された.
ゲノムにおけるより詳細な位置情報を得る目的で,ヒストンH2Bの112番目のセリン残基のN-アセチルグルコサミン修飾についてクロマチン免疫沈降-シークエンシング解析を行った.その結果,HeLa細胞のゲノムから47,375箇所のピークを認め,そのうち2048箇所のピークは参照配列の遺伝子における転写開始点から±2 kbの位置に存在することがわかった.マイクロアレイ解析と組み合わせることにより,これらヒストンH2Bの112番目のセリン残基のN-アセチルグルコサミン修飾の標的のうち1299遺伝子については転写活性の評価が可能であった.その結果,じつに78.6%にあたる1021遺伝子が比較的高いレベルで転写されていることがわかった.これら2048遺伝子をGene Ontology解析ツールにより検索した結果,これらの多くが細胞内代謝と深い関連をもつ遺伝子であった.以上の結果から,N-アセチルグルコサミン転移酵素OGTは細胞外グルコース濃度の上昇にともなってヒストンH2Bの112番目のセリン残基をN-アセチルグルコサミン修飾し,とくに,代謝に関連する遺伝子を活性化させているといった,魅力的なモデルを予想することができた.
4.ヒストンH2BのN-アセチルグルコサミン修飾は120番目のリジン残基のユビキチン修飾を促進する
最近の研究結果から,ヒストンの修飾は単一の状態ではなく複数の修飾が組み合わさった形態で存在することがわかっており1,2),これらエピゲノム修飾のクロストークは高等真核生物の複雑な細胞内プロセス制御を説明するうえで欠くことのできない重要な機構となっている.そこで,ヒストンH2Bの112番目のセリン残基のすぐ近傍に存在する120番目のリジン残基のユビキチン修飾に注目し5),N-アセチルグルコサミン修飾がユビキチン修飾にあたえる影響についてさらなる解析を行った.試験管内反応によりN-アセチルグルコサミン修飾をうけたヒストンH2Bを調製し,ヒストンH2Bの120番目のリジン残基のユビキチンリガーゼであるE1,RAD6,BRE1A/1Bと反応させた.その結果,N-アセチルグルコサミン修飾によりユビキチン修飾が部分的に亢進することがわかった.また,112番目のセリン残基をアラニン残基に置換したヒストンH2Bの変異体を細胞に導入した結果,このヒストンH2Bはユビキチン修飾をうけないことがわかった.ヒストンH2BのN-アセチルグルコサミン修飾にくわえユビキチン修飾もまた転写反応の促進に寄与することが知られていることから,このことは,これらヒストンH2Bにおいて生じる2つの修飾のクロストークが転写制御にはたらく可能性を示していた(図2).
特筆すべき点として,プロモーター領域にN-アセチルグルコサミン修飾とユビキチン修飾の2つをもつ標的遺伝子にはやはり代謝に関連する遺伝子が多くみられ,それらのなかには糖尿病の発症リスクや病態に関係する遺伝子も多く含まれていた.そこで,インスリンのはたらきに不可欠なGSK3β遺伝子を解析モデルとし6),プロモーター領域における経時的なエピゲノム解析を試みた.クロマチン免疫沈降-定量PCR法により評価した結果,グルコースを除いた状態ではN-アセチルグルコサミン修飾とユビキチン修飾はともに低い状態となっていた.グルコースの再負荷ののち,N-アセチルグルコサミン修飾はすぐに上昇し,ユビキチン修飾はやや遅れて蓄積がみられた.また,N-アセチルグルコサミン転移酵素OGTはグルコースの状態にかかわらずヒストンH2Bへの結合がみられたため,ヒストンH2BにおけるN-アセチルグルコサミン修飾の位置特異性にはおそらくOGTによるクロマチン認識が関係しているものと予想された.
おわりに
グルコースは細菌から高等真核生物にいたるまで,もっとも原初的な栄養素のひとつである.当然,グルコースはほとんどすべての細胞内プロセスに制限をくわえているものと予想され,クロマチン制御もその例外ではない.この研究における糖応答性のN-アセチルグルコサミン修飾とユビキチン修飾の新しいクロストークの発見はエピジェネティクス制御に新しい概念をもたらすと同時に,細胞が栄養を感知して遺伝子発現を誘導するしくみについて基礎的な理解を助けるものである.
また,ゲノムDNAがタンパク質のアミノ酸配列をコードしているのに対し,エピゲノム修飾は近傍の遺伝子の発現量を規定している.したがって,DNAの変異と同様に,エピゲノム修飾の破綻もまた細胞に大きな障害をもたらす結果となる.最近では,エピゲノム研究にもとづく診断,創薬,治療などさまざまな試みがなされており,ヒストンのアセチル化など一部の修飾を標的とした薬剤の開発も成果をあげてきた7).このような現状を鑑みれば,この研究の成果もまた,メタボリックシンドロームを標的としたエピゲノム診断あるいは医療などに役立てられていく可能性が期待できる.
文 献
- Bernstein, B. E., Meissner, A. & Lander, E. S.: The mammalian epigenome. Cell, 128, 669-681 (2007)[PubMed]
- Kouzarides, T.: Chromatin modifications and their function. Cell, 128, 693-705 (2007)[PubMed]
- Fujiki, R., Chikanishi, T., Hashiba, W. et al.: GlcNAcylation of a histone methyltransferase in retinoic-acid-induced granulopoiesis. Nature, 459, 455-459 (2009)[PubMed]
- Hart, G. W., Housley, M. P., Slawson, C.: Cycling of O-linked β-N-acetylglucosamine on nucleocytoplasmic proteins. Nature, 446, 1017-1022 (2007)[PubMed]
- Kim J., Guermah, M., McGinty, R. K. et al.: RAD6-mediated transcription-coupled H2B ubiquitylation directly stimulates H3K4 methylation in human cells. Cell, 137, 459-471 (2009)[PubMed]
- Plyte S. E., Hughes, K., Nikolakaki, E. et al.: Glycogen synthase kinase-3: functions in oncogenesis and development. Biochim. Biophys. Acta, 1114, 147-162 (1992)[PubMed]
- Mund, C. & Lyko, F.: Epigenetic cancer therapy: Proof of concept and remaining challenges. Bioessays, 32, 949-957 (2010)[PubMed]
著者プロフィール
略歴:2007年 東京大学農学生命科学研究科博士課程 修了,同年 科学技術振興機構ERATO加藤核内複合体プロジェクト 博士研究員を経て,2009年より東京大学分子細胞生物学研究所 助教,2011年より科学技術振興機構 さきがけ研究員を兼任.
研究テーマ:核における糖修飾を介するクロマチン制御機構の解明.
抱負:精製による新規因子の取得と質量分析計を使った同定に関する技術をさらに磨いていきたい.
加藤 茂明(Shigeaki Kato)
東京大学分子細胞生物学研究所 教授.
研究室URL:http://www.iam.u-tokyo.ac.jp/bnsikato/
© 2011 藤木亮次・加藤茂明 Licensed under CC 表示 2.1 日本