レシピエントに由来する非造血系の抗原提示細胞は急性の移植片対宿主病を誘導する
小山 幹子
(オーストラリアQueensland Institute of Medical Research,Bone Marrow Transplantation Laboratory)
email:小山幹子
DOI: 10.7875/first.author.2011.182
Recipient nonhematopoietic antigen-presenting cells are sufficient to induce lethal acute graft-versus-host disease.
Motoko Koyama, Rachel D. Kuns, Stuart D. Olver, Neil C. Raffelt, Yana A. Wilson, Alistair L. J. Don, Katie E. Lineburg, Melody Cheong, Renee J. Robb, Kate A. Markey, Antiopi Varelias, Bernard Malissen, Günter J. Hämmerling, Andrew D. Clouston, Christian R. Engwerda, Purnima Bhat, Kelli P. A. MacDonald, Geoffrey R. Hill
Nature Medicine, 18, 135-142 (2012)
アロ抗原が移植片対宿主病をひき起こすにいたるその抗原提示の経路は,いまだ明らかではない.レシピエントに由来するアロ抗原がプロセシングされペプチドとしてドナーあるいはレシピエントのMHCクラスIIを介して抗原提示される骨髄移植モデルを用い,どういった抗原提示細胞が急性の移植片対宿主病をひき起こすかを検討した.ドナーに由来する抗原提示細胞は潜在的には単独で致死的な急性の移植片対宿主病を誘導しうるが,レシピエントに由来する抗原提示細胞と比較するとその能力は1/100から1/1000でしかなかった.レシピエントに由来する抗原提示細胞のうち,造血系の抗原提示細胞は単独での移植片対宿主病の誘導能は限定的である一方,非造血系の抗原提示細胞はレシピエントに由来するすべて抗原提示細胞が正常な場合に匹敵する移植片対宿主病を単独でひき起こした.なおかつ,造血系の抗原提示細胞のうち一般にもっとも抗原提示能が高いとされる樹状細胞は,移植片対宿主病の誘導には必要なかった.これらの結果は,急性の移植片対宿主病を誘導するアロ抗原の提示は,移植まえの処置ののち残存するレシピエントに由来する造血系の抗原提示細胞,とくに樹状細胞によると考えられてきた現在のパラダイムに反するものであり,移植片対宿主病の予防および治療のターゲットとして,樹状細胞などひとつの抗原提示細胞の画分に焦点をあてるより,抗原提示そのものを視野に入れる必要のあることを示唆した.
移植片対宿主病(graft-versus-host disease:GVHD)は造血幹細胞の移植ののちの重要な合併症のひとつであり,移植関連死の原因ともなる.急性の移植片対宿主病は移植片に混入したドナーに由来する成熟T細胞によりひき起こされる1).このT細胞にはCD4陽性T細胞とCD8陽性T細胞とが含まれるが,移植片対宿主病の実験モデルではCD4陽性T細胞依存性の移植片対宿主病とCD8陽性T細胞依存性の移植片対宿主病とに分けて検証される.CD8陽性T細胞に依存性の急性の移植片対宿主病はレシピエントに由来する造血系の抗原提示細胞に存在するMHCクラスI(MHC:major histocompatibility complex,主要組織適合抗原複合体)による抗原提示を必要とし2),ドナーのもつ抗原提示細胞はこの反応を増強する3).その一方,CD4陽性T細胞に依存性の急性の移植片対宿主病に関してはいまだその全貌には不明点が多くある.レシピエントに由来する造血系の抗原提示細胞がCD4陽性T細胞依存性の急性の移植片対宿主病を誘導するという報告では,レシピエントとドナーとのMHC不適合モデルが用いられており,ドナーに由来するT細胞が提示される抗原を認識するよりMHC自体の形態的な相違に反応するため,HLA(ヒトのMHC)適合移植が主である臨床での移植を完全には反映していない可能性があり,また,レシピエントに由来する非造血系の抗原提示細胞の抗原提示能に言及されていない4).レシピエントに由来する抗原提示細胞およびドナーに由来する抗原提示細胞のいずれでもCD4陽性T細胞に依存性の移植片対宿主病を誘導できるという報告では,共刺激による慢性の移植片対宿主病の誘導の有無を評価しており,急性の移植片対宿主病での抗原提示を直接に評価したものではない5).また,抗原提示細胞の画分に関しては樹状細胞が重要と目されてきたが6-14),ほかの抗原提示細胞と競合するなかでのレシピエントに由来する樹状細胞の役割はこれまで直接には検証されていなかった.このように,ドナーに由来するCD4陽性T細胞がアロ抗原を提示され急性の移植片対宿主病をひき起こす機序は完全には解明されていない.この研究は,移植片対宿主病の予防および治療をみすえ,どういった細胞画分がどういった機序でアロ反応性のエフェクターT細胞を誘導して急性の移植片対宿主病をひき起こすかを明らかにすることを目的とした.
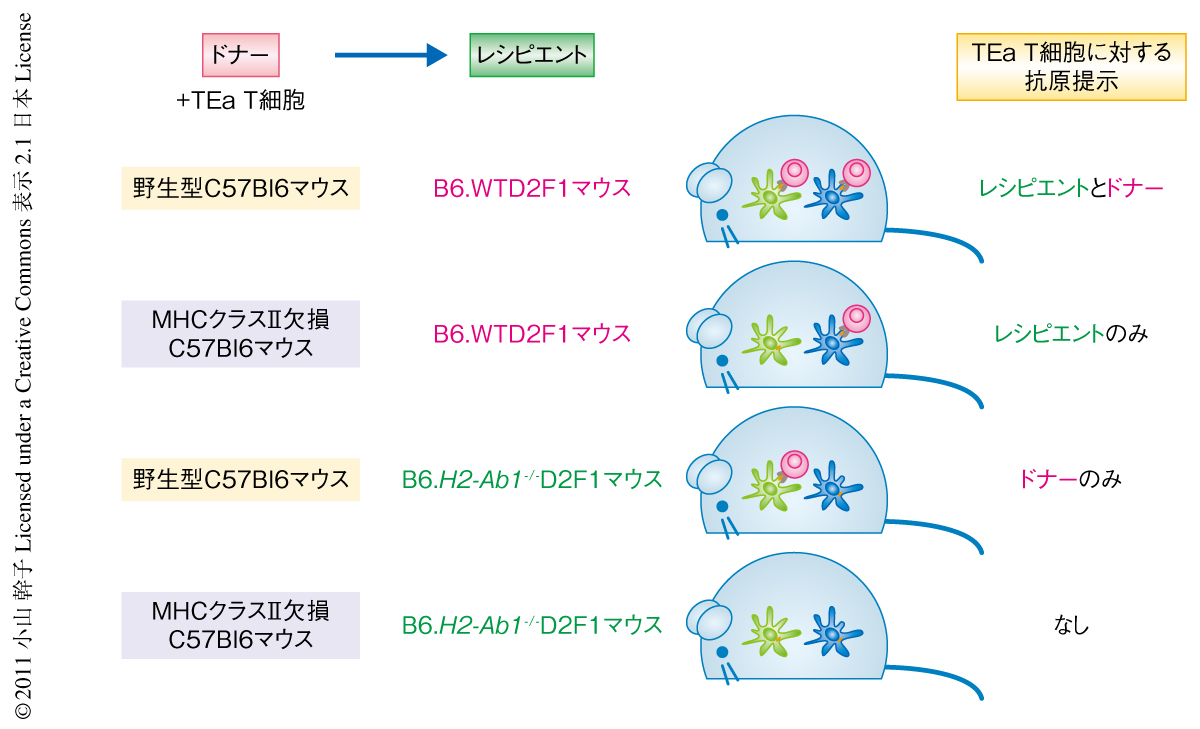
この研究では,抗原-MHC特異的なT細胞受容体を遺伝子導入したT細胞(TEa T細胞)を用いた.このTEa T細胞はC57Bl6マウスに由来するトランスジェニックマウスから得たもので,マウスMHCクラスIIのI-Abに提示されるI-Ed由来ペプチドに反応する.I-AやI-EはそれぞれMHCクラスII遺伝子座を表し,bやdはその多型性を示す.野生型C57Bl6マウスはI-AbをもちI-Edをもたない.DBA/2マウスはI-AbをもたないがI-Edをもつ.野生型C57Bl6マウスとDBA/2マウスを両親とするB6.WTD2F1マウスはI-AbとI-Edの両方をもつ.したがって,野生型C57Bl6マウスのT細胞を除去した骨髄細胞とTEa T細胞をB6.WTD2F1マウスに移植した場合,ドナーあるいはレシピエントのI-Abに提示されたI-Ed由来ペプチドに反応したTEa T細胞により移植片対宿主病がひき起こされる.しかし,骨髄のドナーがMHCクラスII欠損C57Bl6マウスであったり,あるいは,レシピエントがMHCクラスII欠損C57Bl6マウスとDBA/2マウスを両親とするB6.H2-Ab1-/-D2F1マウスであったりした場合には,I-Abの欠損のためドナーあるいはレシピエントによるTEa T細胞への抗原提示は行われない(図1).こうしてドナーとレシピエントとの抗原提示を比較すると,移植片対宿主病における生存率や反応したTEa T細胞の増殖において,レシピエントのほうがドナーよりもMHCクラスIIの抗原提示を介したアロ反応,移植片対宿主病をはるかに強く惹起することが示された.
では,レシピエントに由来するどの細胞画分が移植片対宿主病の誘導に必要なのか.これまでに発表されてきた論文からは,レシピエントに由来するB細胞やマクロファージ,ランゲルハンス細胞は移植片対宿主病の誘導に必要ないとされる9,11,13,14).こうした知見より樹状細胞に注目し,レシピエントに由来する樹状細胞の有無による移植片対宿主病の違いを検討した.マウスの樹状細胞はCD11cを発現している.CD11c遺伝子のプロモーター領域にジフテリア毒素受容体遺伝子とトリ卵白アルブミン遺伝子が組み込んだトランスジェニックマウス(DOGマウス)にジフテリア毒素を投与すると樹状細胞が除去される.ジフテリア毒素によるCD11c陽性の樹状細胞の除去はリンパ組織だけでなく移植片対宿主病の標的臓器においても起こり,トリ卵白アルブミン抗原(DOGマウスでは樹状細胞にのみ発現)に反応するOT-II細胞を移植したところジフテリア毒素を投与したマウスではOT-II細胞の増殖がないことからも,樹状細胞は機能的にも十分に除去されていることが示された.
こうした樹状細胞の除去の効率を確認したうえで,レシピエントに由来する樹状細胞の除去がレシピエントマウスに全身性に発現するアロ抗原に反応するドナーに由来するTEa T細胞に及ぼす影響を調べた(図2).その結果,樹状細胞の除去はTEa T細胞のより強い分裂と増殖,エフェクターT細胞の機能の獲得(インターフェロンγおよびTNFの発現)をひき起こした.樹状細胞の存在によりTEa T細胞は分裂しつつもアポトーシスにいたるが,樹状細胞の除去はこのアポトーシスをさまげることにより過剰なTEa T細胞の増殖および蓄積をまねくものと考えられた.また,移植片対宿主病の生存曲線において樹状細胞の除去により早期の死亡が増加した.
これらの結果は,樹状細胞が移植片対宿主病の誘導に強くかかわっていると示唆する過去の報告とは合致しなかった.そこで,この結果がT細胞受容体を遺伝子導入したT細胞にかぎられた特殊な反応でないことを確認するため,TEa T細胞の代わりにポリクローナルな野生型C57Bl6マウスのCD4陽性T細胞を移植した.その結果,TEa T細胞を移植した場合と同様の反応がみられ,さらに,生存率では強い差をもって樹状細胞の除去は移植片対宿主病を増強した.これらの結果より,レシピエントに由来する樹状細胞は移植片対宿主病の誘導には必要のないことが示された.
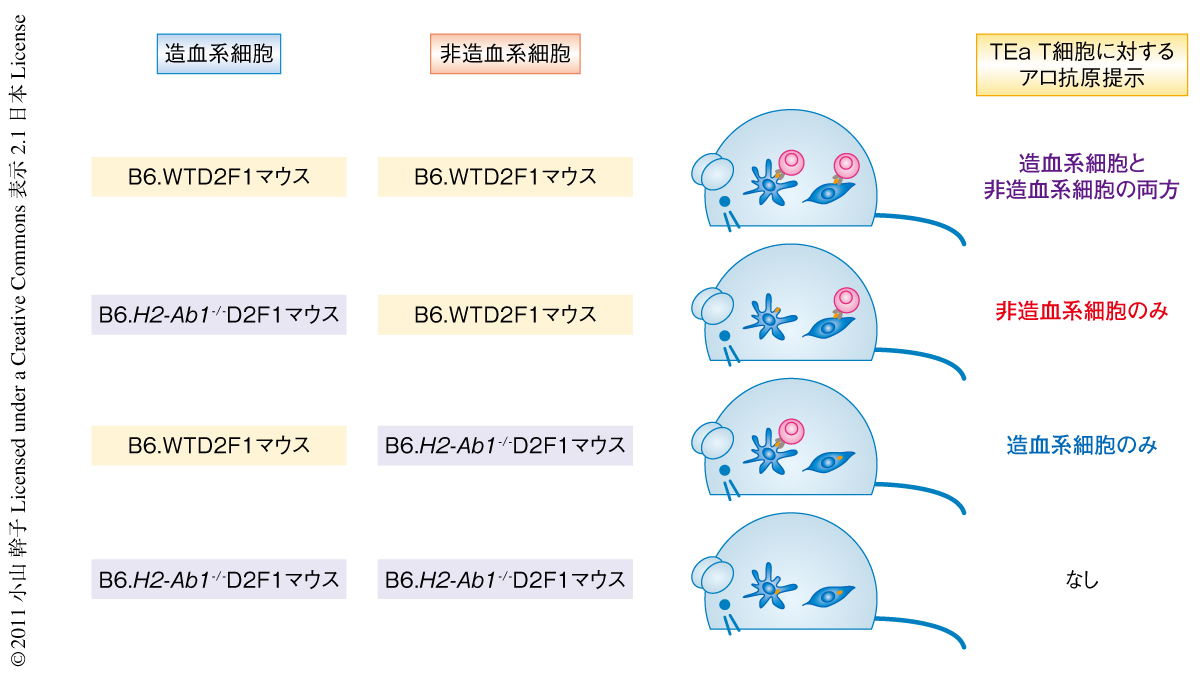
レシピエントのMHCクラスIIによる抗原提示が移植片対宿主病をひき起こす一方,レシピエントのB細胞,マクロファージ,ランゲルハンス細胞,そして,樹状細胞,すなわち,造血系の抗原提示細胞が移植片対宿主病の誘導に不必要であるなら,どういった細胞が必要なのか,非造血系の抗原提示細胞がMHCクラスIIを介して移植片対宿主病を誘導しているのか,という疑問が生じた.そこで,造血組織のキメラを用い,造血系の抗原提示細胞あるいは非造血系の抗原提示細胞の役割を調べた.野生型C57Bl6マウスとDBA/2マウスを両親とするB6.WTD2F1マウス,あるいは,MHCクラスII欠損C57Bl6マウスとDBA/2マウスを両親とするB6.H2-Ab1-/-D2F1マウスにT細胞を除去した骨髄を移植することで造血組織のみを再構築したキメラをつくり,3~4カ月ののち,MHCクラスII欠損C57Bl6マウスに由来する骨髄細胞とTEa T細胞を移植すると,TEa T細胞は造血系細胞あるいは非造血系細胞に発現するI-Abを介して抗原刺激をうけ活性化した(図3).非造血系細胞のみにより抗原提示されたマウスは,非造血系細胞と造血系細胞の両方から抗原提示をうけたマウスと同様に,早期に致死的な移植片対宿主病をひき起こした.しかし,造血系細胞のみにより抗原提示されたマウスでは62%が長期にわたり生存した.同様に,移植片対宿主病の標的臓器のひとつである腸管でのTEa T細胞の増殖,腸管の組織学的な病理,炎症性サイトカインであるTNFの血清中濃度のいずれにおいても,非造血系細胞のみが抗原提示できるマウスでは造血系の抗原提示細胞と非造血系の抗原提示細胞が正常なマウスと同様に重度の反応をひき起こしたのに対し,造血系細胞のみが抗原提示できるマウスでは軽度の反応しかひき起こさなかった.この結果は,キメラのなかで再構築されずに残存するランゲルハンス細胞に影響されたものではなかった.また,同様の結果がポリクローナルなCD4陽性T細胞を用いたMHC適合移植でも確認された.これらにより,レシピエントに由来する非造血系の抗原提示細胞は致死的な急性の移植片対宿主病を誘導するのに十分であることが示された.
では,MHCクラスIIを発現する非造血系の抗原提示細胞はどのように存在するのだろうか.定常状態においてさえ,移植片対宿主病の標的臓器の表面,とりわけ,腸管の繊毛にはMHCクラスIIを発現する多数の非造血系細胞が存在する.この細胞画分はリンパ組織では検出されなかった.また,これらの細胞はビメンチンやα平滑筋アクチンを発現し間葉系に起源をもつ細胞であることが示唆され,移植まえの処置である全身への放射線照射により抗原提示をサポートするCD40,CD80,CD86を発現した.しかしながら,ナイーブT細胞であるTEa T細胞はリンパ組織への指向性をもつはずであり,直接に標的臓器に侵入するとは考えにくかった.移植ののちの早期のリンパ組織の解析により,移植されたTEa T細胞は抗原提示の有無にかかわりなく活性化され,また,ナイーブT細胞の表現型を失いエフェクターメモリーT細胞あるいは直近に活性化されたT細胞の表現型を獲得することが示された.また,腸管に付属するリンパ組織であるパイエル板では,Th1への分化のレベルに抗原提示の有無により差がみられた.TEaが腸管へ侵入し増殖する早期に腸管の繊毛において,TEa T細胞と非造血系MHCクラスII発現細胞が細胞どうし接触する組織像も認められた.また,移植ののちの早期に,腸管の繊毛だけでなく上皮細胞にもMHCクラスIIの発現が認められた.こうした結果から,移植片に混入するナイーブT細胞はリンパ組織において抗原提示をうけずとも活性化されてメモリーT細胞となり標的臓器へ侵入し,標的臓器において抗原提示をうけ完全なエフェクターT細胞としての機能を獲得し組織の損傷をひき起こすという流れが示唆された.
抗原提示を行う細胞と経路はMHCクラスIとMHCクラスIIとでは異なるようであるが2,3),造血系の抗原提示細胞なしにMHCクラスIIを介して急性の移植片対宿主病がひき起こされるという結果は,樹状細胞など個々の造血系の抗原提示細胞の画分をターゲットとした移植片対宿主病の予防法および治療法の開発に再考を促すものとなるだろう.臨床では必ずしも前処置に全身への放射線照射を含まないことから,化学療法による前処置により非造血系の抗原提示細胞が活性化されるかどうかは検証の必要がある.
略歴:2009年 岡山大学大学院医歯学総合研究科 修了,同年よりオーストラリアQueensland Institute of Medical Research.
研究テーマ:移植免疫,造血幹細胞の移植.
© 2011 小山 幹子 Licensed under CC 表示 2.1 日本
(オーストラリアQueensland Institute of Medical Research,Bone Marrow Transplantation Laboratory)
email:小山幹子
DOI: 10.7875/first.author.2011.182
Recipient nonhematopoietic antigen-presenting cells are sufficient to induce lethal acute graft-versus-host disease.
Motoko Koyama, Rachel D. Kuns, Stuart D. Olver, Neil C. Raffelt, Yana A. Wilson, Alistair L. J. Don, Katie E. Lineburg, Melody Cheong, Renee J. Robb, Kate A. Markey, Antiopi Varelias, Bernard Malissen, Günter J. Hämmerling, Andrew D. Clouston, Christian R. Engwerda, Purnima Bhat, Kelli P. A. MacDonald, Geoffrey R. Hill
Nature Medicine, 18, 135-142 (2012)
要 約
アロ抗原が移植片対宿主病をひき起こすにいたるその抗原提示の経路は,いまだ明らかではない.レシピエントに由来するアロ抗原がプロセシングされペプチドとしてドナーあるいはレシピエントのMHCクラスIIを介して抗原提示される骨髄移植モデルを用い,どういった抗原提示細胞が急性の移植片対宿主病をひき起こすかを検討した.ドナーに由来する抗原提示細胞は潜在的には単独で致死的な急性の移植片対宿主病を誘導しうるが,レシピエントに由来する抗原提示細胞と比較するとその能力は1/100から1/1000でしかなかった.レシピエントに由来する抗原提示細胞のうち,造血系の抗原提示細胞は単独での移植片対宿主病の誘導能は限定的である一方,非造血系の抗原提示細胞はレシピエントに由来するすべて抗原提示細胞が正常な場合に匹敵する移植片対宿主病を単独でひき起こした.なおかつ,造血系の抗原提示細胞のうち一般にもっとも抗原提示能が高いとされる樹状細胞は,移植片対宿主病の誘導には必要なかった.これらの結果は,急性の移植片対宿主病を誘導するアロ抗原の提示は,移植まえの処置ののち残存するレシピエントに由来する造血系の抗原提示細胞,とくに樹状細胞によると考えられてきた現在のパラダイムに反するものであり,移植片対宿主病の予防および治療のターゲットとして,樹状細胞などひとつの抗原提示細胞の画分に焦点をあてるより,抗原提示そのものを視野に入れる必要のあることを示唆した.
はじめに
移植片対宿主病(graft-versus-host disease:GVHD)は造血幹細胞の移植ののちの重要な合併症のひとつであり,移植関連死の原因ともなる.急性の移植片対宿主病は移植片に混入したドナーに由来する成熟T細胞によりひき起こされる1).このT細胞にはCD4陽性T細胞とCD8陽性T細胞とが含まれるが,移植片対宿主病の実験モデルではCD4陽性T細胞依存性の移植片対宿主病とCD8陽性T細胞依存性の移植片対宿主病とに分けて検証される.CD8陽性T細胞に依存性の急性の移植片対宿主病はレシピエントに由来する造血系の抗原提示細胞に存在するMHCクラスI(MHC:major histocompatibility complex,主要組織適合抗原複合体)による抗原提示を必要とし2),ドナーのもつ抗原提示細胞はこの反応を増強する3).その一方,CD4陽性T細胞に依存性の急性の移植片対宿主病に関してはいまだその全貌には不明点が多くある.レシピエントに由来する造血系の抗原提示細胞がCD4陽性T細胞依存性の急性の移植片対宿主病を誘導するという報告では,レシピエントとドナーとのMHC不適合モデルが用いられており,ドナーに由来するT細胞が提示される抗原を認識するよりMHC自体の形態的な相違に反応するため,HLA(ヒトのMHC)適合移植が主である臨床での移植を完全には反映していない可能性があり,また,レシピエントに由来する非造血系の抗原提示細胞の抗原提示能に言及されていない4).レシピエントに由来する抗原提示細胞およびドナーに由来する抗原提示細胞のいずれでもCD4陽性T細胞に依存性の移植片対宿主病を誘導できるという報告では,共刺激による慢性の移植片対宿主病の誘導の有無を評価しており,急性の移植片対宿主病での抗原提示を直接に評価したものではない5).また,抗原提示細胞の画分に関しては樹状細胞が重要と目されてきたが6-14),ほかの抗原提示細胞と競合するなかでのレシピエントに由来する樹状細胞の役割はこれまで直接には検証されていなかった.このように,ドナーに由来するCD4陽性T細胞がアロ抗原を提示され急性の移植片対宿主病をひき起こす機序は完全には解明されていない.この研究は,移植片対宿主病の予防および治療をみすえ,どういった細胞画分がどういった機序でアロ反応性のエフェクターT細胞を誘導して急性の移植片対宿主病をひき起こすかを明らかにすることを目的とした.
1.レシピエントに由来する抗原提示細胞のほうがドナーに由来する抗原提示細胞よりも移植片対宿主病をはるかに強く惹起する
この研究では,抗原-MHC特異的なT細胞受容体を遺伝子導入したT細胞(TEa T細胞)を用いた.このTEa T細胞はC57Bl6マウスに由来するトランスジェニックマウスから得たもので,マウスMHCクラスIIのI-Abに提示されるI-Ed由来ペプチドに反応する.I-AやI-EはそれぞれMHCクラスII遺伝子座を表し,bやdはその多型性を示す.野生型C57Bl6マウスはI-AbをもちI-Edをもたない.DBA/2マウスはI-AbをもたないがI-Edをもつ.野生型C57Bl6マウスとDBA/2マウスを両親とするB6.WTD2F1マウスはI-AbとI-Edの両方をもつ.したがって,野生型C57Bl6マウスのT細胞を除去した骨髄細胞とTEa T細胞をB6.WTD2F1マウスに移植した場合,ドナーあるいはレシピエントのI-Abに提示されたI-Ed由来ペプチドに反応したTEa T細胞により移植片対宿主病がひき起こされる.しかし,骨髄のドナーがMHCクラスII欠損C57Bl6マウスであったり,あるいは,レシピエントがMHCクラスII欠損C57Bl6マウスとDBA/2マウスを両親とするB6.H2-Ab1-/-D2F1マウスであったりした場合には,I-Abの欠損のためドナーあるいはレシピエントによるTEa T細胞への抗原提示は行われない(図1).こうしてドナーとレシピエントとの抗原提示を比較すると,移植片対宿主病における生存率や反応したTEa T細胞の増殖において,レシピエントのほうがドナーよりもMHCクラスIIの抗原提示を介したアロ反応,移植片対宿主病をはるかに強く惹起することが示された.
2.レシピエントに由来する樹状細胞は移植片対宿主病の誘導には必要ない
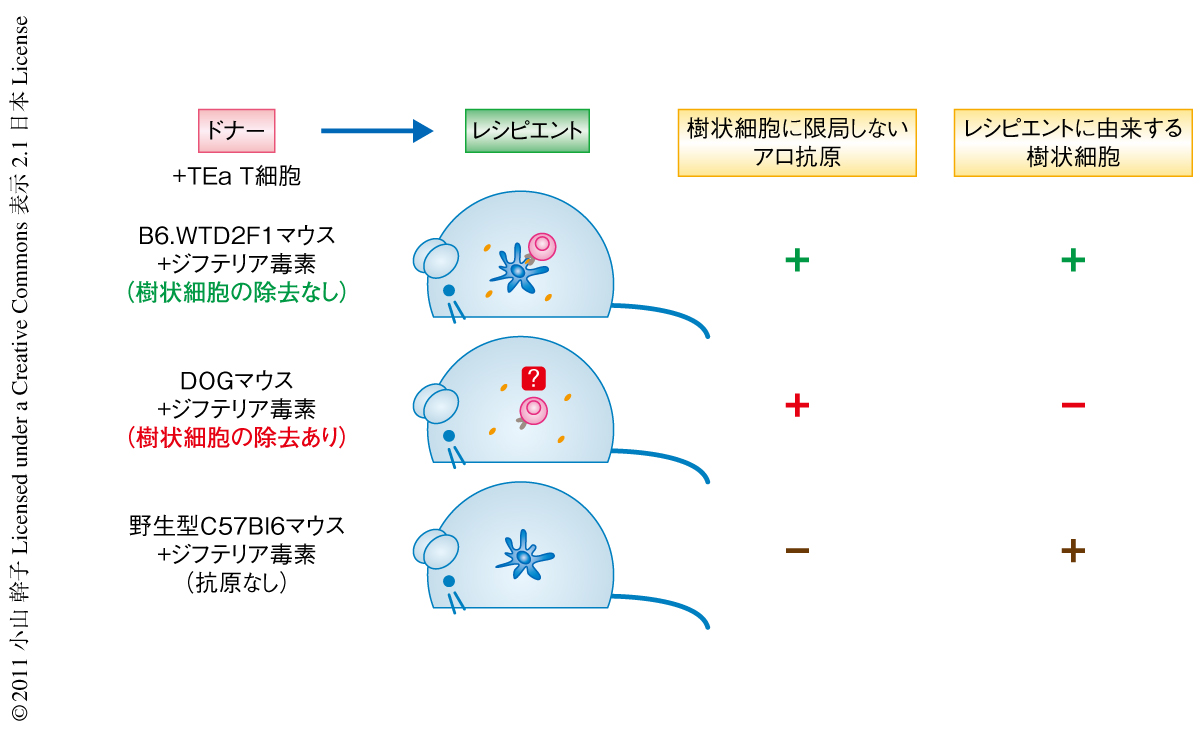
では,レシピエントに由来するどの細胞画分が移植片対宿主病の誘導に必要なのか.これまでに発表されてきた論文からは,レシピエントに由来するB細胞やマクロファージ,ランゲルハンス細胞は移植片対宿主病の誘導に必要ないとされる9,11,13,14).こうした知見より樹状細胞に注目し,レシピエントに由来する樹状細胞の有無による移植片対宿主病の違いを検討した.マウスの樹状細胞はCD11cを発現している.CD11c遺伝子のプロモーター領域にジフテリア毒素受容体遺伝子とトリ卵白アルブミン遺伝子が組み込んだトランスジェニックマウス(DOGマウス)にジフテリア毒素を投与すると樹状細胞が除去される.ジフテリア毒素によるCD11c陽性の樹状細胞の除去はリンパ組織だけでなく移植片対宿主病の標的臓器においても起こり,トリ卵白アルブミン抗原(DOGマウスでは樹状細胞にのみ発現)に反応するOT-II細胞を移植したところジフテリア毒素を投与したマウスではOT-II細胞の増殖がないことからも,樹状細胞は機能的にも十分に除去されていることが示された.
こうした樹状細胞の除去の効率を確認したうえで,レシピエントに由来する樹状細胞の除去がレシピエントマウスに全身性に発現するアロ抗原に反応するドナーに由来するTEa T細胞に及ぼす影響を調べた(図2).その結果,樹状細胞の除去はTEa T細胞のより強い分裂と増殖,エフェクターT細胞の機能の獲得(インターフェロンγおよびTNFの発現)をひき起こした.樹状細胞の存在によりTEa T細胞は分裂しつつもアポトーシスにいたるが,樹状細胞の除去はこのアポトーシスをさまげることにより過剰なTEa T細胞の増殖および蓄積をまねくものと考えられた.また,移植片対宿主病の生存曲線において樹状細胞の除去により早期の死亡が増加した.
これらの結果は,樹状細胞が移植片対宿主病の誘導に強くかかわっていると示唆する過去の報告とは合致しなかった.そこで,この結果がT細胞受容体を遺伝子導入したT細胞にかぎられた特殊な反応でないことを確認するため,TEa T細胞の代わりにポリクローナルな野生型C57Bl6マウスのCD4陽性T細胞を移植した.その結果,TEa T細胞を移植した場合と同様の反応がみられ,さらに,生存率では強い差をもって樹状細胞の除去は移植片対宿主病を増強した.これらの結果より,レシピエントに由来する樹状細胞は移植片対宿主病の誘導には必要のないことが示された.
3.レシピエントに由来する非造血系の抗原提示細胞は移植片対宿主病の誘導に十分である
レシピエントのMHCクラスIIによる抗原提示が移植片対宿主病をひき起こす一方,レシピエントのB細胞,マクロファージ,ランゲルハンス細胞,そして,樹状細胞,すなわち,造血系の抗原提示細胞が移植片対宿主病の誘導に不必要であるなら,どういった細胞が必要なのか,非造血系の抗原提示細胞がMHCクラスIIを介して移植片対宿主病を誘導しているのか,という疑問が生じた.そこで,造血組織のキメラを用い,造血系の抗原提示細胞あるいは非造血系の抗原提示細胞の役割を調べた.野生型C57Bl6マウスとDBA/2マウスを両親とするB6.WTD2F1マウス,あるいは,MHCクラスII欠損C57Bl6マウスとDBA/2マウスを両親とするB6.H2-Ab1-/-D2F1マウスにT細胞を除去した骨髄を移植することで造血組織のみを再構築したキメラをつくり,3~4カ月ののち,MHCクラスII欠損C57Bl6マウスに由来する骨髄細胞とTEa T細胞を移植すると,TEa T細胞は造血系細胞あるいは非造血系細胞に発現するI-Abを介して抗原刺激をうけ活性化した(図3).非造血系細胞のみにより抗原提示されたマウスは,非造血系細胞と造血系細胞の両方から抗原提示をうけたマウスと同様に,早期に致死的な移植片対宿主病をひき起こした.しかし,造血系細胞のみにより抗原提示されたマウスでは62%が長期にわたり生存した.同様に,移植片対宿主病の標的臓器のひとつである腸管でのTEa T細胞の増殖,腸管の組織学的な病理,炎症性サイトカインであるTNFの血清中濃度のいずれにおいても,非造血系細胞のみが抗原提示できるマウスでは造血系の抗原提示細胞と非造血系の抗原提示細胞が正常なマウスと同様に重度の反応をひき起こしたのに対し,造血系細胞のみが抗原提示できるマウスでは軽度の反応しかひき起こさなかった.この結果は,キメラのなかで再構築されずに残存するランゲルハンス細胞に影響されたものではなかった.また,同様の結果がポリクローナルなCD4陽性T細胞を用いたMHC適合移植でも確認された.これらにより,レシピエントに由来する非造血系の抗原提示細胞は致死的な急性の移植片対宿主病を誘導するのに十分であることが示された.
4.移植片に混入するナイーブT細胞は抗原提示をうけなくとも活性化される
では,MHCクラスIIを発現する非造血系の抗原提示細胞はどのように存在するのだろうか.定常状態においてさえ,移植片対宿主病の標的臓器の表面,とりわけ,腸管の繊毛にはMHCクラスIIを発現する多数の非造血系細胞が存在する.この細胞画分はリンパ組織では検出されなかった.また,これらの細胞はビメンチンやα平滑筋アクチンを発現し間葉系に起源をもつ細胞であることが示唆され,移植まえの処置である全身への放射線照射により抗原提示をサポートするCD40,CD80,CD86を発現した.しかしながら,ナイーブT細胞であるTEa T細胞はリンパ組織への指向性をもつはずであり,直接に標的臓器に侵入するとは考えにくかった.移植ののちの早期のリンパ組織の解析により,移植されたTEa T細胞は抗原提示の有無にかかわりなく活性化され,また,ナイーブT細胞の表現型を失いエフェクターメモリーT細胞あるいは直近に活性化されたT細胞の表現型を獲得することが示された.また,腸管に付属するリンパ組織であるパイエル板では,Th1への分化のレベルに抗原提示の有無により差がみられた.TEaが腸管へ侵入し増殖する早期に腸管の繊毛において,TEa T細胞と非造血系MHCクラスII発現細胞が細胞どうし接触する組織像も認められた.また,移植ののちの早期に,腸管の繊毛だけでなく上皮細胞にもMHCクラスIIの発現が認められた.こうした結果から,移植片に混入するナイーブT細胞はリンパ組織において抗原提示をうけずとも活性化されてメモリーT細胞となり標的臓器へ侵入し,標的臓器において抗原提示をうけ完全なエフェクターT細胞としての機能を獲得し組織の損傷をひき起こすという流れが示唆された.
おわりに
抗原提示を行う細胞と経路はMHCクラスIとMHCクラスIIとでは異なるようであるが2,3),造血系の抗原提示細胞なしにMHCクラスIIを介して急性の移植片対宿主病がひき起こされるという結果は,樹状細胞など個々の造血系の抗原提示細胞の画分をターゲットとした移植片対宿主病の予防法および治療法の開発に再考を促すものとなるだろう.臨床では必ずしも前処置に全身への放射線照射を含まないことから,化学療法による前処置により非造血系の抗原提示細胞が活性化されるかどうかは検証の必要がある.
文 献
- Shlomchik, W. D.: Graft-versus-host disease. Nat. Rev. Immunol., 7, 340-352 (2007)[PubMed]
- Shlomchik, W. D., Couzens, M. S., Tang, C. B. et al.: Prevention of graft versus host disease by inactivation of host antigen-presenting cells. Science, 285, 412-415 (1999)[PubMed]
- Matte, C. C., Liu, J., Cormier, J. et al.: Donor APCs are required for maximal GVHD but not for GVL. Nat. Med., 10, 987-992 (2004)[PubMed]
- Teshima, T., Ordemann, R., Reddy, P. et al.: Acute graft-versus-host disease does not require alloantigen expression on host epithelium. Nat. Med., 8, 575-581 (2002)[PubMed]
- Anderson, B. E., McNiff, J. M., Jain, D. et al.: Distinct roles for donor- and host-derived antigen-presenting cells and costimulatory molecules in murine chronic graft-versus-host disease: requirements depend on target organ. Blood, 105, 2227-2234 (2005)[PubMed]
- Zhang, Y., Louboutin, J. P., Zhu, J. et al.: Preterminal host dendritic cells in irradiated mice prime CD8+ T cell-mediated acute graft-versus-host disease. J. Clin. Invest., 109, 1335-1344 (2002)[PubMed]
- Duffner, U. A., Maeda, Y., Cooke, K. R. et al.: Host dendritic cells alone are sufficient to initiate acute graft-versus-host disease. J. Immunol., 172, 7393-7398 (2004)[PubMed]
- Koyama, M., Hashimoto, D., Aoyama, K. et al.: Plasmacytoid dendritic cells prime alloreactive T cells to mediate graft-versus-host disease as antigen-presenting cells. Blood, 113, 2088-2095 (2009)[PubMed]
- Li, H., Kaplan, D. H., Matte-Martone, C. et al.: Langerhans cells are not required for graft-versus-host disease. Blood, 117, 697-707 (2011)[PubMed]
- MacDonald, K. P., Kuns, R. D., Rowe, V. et al.: Effector and regulatory T-cell function is differentially regulated by RelB within antigen-presenting cells during GVHD. Blood, 109, 5049-5057(2007)[PubMed]
- MacDonald, K. P., Palmer, J. S., Cronau, S. et al.: An antibody against the colony-stimulating factor 1 receptor depletes the resident subset of monocytes and tissue- and tumor-associated macrophages but does not inhibit inflammation. Blood, 116, 3955-3963 (2010)[PubMed]
- Markey, K. A., Banovic, T., Kuns, R. D. et al.: Conventional dendritic cells are the critical donor APC presenting alloantigen after experimental bone marrow transplantation. Blood, 113, 5644-5649 (2009)[PubMed]
- Matte-Martone, C., Wang, X., Anderson, B. et al.: Recipient B cells are not required for graft-versus-host disease induction. Biol. Blood Marrow Transplant., 16, 1222-1230 (2010)[PubMed]
- Rowe, V., Banovic, T., MacDonald, K. P. et al.: Host B cells produce IL-10 following TBI and attenuate acute GVHD after allogeneic bone marrow transplantation. Blood, 108, 2485-2492 (2006)[PubMed]
著者プロフィール
略歴:2009年 岡山大学大学院医歯学総合研究科 修了,同年よりオーストラリアQueensland Institute of Medical Research.
研究テーマ:移植免疫,造血幹細胞の移植.
© 2011 小山 幹子 Licensed under CC 表示 2.1 日本