ヒトの脳の時空間トランスクリプトーム
川沢 今村 百可
(米国Yale大学School of Medicine,Department of Neurobiology)
email:川沢今村百可
DOI: 10.7875/first.author.2011.178
Spatio-temporal transcriptome of the human brain.
Hyo Jung Kang, Yuka Imamura Kawasawa, Feng Cheng, Ying Zhu, Xuming Xu, Mingfeng Li, André M. M. Sousa, Mihovil Pletikos, Kyle A. Meyer, Goran Sedmak, Tobias Guennel, Yurae Shin, Matthew B. Johnson, Željka Krsnik, Simone Mayer, Sofia Fertuzinhos, Sheila Umlauf, Steven N. Lisgo, Alexander Vortmeyer, Daniel R. Weinberger, Shrikant Mane, Thomas M. Hyde, Anita Huttner, Mark Reimers, Joel E. Kleinman, Nenad Šestan
Nature, 478, 483-489 (2011)
脳の正常な発達と機能は脳における遺伝子の発現を緻密に制御することにより確立されている.しかしながら,一生をつうじたヒトの脳の遺伝子発現パターンは詳細には解析されておらず,その全体像は不明であった.この研究では,発達期および成人の死後脳を多数取得し,脳ごとに多数の部位に分けてエキソンマイクロアレイによる時空間トランスクリプトームの解析を行い,さらにそれぞれの試料提供者の遺伝子多型の情報も関連づけて解析した.その結果,ヒトの脳では86%の遺伝子が発現し,このうちの90%は遺伝子全体の発現量あるいはエキソンごとの発現量が時空間特異的に変化していた.これらのうち大部分は胎児期の脳において発現量が変化しており,発達とともに脳の部位ごとの差異は減少していくことがわかった.また,時空間特異的な発現パターンをもつ遺伝子の存在が明らかになり,性別により遺伝子およびエキソンにおいて遺伝子発現に変化のあることも見い出された.さらに,さまざまな神経生物学的な特徴を共有する遺伝子,あるいは,精神神経疾患に関連した遺伝子に注目してそれぞれの発現プロファイルを同定し,遺伝子多型の及ぼす遺伝子発現の変化への影響についても解析した.この研究で得られたデータセットは一般に公開されており,ヒトの脳の発達における遺伝子制御の研究に多くの情報を提供するものと期待される.
ヒトの脳の発達は複雑かつ精緻に制御され,なおかつ,その成熟には非常に長い時間が必要である1).ヒトはその進化にともない高度な認知能力および運動能力を獲得したが,それとひき換えに,さまざまな精神神経疾患に罹患するというリスクを背負った2).また,性別による差は脳の発達と機能に重要な影響を及ぼすが,同時に,自閉症やうつ病といった病態の危険因子としても知られている3).このようなヒトの脳に特異的な発達,進化,また,精神神経疾患の発症機構を探るうえで,ヒトの脳の時空間トランスクリプトームの基本動態を知ることは非常に重要であるが,これまでの研究は,少数の試料しか解析していなかったり,かぎられた部位や年齢の脳にしか注目していなかったりした4,5).そこでこの研究では,これまでで最大規模のヒト脳トランスクリプトームのデータセットの構築をめざし,多数の正常死後脳の検体を取得し16の異なる脳部位での遺伝子発現を解析した.用いた検体は受精後40日から82歳にまで及ぶ合計57の正常死後脳で,男女および複数の人種をカバーし,データを取得した組織試料の総数は1340個にものぼった.
ヒトの脳の時空間トランスクリプトームの解析を行うにあたり,まず,時間分解能を設定した.過去の研究を参考に,ヒト脳の発達の程度にしたがい胎児期から老年期までを15の期間に分類し,それぞれの期間に複数の検体が含まれるよう設定した.くわえて,以下の解析では15の期間ごとの解析だけではなく,統計的な信頼度を上げる意味で,胎児期(受精後38週まで),若年期(出生後から20歳まで),および,成年期(20歳以降,老年期まで)の3つの大きな区分での比較,あるいは,4つから5つの期間ごとに一定幅をもたせて時間変化をおうスライディングウィンドウアルゴリズムを応用するなどして,さまざまな時間分解能での解析を行った.一方,空間分解能については,大脳新皮質より11の部位,そのほか5つの部位とあわせて合計で16の部位を,入手が可能であれば左右両方の脳半球より採取することで,最大で検体あたり32の部位を得ることで設定した.左右の試料は同じグループとして計算して16の部位ごとでの解析を行ったが,大脳新皮質をまとめて1グループとして合計で6つの部位について解析したり,あるいは,大脳新皮質の11の部位について解析を行ったりするなどして,さまざまな空間分解能でのトランスクリプトームの解析を行った.
また,ヒト死後脳を用いた解析においてもっとも大きな問題となる試料の品質管理についても徹底した吟味を行った.厳密な判断基準により,当初は94個収集した脳検体のうち37個を除外し,また,1414個の組織試料のうち74個を除外し,残り57個の脳検体および1340個の組織試料から実際のデータを得た.
トランスクリプトームの解析には米国Affymetrix社のHuman Exon Arrayを使用した.mRNA発現量を正確に定量できるとAffymetrix社が定義する17,565個の遺伝子(その大部分はタンパク質をコードする遺伝子)にしぼって解析したところ,そのうちの15,132個(86.1%)が脳において特定の部位または特定の時期に有意に発現していることを認めた.このうち70.9%が部位ごとに異なる発現パターンを示し,それよりさらに多い89.9%が時間ごとに異なる発現パターンを示した.また,その大部分は胎児期に変化しており,若年期,成年期と成長するにつれ変化の度合いは収束していくこともわかった.スプライシングインデックスを計算することによりエキソン単位での発現解析を行ったところ,さきの15,132個の脳における発現遺伝子のうち,90.2%が特定の部位あるいは特定の時期においてその発現量が有意に変化しており,これもまた,大部分が胎児期に変化し,若年期,成年期と成長するにつれ変化の度合いが減少していることがわかった.また,脳の部位ごとにみた場合,小脳に特異的に発現している遺伝子が561個存在したのに対し,視床背内側核では216個,線条体では137個,扁桃体では4個,海馬では48個,大脳新皮質では46個が認められるだけであり,小脳がもっとも突出した特異的な発現を示していた.
なお,トランスクリプトームの差異は,すべての遺伝子を対象として解析した場合,時空間における変動がもっとも大きく,性差や人種,個人差などの影響はそれに比べると微々たるものであることもわかった.
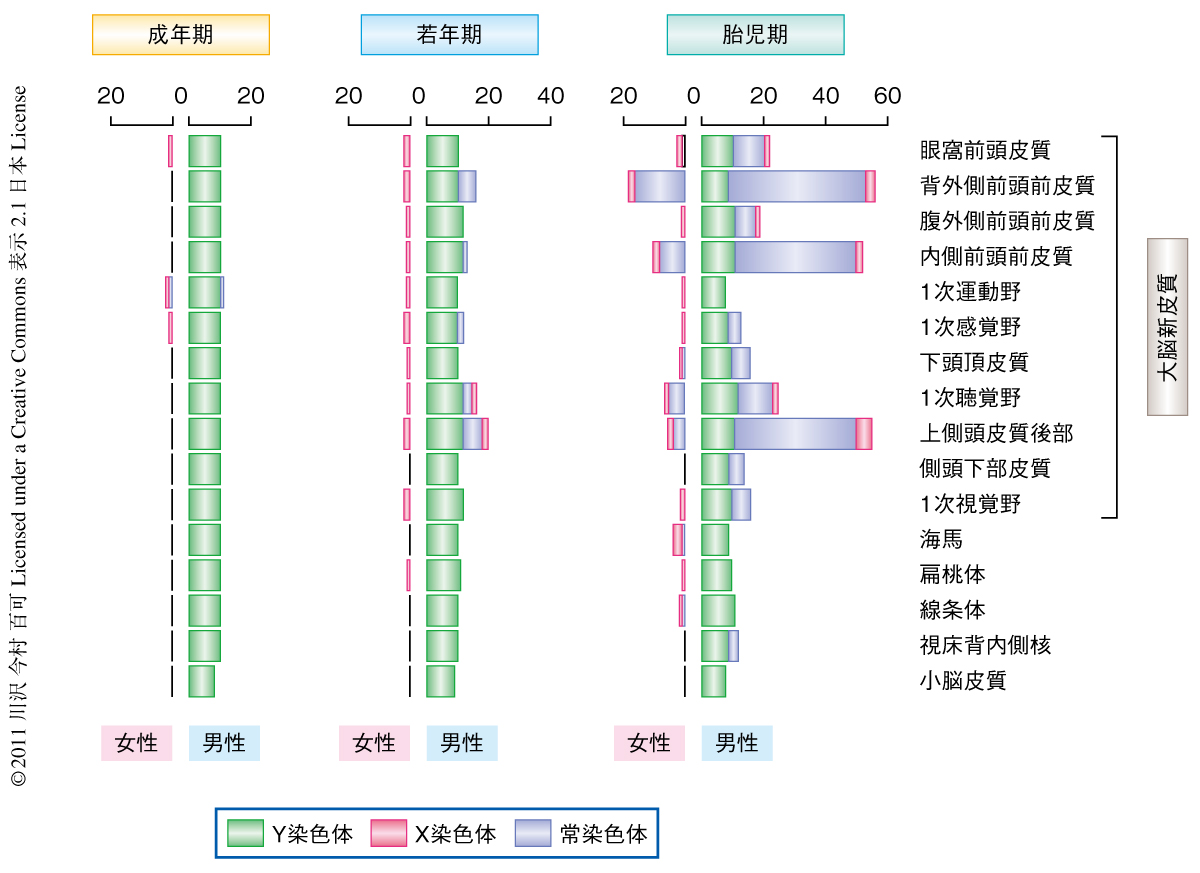
これまでの研究により発達期および成人の脳における遺伝子発現の性別による差が報告されてきた6).この研究では,スライディングウィンドウアルゴリズムとt検定を用いて脳の時空間における遺伝子発現の性別による差を検討した結果,159個の遺伝子が性差をもつことがわかった.このなかには過去に報告されていたものもあれば,新規に同定されたものもあった.このうち13個がY染色体に(当然の結果として,男性のみに発現が認められる),9個がX染色体に(女性に多く発現しているものもあれば,男性に多く認められるものもあった),137個が常染色体にコードされている遺伝子であった.これらのうち76.7%が男性において多く発現しており,また,胎児期における性差のほうが若年期や成年期より際立って大きいこともわかった.また,脳の部位によっても性差の程度は異なっており,遺伝子発現の男女における差は時間および空間により異なる制御をうけていることがわかった(図1).エキソン単位での発現解析を行ったところ,155個の遺伝子(うち,145個が常染色体性)が有意に性差を示した.発現に性差を示した遺伝子のうち,IGF2遺伝子は脳の大きさと認知能力の獲得,KCNH2遺伝子は統合失調症,また,NLGN4X遺伝子は自閉症およびX染色体性の認知機能の障害に関連していることが知られている.性によりこれら疾患の症状の出現時期や表現型に違いがあることが知られており,男女の脳における時空間特異的な遺伝子発現の制御の詳細を知ることは,これら疾患の発現機序の解明になんらかの示唆をあたえるものと思われる.
多次元のトランスクリプトームデータの解析を行う際に,そこから意味のある遺伝子をみつけだすことは容易ではない.さまざまな解析法が開発利用されているが,なかでも,加重遺伝子共発現ネットワーク解析法は,ある状態において発現制御がひとまとまりで行われている遺伝子セット(モジュール)を同定するのに適した方法である7).この加重遺伝子共発現ネットワーク解析法を用いることで29のモジュールを同定することに成功した.それらは時空間特異的な発現パターンをもっていたり,特定の生物学的な機能をもっていたりするものであった.なかでも,M8モジュールは胎児の初期に大脳新皮質と海馬において高い発現を示す遺伝子セットであり,それぞれの遺伝子のあいだで高い相互作用を示す遺伝子(ハブ遺伝子)のなかには,TBR1遺伝子,FEZF2遺伝子,FOXG1遺伝子,SATB2遺伝子,NEUROD6遺伝子,EMX1遺伝子といった,大脳新皮質や海馬での投射性ニューロンの発達に重要な役割をもつ転写因子をコードする遺伝子が含まれていた.また,M15モジュールはM8モジュールと相反する時間パターンを示す遺伝子セットであり,そのハブ遺伝子のなかには,うつ病に関連するGDA遺伝子や,統合失調症や情動障害に関連するNRGN遺伝子およびRGS4遺伝子が含まれていた.
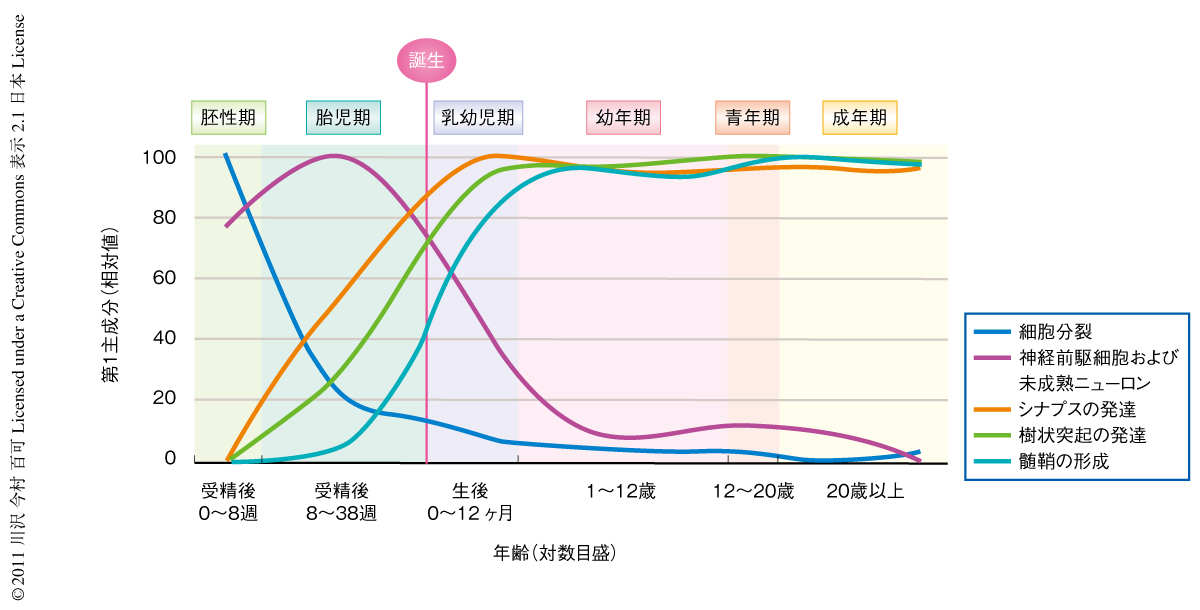
この研究で得られたデータを利用してさらにどのような解析ができるのか,その一例として,神経の発生や精神神経疾患に関連する遺伝子の動的かつ定量的な発現プロファイルを解析することにより,それらの生物学的な意味や分子機構を探るというアプローチを提案した.ここでは,細胞分裂に関連する遺伝子,神経前駆細胞および未分化ニューロンに発現している遺伝子,シナプスの発達に関連する遺伝子,樹状突起の発達に関連する遺伝子,髄鞘の形成に関連する遺伝子について,発現動態を対象とした主成分解析を行い,第1主成分の相対値を時間軸にそってプロットした(図2).なお,それぞれの遺伝子のリストは過去の文献などを参照に手作業で作成した.ここでは大脳新皮質のデータのみを示したが,この遺伝子発現プロファイルは脳の部位により異なるパターンを示す場合もあり,それぞれの部位の生物学的な意味と関連づけることができた.
また,精神神経疾患に関連する遺伝子についても同様の解析を行った.なかでも,その疾患責任遺伝子の解析が進んでいる自閉症と統合失調症について,さきと同様に過去の文献などから遺伝子のリストを作成し,そのおのおのについて時空間特異的な遺伝子発現プロファイルを作成した.この結果,発現パターンの類似した遺伝子を相関係数をもとにランキングすることにより,その生物学的な意味を議論することができた.
遺伝子発現の個人差に影響を及ぼす遺伝子多型の解析を行った.組織レベルや細胞レベルでの遺伝子発現の個人差は体質や疾患感受性と深くかかわっていることがわかってきている8).このような遺伝子発現に影響を及ぼすような遺伝子多型を発現QTL(QTL:quantitative trait locus,量的形質遺伝子座)とよぶが,そのなかでも,遺伝子の近傍の発現調節領域にある1塩基多型(SNP)について解析を行った.それぞれの試料提供者のSNPの情報は米国Illumina社の2.5 Million SNP Chipを用いて取得し,時空間特異的な遺伝子発現パターンと関連のあるものを抽出した.なお,この解析には通常は数百数千単位の試料数を必要とするが,試料提供者の数の少なさを脳を複数の部位に分けて解析することによりカバーし,また,結果を慎重に解釈することでデータの信頼度を上げるよう努力した.この結果,大脳新皮質で39個,海馬で8個,扁桃体で4個,線条体で2個,視床背内側核で6個,小脳皮質で5個の発現QTLが同定され,そのうちの一例(rs10785190およびGLIPR1L2遺伝子)については定量RT-PCR法によっても検証がなされた.GLIPR1L2遺伝子は機能未知だがヒトの脳における個人差の形成になんらかの役割を担っている可能性があり,今後の研究の発展が期待される.
ヒトの脳の発達と機能,および,さまざまな精神神経疾患の発症機序を理解するうえで,網羅的かつ信頼度の高い脳の遺伝子発現プロファイルを作成することは急務とされていた.Nature誌の同じ号に掲載された論文とともに9),この研究の成果は,受精ののち数週から80歳をこえる老年期までのヒトの一生をつうじた脳標本から膨大な遺伝子発現データベースを作成したというその規模,また,厳密なデータ品質管理による結果の信頼性において,過去のどの研究をも凌駕した.すべての情報はWebサイトより公開しており(http://www.humanbraintranscriptome.org),世界中の研究者にさらなるデータマイニングの機会を提供しているという特徴も強調したい.
また,この研究により,ヒトの脳の時空間トランスクリプトームは胎児期および出生直後にもっとも大きな変化をとげることがわかったが,この時期のヒト正常死後脳をよい状態を維持したまま取得することは非常にむずかしく10),このような大規模データベースの作成を困難なものにしてきた.筆者らの研究は,米国NIHの脳バンクおよびそのほかの協力機関の長年にわたる脳標本の収集の努力なくして遂行できなかったが,今後も試料数を増やす努力をつづけ,解析精度をさらに向上させるよう努める予定である.また,大規模並列RNA塩基配列解析によるより詳細なトランスクリプトーム解析や,1細胞レベルでの解析を行うことにより,より解像度の高いデータベースの作成をめざし,また,ヒト以外の霊長類の脳のトランスクリプトームの作成および比較を行うことにより,ヒトの脳の発達,進化,精神神経疾患の発症機序の解明といったさらなる研究の発展をめざしたい.
略歴:2001年 東京大学大学院医学系研究科 修了,同年 米国Texas大学Southwestern Medical Center at Dallas Postdoctoral Associate,2005年米国Yale大学School of Medicine Postdoctoral Associate,2008年 米国The Rothberg Institute for Childhood Diseasesを経て,2009年より米国Yale大学School of Medicine Associate Research Scientist.
研究テーマ:次世代シークエンサーによるヒトの脳の遺伝子発現の解析.
関心事:ヒトの脳,とくに,前頭前野の発達と進化,次世代シークエンシングの技術開発にも興味があります.
© 2011 川沢 今村 百可 Licensed under CC 表示 2.1 日本
(米国Yale大学School of Medicine,Department of Neurobiology)
email:川沢今村百可
DOI: 10.7875/first.author.2011.178
Spatio-temporal transcriptome of the human brain.
Hyo Jung Kang, Yuka Imamura Kawasawa, Feng Cheng, Ying Zhu, Xuming Xu, Mingfeng Li, André M. M. Sousa, Mihovil Pletikos, Kyle A. Meyer, Goran Sedmak, Tobias Guennel, Yurae Shin, Matthew B. Johnson, Željka Krsnik, Simone Mayer, Sofia Fertuzinhos, Sheila Umlauf, Steven N. Lisgo, Alexander Vortmeyer, Daniel R. Weinberger, Shrikant Mane, Thomas M. Hyde, Anita Huttner, Mark Reimers, Joel E. Kleinman, Nenad Šestan
Nature, 478, 483-489 (2011)
要 約
脳の正常な発達と機能は脳における遺伝子の発現を緻密に制御することにより確立されている.しかしながら,一生をつうじたヒトの脳の遺伝子発現パターンは詳細には解析されておらず,その全体像は不明であった.この研究では,発達期および成人の死後脳を多数取得し,脳ごとに多数の部位に分けてエキソンマイクロアレイによる時空間トランスクリプトームの解析を行い,さらにそれぞれの試料提供者の遺伝子多型の情報も関連づけて解析した.その結果,ヒトの脳では86%の遺伝子が発現し,このうちの90%は遺伝子全体の発現量あるいはエキソンごとの発現量が時空間特異的に変化していた.これらのうち大部分は胎児期の脳において発現量が変化しており,発達とともに脳の部位ごとの差異は減少していくことがわかった.また,時空間特異的な発現パターンをもつ遺伝子の存在が明らかになり,性別により遺伝子およびエキソンにおいて遺伝子発現に変化のあることも見い出された.さらに,さまざまな神経生物学的な特徴を共有する遺伝子,あるいは,精神神経疾患に関連した遺伝子に注目してそれぞれの発現プロファイルを同定し,遺伝子多型の及ぼす遺伝子発現の変化への影響についても解析した.この研究で得られたデータセットは一般に公開されており,ヒトの脳の発達における遺伝子制御の研究に多くの情報を提供するものと期待される.
はじめに
ヒトの脳の発達は複雑かつ精緻に制御され,なおかつ,その成熟には非常に長い時間が必要である1).ヒトはその進化にともない高度な認知能力および運動能力を獲得したが,それとひき換えに,さまざまな精神神経疾患に罹患するというリスクを背負った2).また,性別による差は脳の発達と機能に重要な影響を及ぼすが,同時に,自閉症やうつ病といった病態の危険因子としても知られている3).このようなヒトの脳に特異的な発達,進化,また,精神神経疾患の発症機構を探るうえで,ヒトの脳の時空間トランスクリプトームの基本動態を知ることは非常に重要であるが,これまでの研究は,少数の試料しか解析していなかったり,かぎられた部位や年齢の脳にしか注目していなかったりした4,5).そこでこの研究では,これまでで最大規模のヒト脳トランスクリプトームのデータセットの構築をめざし,多数の正常死後脳の検体を取得し16の異なる脳部位での遺伝子発現を解析した.用いた検体は受精後40日から82歳にまで及ぶ合計57の正常死後脳で,男女および複数の人種をカバーし,データを取得した組織試料の総数は1340個にものぼった.
1.研究計画,データの分解能,試料の品質管理
ヒトの脳の時空間トランスクリプトームの解析を行うにあたり,まず,時間分解能を設定した.過去の研究を参考に,ヒト脳の発達の程度にしたがい胎児期から老年期までを15の期間に分類し,それぞれの期間に複数の検体が含まれるよう設定した.くわえて,以下の解析では15の期間ごとの解析だけではなく,統計的な信頼度を上げる意味で,胎児期(受精後38週まで),若年期(出生後から20歳まで),および,成年期(20歳以降,老年期まで)の3つの大きな区分での比較,あるいは,4つから5つの期間ごとに一定幅をもたせて時間変化をおうスライディングウィンドウアルゴリズムを応用するなどして,さまざまな時間分解能での解析を行った.一方,空間分解能については,大脳新皮質より11の部位,そのほか5つの部位とあわせて合計で16の部位を,入手が可能であれば左右両方の脳半球より採取することで,最大で検体あたり32の部位を得ることで設定した.左右の試料は同じグループとして計算して16の部位ごとでの解析を行ったが,大脳新皮質をまとめて1グループとして合計で6つの部位について解析したり,あるいは,大脳新皮質の11の部位について解析を行ったりするなどして,さまざまな空間分解能でのトランスクリプトームの解析を行った.
また,ヒト死後脳を用いた解析においてもっとも大きな問題となる試料の品質管理についても徹底した吟味を行った.厳密な判断基準により,当初は94個収集した脳検体のうち37個を除外し,また,1414個の組織試料のうち74個を除外し,残り57個の脳検体および1340個の組織試料から実際のデータを得た.
2.時空間トランスクリプトームの全体像
トランスクリプトームの解析には米国Affymetrix社のHuman Exon Arrayを使用した.mRNA発現量を正確に定量できるとAffymetrix社が定義する17,565個の遺伝子(その大部分はタンパク質をコードする遺伝子)にしぼって解析したところ,そのうちの15,132個(86.1%)が脳において特定の部位または特定の時期に有意に発現していることを認めた.このうち70.9%が部位ごとに異なる発現パターンを示し,それよりさらに多い89.9%が時間ごとに異なる発現パターンを示した.また,その大部分は胎児期に変化しており,若年期,成年期と成長するにつれ変化の度合いは収束していくこともわかった.スプライシングインデックスを計算することによりエキソン単位での発現解析を行ったところ,さきの15,132個の脳における発現遺伝子のうち,90.2%が特定の部位あるいは特定の時期においてその発現量が有意に変化しており,これもまた,大部分が胎児期に変化し,若年期,成年期と成長するにつれ変化の度合いが減少していることがわかった.また,脳の部位ごとにみた場合,小脳に特異的に発現している遺伝子が561個存在したのに対し,視床背内側核では216個,線条体では137個,扁桃体では4個,海馬では48個,大脳新皮質では46個が認められるだけであり,小脳がもっとも突出した特異的な発現を示していた.
なお,トランスクリプトームの差異は,すべての遺伝子を対象として解析した場合,時空間における変動がもっとも大きく,性差や人種,個人差などの影響はそれに比べると微々たるものであることもわかった.
3.遺伝子発現における性別による差
これまでの研究により発達期および成人の脳における遺伝子発現の性別による差が報告されてきた6).この研究では,スライディングウィンドウアルゴリズムとt検定を用いて脳の時空間における遺伝子発現の性別による差を検討した結果,159個の遺伝子が性差をもつことがわかった.このなかには過去に報告されていたものもあれば,新規に同定されたものもあった.このうち13個がY染色体に(当然の結果として,男性のみに発現が認められる),9個がX染色体に(女性に多く発現しているものもあれば,男性に多く認められるものもあった),137個が常染色体にコードされている遺伝子であった.これらのうち76.7%が男性において多く発現しており,また,胎児期における性差のほうが若年期や成年期より際立って大きいこともわかった.また,脳の部位によっても性差の程度は異なっており,遺伝子発現の男女における差は時間および空間により異なる制御をうけていることがわかった(図1).エキソン単位での発現解析を行ったところ,155個の遺伝子(うち,145個が常染色体性)が有意に性差を示した.発現に性差を示した遺伝子のうち,IGF2遺伝子は脳の大きさと認知能力の獲得,KCNH2遺伝子は統合失調症,また,NLGN4X遺伝子は自閉症およびX染色体性の認知機能の障害に関連していることが知られている.性によりこれら疾患の症状の出現時期や表現型に違いがあることが知られており,男女の脳における時空間特異的な遺伝子発現の制御の詳細を知ることは,これら疾患の発現機序の解明になんらかの示唆をあたえるものと思われる.
4.時空間特異的に発現制御されている遺伝子
多次元のトランスクリプトームデータの解析を行う際に,そこから意味のある遺伝子をみつけだすことは容易ではない.さまざまな解析法が開発利用されているが,なかでも,加重遺伝子共発現ネットワーク解析法は,ある状態において発現制御がひとまとまりで行われている遺伝子セット(モジュール)を同定するのに適した方法である7).この加重遺伝子共発現ネットワーク解析法を用いることで29のモジュールを同定することに成功した.それらは時空間特異的な発現パターンをもっていたり,特定の生物学的な機能をもっていたりするものであった.なかでも,M8モジュールは胎児の初期に大脳新皮質と海馬において高い発現を示す遺伝子セットであり,それぞれの遺伝子のあいだで高い相互作用を示す遺伝子(ハブ遺伝子)のなかには,TBR1遺伝子,FEZF2遺伝子,FOXG1遺伝子,SATB2遺伝子,NEUROD6遺伝子,EMX1遺伝子といった,大脳新皮質や海馬での投射性ニューロンの発達に重要な役割をもつ転写因子をコードする遺伝子が含まれていた.また,M15モジュールはM8モジュールと相反する時間パターンを示す遺伝子セットであり,そのハブ遺伝子のなかには,うつ病に関連するGDA遺伝子や,統合失調症や情動障害に関連するNRGN遺伝子およびRGS4遺伝子が含まれていた.
5.発達期の脳における遺伝子発現プロファイル
この研究で得られたデータを利用してさらにどのような解析ができるのか,その一例として,神経の発生や精神神経疾患に関連する遺伝子の動的かつ定量的な発現プロファイルを解析することにより,それらの生物学的な意味や分子機構を探るというアプローチを提案した.ここでは,細胞分裂に関連する遺伝子,神経前駆細胞および未分化ニューロンに発現している遺伝子,シナプスの発達に関連する遺伝子,樹状突起の発達に関連する遺伝子,髄鞘の形成に関連する遺伝子について,発現動態を対象とした主成分解析を行い,第1主成分の相対値を時間軸にそってプロットした(図2).なお,それぞれの遺伝子のリストは過去の文献などを参照に手作業で作成した.ここでは大脳新皮質のデータのみを示したが,この遺伝子発現プロファイルは脳の部位により異なるパターンを示す場合もあり,それぞれの部位の生物学的な意味と関連づけることができた.
また,精神神経疾患に関連する遺伝子についても同様の解析を行った.なかでも,その疾患責任遺伝子の解析が進んでいる自閉症と統合失調症について,さきと同様に過去の文献などから遺伝子のリストを作成し,そのおのおのについて時空間特異的な遺伝子発現プロファイルを作成した.この結果,発現パターンの類似した遺伝子を相関係数をもとにランキングすることにより,その生物学的な意味を議論することができた.
6.発現QTL
遺伝子発現の個人差に影響を及ぼす遺伝子多型の解析を行った.組織レベルや細胞レベルでの遺伝子発現の個人差は体質や疾患感受性と深くかかわっていることがわかってきている8).このような遺伝子発現に影響を及ぼすような遺伝子多型を発現QTL(QTL:quantitative trait locus,量的形質遺伝子座)とよぶが,そのなかでも,遺伝子の近傍の発現調節領域にある1塩基多型(SNP)について解析を行った.それぞれの試料提供者のSNPの情報は米国Illumina社の2.5 Million SNP Chipを用いて取得し,時空間特異的な遺伝子発現パターンと関連のあるものを抽出した.なお,この解析には通常は数百数千単位の試料数を必要とするが,試料提供者の数の少なさを脳を複数の部位に分けて解析することによりカバーし,また,結果を慎重に解釈することでデータの信頼度を上げるよう努力した.この結果,大脳新皮質で39個,海馬で8個,扁桃体で4個,線条体で2個,視床背内側核で6個,小脳皮質で5個の発現QTLが同定され,そのうちの一例(rs10785190およびGLIPR1L2遺伝子)については定量RT-PCR法によっても検証がなされた.GLIPR1L2遺伝子は機能未知だがヒトの脳における個人差の形成になんらかの役割を担っている可能性があり,今後の研究の発展が期待される.
おわりに
ヒトの脳の発達と機能,および,さまざまな精神神経疾患の発症機序を理解するうえで,網羅的かつ信頼度の高い脳の遺伝子発現プロファイルを作成することは急務とされていた.Nature誌の同じ号に掲載された論文とともに9),この研究の成果は,受精ののち数週から80歳をこえる老年期までのヒトの一生をつうじた脳標本から膨大な遺伝子発現データベースを作成したというその規模,また,厳密なデータ品質管理による結果の信頼性において,過去のどの研究をも凌駕した.すべての情報はWebサイトより公開しており(http://www.humanbraintranscriptome.org),世界中の研究者にさらなるデータマイニングの機会を提供しているという特徴も強調したい.
また,この研究により,ヒトの脳の時空間トランスクリプトームは胎児期および出生直後にもっとも大きな変化をとげることがわかったが,この時期のヒト正常死後脳をよい状態を維持したまま取得することは非常にむずかしく10),このような大規模データベースの作成を困難なものにしてきた.筆者らの研究は,米国NIHの脳バンクおよびそのほかの協力機関の長年にわたる脳標本の収集の努力なくして遂行できなかったが,今後も試料数を増やす努力をつづけ,解析精度をさらに向上させるよう努める予定である.また,大規模並列RNA塩基配列解析によるより詳細なトランスクリプトーム解析や,1細胞レベルでの解析を行うことにより,より解像度の高いデータベースの作成をめざし,また,ヒト以外の霊長類の脳のトランスクリプトームの作成および比較を行うことにより,ヒトの脳の発達,進化,精神神経疾患の発症機序の解明といったさらなる研究の発展をめざしたい.
文 献
- Kostovic, I. & Judas, M.: Prolonged coexistence of transient and permanent circuitry lements in the developing cerebral cortex of fetuses and preterm infants. Dev. Med. Child Neurol., 48, 388-393 (2006)[PubMed]
- Rubenstein, J. L.: Annual research review: development of the cerebral cortex: implications for neurodevelopmental disorders. J. Child Psychol. Psychiatry, 52, 339-355 (2011)[PubMed]
- Jamain, S., Quach, H., Betancur, C. et al.: Mutations of the X-linked genes encoding neuroligins NLGN3 and NLGN4 are associated with autism. Nat. Genet., 34, 27-29 (2003)[PubMed]
- Abrahams, B., Tentler, D., Perederiy, J. V. et al.: Genome-wide analyses of human perisylvian cerebral cortical patterning. Proc. Natl. Acad. Sci. USA, 104, 17849-17854 (2007)[PubMed]
- Johnson, M., Kawasawa, Y. I., Mason, C. E. et al.: Functional and evolutionary insights into human brain development through global transcriptome analysis. Neuron, 62, 494-509 (2009)[PubMed]
- Vawter, M., Evans, S., Choudary, P. et al.: Gender-specific gene expression in post-mortem human brain: localization to sex chromosomes. Neuropsychopharmacology, 29, 373-384 (2004)[PubMed]
- Zhang, B. & Horvath, S.: A general framework for weighted gene co-expression network analysis. Stat. Appl. Genet. Mol. Biol., 4, 17 (2005)[PubMed]
- Stranger, B. E., Nica, A. C., Forrest, M. S. et al.: Population genomics of human gene expression. Nat. Genet., 39, 1217-1224 (2007)[PubMed]
- Colantuoni, C., Lipska, B. K., Ye, T. et al.: Temporal dynamics and genetic control of transcription in the human prefrontal cortex. Nature, 478, 519-523 (2011)[PubMed]
- Abbott, A.: Tissue-bank shortage: brain child. Nature, 478, 442 (2011)[PubMed]
著者プロフィール
略歴:2001年 東京大学大学院医学系研究科 修了,同年 米国Texas大学Southwestern Medical Center at Dallas Postdoctoral Associate,2005年米国Yale大学School of Medicine Postdoctoral Associate,2008年 米国The Rothberg Institute for Childhood Diseasesを経て,2009年より米国Yale大学School of Medicine Associate Research Scientist.
研究テーマ:次世代シークエンサーによるヒトの脳の遺伝子発現の解析.
関心事:ヒトの脳,とくに,前頭前野の発達と進化,次世代シークエンシングの技術開発にも興味があります.
© 2011 川沢 今村 百可 Licensed under CC 表示 2.1 日本