オートファジーに機能するユビキチン活性化酵素Atg7の構造とそのユニークなAtg8活性化の機構
野田展生1・稲垣冬彦2
(1微生物化学研究会微生物化学研究所 分子構造解析部,2北海道大学大学院先端生命科学研究院 次世代ポストゲノム研究センター)
email:野田展生,稲垣冬彦
DOI: 10.7875/first.author.2011.176
Structural basis of Atg8 activation by a homo-dimeric E1, Atg7.
Nobuo N. Noda, Kenji Satoo, Yuko Fujioka, Hiroyuki Kumeta, Kenji Ogura, Hitoshi Nakatogawa, Yoshinori Ohsumi, Fuyuhiko Inagaki
Molecular Cell, 44, 462-475 (2011)
Atg7は2つのユビキチン様タンパク質Atg8およびAtg12を活性化するユビキチン活性化酵素であり,オートファジーにおいて重要な役割を担う.今回,筆者らは,Atg7のほぼ全長の結晶構造,Atg7のC末端ドメインとAtg8との複合体の結晶構造,さらに,Atg7のC末端側の領域とAtg8との複合体のNMR構造を決定した.Atg7はN末端側のAtg3の認識にかかわるドメインとC末端側のアデニル化ドメインとが短いリンカーでつながれた構造をとり,アデニル化ドメインを介してホモ二量体を形成していた.Atg8との複合体の構造解析および生化学的な解析の結果,Atg7はアデニル化ドメインのさらにC末端側にある固有の領域でAtg8をとらえ,つづいてアデニル化ドメインに受け渡すことでAtg8の活性化を行っていること,活性化されたAtg8は自らが結合しているAtg7分子とは別のAtg7分子に結合したAtg3へ受け渡されることが明らかになった.
オートファジーは真核生物において保存された細胞における主要な分解経路であり,タンパク質からオルガネラ,細胞に侵入した細菌にいたるまで,さまざまな対象をオートファゴソームとよばれる二重膜の構造体に隔離し,リソソームあるいは液胞へと輸送することでその分解を行う.この過程には多くのAtgタンパク質が関与しており,とくに,2つのユビキチン様結合系であるAtg8結合系およびAtg12結合系が重要なはたらきを担う1,2).Atg7はこの2つの結合系において共通して機能するユビキチン活性化酵素であり,ATPを使いAtg8およびAtg12のアデニル化反応を行ったのち,自らのもつ触媒システイン残基であるCys507を介してそれぞれのC末端にあるグリシン残基とチオエステル結合を形成したのち,それぞれに特異的なユビキチン結合酵素であるAtg3およびAtg10のもつ触媒システイン残基へと受け渡す.最終的に,Atg8はリン脂質であるホスファチジルエタノールアミンと,Atg12はAtg5と共有結合し,オートファゴソームの形成にはたらく3,4).ユビキチンやSUMO,NEDD8などに対する一般的なユビキチン活性化酵素に関してはこれまで詳細な構造生物学的な研究が行われ共通した特徴が明らかになっている5).これら一般的なユビキチン活性化酵素はヘテロ二量体もしくは単量体として機能し,以下の4つのドメイン,すなわち,1)活性のあるアデニル化ドメイン,2)活性のないアデニル化ドメイン,3)ユビキチン結合酵素との結合にかかわるユビキチンフォールドドメイン,4)触媒システインドメイン,からなり,ATP結合部位および触媒システイン残基を1つずつもつ.Atg7は一般的なユビキチン活性化酵素とはアデニル化ドメインのみで配列相同性を示し6),さらに,ホモ二量体として機能することから7),顕著に異なる立体構造をもつことが示唆されていた8).筆者らは,Atg7のほぼ全長の結晶構造と,Atg7のC末端ドメインとAtg8との複合体の結晶構造,さらに,Atg7のC末端側の領域とAtg8との複合体のNMR構造を決定し,そのユニークな立体構造,および,ほかのユビキチン活性化酵素とは顕著に異なるAtg8活性化の機構を明らかにした.
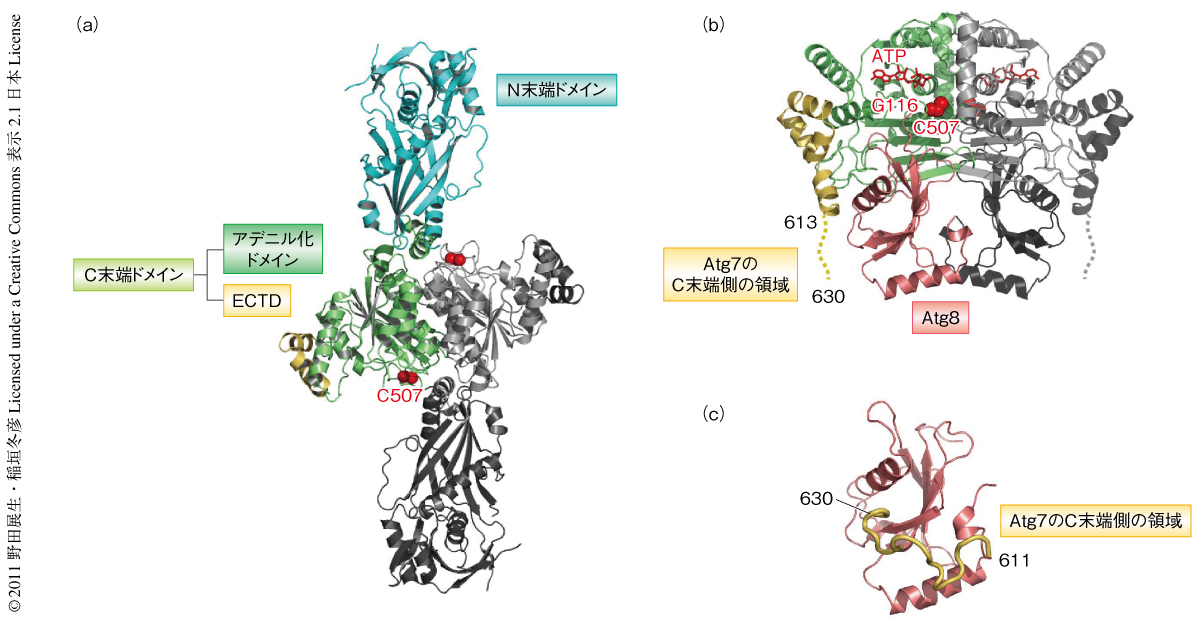
Atg7は全長630アミノ酸残基からなるが,C末端の35残基あるいは17残基を欠失させることで結晶化し,Znの異常分散を利用した単波長異常分散法によりその結晶構造を決定した(PDB ID:3VH1,PDB ID:3VH2).Atg7はN末端側の約半分からなるN末端ドメイン(N-terminal domain:NTD)とC末端側の約半分からなるC末端ドメイン(C-terminal domain:CTD)の2つのドメインが短いリンカー領域で結ばれた構造をもっていた(図1a).N末端ドメインはほかのユビキチン活性化酵素には認められず,また,構造比較でも低い構造類似性のものしか認められなかった.C末端ドメインはほかのユビキチン活性化酵素と類似した構造をもつアデニル化ドメインと,そのさらにC末端側にあるAtg7に固有の領域であるextreme C-terminal domain(ECTD)からなっていた.触媒システイン残基であるCys507はアデニル化ドメインがもつループ構造のひとつであるクロスオーバーループに存在し,一般的なユビキチン活性化酵素にみられるような触媒システインドメインは存在しなかった.Atg7は結晶においてアデニル化ドメイン領域を介しホモ二量体を形成しており,結果として,2つのATP結合部位と2つの触媒システイン残基をもっていた.Atg7は一般的なユビキチン活性化酵素においてユビキチン結合酵素との結合を担うユビキチンフォールドドメインを欠いていることから,別の領域でユビキチン結合酵素であるAtg3を認識する必要がある.変異体タンパク質を用いた結合実験により,Atg7に固有のN末端ドメインがAtg3との結合を担うことが明らかになった.N末端ドメインの表面には高度に塩基性残基が集合した領域が保存されているが,Atg7はこの塩基性の面を介しAtg3と直接に結合していた.一方,Atg8の認識はAtg7のC末端ドメインが担っており,C末端ドメインのみでAtg8とチオエステル結合を形成できた.
Atg8との複合体の結晶化はAtg7のC末端ドメインを用いて行い,Atg7のC末端ドメインとAtg8との複合体(PDB ID:3VH3),および,それにATPの結合した三者複合体(PDB ID:3VH4)の結晶構造が分子置換法により決定された.Atg7のC末端ドメインは全長Atg7の結晶構造と類似の様式でホモ二量体を形成し,Atg8およびATPは2分子ずつ結合していた(図1b).その相互作用の様式は既知のユビキチン活性化酵素とその基質であるユビキチン様タンパク質およびATPとのあいだでみられたものと類似していた.Atg7のクロスオーバーループはAtg8の非存在下ではAtg8結合部位の付近に結合していたが,Atg8との複合体の結晶構造では大規模な構造変化を起こしAtg8のユビキチン骨格部分を取り囲むような構造をとっていた.Atg8のGly116のカルボキシル酸素原子はATPのα位のリン原子から2.8Åの位置にありアデニル化反応を起こすのに適した配置と考えられたが,結晶においてアデニル化は進行していなかった.Atg8のC末端領域はクロスオーバーループとアデニル化ドメインとのあいだにはさまれており,クロスオーバーループのCys507はAtg8のGly116の上方,約14Åに位置した.この距離はチオエステル結合を形成するには遠すぎるが,クロスオーバーループが構造変化を起こすことによりCys507はAtg8のGly116の近傍に十分に近づくことができると推定された.Atg7のC末端ドメインとAtg8とのあいだには多くの疎水性相互作用および親水性相互作用が認められ,それらにかかわる残基への変異の導入によりin vitroにおけるAtg7とAtg8とのあいだのチオエステル結合の形成反応は顕著に阻害されたが,一方で,これらの変異導入はAtg7とAtg8とのあいだの親和性にはほとんど影響しなかった.
不思議なことに,Atg7のC末端の13残基(618~630)は,複合体の結晶構造においては電子密度が認められずAtg8には結合していなかったが,この13残基を欠失させるとAtg7とAtg8とのあいだの親和性はほぼ完全に失われ,チオエステル結合の形成反応も完全に阻害された.この結果は,この領域が出芽酵母においてAtg8とホスファチジルエタノールアミンとの結合体の形成およびオートファジー活性に重要であるとの報告と一致した7).そこで,Atg7のC末端側の領域とAtg8との溶液における相互作用をNMRを用いて調べた.Atg7のC末端の30残基(601~630)に対応するペプチドとAtg8との複合体のNMR構造を決定した結果(PDB ID:2LI5),Atg7のC末端の13残基(618~630)はAtg8のもつAtg8ファミリー相互作用モチーフ(Atg8-family interacting motif:AIM)との結合領域に結合し9),多数の疎水性相互作用およびイオン性相互作用を形成していた(図1c).その相互作用の様式は典型的なAtg8とAtg8ファミリー相互作用モチーフとのあいだの相互作用とは異なるものであった10).これらの相互作用を破壊するような変異の導入によりAtg7とAtg8とのあいだの親和性は低下し,Atg7とAtg8とのあいだのチオエステル結合の形成反応の効率も低下したことから,NMRで決定した複合体の構造は機能的に重要な相互作用を反映しているものと考えられた.
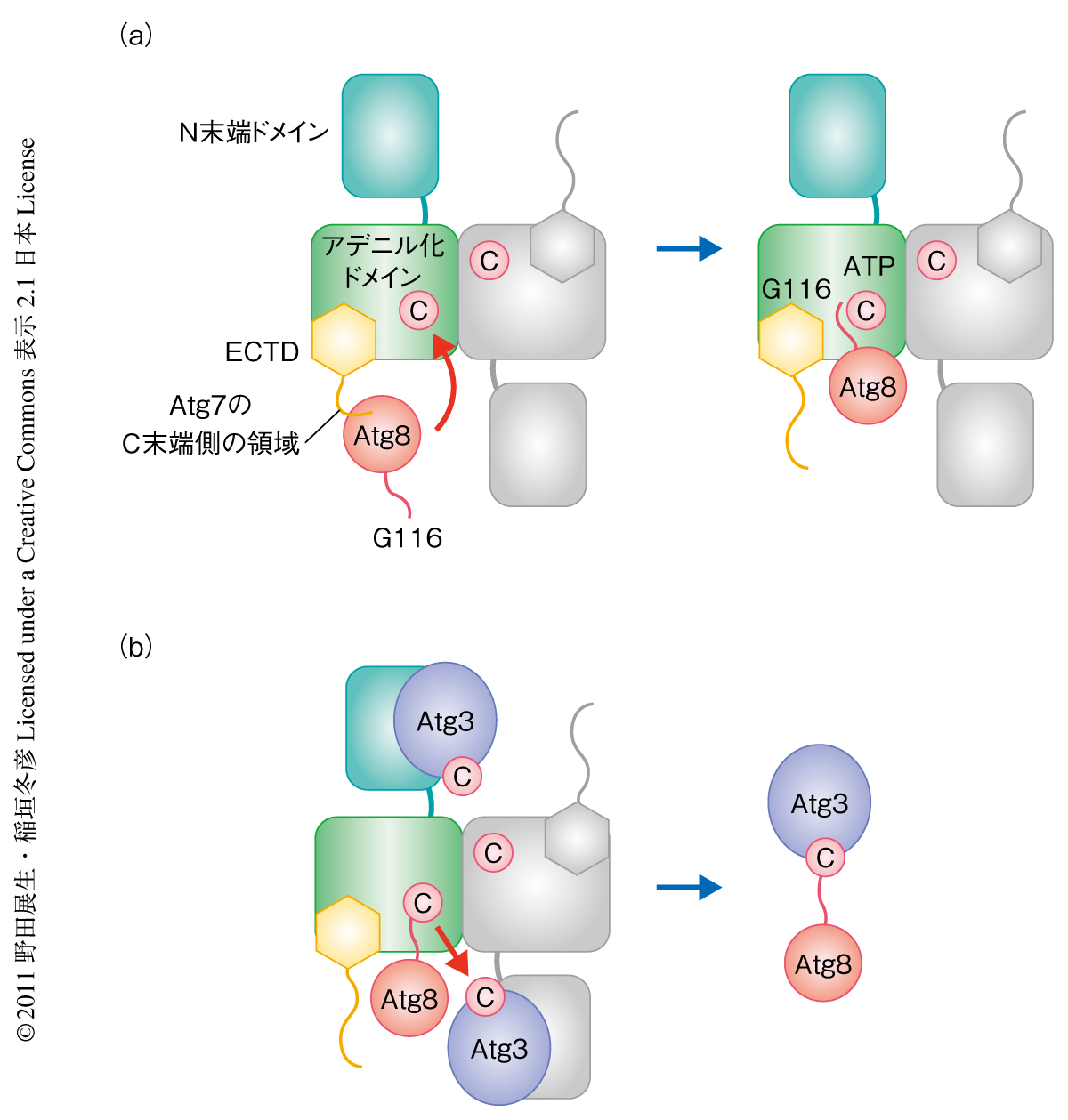
Atg7とAtg8とのあいだの相互作用は結晶構造とNMR構造とでまったく異なっていたが,どちらの構造もAtg7~Atg8チオエステル中間体の形成反応には重要であるという結果になった.しかしながら,この2つの複合体の構造を重ね合わせてみると,結晶構造においてみられたAtg7とAtg8とのあいだの相互作用を形成した状態で,NMR構造においてみられたAtg7とAtg8とのあいだの相互作用を形成することは距離的に不可能であること,すなわち,この2つの相互作用は互いに排他的であることがわかった.Atg7とAtg8とのあいだの親和性にはNMR構造においてみられた相互作用が必須であり,一方,アデニル化反応やチオエステル結合の形成反応が起こるためには結晶構造においてみられたようにAtg8のGly116がAtg7のATP結合部位やCys507の近傍に結合することが必須であった.以上の結果より,Atg7によるAtg8の認識は少なくとも2段階をへて行われていることが示唆された(図2a).まず,Atg7は自らのC末端側にあるフレキシブルな領域を用いて毛鉤釣りのようにAtg8をとらえる(NMR構造においてみられた相互作用).つづいて,Atg7はAtg8をアデニル化ドメインへと移動し,アデニル化反応およびチオエステル結合の形成反応を進行させる(結晶構造においてみられた相互作用).
Atg7とAtg8とのあいだにチオエステル結合が形成されたのち,Atg8はAtg3の触媒Cys234へと受け渡されAtg3~Atg8チオエステル中間体を形成する.一般的なユビキチン活性化酵素ではユビキチン結合酵素の認識はユビキチンフォールドドメインが担い,このユビキチンフォールドドメインはアデニル化ドメインのC末端側にひとつだけ存在する5).一方,Atg7はホモ二量体を形成するためAtg3の結合部位であるN末端ドメインは2つ存在し,したがって,Atg3も2分子がAtg7ホモ二量体に結合する.さらに,N末端ドメインはユビキチンフォールドドメインの場合とは反対のアデニル化ドメインのN末端側に位置する.これらの構造的な特徴により,Atg7のアデニル化ドメインに結合したAtg8は,同じAtg7分子のN末端ドメインに結合したAtg3との距離よりも,ホモ二量体を形成したもう一方のAtg7分子のN末端ドメインに結合したAtg3との距離のほうが近くなる.すなわち,1分子のAtg7のなかでAtg8をAtg3にわたす反応(シス)よりも,2分子のAtg7のあいだでAtg8をAtg3にわたす反応(トランス)のほうが構造的に都合がよい.
実際に,Atg8は2つのAtg7分子のあいだでAtg3へと受け渡されていることを生化学的に証明するため,全長のAtg7とAtg7のC末端ドメインとからなるヘテロ二量体の調製を行った.全長のAtg7にグルタチオン-S-トランスフェラーゼタグを,Atg7のC末端ドメインにヘキサヒスチジンタグをつけて大腸菌において共発現させ,それぞれのタグに対する親和性カラムで順に精製することで全長のAtg7とAtg7のC末端ドメインからなるヘテロ二量体を単離した.しかしながら,調製したヘテロ二量体は安定性が低く,精製ののち数時間以内に全長のAtg7からなるホモ二量体およびAtg7のC末端ドメインからなるホモ二量体への変換が認められた.そこで,構造情報にもとづきヘテロ二量体を安定化することを試みた.結晶構造ではAtg7はアデニル化ドメインを介してホモ二量体を形成しており,その境界面では一方のAtg7のもつArg511ともう一方のAtg7のもつGlu524とのあいだで塩橋が形成されていた.そこで,全長のAtg7のGlu524,および,Atg7のC末端ドメインのArg511に変異を導入し,同様の共発現系と精製系によりヘテロ二量体を調製したところ安定性が格段に向上し,少なくとも24時間はホモ二量体への変換が認められなかった.こうして安定化したヘテロ二量体に対し全長のAtg7の変異体のみ,あるいは,Atg7のC末端ドメインの変異体のみにCys507への変異を導入し,Atg3,Atg8およびATPと反応させた結果,全長のAtg7の変異体についてCys507に変異を導入したヘテロ二量体では効率よく形成されたAtg3~Atg8チオエステル結合体が,Atg7のC末端ドメインの変異体についてCys507に変異を導入したヘテロ二量体ではほとんど形成されなかった.すなわち,Atg7ホモ二量体におけるAtg3へのAtg8の受け渡し反応は,同じAtg7分子内(シス)ではなく,異なる2つのAtg7分子間(トランス)において進むことが明らかになった(図2b).
Atg7はほかのユビキチン活性化酵素ではみられない固有の構造と分子機構を用いてAtg8の活性化反応を担うことが明らかになった.Atg7が一般的なユビキチン活性化酵素とは異なるホモ二量体構造をとる意義は長らく不明であったが,Atg3へのAtg8の受け渡しが異なる2つのAtg7分子のあいだで進むことが明らかにされ,ホモ二量体の形成の意義のひとつがはじめて示された.Atg7はAtg8にくわえ,もうひとつのユビキチン様タンパク質であるAtg12も活性化し,Atg12に特異的なユビキチン結合酵素であるAtg10へと受け渡す反応を触媒する3).Atg7が2つのユビキチン様タンパク質と2つのユビキチン結合酵素をどのように認識し,それぞれ適切なペアでチオエステル結合を形成させるのか,今後,明らかにしていかなければならない課題である.
略歴:2001年 東京大学大学院薬学系研究科博士課程 修了,同年 北海道大学大学院薬学研究科 博士研究員,2005年 同 助手,2008年 同 講師を経て,2011年より微生物化学研究会微生物化学研究所 主席研究員.
研究テーマ:オートファジーの分子機構.
抱負:オートファジーの本質にせまりたい.
稲垣 冬彦(Fuyuhiko Inagaki)
北海道大学大学院先端生命科学研究院 特任教授.
© 2011 野田展生・稲垣冬彦 Licensed under CC 表示 2.1 日本
(1微生物化学研究会微生物化学研究所 分子構造解析部,2北海道大学大学院先端生命科学研究院 次世代ポストゲノム研究センター)
email:野田展生,稲垣冬彦
DOI: 10.7875/first.author.2011.176
Structural basis of Atg8 activation by a homo-dimeric E1, Atg7.
Nobuo N. Noda, Kenji Satoo, Yuko Fujioka, Hiroyuki Kumeta, Kenji Ogura, Hitoshi Nakatogawa, Yoshinori Ohsumi, Fuyuhiko Inagaki
Molecular Cell, 44, 462-475 (2011)
要 約
Atg7は2つのユビキチン様タンパク質Atg8およびAtg12を活性化するユビキチン活性化酵素であり,オートファジーにおいて重要な役割を担う.今回,筆者らは,Atg7のほぼ全長の結晶構造,Atg7のC末端ドメインとAtg8との複合体の結晶構造,さらに,Atg7のC末端側の領域とAtg8との複合体のNMR構造を決定した.Atg7はN末端側のAtg3の認識にかかわるドメインとC末端側のアデニル化ドメインとが短いリンカーでつながれた構造をとり,アデニル化ドメインを介してホモ二量体を形成していた.Atg8との複合体の構造解析および生化学的な解析の結果,Atg7はアデニル化ドメインのさらにC末端側にある固有の領域でAtg8をとらえ,つづいてアデニル化ドメインに受け渡すことでAtg8の活性化を行っていること,活性化されたAtg8は自らが結合しているAtg7分子とは別のAtg7分子に結合したAtg3へ受け渡されることが明らかになった.
はじめに
オートファジーは真核生物において保存された細胞における主要な分解経路であり,タンパク質からオルガネラ,細胞に侵入した細菌にいたるまで,さまざまな対象をオートファゴソームとよばれる二重膜の構造体に隔離し,リソソームあるいは液胞へと輸送することでその分解を行う.この過程には多くのAtgタンパク質が関与しており,とくに,2つのユビキチン様結合系であるAtg8結合系およびAtg12結合系が重要なはたらきを担う1,2).Atg7はこの2つの結合系において共通して機能するユビキチン活性化酵素であり,ATPを使いAtg8およびAtg12のアデニル化反応を行ったのち,自らのもつ触媒システイン残基であるCys507を介してそれぞれのC末端にあるグリシン残基とチオエステル結合を形成したのち,それぞれに特異的なユビキチン結合酵素であるAtg3およびAtg10のもつ触媒システイン残基へと受け渡す.最終的に,Atg8はリン脂質であるホスファチジルエタノールアミンと,Atg12はAtg5と共有結合し,オートファゴソームの形成にはたらく3,4).ユビキチンやSUMO,NEDD8などに対する一般的なユビキチン活性化酵素に関してはこれまで詳細な構造生物学的な研究が行われ共通した特徴が明らかになっている5).これら一般的なユビキチン活性化酵素はヘテロ二量体もしくは単量体として機能し,以下の4つのドメイン,すなわち,1)活性のあるアデニル化ドメイン,2)活性のないアデニル化ドメイン,3)ユビキチン結合酵素との結合にかかわるユビキチンフォールドドメイン,4)触媒システインドメイン,からなり,ATP結合部位および触媒システイン残基を1つずつもつ.Atg7は一般的なユビキチン活性化酵素とはアデニル化ドメインのみで配列相同性を示し6),さらに,ホモ二量体として機能することから7),顕著に異なる立体構造をもつことが示唆されていた8).筆者らは,Atg7のほぼ全長の結晶構造と,Atg7のC末端ドメインとAtg8との複合体の結晶構造,さらに,Atg7のC末端側の領域とAtg8との複合体のNMR構造を決定し,そのユニークな立体構造,および,ほかのユビキチン活性化酵素とは顕著に異なるAtg8活性化の機構を明らかにした.
1.Atg7の全体構造
Atg7は全長630アミノ酸残基からなるが,C末端の35残基あるいは17残基を欠失させることで結晶化し,Znの異常分散を利用した単波長異常分散法によりその結晶構造を決定した(PDB ID:3VH1,PDB ID:3VH2).Atg7はN末端側の約半分からなるN末端ドメイン(N-terminal domain:NTD)とC末端側の約半分からなるC末端ドメイン(C-terminal domain:CTD)の2つのドメインが短いリンカー領域で結ばれた構造をもっていた(図1a).N末端ドメインはほかのユビキチン活性化酵素には認められず,また,構造比較でも低い構造類似性のものしか認められなかった.C末端ドメインはほかのユビキチン活性化酵素と類似した構造をもつアデニル化ドメインと,そのさらにC末端側にあるAtg7に固有の領域であるextreme C-terminal domain(ECTD)からなっていた.触媒システイン残基であるCys507はアデニル化ドメインがもつループ構造のひとつであるクロスオーバーループに存在し,一般的なユビキチン活性化酵素にみられるような触媒システインドメインは存在しなかった.Atg7は結晶においてアデニル化ドメイン領域を介しホモ二量体を形成しており,結果として,2つのATP結合部位と2つの触媒システイン残基をもっていた.Atg7は一般的なユビキチン活性化酵素においてユビキチン結合酵素との結合を担うユビキチンフォールドドメインを欠いていることから,別の領域でユビキチン結合酵素であるAtg3を認識する必要がある.変異体タンパク質を用いた結合実験により,Atg7に固有のN末端ドメインがAtg3との結合を担うことが明らかになった.N末端ドメインの表面には高度に塩基性残基が集合した領域が保存されているが,Atg7はこの塩基性の面を介しAtg3と直接に結合していた.一方,Atg8の認識はAtg7のC末端ドメインが担っており,C末端ドメインのみでAtg8とチオエステル結合を形成できた.
2.Atg7によるAtg8の2段階の認識機構
Atg8との複合体の結晶化はAtg7のC末端ドメインを用いて行い,Atg7のC末端ドメインとAtg8との複合体(PDB ID:3VH3),および,それにATPの結合した三者複合体(PDB ID:3VH4)の結晶構造が分子置換法により決定された.Atg7のC末端ドメインは全長Atg7の結晶構造と類似の様式でホモ二量体を形成し,Atg8およびATPは2分子ずつ結合していた(図1b).その相互作用の様式は既知のユビキチン活性化酵素とその基質であるユビキチン様タンパク質およびATPとのあいだでみられたものと類似していた.Atg7のクロスオーバーループはAtg8の非存在下ではAtg8結合部位の付近に結合していたが,Atg8との複合体の結晶構造では大規模な構造変化を起こしAtg8のユビキチン骨格部分を取り囲むような構造をとっていた.Atg8のGly116のカルボキシル酸素原子はATPのα位のリン原子から2.8Åの位置にありアデニル化反応を起こすのに適した配置と考えられたが,結晶においてアデニル化は進行していなかった.Atg8のC末端領域はクロスオーバーループとアデニル化ドメインとのあいだにはさまれており,クロスオーバーループのCys507はAtg8のGly116の上方,約14Åに位置した.この距離はチオエステル結合を形成するには遠すぎるが,クロスオーバーループが構造変化を起こすことによりCys507はAtg8のGly116の近傍に十分に近づくことができると推定された.Atg7のC末端ドメインとAtg8とのあいだには多くの疎水性相互作用および親水性相互作用が認められ,それらにかかわる残基への変異の導入によりin vitroにおけるAtg7とAtg8とのあいだのチオエステル結合の形成反応は顕著に阻害されたが,一方で,これらの変異導入はAtg7とAtg8とのあいだの親和性にはほとんど影響しなかった.
不思議なことに,Atg7のC末端の13残基(618~630)は,複合体の結晶構造においては電子密度が認められずAtg8には結合していなかったが,この13残基を欠失させるとAtg7とAtg8とのあいだの親和性はほぼ完全に失われ,チオエステル結合の形成反応も完全に阻害された.この結果は,この領域が出芽酵母においてAtg8とホスファチジルエタノールアミンとの結合体の形成およびオートファジー活性に重要であるとの報告と一致した7).そこで,Atg7のC末端側の領域とAtg8との溶液における相互作用をNMRを用いて調べた.Atg7のC末端の30残基(601~630)に対応するペプチドとAtg8との複合体のNMR構造を決定した結果(PDB ID:2LI5),Atg7のC末端の13残基(618~630)はAtg8のもつAtg8ファミリー相互作用モチーフ(Atg8-family interacting motif:AIM)との結合領域に結合し9),多数の疎水性相互作用およびイオン性相互作用を形成していた(図1c).その相互作用の様式は典型的なAtg8とAtg8ファミリー相互作用モチーフとのあいだの相互作用とは異なるものであった10).これらの相互作用を破壊するような変異の導入によりAtg7とAtg8とのあいだの親和性は低下し,Atg7とAtg8とのあいだのチオエステル結合の形成反応の効率も低下したことから,NMRで決定した複合体の構造は機能的に重要な相互作用を反映しているものと考えられた.
Atg7とAtg8とのあいだの相互作用は結晶構造とNMR構造とでまったく異なっていたが,どちらの構造もAtg7~Atg8チオエステル中間体の形成反応には重要であるという結果になった.しかしながら,この2つの複合体の構造を重ね合わせてみると,結晶構造においてみられたAtg7とAtg8とのあいだの相互作用を形成した状態で,NMR構造においてみられたAtg7とAtg8とのあいだの相互作用を形成することは距離的に不可能であること,すなわち,この2つの相互作用は互いに排他的であることがわかった.Atg7とAtg8とのあいだの親和性にはNMR構造においてみられた相互作用が必須であり,一方,アデニル化反応やチオエステル結合の形成反応が起こるためには結晶構造においてみられたようにAtg8のGly116がAtg7のATP結合部位やCys507の近傍に結合することが必須であった.以上の結果より,Atg7によるAtg8の認識は少なくとも2段階をへて行われていることが示唆された(図2a).まず,Atg7は自らのC末端側にあるフレキシブルな領域を用いて毛鉤釣りのようにAtg8をとらえる(NMR構造においてみられた相互作用).つづいて,Atg7はAtg8をアデニル化ドメインへと移動し,アデニル化反応およびチオエステル結合の形成反応を進行させる(結晶構造においてみられた相互作用).
3.Atg8は2つのAtg7分子のあいだでAtg3へと受け渡されている
Atg7とAtg8とのあいだにチオエステル結合が形成されたのち,Atg8はAtg3の触媒Cys234へと受け渡されAtg3~Atg8チオエステル中間体を形成する.一般的なユビキチン活性化酵素ではユビキチン結合酵素の認識はユビキチンフォールドドメインが担い,このユビキチンフォールドドメインはアデニル化ドメインのC末端側にひとつだけ存在する5).一方,Atg7はホモ二量体を形成するためAtg3の結合部位であるN末端ドメインは2つ存在し,したがって,Atg3も2分子がAtg7ホモ二量体に結合する.さらに,N末端ドメインはユビキチンフォールドドメインの場合とは反対のアデニル化ドメインのN末端側に位置する.これらの構造的な特徴により,Atg7のアデニル化ドメインに結合したAtg8は,同じAtg7分子のN末端ドメインに結合したAtg3との距離よりも,ホモ二量体を形成したもう一方のAtg7分子のN末端ドメインに結合したAtg3との距離のほうが近くなる.すなわち,1分子のAtg7のなかでAtg8をAtg3にわたす反応(シス)よりも,2分子のAtg7のあいだでAtg8をAtg3にわたす反応(トランス)のほうが構造的に都合がよい.
実際に,Atg8は2つのAtg7分子のあいだでAtg3へと受け渡されていることを生化学的に証明するため,全長のAtg7とAtg7のC末端ドメインとからなるヘテロ二量体の調製を行った.全長のAtg7にグルタチオン-S-トランスフェラーゼタグを,Atg7のC末端ドメインにヘキサヒスチジンタグをつけて大腸菌において共発現させ,それぞれのタグに対する親和性カラムで順に精製することで全長のAtg7とAtg7のC末端ドメインからなるヘテロ二量体を単離した.しかしながら,調製したヘテロ二量体は安定性が低く,精製ののち数時間以内に全長のAtg7からなるホモ二量体およびAtg7のC末端ドメインからなるホモ二量体への変換が認められた.そこで,構造情報にもとづきヘテロ二量体を安定化することを試みた.結晶構造ではAtg7はアデニル化ドメインを介してホモ二量体を形成しており,その境界面では一方のAtg7のもつArg511ともう一方のAtg7のもつGlu524とのあいだで塩橋が形成されていた.そこで,全長のAtg7のGlu524,および,Atg7のC末端ドメインのArg511に変異を導入し,同様の共発現系と精製系によりヘテロ二量体を調製したところ安定性が格段に向上し,少なくとも24時間はホモ二量体への変換が認められなかった.こうして安定化したヘテロ二量体に対し全長のAtg7の変異体のみ,あるいは,Atg7のC末端ドメインの変異体のみにCys507への変異を導入し,Atg3,Atg8およびATPと反応させた結果,全長のAtg7の変異体についてCys507に変異を導入したヘテロ二量体では効率よく形成されたAtg3~Atg8チオエステル結合体が,Atg7のC末端ドメインの変異体についてCys507に変異を導入したヘテロ二量体ではほとんど形成されなかった.すなわち,Atg7ホモ二量体におけるAtg3へのAtg8の受け渡し反応は,同じAtg7分子内(シス)ではなく,異なる2つのAtg7分子間(トランス)において進むことが明らかになった(図2b).
おわりに
Atg7はほかのユビキチン活性化酵素ではみられない固有の構造と分子機構を用いてAtg8の活性化反応を担うことが明らかになった.Atg7が一般的なユビキチン活性化酵素とは異なるホモ二量体構造をとる意義は長らく不明であったが,Atg3へのAtg8の受け渡しが異なる2つのAtg7分子のあいだで進むことが明らかにされ,ホモ二量体の形成の意義のひとつがはじめて示された.Atg7はAtg8にくわえ,もうひとつのユビキチン様タンパク質であるAtg12も活性化し,Atg12に特異的なユビキチン結合酵素であるAtg10へと受け渡す反応を触媒する3).Atg7が2つのユビキチン様タンパク質と2つのユビキチン結合酵素をどのように認識し,それぞれ適切なペアでチオエステル結合を形成させるのか,今後,明らかにしていかなければならない課題である.
文 献
- Mizushima, N., Yoshimori, T., Ohsumi, Y.: The role of Atg proteins in autophagosome formation. Annu. Rev. Cell Dev. Biol., 27, 107-132 (2011)[PubMed]
- Nakatogawa, H., Suzuki, K., Kamada, Y. et al.: Dynamics and diversity in autophagy mechanisms: lessons from yeast. Nat. Rev. Mol. Cell Biol., 10, 458-467 (2009)[PubMed]
- Mizushima, N., Noda, T., Yoshimori, T. et al.: A protein conjugation system essential for autophagy. Nature, 395, 395-398 (1998)[PubMed]
- Ichimura, Y., Kirisako, T., Takao, T. et al.: A ubiquitin-like system mediates protein lipidation. Nature, 408, 488-492 (2000)[PubMed]
- Schulman, B. A., Harper, J. W.: Ubiquitin-like protein activation by E1 enzymes: the apex for downstream signaling pathways. Nat. Rev. Mol. Cell Biol., 10, 319-331 (2009)[PubMed]
- Tanida, I., Mizushima, N., Kiyooka, M. et al.: Apg7p/Cvt2p: A novel protein-activating enzyme essential for autophagy. Mol. Biol. Cell, 10, 1367-1379 (1999)[PubMed]
- Komatsu, M., Tanida, I., Ueno, T. et al.: The C-terminal region of an Apg7p/Cvt2p is required for homodimerization and is essential for its E1 activity and E1-E2 complex formation. J. Biol. Chem., 276, 9846-9854 (2001)[PubMed]
- Noda, N. N., Ohsumi, Y., Inagaki, F.: ATG systems from the protein structural point of view. Chem. Rev., 109, 1587-1598 (2009)[PubMed]
- Noda, N. N., Ohsumi, Y., Inagaki, F.: Atg8-family interacting motif crucial for selective autophagy. FEBS Lett., 584, 1379-1385 (2010)[PubMed]
- Noda, N. N., Kumeta, H., Nakatogawa, H. et al.: Structural basis of target recognition by Atg8/LC3 during selective autophagy. Genes Cells, 13, 1211-1218 (2008)[PubMed]
著者プロフィール
略歴:2001年 東京大学大学院薬学系研究科博士課程 修了,同年 北海道大学大学院薬学研究科 博士研究員,2005年 同 助手,2008年 同 講師を経て,2011年より微生物化学研究会微生物化学研究所 主席研究員.
研究テーマ:オートファジーの分子機構.
抱負:オートファジーの本質にせまりたい.
稲垣 冬彦(Fuyuhiko Inagaki)
北海道大学大学院先端生命科学研究院 特任教授.
© 2011 野田展生・稲垣冬彦 Licensed under CC 表示 2.1 日本