IκBキナーゼ複合体は炎症性サイトカイン遺伝子mRNAの安定性をregnase-1の分解を介し制御している
岩崎秀典・竹内 理・審良静男
(大阪大学免疫学フロンティア研究センター 自然免疫学研究室)
email:岩崎秀典,竹内 理,審良静男
DOI: 10.7875/first.author.2011.172
The IκB kinase complex regulates the stability of cytokine-encoding mRNA induced by TLR-IL-1R by controlling degradation of regnase-1.
Hidenori Iwasaki, Osamu Takeuchi, Shunsuke Teraguchi, Kazufumi Matsushita, Takuya Uehata, Kanako Kuniyoshi, Takashi Satoh, Tatsuya Saitoh, Mutsuyoshi Matsushita, Daron M. Standley, Shizuo Akira
Nature Immunology, 12, 1167-1175 (2011)
Toll様受容体はIκBキナーゼ複合体を活性化することで炎症の際にNF-κBの発現を誘導することが知られている.これまで,筆者らは,RNA分解酵素であるregnase-1がIL-6やIL-12といった炎症性サイトカインのmRNAの不安定化を制御して炎症性の疾患の発症を抑制していることを報告している.この研究においては,IκBキナーゼ複合体がIL-6 mRNAの安定性をregnase-1の分解を介して制御していることを明らかにした.IL-1受容体あるいはToll様受容体の刺激によりIκBキナーゼ複合体がregnase-1をリン酸化し,ユビキチン-プロテアソーム系がregnase-1を分解していた.また,regnase-1は自らのmRNAの3’側非翻訳領域にあるステムループ構造を認識して負に制御しており,Toll様受容体あるいはIL-1受容体の刺激の負のフィードバックにおいてregnase-1の関与が示唆された.IκBキナーゼ複合体は転写の活性化を担うIκBαだけでなく,IL-6 mRNA発現のブレーキ役であるregnase-1をもリン酸化し分解するという,炎症性サイトカイン遺伝子の発現の新しい制御機構が明らかになった.
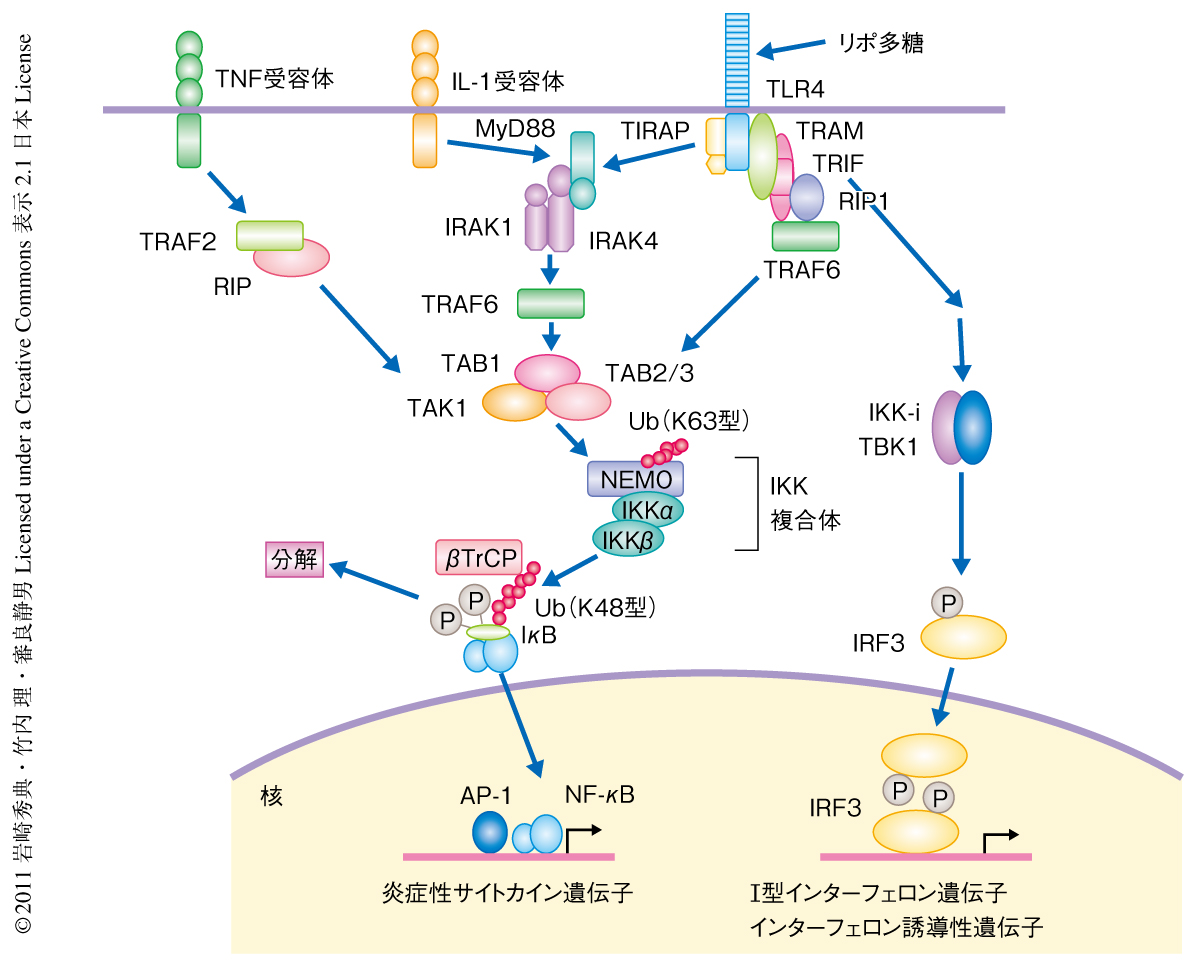
自然免疫は細菌,ウイルス,寄生虫といった感染病原体の初期の認識,ならびに,そののちの炎症反応の惹起や獲得免疫の誘導に重要な役割をはたす生体防御機構である.炎症反応にはTNF(tumor necrosis factor,腫瘍壊死因子),IL-1βおよびIL-6(IL:interleukin,インターロイキン)のような炎症性サイトカインの関与が知られている1-3).それら炎症性サイトカインの発現は通常の細胞においては抑制されており,病原体による感染が起こると病原体を認識する受容体であるToll様受容体(Toll-like receptor:TLR)を介し急速にその発現が惹起される(図1).TLR3を除くすべてのToll様受容体とIL-1受容体はアダプタータンパク質であるMyD88に依存的にシグナル伝達を開始する.そののち,MyD88と会合したIRAK4はIRAK1およびIRAK2を活性化する.つづいて,NEMO,IκBキナーゼα,IκBキナーゼβにより構成されるIκBキナーゼ複合体がIκBαのDSGxxSモチーフをリン酸化する.リン酸化したIκBαはユビキチンリガーゼであるβTRCP複合体によりユビキチン化されプロテアソームにおいて分解される.それによりそれまでIκBαと結合することでその活性が抑制されていたNF-κBが核へと移行し炎症性サイトカイン遺伝子の転写を誘導する4,5).この転写活性化による制御にくわえて,mRNAはその分解速度によっても制御されている.たとえば,TTPはTNF mRNAの3’側非翻訳領域に存在するAUリッチ配列と会合してその不安定化をひき起こす6).
これまで,筆者らは,Toll様受容体の刺激により誘導されてIL-6 mRNAを不安定化する新規のRNA分解酵素Zc3h12aを同定し,その機能からこれをregnase-1(regulatory RNase-1)と命名した7).regnase-1はIL-6 mRNAの3’側非翻訳領域に存在する,AUリッチ配列とは異なるステムループ構造に依存的にIL-6 mRNAを不安定化した.regnase-1を欠損したマウスは自発的な自己免疫炎症性の疾患を発症する.このことは,regnase-1を介したmRNAの発現制御が恒常性の維持に必要不可欠であることを示している.この研究では,Toll様受容体の刺激ののちのregnase-1の機能に関し検討を行った.
regnase-1のタンパク質レベルにおける発現を検討するため新規に抗体を作製したところ,regnase-1はタンパク質レベルにおいて刺激をうけるまえの定常状態においても発現していることが明らかになった.この結果と対応して,regnase-1を欠損した細胞では定常状態においてもIL-6 mRNAの発現が野生型の細胞と比べ上昇していた.
つぎに,regnase-1のToll様受容体あるいはIL-1受容体の刺激による変化を腹腔内マクロファージおよびHeLa細胞において検討した.regnase-1はToll様受容体あるいはIL-1受容体の刺激ののち数分間で,SDS-ポリアクリルアミドゲル電気泳動における泳動度が変化するとともに消失し,120分以内に再び発現した.一方,TNF受容体の刺激ではregnase-1は消失しなかった.解析の結果,この反応はシグナル伝達タンパク質であるMyD88,IRAK4,IRAK1,IRAK2を介していることが明らかになった.Toll様受容体あるいはIL-1受容体の刺激によるregnase-1の発現変化のキネティクスは,IκBαの発現変化と類似していた.Toll様受容体あるいはIL-1受容体の刺激によるregnase-1の泳動度の変化は脱リン酸化酵素による処理で消失し,また,Toll様受容体あるいはIL-1受容体の刺激によりregnase-1はユビキチン化されていた.さらに,阻害剤を用いた解析によりregnase-1はプロテアソームにおいて分解されていることが示された.以上の結果より,regnase-1はリン酸化され,ユビキチン-プロテアソーム系により分解されていることが明らかになった.
regnase-1をリン酸化するキナーゼを探索した.Toll様受容体あるいはIL-1受容体の刺激により活性化される各種のMAPキナーゼ(ERK,JNK,p38,PI3K)の阻害剤はregnase-1の分解を抑制しなかった.これに対して,IκBキナーゼβに特異的な阻害剤の存在下ではregnase-1の分解が抑制された.さらに,IκBキナーゼ複合体を欠損した細胞を用いてregnase-1の分解への影響を検討した.その結果,IκBキナーゼβの欠損細胞ではregnase-1の分解が部分的に抑制され,IκBキナーゼαの欠損細胞およびIκBキナーゼβの欠損細胞ではregnase-1の分解が完全に抑制された.さらに,NEMOの欠損細胞でもregnase-1の分解が完全に抑制された.したがって,regnase-1の分解にはIκBキナーゼ複合体が必須であることが明らかになった.
IκBキナーゼ複合体はIκBαのDSGxxSモチーフをリン酸化することが知られている4,5).regnase-1にもDSGxxSモチーフが存在し,IκBキナーゼ複合体が直接にregnase-1をリン酸化することがin vitroキナーゼアッセイにより示された.regnase-1のDSGxxSモチーフの435番目および439番目のセリン残基の変異体を作製したところ,IκBキナーゼαおよびIκBキナーゼβはこの変異体をリン酸化しなかった.つまり,IκBキナーゼ複合体は435番目および439番目のセリン残基を標的にregnase-1をリン酸化していることが明らかになった.
Toll様受容体あるいはIL-1受容体の刺激において,リン酸化されたIκBαはユビキチンリガーゼであるβTRCPによりユビキチン化され分解されることが知られている4,5).そこで,regnase-1,IκBキナーゼβ,βTRCPの相互作用を検討した.HEK293細胞においてIκBキナーゼβおよびβTRCPを共発現すると,regnase-1,IκBキナーゼβ,βTRCPが会合していることが示された.さらに,IκBキナーゼβのキナーゼ活性欠損変異体,および,regnase-1のリン酸化部位変異体を用いたところ,regnase-1とβTRCPとの会合は抑制されていた.つまり,regnase-1とβTRCPとの会合にはIκBキナーゼβのキナーゼ活性およびregnase-1のリン酸化部位が必要不可欠であることが示された.
筆者らは,regnase-1を欠損したマクロファージにおいてはIL-6 mRNAは安定化していることを報告している7).そこで,IκBキナーゼを介するregnase-1のリン酸化と分解がIL-6 mRNAの安定性を制御しているのかどうかを検証した.regnase-1の435番目および439番目のセリン残基の変異体は,野生型のregnase-1よりもIL-6 mRNAの発現を抑制した.以上の結果から,IκBキナーゼはregnase-1のDSGxxSモチーフをリン酸化し,βTRCPはユビキチン-プロテアソーム系の活性化に関与していることが示された.さらに,regnase-1のリン酸化はToll様受容体あるいはIL-1受容体の刺激によるIL-6 mRNAの発現増強に関与していることが示された.
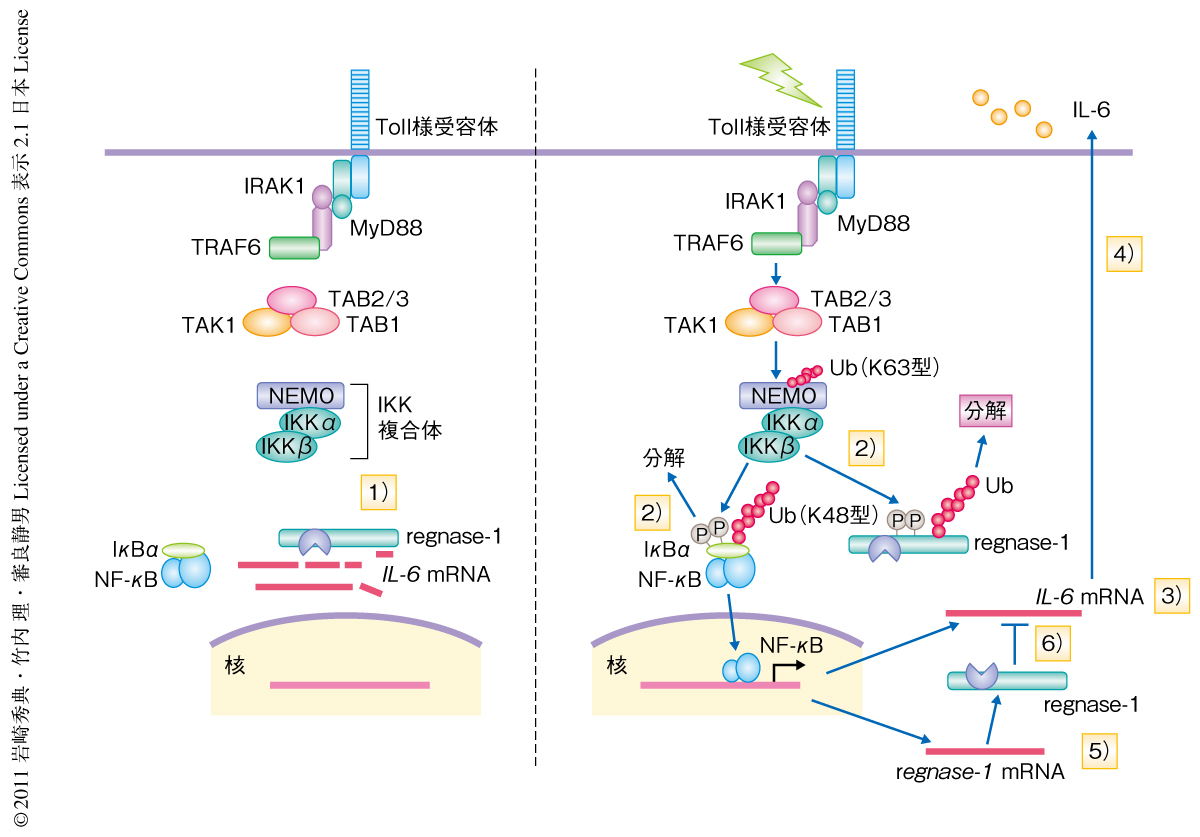
IκBキナーゼ複合体が転写の制御にくわえて,IL-6 mRNAの安定性も制御しているのかどうか検討した.IκBキナーゼ複合体においてその活性化を担う構成タンパク質であるNEMOの欠損細胞において,リポ多糖によるToll様受容体の刺激はIL-6 mRNAを安定化しなかったことから,IκBキナーゼ複合体はIL-6 mRNAを安定化していることが示された.TNFの刺激ではなく,IL-1βの刺激の20分後においてregnase-1は消失し再発現した.また,IL-1β刺激はTNF刺激よりもIL-6 mRNAの発現を高めた.そこで,IL-1βもしくはTNFの刺激の20分後からのIL-6 mRNAの半減期を測定すると,TNF刺激のときのIL-6 mRNAの半減期は無刺激のときと変わらなかったが,IL-1β刺激のときのIL-6 mRNAの半減期は延長されていた.さらに,IL-1β刺激ののちのregnase-1の再発現におけるIL-6 mRNAの半減期は,TNF刺激のときおよび無刺激のときと同様だった.以上の結果から,IκBキナーゼ複合体はToll様受容体あるいはIL-1受容体の刺激により,IκBα-NF-κBシグナル伝達経路によるサイトカイン遺伝子の転写の活性化だけでなく,regnase-1の分解を介したmRNAの安定化をも誘導していることが示された.
TNF受容体ではなく,Toll様受容体あるいはIL-1受容体の刺激によりregnase-1が分解される分子機構を検討した.IκBキナーゼ複合体の活性化のみではregnase-1のリン酸化は十分ではなかった.TNF受容体,IL-1受容体およびToll様受容体の下流のシグナル伝達タンパク質は,TAK1の下流では共有されている一方,IRAK1,IRAK2,MyD88はTNF受容体の刺激ではなくToll様受容体あるいはIL-1受容体の刺激により活性化されることが知られている6)(図1).さらに,IRAKはNF-κBの活性化にくわえmRNAの安定性をも制御するが,IRAK1とIRAK2のダブルノックアウト細胞においてもMyD88の下流タンパク質であるNF-κBが活性化されていることが報告されている8,9).したがって,regnase-1の分解にはMyD88,IRAK1,IRAK2のすべてが必要であり,IκBキナーゼ複合体の単純な活性化だけでなくIRAKを介した分子機構によりregnase-1は分解されているのではないかと仮定した.この仮説を検証するためregnase-1とIRAK1との相互作用を解析したところ,IRAK1はregnase-1と結合するとともにこれを直接にリン酸化していた.さらに,regnase-1,IRAK1,IκBキナーゼβの相互作用を解析したところ,IRAK1はregnase-1とIκBキナーゼβとの会合,および,regnase-1のユビキチン化を増強した.以上の結果から,IRAK1はregnase-1を直接にリン酸化することにより,IκBキナーゼβを介したregnase-1のユビキチン化を促進しているものと考えられた.
いちどregnase-1が急速な分解を起こすと,刺激ののち60分から120分以内に再発現する.regnase-1遺伝子の転写はNF-κBなどの転写因子により制御されており,regnase-1 mRNAの発現は刺激ののちの転写を必要とする.NF-κBの活性化はIL-1βの刺激およびTNFの刺激により同様に誘導されるが,IL-1β刺激はTNF刺激よりもregnase-1 mRNAを強く発現させる.さらに,IL-1βの刺激20分後のregnase-1の半減期は無刺激のときより長くなり,これに対して,刺激240分後のregnase-1の半減期は無刺激のときのregnase-1の半減期と同様であった.以上の結果から,regnase-1 mRNAはRNA分解酵素であるregnase-1自体の標的になっているとの仮説をたてた.これを検証するため,regnase-1遺伝子の3’側非翻訳領域をもつβグロビン遺伝子をTetオフ系に組み込み,regnase-1遺伝子とともに細胞に発現させてmRNAの安定性を検討する実験系を構築した.その結果,regnase-1は自らのmRNAを安定化していることが示された.さらに,regnase-1は自らのmRNAの3’側非翻訳領域にあるステムループ構造を標的にしてこれを分解していることが示された.このように,regnase-1は自己のmRNAを標的のひとつとして分解することにより,最終的な炎症の収束および恒常性の維持にかかわっているものと考えられた.また,この制御機構のモデル化およびシミュレーションを試み,IL-1βの刺激およびTNFの刺激に対するregnase-1やIL-6の発現の違いを説明する数理モデルの構築にも成功した.
筆者らは,IκBキナーゼ複合体がToll様受容体あるいはIL-1受容体の刺激によるIL-6 mRNAの転写だけでなく,IL-6 mRNAの安定性をも制御していることを明らかにした.そして,その安定化にはIκBキナーゼ複合体によるregnase-1の分解機構が関与していることが示された.さらに,regnase-1は自らのmRNAを負に制御することによりToll様受容体あるいはIL-1受容体の刺激による負のフィードバックに関与していることが示された(図2).これまで,IκBキナーゼ複合体によるサイトカイン遺伝子mRNAの制御は転写により行われていることが知られていた.しかしながら,転写だけでなくmRNAの安定化による制御を行うことにより,細菌感染の際にサイトカインをより迅速に発現させていることが示唆された.
IκBキナーゼ複合体はさまざまなサイトカイン遺伝子の転写を誘導することが報告されている2,10).この研究により,ほかのサイトカインや接着分子などにおいても同様の分子機構によりmRNAを制御することで迅速な誘導とのちの負のフィードバックを行っている可能性が想定される.炎症制御の転写調節機構に関してこれまでさまざまな研究がなされているが,mRNAの安定性の制御機構に関してはほとんど明らかになっていない.今後,mRNAの安定性の制御の分子機構を解析することで,炎症応答の包括的な調節機構を明らかにしていきたい.
略歴:2005年より日本たばこ産業医薬総合研究所 研究員,2009年より大阪大学免疫学フロンティア研究センター 特別研究員.
研究テーマ:ジンクフィンガータンパク質の免疫における役割.
抱負:迅速に,かつ,ときには慎重に,研究を進めていきたい.
竹内 理(Osamu Takeuchi)
大阪大学免疫学フロンティア研究センター 准教授.
審良 静男(Shizuo Akira)
大阪大学免疫学フロンティア研究センター 教授.
研究室URL:http://hostdefense.ifrec.osaka-u.ac.jp/ja/index.html
© 2011 岩崎秀典・竹内 理・審良静男 Licensed under CC 表示 2.1 日本
(大阪大学免疫学フロンティア研究センター 自然免疫学研究室)
email:岩崎秀典,竹内 理,審良静男
DOI: 10.7875/first.author.2011.172
The IκB kinase complex regulates the stability of cytokine-encoding mRNA induced by TLR-IL-1R by controlling degradation of regnase-1.
Hidenori Iwasaki, Osamu Takeuchi, Shunsuke Teraguchi, Kazufumi Matsushita, Takuya Uehata, Kanako Kuniyoshi, Takashi Satoh, Tatsuya Saitoh, Mutsuyoshi Matsushita, Daron M. Standley, Shizuo Akira
Nature Immunology, 12, 1167-1175 (2011)
要 約
Toll様受容体はIκBキナーゼ複合体を活性化することで炎症の際にNF-κBの発現を誘導することが知られている.これまで,筆者らは,RNA分解酵素であるregnase-1がIL-6やIL-12といった炎症性サイトカインのmRNAの不安定化を制御して炎症性の疾患の発症を抑制していることを報告している.この研究においては,IκBキナーゼ複合体がIL-6 mRNAの安定性をregnase-1の分解を介して制御していることを明らかにした.IL-1受容体あるいはToll様受容体の刺激によりIκBキナーゼ複合体がregnase-1をリン酸化し,ユビキチン-プロテアソーム系がregnase-1を分解していた.また,regnase-1は自らのmRNAの3’側非翻訳領域にあるステムループ構造を認識して負に制御しており,Toll様受容体あるいはIL-1受容体の刺激の負のフィードバックにおいてregnase-1の関与が示唆された.IκBキナーゼ複合体は転写の活性化を担うIκBαだけでなく,IL-6 mRNA発現のブレーキ役であるregnase-1をもリン酸化し分解するという,炎症性サイトカイン遺伝子の発現の新しい制御機構が明らかになった.
はじめに
自然免疫は細菌,ウイルス,寄生虫といった感染病原体の初期の認識,ならびに,そののちの炎症反応の惹起や獲得免疫の誘導に重要な役割をはたす生体防御機構である.炎症反応にはTNF(tumor necrosis factor,腫瘍壊死因子),IL-1βおよびIL-6(IL:interleukin,インターロイキン)のような炎症性サイトカインの関与が知られている1-3).それら炎症性サイトカインの発現は通常の細胞においては抑制されており,病原体による感染が起こると病原体を認識する受容体であるToll様受容体(Toll-like receptor:TLR)を介し急速にその発現が惹起される(図1).TLR3を除くすべてのToll様受容体とIL-1受容体はアダプタータンパク質であるMyD88に依存的にシグナル伝達を開始する.そののち,MyD88と会合したIRAK4はIRAK1およびIRAK2を活性化する.つづいて,NEMO,IκBキナーゼα,IκBキナーゼβにより構成されるIκBキナーゼ複合体がIκBαのDSGxxSモチーフをリン酸化する.リン酸化したIκBαはユビキチンリガーゼであるβTRCP複合体によりユビキチン化されプロテアソームにおいて分解される.それによりそれまでIκBαと結合することでその活性が抑制されていたNF-κBが核へと移行し炎症性サイトカイン遺伝子の転写を誘導する4,5).この転写活性化による制御にくわえて,mRNAはその分解速度によっても制御されている.たとえば,TTPはTNF mRNAの3’側非翻訳領域に存在するAUリッチ配列と会合してその不安定化をひき起こす6).
これまで,筆者らは,Toll様受容体の刺激により誘導されてIL-6 mRNAを不安定化する新規のRNA分解酵素Zc3h12aを同定し,その機能からこれをregnase-1(regulatory RNase-1)と命名した7).regnase-1はIL-6 mRNAの3’側非翻訳領域に存在する,AUリッチ配列とは異なるステムループ構造に依存的にIL-6 mRNAを不安定化した.regnase-1を欠損したマウスは自発的な自己免疫炎症性の疾患を発症する.このことは,regnase-1を介したmRNAの発現制御が恒常性の維持に必要不可欠であることを示している.この研究では,Toll様受容体の刺激ののちのregnase-1の機能に関し検討を行った.
1.regnase-1はToll様受容体あるいはIL-1受容体の刺激による反応によりリン酸化され分解される
regnase-1のタンパク質レベルにおける発現を検討するため新規に抗体を作製したところ,regnase-1はタンパク質レベルにおいて刺激をうけるまえの定常状態においても発現していることが明らかになった.この結果と対応して,regnase-1を欠損した細胞では定常状態においてもIL-6 mRNAの発現が野生型の細胞と比べ上昇していた.
つぎに,regnase-1のToll様受容体あるいはIL-1受容体の刺激による変化を腹腔内マクロファージおよびHeLa細胞において検討した.regnase-1はToll様受容体あるいはIL-1受容体の刺激ののち数分間で,SDS-ポリアクリルアミドゲル電気泳動における泳動度が変化するとともに消失し,120分以内に再び発現した.一方,TNF受容体の刺激ではregnase-1は消失しなかった.解析の結果,この反応はシグナル伝達タンパク質であるMyD88,IRAK4,IRAK1,IRAK2を介していることが明らかになった.Toll様受容体あるいはIL-1受容体の刺激によるregnase-1の発現変化のキネティクスは,IκBαの発現変化と類似していた.Toll様受容体あるいはIL-1受容体の刺激によるregnase-1の泳動度の変化は脱リン酸化酵素による処理で消失し,また,Toll様受容体あるいはIL-1受容体の刺激によりregnase-1はユビキチン化されていた.さらに,阻害剤を用いた解析によりregnase-1はプロテアソームにおいて分解されていることが示された.以上の結果より,regnase-1はリン酸化され,ユビキチン-プロテアソーム系により分解されていることが明らかになった.
2.regnase-1のDSGxxSモチーフはIκBキナーゼ複合体によりリン酸化される
regnase-1をリン酸化するキナーゼを探索した.Toll様受容体あるいはIL-1受容体の刺激により活性化される各種のMAPキナーゼ(ERK,JNK,p38,PI3K)の阻害剤はregnase-1の分解を抑制しなかった.これに対して,IκBキナーゼβに特異的な阻害剤の存在下ではregnase-1の分解が抑制された.さらに,IκBキナーゼ複合体を欠損した細胞を用いてregnase-1の分解への影響を検討した.その結果,IκBキナーゼβの欠損細胞ではregnase-1の分解が部分的に抑制され,IκBキナーゼαの欠損細胞およびIκBキナーゼβの欠損細胞ではregnase-1の分解が完全に抑制された.さらに,NEMOの欠損細胞でもregnase-1の分解が完全に抑制された.したがって,regnase-1の分解にはIκBキナーゼ複合体が必須であることが明らかになった.
IκBキナーゼ複合体はIκBαのDSGxxSモチーフをリン酸化することが知られている4,5).regnase-1にもDSGxxSモチーフが存在し,IκBキナーゼ複合体が直接にregnase-1をリン酸化することがin vitroキナーゼアッセイにより示された.regnase-1のDSGxxSモチーフの435番目および439番目のセリン残基の変異体を作製したところ,IκBキナーゼαおよびIκBキナーゼβはこの変異体をリン酸化しなかった.つまり,IκBキナーゼ複合体は435番目および439番目のセリン残基を標的にregnase-1をリン酸化していることが明らかになった.
Toll様受容体あるいはIL-1受容体の刺激において,リン酸化されたIκBαはユビキチンリガーゼであるβTRCPによりユビキチン化され分解されることが知られている4,5).そこで,regnase-1,IκBキナーゼβ,βTRCPの相互作用を検討した.HEK293細胞においてIκBキナーゼβおよびβTRCPを共発現すると,regnase-1,IκBキナーゼβ,βTRCPが会合していることが示された.さらに,IκBキナーゼβのキナーゼ活性欠損変異体,および,regnase-1のリン酸化部位変異体を用いたところ,regnase-1とβTRCPとの会合は抑制されていた.つまり,regnase-1とβTRCPとの会合にはIκBキナーゼβのキナーゼ活性およびregnase-1のリン酸化部位が必要不可欠であることが示された.
筆者らは,regnase-1を欠損したマクロファージにおいてはIL-6 mRNAは安定化していることを報告している7).そこで,IκBキナーゼを介するregnase-1のリン酸化と分解がIL-6 mRNAの安定性を制御しているのかどうかを検証した.regnase-1の435番目および439番目のセリン残基の変異体は,野生型のregnase-1よりもIL-6 mRNAの発現を抑制した.以上の結果から,IκBキナーゼはregnase-1のDSGxxSモチーフをリン酸化し,βTRCPはユビキチン-プロテアソーム系の活性化に関与していることが示された.さらに,regnase-1のリン酸化はToll様受容体あるいはIL-1受容体の刺激によるIL-6 mRNAの発現増強に関与していることが示された.
3.IκBキナーゼ複合体はIL-6 mRNAの安定性の増強にはたらく
IκBキナーゼ複合体が転写の制御にくわえて,IL-6 mRNAの安定性も制御しているのかどうか検討した.IκBキナーゼ複合体においてその活性化を担う構成タンパク質であるNEMOの欠損細胞において,リポ多糖によるToll様受容体の刺激はIL-6 mRNAを安定化しなかったことから,IκBキナーゼ複合体はIL-6 mRNAを安定化していることが示された.TNFの刺激ではなく,IL-1βの刺激の20分後においてregnase-1は消失し再発現した.また,IL-1β刺激はTNF刺激よりもIL-6 mRNAの発現を高めた.そこで,IL-1βもしくはTNFの刺激の20分後からのIL-6 mRNAの半減期を測定すると,TNF刺激のときのIL-6 mRNAの半減期は無刺激のときと変わらなかったが,IL-1β刺激のときのIL-6 mRNAの半減期は延長されていた.さらに,IL-1β刺激ののちのregnase-1の再発現におけるIL-6 mRNAの半減期は,TNF刺激のときおよび無刺激のときと同様だった.以上の結果から,IκBキナーゼ複合体はToll様受容体あるいはIL-1受容体の刺激により,IκBα-NF-κBシグナル伝達経路によるサイトカイン遺伝子の転写の活性化だけでなく,regnase-1の分解を介したmRNAの安定化をも誘導していることが示された.
4.IRAK1はregnase-1と結合しこれをリン酸化する
TNF受容体ではなく,Toll様受容体あるいはIL-1受容体の刺激によりregnase-1が分解される分子機構を検討した.IκBキナーゼ複合体の活性化のみではregnase-1のリン酸化は十分ではなかった.TNF受容体,IL-1受容体およびToll様受容体の下流のシグナル伝達タンパク質は,TAK1の下流では共有されている一方,IRAK1,IRAK2,MyD88はTNF受容体の刺激ではなくToll様受容体あるいはIL-1受容体の刺激により活性化されることが知られている6)(図1).さらに,IRAKはNF-κBの活性化にくわえmRNAの安定性をも制御するが,IRAK1とIRAK2のダブルノックアウト細胞においてもMyD88の下流タンパク質であるNF-κBが活性化されていることが報告されている8,9).したがって,regnase-1の分解にはMyD88,IRAK1,IRAK2のすべてが必要であり,IκBキナーゼ複合体の単純な活性化だけでなくIRAKを介した分子機構によりregnase-1は分解されているのではないかと仮定した.この仮説を検証するためregnase-1とIRAK1との相互作用を解析したところ,IRAK1はregnase-1と結合するとともにこれを直接にリン酸化していた.さらに,regnase-1,IRAK1,IκBキナーゼβの相互作用を解析したところ,IRAK1はregnase-1とIκBキナーゼβとの会合,および,regnase-1のユビキチン化を増強した.以上の結果から,IRAK1はregnase-1を直接にリン酸化することにより,IκBキナーゼβを介したregnase-1のユビキチン化を促進しているものと考えられた.
5.regnase-1は自らのmRNAの安定性を制御する
いちどregnase-1が急速な分解を起こすと,刺激ののち60分から120分以内に再発現する.regnase-1遺伝子の転写はNF-κBなどの転写因子により制御されており,regnase-1 mRNAの発現は刺激ののちの転写を必要とする.NF-κBの活性化はIL-1βの刺激およびTNFの刺激により同様に誘導されるが,IL-1β刺激はTNF刺激よりもregnase-1 mRNAを強く発現させる.さらに,IL-1βの刺激20分後のregnase-1の半減期は無刺激のときより長くなり,これに対して,刺激240分後のregnase-1の半減期は無刺激のときのregnase-1の半減期と同様であった.以上の結果から,regnase-1 mRNAはRNA分解酵素であるregnase-1自体の標的になっているとの仮説をたてた.これを検証するため,regnase-1遺伝子の3’側非翻訳領域をもつβグロビン遺伝子をTetオフ系に組み込み,regnase-1遺伝子とともに細胞に発現させてmRNAの安定性を検討する実験系を構築した.その結果,regnase-1は自らのmRNAを安定化していることが示された.さらに,regnase-1は自らのmRNAの3’側非翻訳領域にあるステムループ構造を標的にしてこれを分解していることが示された.このように,regnase-1は自己のmRNAを標的のひとつとして分解することにより,最終的な炎症の収束および恒常性の維持にかかわっているものと考えられた.また,この制御機構のモデル化およびシミュレーションを試み,IL-1βの刺激およびTNFの刺激に対するregnase-1やIL-6の発現の違いを説明する数理モデルの構築にも成功した.
おわりに
筆者らは,IκBキナーゼ複合体がToll様受容体あるいはIL-1受容体の刺激によるIL-6 mRNAの転写だけでなく,IL-6 mRNAの安定性をも制御していることを明らかにした.そして,その安定化にはIκBキナーゼ複合体によるregnase-1の分解機構が関与していることが示された.さらに,regnase-1は自らのmRNAを負に制御することによりToll様受容体あるいはIL-1受容体の刺激による負のフィードバックに関与していることが示された(図2).これまで,IκBキナーゼ複合体によるサイトカイン遺伝子mRNAの制御は転写により行われていることが知られていた.しかしながら,転写だけでなくmRNAの安定化による制御を行うことにより,細菌感染の際にサイトカインをより迅速に発現させていることが示唆された.
IκBキナーゼ複合体はさまざまなサイトカイン遺伝子の転写を誘導することが報告されている2,10).この研究により,ほかのサイトカインや接着分子などにおいても同様の分子機構によりmRNAを制御することで迅速な誘導とのちの負のフィードバックを行っている可能性が想定される.炎症制御の転写調節機構に関してこれまでさまざまな研究がなされているが,mRNAの安定性の制御機構に関してはほとんど明らかになっていない.今後,mRNAの安定性の制御の分子機構を解析することで,炎症応答の包括的な調節機構を明らかにしていきたい.
文 献
- Takeuchi, O. & Akira, S.: Pattern recognition receptors and inflammation. Cell, 140, 805-820 (2010)[PubMed]
- Beutler, B.: Microbe sensing, positive feedback loops, and the pathogenesis of inflammatory diseases. Immunol. Rev., 227, 248-263 (2009)[PubMed]
- Medzhitov, R. & Horng, T.: Transcriptional control of the inflammatory response. Nat. Rev. Immunol., 9, 692-703 (2009)[PubMed]
- Karin, M. & Ben-Neriah, Y.: Phosphorylation meets ubiquitination: the control of NF-κB activity. Annu. Rev. Immunol., 18, 621-663 (2000)[PubMed]
- Hayden, M. S. & Ghosh, S.: Shared principles in NF-κB signaling. Cell, 132, 344-362 (2008)[PubMed]
- Anderson, P.: Post-transcriptional control of cytokine production. Nat. Immunol., 9, 353-359 (2008)[PubMed]
- Matsushita, K., Takeuchi, O., Standley, D. M. et al.: Zc3h12a is an RNase essential for controlling immune responses by regulating mRNA decay. Nature, 458, 1185-1190 (2009)[PubMed]
- Hartupee, J., Li, X. & Hamilton, T.: Interleukin 1α-induced NFκB activation and chemokine mRNA stabilization diverge at IRAK1. J. Biol. Chem., 283, 15689-15693 (2008)[PubMed]
- Wan, Y., Xiao, H., Affolter, J. et al.: Interleukin-1 receptor-associated kinase 2 is critical for lipopolysaccharide-mediated post-transcriptional control. J. Biol. Chem., 284, 10367-10375 (2009)[PubMed]
- Hao, S. & Baltimore, D.: The stability of mRNA influences the temporal order of the induction of genes encoding inflammatory molecules. Nat. Immunol., 10, 281-288 (2009)[PubMed]
著者プロフィール
略歴:2005年より日本たばこ産業医薬総合研究所 研究員,2009年より大阪大学免疫学フロンティア研究センター 特別研究員.
研究テーマ:ジンクフィンガータンパク質の免疫における役割.
抱負:迅速に,かつ,ときには慎重に,研究を進めていきたい.
竹内 理(Osamu Takeuchi)
大阪大学免疫学フロンティア研究センター 准教授.
審良 静男(Shizuo Akira)
大阪大学免疫学フロンティア研究センター 教授.
研究室URL:http://hostdefense.ifrec.osaka-u.ac.jp/ja/index.html
© 2011 岩崎秀典・竹内 理・審良静男 Licensed under CC 表示 2.1 日本