腸炎ビブリオ菌の下痢原性に寄与する新規のIII型分泌装置のエフェクターVopVの同定
日吉大貴・児玉年央
(大阪大学微生物病研究所 感染症国際研究センターゲノム病原細菌学研究グループ)
email:日吉大貴,児玉年央
DOI: 10.7875/first.author.2011.170
VopV, an F-actin-binding type III secretion effector, is required for Vibrio parahaemolyticus-induced enterotoxicity.
Hirotaka Hiyoshi, Toshio Kodama, Kazunobu Saito, Kazuyoshi Gotoh, Shigeaki Matsuda, Yukihiro Akeda, Takeshi Honda, Tetsuya Iida
Cell Host & Microbe, 10, 401-409 (2011)
多くのグラム陰性の病原細菌はIII型分泌装置とよばれるタンパク質の分泌装置をもつ.III型分泌装置はエフェクターと総称されるタンパク質性の病原因子を宿主細胞に直接に注入することができ,注入されたエフェクターの作用によりさまざまな病態が形成されるものと考えられている.これまで,筆者らは,食中毒の原因細菌である腸炎ビブリオ菌による激しい下痢には小染色体にコードされるIII型分泌装置であるT3SS2が必須であることを明らかにしてきた.しかしながら,このT3SS2に依存的な下痢原性に寄与するエフェクターはこれまで同定されていなかった.この研究では,III型分泌装置T3SS2から分泌される新規のエフェクターVopVを同定し,ウサギ腸管ループ試験により下痢原性に重要であることを見い出した.さらに,このVopVはFアクチンに結合すること,VopVのFアクチン結合活性は下痢誘導活性と相関することを明らかにした.また,コレラ毒素非産生性コレラ菌のもつIII型分泌装置やVopVのホモログであるVopMも下痢原性に重要であることが明らかになった.このことから,新規のIII型分泌装置のエフェクターVopVが種をこえて下痢の発症に重要な役割をはたしていることが示唆された.
グラム陰性細菌である腸炎ビブリオ菌(Vibrio parahaemolyticus)はわが国における主要な食中毒の原因細菌のひとつである.腸炎ビブリオ菌は汽水域に生息しているが,この細菌に汚染された生あるいは加熱が不十分な魚介類を食べることにより経口感染して炎症性の下痢をひき起こすことが知られている.刺身や寿司を好む人の多い我が国では腸炎ビブリオ菌による食中毒は高い発生件数を示していたが,厚生労働省の食中毒統計によると1998年をピークに大きく減少している.これは,魚介類の扱いに対する厚生労働省からの厳しい規制が功を奏したものと考えられる.しかしながら,近年では世界各国から腸炎ビブリオ菌による集団感染の報告が増加しており1),腸炎ビブリオ菌による下痢の発症機構の解明は重要である.
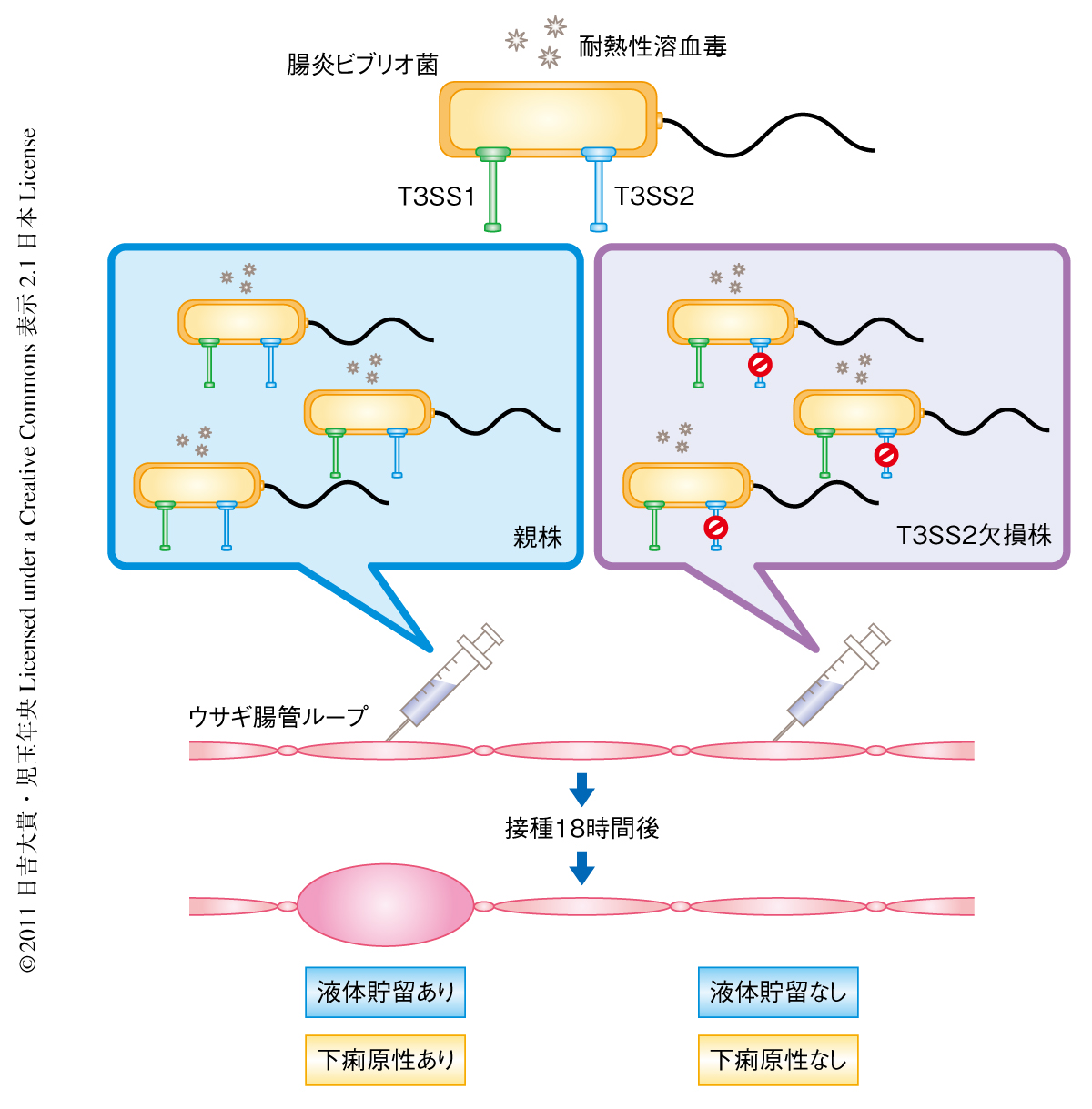
この細菌による下痢症患者から分離された多くの腸炎ビブリオ菌は耐熱性溶血毒(thermostable direct hemolysin:TDH)をコードする遺伝子を保有している.この耐熱性溶血毒の活性は我妻培地とよばれるヒト赤血球を用いた血液寒天培地においてβ溶血を示す.この現象は神奈川現象とよばれ,病原株と非病原株とを区別するための指標として疫学的に重要な意味をもつ2).また,精製した耐熱性溶血毒が溶血活性だけでなく腸管毒性活性ももつことから,耐熱性溶血毒は腸炎ビブリオ菌における主要な病原因子と考えられてきた3).ところが,耐熱性溶血毒の遺伝子をもつ神奈川現象陽性の腸炎ビブリオ菌は大小2つの染色体のそれぞれにIII型分泌装置遺伝子群であるT3SS1遺伝子群およびT3SS2遺伝子群を保有していることが明らかにされた4).III型分泌装置(type III secretion system:T3SS)とは注射針様の構造をしたタンパク質の分泌装置であり,細菌のなかでつくられた多種多様なエフェクターとよばれるタンパク質を宿主細胞のなかに打ち込むはたらきをもっている.腸管出血性大腸菌,サルモネラ菌や赤痢菌など,多くのグラム陰性の病原細菌に特化した病原因子として知られており,打ち込んだエフェクターの作用により宿主にさまざまな病態変化をひき起こす5).筆者らは,これまでに,腸炎ビブリオ菌の下痢原性を評価するための唯一の動物モデルであるウサギ腸管ループ試験により,耐熱性溶血毒やT3SS1ではなく,III型分泌装置のうちT3SS2が腸炎ビブリオ菌の下痢原性に必須であることを明らかにした6)(図1).この結果にくわえ,T3SS2遺伝子群は耐熱性溶血毒を保持している神奈川現象陽性の菌株が特異的に保有しているという疫学的な観点からも7),腸炎ビブリオ菌による激しい下痢症状にT3SS2が強く関与していることが示唆された.しかし,T3SS2から分泌されるさまざまなエフェクターのうち,どのエフェクターが下痢の発症に寄与しているかはこれまで明らかにされていなかった.
この研究では,腸炎ビブリオ菌のもつIII型分泌装置T3SS2の新規のエフェクターとしてVopVを同定し,腸炎ビブリオ菌の下痢原性に重要であることを明らかにした.さらに,VopVがFアクチンに対する結合活性をもつこと,この活性が下痢誘導活性と相関することを示した.
腸炎ビブリオ菌のIII型分泌装置T3SS2から分泌され宿主細胞に打ち込まれるエフェクターとしては,これまでに5種が知られている.しかしながら,それらエフェクターのT3SS2に依存的な下痢原性への関与を評価した報告はなかった.そこで,T3SS2に依存的な腸炎ビブリオ菌の下痢原性に寄与するエフェクターを同定するため,まず,既知の5種のエフェクターが下痢原性に寄与するかどうかウサギ腸管ループ試験により評価した.しかしながら,それらの下痢原性への寄与は顕著ではなかった.この結果から,既知のエフェクターのほかにT3SS2に依存的な下痢原性に寄与する未知のエフェクターの存在する可能性が考えられた.
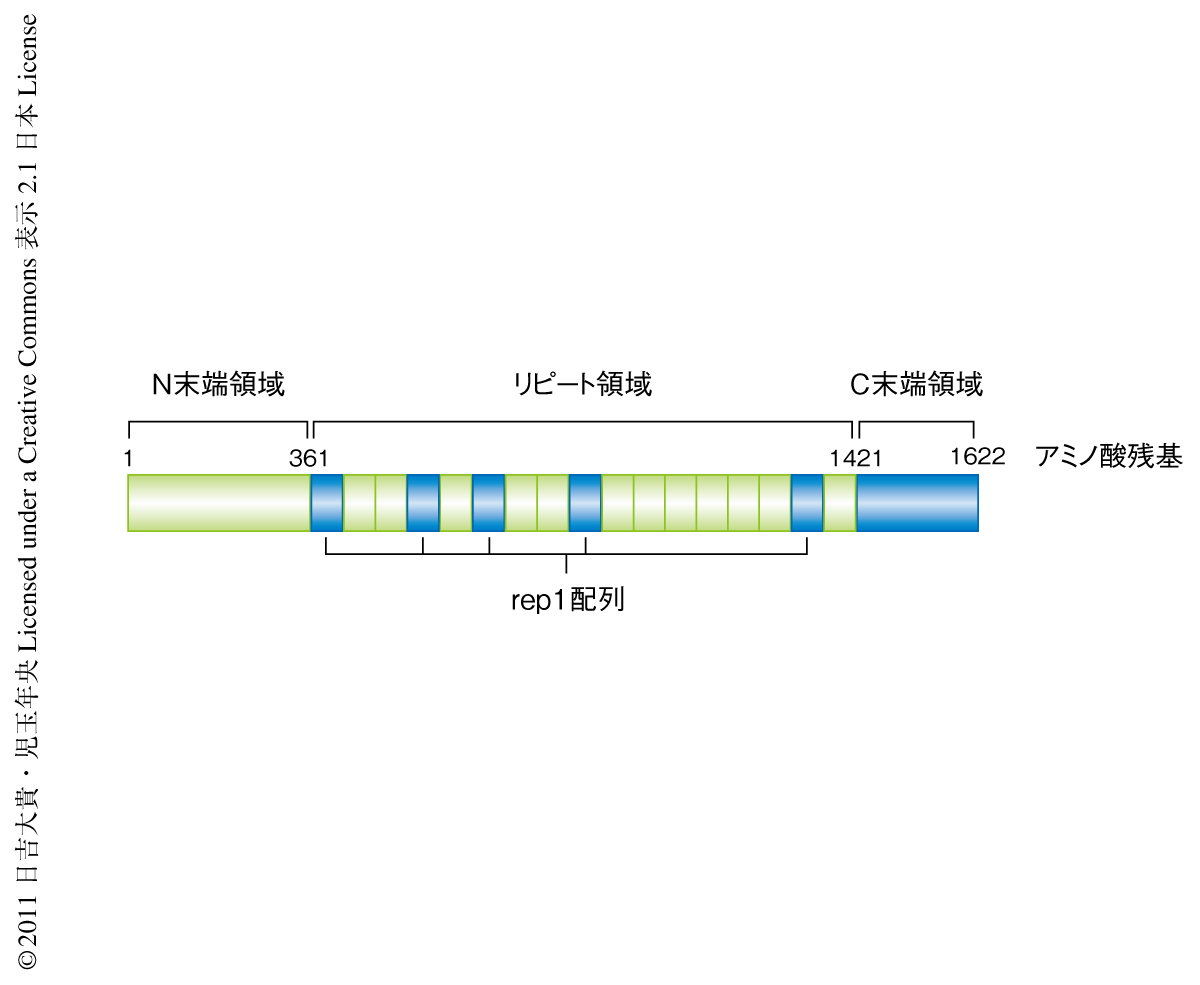
そこで,親株とT3SS2欠損株の培養液に分泌されたタンパク質をプロテオーム解析することによりIII型分泌装置T3SS2から分泌される新規のエフェクターの同定を試みた.その結果,T3SS2の新規のエフェクターの候補としてVopVが同定された.さらなる解析により,このVopVがT3SS2に依存的に分泌され,さらに,T3SS2に依存的に宿主細胞に打ち込まれていることを確認できたことから,VopVはT3SS2の新規のエフェクターであると結論づけた.VopVのアミノ酸配列からはその機能が推測できるようなドメインやモチーフを見い出すことはできなかったが,全長の半分以上は特徴的なリピート領域でしめられており,1622アミノ酸残基と既存のエフェクターと比べるとかなり大きなサイズのエフェクターであることがわかった(図2).
VopVがT3SS2に依存的な腸炎ビブリオ菌の下痢原性に寄与するのかどうかを確認するため,vopV遺伝子欠損株を作製しウサギ腸管ループ試験により評価した.その結果,親株の接種で認められる強い下痢原性(ウサギ腸管ループにおける液体貯留活性,および,病理組織学的な所見により認められる激しい炎症像)は,vopV遺伝子欠損株においてT3SS2欠損株や非感染株と同じ程度にまで低下することが明らかになった.また,低下した下痢原性はvopV遺伝子の相補により親株と同じ程度にまで回復した.これらのことから,同定された新規のエフェクターVopVはIII型分泌装置T3SS2に依存的な腸炎ビブリオ菌の下痢原性に必須であることが明らかになった.
宿主細胞に打ち込まれたエフェクターの多くが宿主のもつなんらかのタンパク質と相互作用することが知られており,標的タンパク質の特定はそのエフェクターの機能を理解するうえで重要である.そこで,VopVと相互作用する宿主細胞のタンパク質の同定をプルダウンアッセイにより試みた.その結果,精製したVopVと特異的に相互作用するタンパク質が認められ,これを質量分析により解析したところβアクチンであることが明らかになった.この結合は精製したVopVとFアクチンとを用いた共沈試験においても認められることから,これらは直接に結合していることが確認された.さらなる解析により,VopVのC末端領域,および,リピート領域に5つ存在する68残基からなる短いアミノ酸配列rep1がそれぞれ独立してFアクチンと結合することが明らかになった(図2).さらに,このようにFアクチン結合部位が複数あることにより,VopVがFアクチンを束化する活性をもつことも見い出された.
VopVのFアクチン結合活性がVopVの下痢原性に関与するのかどうか,いくつかのVopV変異体を分泌する菌株を作製しウサギ腸管ループ試験により評価した.その結果,Fアクチンに結合する部位をすべて削除した360アミノ酸残基からなるN末端領域のみでは下痢原性は認められなくなったが,そこにFアクチン結合活性をもつC末端領域またはリピート領域に存在するrep1配列を連結することで全長のVopVと同じ程度の下痢原性を回復できることが明らかになった.このことから,VopVによる下痢原性の発揮にはFアクチン結合活性が必須であることが示唆された.
コレラ菌(Vibrio cholerae)はコレラ毒素によりヒトに激しい下痢(コレラ)をひき起こす.しかし,コレラ毒素を産生しないコレラ毒素非産生性コレラ菌もまた散発的に炎症下痢の集団感染をひき起こすことが知られている8).このようなコレラ毒素非産生性コレラ菌の病原因子としてエルトールヘモリジンが下痢原性に寄与するとの報告があるが,それのみではコレラ毒素非産生性コレラ菌の下痢原性を十分に説明できないことからほかの病原因子の存在が示唆されていた9).近年,コレラ毒素非産生性コレラ菌が腸炎ビブリオ菌のT3SS2遺伝子群に類似したIII型分泌装置遺伝子群をもつことが報告された10).さらに,その遺伝子群のなかにVopVのホモログであるVopMの遺伝子が存在していることを確認することができた.このことから,コレラ毒素非産生性コレラ菌のIII型分泌装置やVopMもまた下痢原性に寄与している可能性が考えられたため,それらの欠損株を作製しウサギ腸管ループ試験により評価した.
ウサギ腸管ループ試験においてコレラ毒素非産生性コレラ菌の野生株は腸炎ビブリオ菌と同様に強い下痢原性を示した.この下痢原性はエルトールヘモリジンの遺伝子を欠損させることで若干の低下がみられたが,その大部分は残存していた.しかし,その残存していた下痢原性はIII型分泌装置の欠損株やvopM遺伝子欠損株において非感染株と同じ程度にまで低下することが見い出された.さらに,低下した下痢原性はvopM遺伝子だけでなくvopV遺伝子の相補により完全に回復した.このことから,新規のIII型分泌装置のエフェクターであるVopVが種をこえてVibrio属細菌による下痢の発症に重要な役割をはたしていることが示唆された.
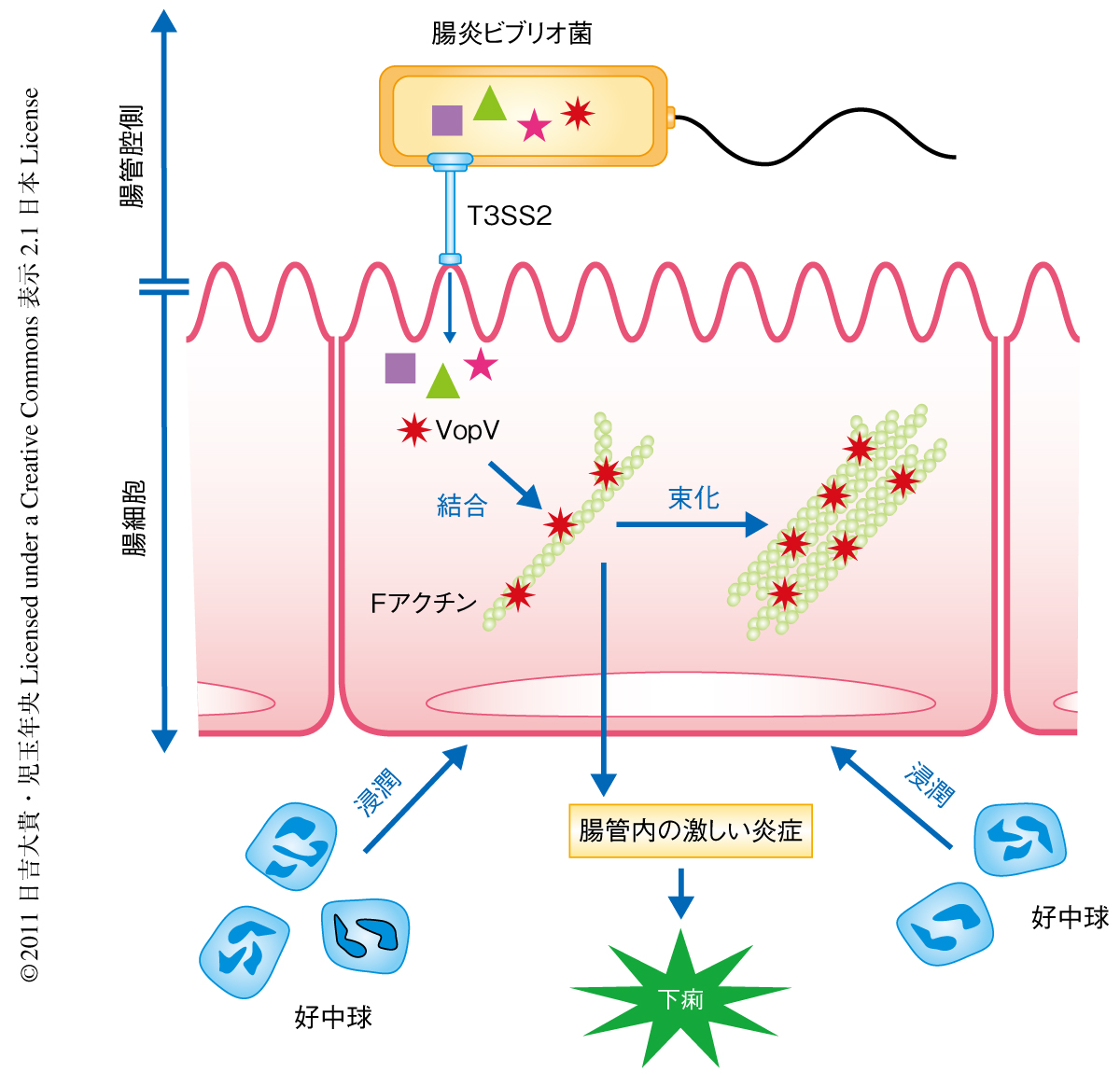
この研究により,腸炎ビブリオ菌による激しい下痢にIII型分泌装置T3SS2から分泌される新規のエフェクターVopVが重要な役割をはたしていることが明らかになった(図3).さらに,コレラ毒素非産生性コレラ菌のIII型分泌装置やVopVのホモログであるVopMがその下痢原性に重要であることも示された.VopVがFアクチンに結合することでどのように下痢原性を発揮するのかなど不明な点はまだまだ多く残されているが,VopVの機能をさらに解析することにより,腸炎ビブリオ菌だけでなくコレラ菌の下痢の発症機構の解明にもつながる可能性が期待される.
略歴:2010年 大阪大学大学院医学系研究科博士課程 修了,同年より大阪大学微生物病研究所 特任研究員.
研究テーマ:腸炎ビブリオ菌のもつIII型分泌装置T3SS2のエフェクターの解析.
関心事:宿主免疫と病原細菌の相互作用.
児玉 年央(Toshio Kodama)
大阪大学微生物病研究所 助教.
© 2011 日吉大貴・児玉年央 Licensed under CC 表示 2.1 日本
(大阪大学微生物病研究所 感染症国際研究センターゲノム病原細菌学研究グループ)
email:日吉大貴,児玉年央
DOI: 10.7875/first.author.2011.170
VopV, an F-actin-binding type III secretion effector, is required for Vibrio parahaemolyticus-induced enterotoxicity.
Hirotaka Hiyoshi, Toshio Kodama, Kazunobu Saito, Kazuyoshi Gotoh, Shigeaki Matsuda, Yukihiro Akeda, Takeshi Honda, Tetsuya Iida
Cell Host & Microbe, 10, 401-409 (2011)
要 約
多くのグラム陰性の病原細菌はIII型分泌装置とよばれるタンパク質の分泌装置をもつ.III型分泌装置はエフェクターと総称されるタンパク質性の病原因子を宿主細胞に直接に注入することができ,注入されたエフェクターの作用によりさまざまな病態が形成されるものと考えられている.これまで,筆者らは,食中毒の原因細菌である腸炎ビブリオ菌による激しい下痢には小染色体にコードされるIII型分泌装置であるT3SS2が必須であることを明らかにしてきた.しかしながら,このT3SS2に依存的な下痢原性に寄与するエフェクターはこれまで同定されていなかった.この研究では,III型分泌装置T3SS2から分泌される新規のエフェクターVopVを同定し,ウサギ腸管ループ試験により下痢原性に重要であることを見い出した.さらに,このVopVはFアクチンに結合すること,VopVのFアクチン結合活性は下痢誘導活性と相関することを明らかにした.また,コレラ毒素非産生性コレラ菌のもつIII型分泌装置やVopVのホモログであるVopMも下痢原性に重要であることが明らかになった.このことから,新規のIII型分泌装置のエフェクターVopVが種をこえて下痢の発症に重要な役割をはたしていることが示唆された.
はじめに
グラム陰性細菌である腸炎ビブリオ菌(Vibrio parahaemolyticus)はわが国における主要な食中毒の原因細菌のひとつである.腸炎ビブリオ菌は汽水域に生息しているが,この細菌に汚染された生あるいは加熱が不十分な魚介類を食べることにより経口感染して炎症性の下痢をひき起こすことが知られている.刺身や寿司を好む人の多い我が国では腸炎ビブリオ菌による食中毒は高い発生件数を示していたが,厚生労働省の食中毒統計によると1998年をピークに大きく減少している.これは,魚介類の扱いに対する厚生労働省からの厳しい規制が功を奏したものと考えられる.しかしながら,近年では世界各国から腸炎ビブリオ菌による集団感染の報告が増加しており1),腸炎ビブリオ菌による下痢の発症機構の解明は重要である.
この細菌による下痢症患者から分離された多くの腸炎ビブリオ菌は耐熱性溶血毒(thermostable direct hemolysin:TDH)をコードする遺伝子を保有している.この耐熱性溶血毒の活性は我妻培地とよばれるヒト赤血球を用いた血液寒天培地においてβ溶血を示す.この現象は神奈川現象とよばれ,病原株と非病原株とを区別するための指標として疫学的に重要な意味をもつ2).また,精製した耐熱性溶血毒が溶血活性だけでなく腸管毒性活性ももつことから,耐熱性溶血毒は腸炎ビブリオ菌における主要な病原因子と考えられてきた3).ところが,耐熱性溶血毒の遺伝子をもつ神奈川現象陽性の腸炎ビブリオ菌は大小2つの染色体のそれぞれにIII型分泌装置遺伝子群であるT3SS1遺伝子群およびT3SS2遺伝子群を保有していることが明らかにされた4).III型分泌装置(type III secretion system:T3SS)とは注射針様の構造をしたタンパク質の分泌装置であり,細菌のなかでつくられた多種多様なエフェクターとよばれるタンパク質を宿主細胞のなかに打ち込むはたらきをもっている.腸管出血性大腸菌,サルモネラ菌や赤痢菌など,多くのグラム陰性の病原細菌に特化した病原因子として知られており,打ち込んだエフェクターの作用により宿主にさまざまな病態変化をひき起こす5).筆者らは,これまでに,腸炎ビブリオ菌の下痢原性を評価するための唯一の動物モデルであるウサギ腸管ループ試験により,耐熱性溶血毒やT3SS1ではなく,III型分泌装置のうちT3SS2が腸炎ビブリオ菌の下痢原性に必須であることを明らかにした6)(図1).この結果にくわえ,T3SS2遺伝子群は耐熱性溶血毒を保持している神奈川現象陽性の菌株が特異的に保有しているという疫学的な観点からも7),腸炎ビブリオ菌による激しい下痢症状にT3SS2が強く関与していることが示唆された.しかし,T3SS2から分泌されるさまざまなエフェクターのうち,どのエフェクターが下痢の発症に寄与しているかはこれまで明らかにされていなかった.
この研究では,腸炎ビブリオ菌のもつIII型分泌装置T3SS2の新規のエフェクターとしてVopVを同定し,腸炎ビブリオ菌の下痢原性に重要であることを明らかにした.さらに,VopVがFアクチンに対する結合活性をもつこと,この活性が下痢誘導活性と相関することを示した.
1.VopVはIII型分泌装置T3SS2に依存的な下痢原性に必須である
腸炎ビブリオ菌のIII型分泌装置T3SS2から分泌され宿主細胞に打ち込まれるエフェクターとしては,これまでに5種が知られている.しかしながら,それらエフェクターのT3SS2に依存的な下痢原性への関与を評価した報告はなかった.そこで,T3SS2に依存的な腸炎ビブリオ菌の下痢原性に寄与するエフェクターを同定するため,まず,既知の5種のエフェクターが下痢原性に寄与するかどうかウサギ腸管ループ試験により評価した.しかしながら,それらの下痢原性への寄与は顕著ではなかった.この結果から,既知のエフェクターのほかにT3SS2に依存的な下痢原性に寄与する未知のエフェクターの存在する可能性が考えられた.
そこで,親株とT3SS2欠損株の培養液に分泌されたタンパク質をプロテオーム解析することによりIII型分泌装置T3SS2から分泌される新規のエフェクターの同定を試みた.その結果,T3SS2の新規のエフェクターの候補としてVopVが同定された.さらなる解析により,このVopVがT3SS2に依存的に分泌され,さらに,T3SS2に依存的に宿主細胞に打ち込まれていることを確認できたことから,VopVはT3SS2の新規のエフェクターであると結論づけた.VopVのアミノ酸配列からはその機能が推測できるようなドメインやモチーフを見い出すことはできなかったが,全長の半分以上は特徴的なリピート領域でしめられており,1622アミノ酸残基と既存のエフェクターと比べるとかなり大きなサイズのエフェクターであることがわかった(図2).
VopVがT3SS2に依存的な腸炎ビブリオ菌の下痢原性に寄与するのかどうかを確認するため,vopV遺伝子欠損株を作製しウサギ腸管ループ試験により評価した.その結果,親株の接種で認められる強い下痢原性(ウサギ腸管ループにおける液体貯留活性,および,病理組織学的な所見により認められる激しい炎症像)は,vopV遺伝子欠損株においてT3SS2欠損株や非感染株と同じ程度にまで低下することが明らかになった.また,低下した下痢原性はvopV遺伝子の相補により親株と同じ程度にまで回復した.これらのことから,同定された新規のエフェクターVopVはIII型分泌装置T3SS2に依存的な腸炎ビブリオ菌の下痢原性に必須であることが明らかになった.
2.VopVはFアクチンに直接に結合する
宿主細胞に打ち込まれたエフェクターの多くが宿主のもつなんらかのタンパク質と相互作用することが知られており,標的タンパク質の特定はそのエフェクターの機能を理解するうえで重要である.そこで,VopVと相互作用する宿主細胞のタンパク質の同定をプルダウンアッセイにより試みた.その結果,精製したVopVと特異的に相互作用するタンパク質が認められ,これを質量分析により解析したところβアクチンであることが明らかになった.この結合は精製したVopVとFアクチンとを用いた共沈試験においても認められることから,これらは直接に結合していることが確認された.さらなる解析により,VopVのC末端領域,および,リピート領域に5つ存在する68残基からなる短いアミノ酸配列rep1がそれぞれ独立してFアクチンと結合することが明らかになった(図2).さらに,このようにFアクチン結合部位が複数あることにより,VopVがFアクチンを束化する活性をもつことも見い出された.
3.Fアクチン結合活性はVopVに依存的な下痢原性に必須である
VopVのFアクチン結合活性がVopVの下痢原性に関与するのかどうか,いくつかのVopV変異体を分泌する菌株を作製しウサギ腸管ループ試験により評価した.その結果,Fアクチンに結合する部位をすべて削除した360アミノ酸残基からなるN末端領域のみでは下痢原性は認められなくなったが,そこにFアクチン結合活性をもつC末端領域またはリピート領域に存在するrep1配列を連結することで全長のVopVと同じ程度の下痢原性を回復できることが明らかになった.このことから,VopVによる下痢原性の発揮にはFアクチン結合活性が必須であることが示唆された.
4.コレラ毒素非産生性コレラ菌のIII型分泌装置およびVopVホモログも下痢原性に重要である
コレラ菌(Vibrio cholerae)はコレラ毒素によりヒトに激しい下痢(コレラ)をひき起こす.しかし,コレラ毒素を産生しないコレラ毒素非産生性コレラ菌もまた散発的に炎症下痢の集団感染をひき起こすことが知られている8).このようなコレラ毒素非産生性コレラ菌の病原因子としてエルトールヘモリジンが下痢原性に寄与するとの報告があるが,それのみではコレラ毒素非産生性コレラ菌の下痢原性を十分に説明できないことからほかの病原因子の存在が示唆されていた9).近年,コレラ毒素非産生性コレラ菌が腸炎ビブリオ菌のT3SS2遺伝子群に類似したIII型分泌装置遺伝子群をもつことが報告された10).さらに,その遺伝子群のなかにVopVのホモログであるVopMの遺伝子が存在していることを確認することができた.このことから,コレラ毒素非産生性コレラ菌のIII型分泌装置やVopMもまた下痢原性に寄与している可能性が考えられたため,それらの欠損株を作製しウサギ腸管ループ試験により評価した.
ウサギ腸管ループ試験においてコレラ毒素非産生性コレラ菌の野生株は腸炎ビブリオ菌と同様に強い下痢原性を示した.この下痢原性はエルトールヘモリジンの遺伝子を欠損させることで若干の低下がみられたが,その大部分は残存していた.しかし,その残存していた下痢原性はIII型分泌装置の欠損株やvopM遺伝子欠損株において非感染株と同じ程度にまで低下することが見い出された.さらに,低下した下痢原性はvopM遺伝子だけでなくvopV遺伝子の相補により完全に回復した.このことから,新規のIII型分泌装置のエフェクターであるVopVが種をこえてVibrio属細菌による下痢の発症に重要な役割をはたしていることが示唆された.
おわりに
この研究により,腸炎ビブリオ菌による激しい下痢にIII型分泌装置T3SS2から分泌される新規のエフェクターVopVが重要な役割をはたしていることが明らかになった(図3).さらに,コレラ毒素非産生性コレラ菌のIII型分泌装置やVopVのホモログであるVopMがその下痢原性に重要であることも示された.VopVがFアクチンに結合することでどのように下痢原性を発揮するのかなど不明な点はまだまだ多く残されているが,VopVの機能をさらに解析することにより,腸炎ビブリオ菌だけでなくコレラ菌の下痢の発症機構の解明にもつながる可能性が期待される.
文 献
- Nair, G. B., Ramamurthy, T., Bhattacharya, S. K. et al.: Global dissemination of Vibrio parahaemolyticus serotype O3:K6 and its serovariants. Clin. Microbiol. Rev., 20, 39-48 (2007)[PubMed]
- Zen-Yoji, H., Hitokoto, H., Morozumi, S. et al.: Purification and characterization of a hemolysin produced by Vibrio parahaemolyticus. J. Infect. Dis., 123, 665-667 (1971)[PubMed]
- Miyamoto, Y., Obara, Y., Nikkawa, T. et al.: Simplified purification and biophysicochemical characteristics of Kanagawa phenomenon-associated hemolysin of Vibrio parahaemolyticus. Infect. Immun., 28, 567-576 (1980)[PubMed]
- Makino, K., Oshima, K., Kurokawa, K. et al.: Genome sequence of Vibrio parahaemolyticus: a pathogenic mechanism distinct from that of V cholerae. Lancet, 361, 743-749 (2003)[PubMed]
- Galan, J. E.: Common themes in the design and function of bacterial effectors. Cell Host Microbe, 5, 571-579 (2009)[PubMed]
- Hiyoshi, H., Kodama, T., Iida, T. et al.: Contribution of Vibrio parahaemolyticus virulence factors to cytotoxicity, enterotoxicity, and lethality in mice. Infect. Immun., 78, 1772-1780 (2010)[PubMed]
- Okada, N., Iida, T., Park, K. S. et al.: Identification and characterization of a novel type III secretion system in trh-positive Vibrio parahaemolyticus strain TH3996 reveal genetic lineage and diversity of pathogenic machinery beyond the species level. Infect. Immun., 77, 904-913 (2009)[PubMed]
- Ramamurthy, T., Bag, P. K., Pal, A. et al.: Virulence patterns of Vibrio cholerae non-O1 strains isolated from hospitalised patients with acute diarrhoea in Calcutta, India. J. Med. Microbiol., 39, 310-317 (1993)[PubMed]
- Faruque, S. M., Chowdhury, N., Kamruzzaman, M. et al.: Genetic diversity and virulence potential of environmental Vibrio cholerae population in a cholera-endemic area. Proc. Natl. Acad. Sci. USA, 101, 2123-2128 (2004)[PubMed]
- Dziejman, M., Serruto, D., Tam, V. C. et al.: Genomic characterization of non-O1, non-O139 Vibrio cholerae reveals genes for a type III secretion system. Proc. Natl. Acad. Sci. USA, 102, 3465-3470 (2005)[PubMed]
著者プロフィール
略歴:2010年 大阪大学大学院医学系研究科博士課程 修了,同年より大阪大学微生物病研究所 特任研究員.
研究テーマ:腸炎ビブリオ菌のもつIII型分泌装置T3SS2のエフェクターの解析.
関心事:宿主免疫と病原細菌の相互作用.
児玉 年央(Toshio Kodama)
大阪大学微生物病研究所 助教.
© 2011 日吉大貴・児玉年央 Licensed under CC 表示 2.1 日本