X染色体連鎖性精神遅滞の原因遺伝子の産物であるOligophrenin 1は代謝型グルタミン酸受容体の活性化により新規に翻訳され長期抑制に機能する
小林 亜希子
(米国Cold Spring Harbor Laboratory)
email:小林亜希子
DOI: 10.7875/first.author.2011.166
Rapid synthesis of the X-linked mental retardation protein OPHN1 mediates mGluR-dependent LTD through interaction with the endocytic machinery.
Nael Nadif Kasri, Akiko Nakano-Kobayashi, Linda Van Aelst
Neuron, 72, 300-315 (2011)
代謝型グルタミン酸受容体の活性化は長期抑制をひき起こし,その異常は薬物中毒や認知障害との関与が示唆されている.その分子機構において代謝型グルタミン酸受容体の活性化により長期抑制に必須の一群のタンパク質が新規に翻訳されるが,そのようなタンパク質のうち同定および機能解析されたものはまだ少ない.この論文では,X染色体連鎖性精神遅滞の原因遺伝子の産物であるOligophrenin 1が代謝型グルタミン酸受容体の活性化により新規に翻訳され,この新たに合成されたOligophrenin 1は長期抑制に必須であること,Oligophrenin 1はエンドサイトーシスに必須のタンパク質Endophilinと結合しAMPA型グルタミン酸受容体のエンドサイトーシスを制御することを明らかにした.
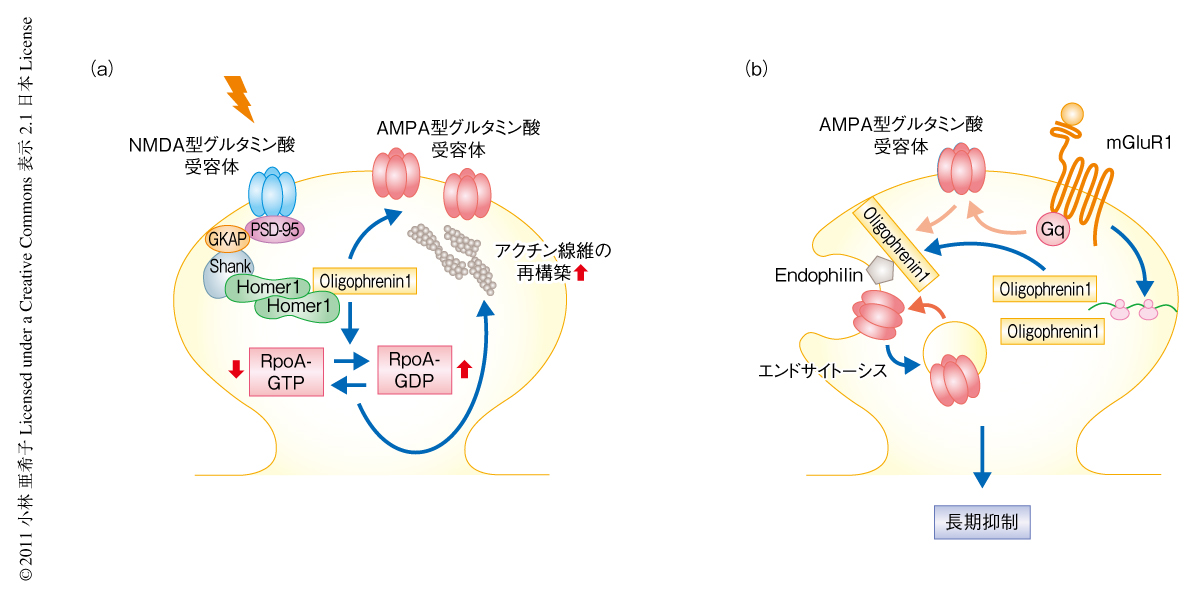
シナプス可塑性のひとつである長期抑制(long-term depression:LTD)はシナプス伝達の効率が持続的に低下する現象であり,とくに,代謝型グルタミン酸受容体の活性化によりひき起こされる長期抑制は薬物中毒や認知障害との関連が示唆されている1).この長期抑制には代謝型グルタミン酸受容体の刺激に依存して短時間のうちに新規のタンパク質の合成が必要である2).その分子機構は,代謝型グルタミン酸受容体の活性化により長期抑制に必要な一群のタンパク質が新規に特異的に翻訳され,これらのタンパク質がシナプスの表面に発現しているAMPA型グルタミン酸受容体のエンドサイトーシスを亢進することで長期抑制をひき起こす1-4),というものである(図1a).
非徴候性のX染色体連鎖性精神遅滞(X-linked mental retardation)の原因遺伝子のひとつとして同定されたOligophrenin 1遺伝子は低分子量GTP結合タンパク質RhoAのGTPase活性化タンパク質(Rho-GAP)をコードし,その機能の欠損がOligophrenin 1遺伝子に変異をもつX染色体連鎖性精神遅滞患者における病態と関連づけられている5).筆者らは,以前に,Oligophrenin 1が神経活動に依存的な興奮性シナプスの成熟および可塑性に重要な機能をはたしていることを明らかにした6).また,Oligophrenin 1は後シナプスの足場タンパク質であるHomer1と結合し後シナプスにおけるスパインの形態および形成に重要な役割をもつこと7),また,エンドサイトーシスに必須のタンパク質であるEndophilinと結合し前シナプスにおいてシナプス小胞の回収に関与すること8),を明らかにした.Oligophrenin 1と相互作用するこれら2つのタンパク質が代謝型グルタミン酸受容体の活性化による長期抑制に関与することが報告されていたことから,筆者らは,Oligophrenin 1がこの長期抑制に機能しているかどうかを解析した.
興奮性シナプスにおけるOligophrenin 1遺伝子の発現抑制の表現型を解析するため,ラットの海馬CA1領域の切片培養において興奮性ニューロンにレンチウイルスを用いてOligophrenin 1 mRNAを標的としたshRNAを導入し8日間培養した.この海馬の切片培養を用い代謝型グルタミン酸受容体のアゴニストで刺激することで代謝型グルタミン酸受容体の活性化による長期抑制を解析した.その結果,代謝型グルタミン酸受容体の活性化で誘導される長期抑制はOligophrenin 1遺伝子の発現抑制により阻害されることを見い出した.一方,Oligophrenin 1遺伝子の発現抑制により定常状態におけるシナプス伝達の低下も観察されたことから,Oligophrenin 1遺伝子の発現を抑制したときの代謝型グルタミン酸受容体の活性化による長期抑制の阻害は,この定常状態におけるシナプス伝達の低下によるものである可能性も考えられた.そこで,Oligophrenin 1がこの長期抑制そのものに機能をはたしているのか,あるいは,定常状態におけるシナプス伝達の制御を介して長期抑制に影響をあたえているのかを検討するため,Oligophrenin 1の結合タンパク質およびOligophrenin 1のRhoA-GAP活性に着目した.
筆者らは以前に,Oligophrenin 1の結合タンパク質を酵母ツーハイブリッド法によりスクリーニングしエンドサイトーシスに必須のタンパク質であるEndophilinを同定した8).代謝型グルタミン酸受容体の活性化による長期抑制はシナプスに発現するAMPA型グルタミン酸受容体がエンドサイトーシスの亢進により減少することに起因することから3),Oligophrenin 1がEndophilinとの結合を介しAMPA型グルタミン酸受容体のエンドサイトーシスを制御する可能性を検討した.Oligophrenin 1のEndophilinとの結合部位ペプチドを用いてOligophrenin 1とEndophilinとの相互作用を阻害した結果,代謝型グルタミン酸受容体の活性化によりひき起こされるシナプスでのAMPA型グルタミン酸受容体量の減少が抑制された.さらに,このEndophilin結合部位ペプチドを用いて定常状態におけるシナプス伝達および代謝型グルタミン酸受容体の活性化による長期抑制を解析したところ,シナプス伝達に変化はなかったが長期抑制は阻害された.くわえて,Endophilinと結合できないOligophrenin 1変異体をOligophrenin 1 shRNAと同時に導入し同様の実験を行った結果,この変異体はOligophrenin 1 shRNAによる定常状態におけるシナプス伝達の低下を相補するが,長期抑制の抑制は相補できないことを見い出した.以上の結果より,Oligophrenin 1とEndophilinとの結合は定常状態におけるシナプス伝達には必要ないが,Oligophrenin 1はこの結合を介して代謝型グルタミン酸受容体の刺激に依存してAMPA型グルタミン酸受容体のエンドサイトーシスを促進し長期抑制を制御していることが示された.
対照的に,Rho-GAP活性をもたないOligophrenin 1変異体,あるいは,Homer1と結合できないOligophrenin 1変異体をOligophrenin 1 shRNAとともに発現させた実験では,両方の変異体とも定常状態におけるシナプス伝達の低下を相補できなかった.このことから,Oligophrenin 1のRho-GAP活性およびHomer1との結合能は定常状態におけるシナプス伝達に必要であることが明らかになった.また,Oligophrenin 1のHomer1との結合部位ペプチドを用いて代謝型グルタミン酸受容体の活性化による長期抑制を解析したところ,長期抑制は正常でありOligophrenin 1とHomer1との結合は長期抑制を介在しないことが示された.
さきに述べたように,代謝型グルタミン酸受容体の活性化による長期抑制には新たなタンパク質の合成が必要であることが知られている2)(図1a).Oligophrenin 1がこの長期抑制に必須であるという結果をふまえ,代謝型グルタミン酸受容体の活性化によりOligophrenin 1の発現が制御されるかどうかを検討した.その結果,代謝型グルタミン酸受容体の活性化によりOligophrenin 1のタンパク質量が劇的に増大すること,この増加は翻訳に依存的であることを見い出した.さらに,このOligophrenin 1の新規の合成が代謝型グルタミン酸受容体の活性化による長期抑制に必須であるかどうかを検討するため,Oligophrenin 1 mRNAを標的にしたsiRNAを30分間から1時間という短時間だけ処置することで,存在する内在性のOligophrenin 1のタンパク質レベルに影響をあたえることなく新規のOligophrenin 1の合成のみを抑制する実験を試みた.その結果,このsiRNAは代謝型グルタミン酸受容体によるAMPA型グルタミン酸受容体のエンドサイトーシスの亢進を阻害し長期抑制を抑制することが明らかになった.以上の結果より,Oligophrenin 1は代謝型グルタミン酸受容体の活性化により新規に翻訳され長期抑制に機能することが示された.
脆弱性X染色体連鎖症候群(fragile X-syndrome)の原因遺伝子FMR1のコードするFMRPはRNA結合タンパク質であり,代謝型グルタミン酸受容体の活性化により翻訳されるmRNAに特異的に結合し,通常の状態ではその翻訳を負に制御しているものと考えられている5)(図1b).FMRPノックアウトマウスでは長期抑制に必須のタンパク質の通常状態での発現レベルの上昇,および,代謝型グルタミン酸受容体の活性化による長期抑制の亢進が観察されており9)(図1b),長期抑制の異常と認知障害および学習障害などの疾患との関連が示唆されている4).
そこで,代謝型グルタミン酸受容体の活性化によるOligophrenin 1の新規の合成がFMRPにより制御されているかどうか,FMRPノックアウトマウスを用いて解析した.その結果,野生型マウスと同様にFMRPノックアウトマウスにおいても代謝型グルタミン酸受容体の活性化によりOligophrenin 1の発現が誘導されたことから,その合成はFMRPに非依存的であることが示された.代謝型グルタミン酸受容体の活性化により新規に翻訳される長期抑制に必須の一群のタンパク質のうち,FMRPに依存しないことが明らかにされたのはOligophrenin 1がはじめてであった.
I型に属する代謝型グルタミン酸受容体にはmGluR1とmGluR5があり両方とも代謝型グルタミン酸受容体の活性化による長期抑制に必須であるが,とくにFMRPの欠損による数々の表現型がmGluR5を阻害あるいは抑制することにより相補されるという知見からmGluR5が大きく脚光をあびている10).しかしながら,I型代謝型グルタミン酸受容体アゴニストによるOligophrenin 1の発現上昇は,mGluR5に特異的な阻害剤ではなく,mGluR1に特異的な阻害剤により抑制されることが見い出だされ,Oligophrenin 1の翻訳制御はmGluR1に依存的であることが明らかになった.これらの結果は,従来のmGluR5-FMRPシグナル伝達経路とは異なる新規の分子機構の存在を示すものであった.
この研究は,X連鎖性精神遅滞の原因遺伝子の産物であるOligophrenin 1が代謝型グルタミン酸受容体の活性化により新規に翻訳される長期抑制に必須のタンパク質であり,Endophilinとの結合を介してこの長期抑制に機能することを示した.また,Oligophrenin 1のRho-GAP活性およびHomer1との結合能は定常状態におけるシナプス伝達に必要である一方で,Endophilinとの結合はAMPA型グルタミン酸受容体のエンドサイトーシスを介した代謝型グルタミン酸受容体の活性化による長期抑制に特異的に機能していることが明らかになった(図2).
従来,代謝型グルタミン酸受容体の活性化による長期抑制の分子機構として,FMRPノックアウトマウスより得られた知見からmGluR5-FMRPシグナル伝達経路が大きく注目されていたが,この論文で示されたOligophrenin 1はmGluR1に依存的かつFMRPに非依存的な経路で新規に合成されることが明らかになったはじめてのタンパク質となった.この論文は,Oligophrenin 1遺伝子の変異による定常状態におけるシナプス伝達の低下,また,代謝型グルタミン酸受容体の活性化による長期抑制の抑制などのニューロンの機能の変化が,学習障害や認知障害というOligophrenin 1遺伝子に変異をもつX染色体連鎖性精神遅滞患者における病態へどのようにつながるかについて洞察をあたえただけでなく,代謝型グルタミン酸受容体の活性化による長期抑制において新規の分子機構のあることを明らかにしたという点で,この研究領域に新たな切り口をあたえたといえよう.
略歴:2006年 東京大学大学院薬学系研究科博士課程 修了,同年 筑波大学大学院人間総合科学研究科 博士研究員を経て,2007年より米国Cold Spring Harbor Laboratory博士研究員.
研究テーマ:精神遅滞の原因遺伝子産物であるOligophrenin 1のシナプス伝達における機能解析.
© 2011 小林 亜希子 Licensed under CC 表示 2.1 日本
(米国Cold Spring Harbor Laboratory)
email:小林亜希子
DOI: 10.7875/first.author.2011.166
Rapid synthesis of the X-linked mental retardation protein OPHN1 mediates mGluR-dependent LTD through interaction with the endocytic machinery.
Nael Nadif Kasri, Akiko Nakano-Kobayashi, Linda Van Aelst
Neuron, 72, 300-315 (2011)
要 約
代謝型グルタミン酸受容体の活性化は長期抑制をひき起こし,その異常は薬物中毒や認知障害との関与が示唆されている.その分子機構において代謝型グルタミン酸受容体の活性化により長期抑制に必須の一群のタンパク質が新規に翻訳されるが,そのようなタンパク質のうち同定および機能解析されたものはまだ少ない.この論文では,X染色体連鎖性精神遅滞の原因遺伝子の産物であるOligophrenin 1が代謝型グルタミン酸受容体の活性化により新規に翻訳され,この新たに合成されたOligophrenin 1は長期抑制に必須であること,Oligophrenin 1はエンドサイトーシスに必須のタンパク質Endophilinと結合しAMPA型グルタミン酸受容体のエンドサイトーシスを制御することを明らかにした.
はじめに
シナプス可塑性のひとつである長期抑制(long-term depression:LTD)はシナプス伝達の効率が持続的に低下する現象であり,とくに,代謝型グルタミン酸受容体の活性化によりひき起こされる長期抑制は薬物中毒や認知障害との関連が示唆されている1).この長期抑制には代謝型グルタミン酸受容体の刺激に依存して短時間のうちに新規のタンパク質の合成が必要である2).その分子機構は,代謝型グルタミン酸受容体の活性化により長期抑制に必要な一群のタンパク質が新規に特異的に翻訳され,これらのタンパク質がシナプスの表面に発現しているAMPA型グルタミン酸受容体のエンドサイトーシスを亢進することで長期抑制をひき起こす1-4),というものである(図1a).
非徴候性のX染色体連鎖性精神遅滞(X-linked mental retardation)の原因遺伝子のひとつとして同定されたOligophrenin 1遺伝子は低分子量GTP結合タンパク質RhoAのGTPase活性化タンパク質(Rho-GAP)をコードし,その機能の欠損がOligophrenin 1遺伝子に変異をもつX染色体連鎖性精神遅滞患者における病態と関連づけられている5).筆者らは,以前に,Oligophrenin 1が神経活動に依存的な興奮性シナプスの成熟および可塑性に重要な機能をはたしていることを明らかにした6).また,Oligophrenin 1は後シナプスの足場タンパク質であるHomer1と結合し後シナプスにおけるスパインの形態および形成に重要な役割をもつこと7),また,エンドサイトーシスに必須のタンパク質であるEndophilinと結合し前シナプスにおいてシナプス小胞の回収に関与すること8),を明らかにした.Oligophrenin 1と相互作用するこれら2つのタンパク質が代謝型グルタミン酸受容体の活性化による長期抑制に関与することが報告されていたことから,筆者らは,Oligophrenin 1がこの長期抑制に機能しているかどうかを解析した.
1.Oligophrenin 1は代謝型グルタミン酸受容体の活性化による長期抑制に必須である
興奮性シナプスにおけるOligophrenin 1遺伝子の発現抑制の表現型を解析するため,ラットの海馬CA1領域の切片培養において興奮性ニューロンにレンチウイルスを用いてOligophrenin 1 mRNAを標的としたshRNAを導入し8日間培養した.この海馬の切片培養を用い代謝型グルタミン酸受容体のアゴニストで刺激することで代謝型グルタミン酸受容体の活性化による長期抑制を解析した.その結果,代謝型グルタミン酸受容体の活性化で誘導される長期抑制はOligophrenin 1遺伝子の発現抑制により阻害されることを見い出した.一方,Oligophrenin 1遺伝子の発現抑制により定常状態におけるシナプス伝達の低下も観察されたことから,Oligophrenin 1遺伝子の発現を抑制したときの代謝型グルタミン酸受容体の活性化による長期抑制の阻害は,この定常状態におけるシナプス伝達の低下によるものである可能性も考えられた.そこで,Oligophrenin 1がこの長期抑制そのものに機能をはたしているのか,あるいは,定常状態におけるシナプス伝達の制御を介して長期抑制に影響をあたえているのかを検討するため,Oligophrenin 1の結合タンパク質およびOligophrenin 1のRhoA-GAP活性に着目した.
2.Oligophrenin 1はEndophilinと結合しAMPA型グルタミン酸受容体のエンドサイトーシスを制御する
筆者らは以前に,Oligophrenin 1の結合タンパク質を酵母ツーハイブリッド法によりスクリーニングしエンドサイトーシスに必須のタンパク質であるEndophilinを同定した8).代謝型グルタミン酸受容体の活性化による長期抑制はシナプスに発現するAMPA型グルタミン酸受容体がエンドサイトーシスの亢進により減少することに起因することから3),Oligophrenin 1がEndophilinとの結合を介しAMPA型グルタミン酸受容体のエンドサイトーシスを制御する可能性を検討した.Oligophrenin 1のEndophilinとの結合部位ペプチドを用いてOligophrenin 1とEndophilinとの相互作用を阻害した結果,代謝型グルタミン酸受容体の活性化によりひき起こされるシナプスでのAMPA型グルタミン酸受容体量の減少が抑制された.さらに,このEndophilin結合部位ペプチドを用いて定常状態におけるシナプス伝達および代謝型グルタミン酸受容体の活性化による長期抑制を解析したところ,シナプス伝達に変化はなかったが長期抑制は阻害された.くわえて,Endophilinと結合できないOligophrenin 1変異体をOligophrenin 1 shRNAと同時に導入し同様の実験を行った結果,この変異体はOligophrenin 1 shRNAによる定常状態におけるシナプス伝達の低下を相補するが,長期抑制の抑制は相補できないことを見い出した.以上の結果より,Oligophrenin 1とEndophilinとの結合は定常状態におけるシナプス伝達には必要ないが,Oligophrenin 1はこの結合を介して代謝型グルタミン酸受容体の刺激に依存してAMPA型グルタミン酸受容体のエンドサイトーシスを促進し長期抑制を制御していることが示された.
対照的に,Rho-GAP活性をもたないOligophrenin 1変異体,あるいは,Homer1と結合できないOligophrenin 1変異体をOligophrenin 1 shRNAとともに発現させた実験では,両方の変異体とも定常状態におけるシナプス伝達の低下を相補できなかった.このことから,Oligophrenin 1のRho-GAP活性およびHomer1との結合能は定常状態におけるシナプス伝達に必要であることが明らかになった.また,Oligophrenin 1のHomer1との結合部位ペプチドを用いて代謝型グルタミン酸受容体の活性化による長期抑制を解析したところ,長期抑制は正常でありOligophrenin 1とHomer1との結合は長期抑制を介在しないことが示された.
3.Oligophrenin 1は代謝型グルタミン酸受容体の活性化により新たに翻訳され長期抑制に機能する
さきに述べたように,代謝型グルタミン酸受容体の活性化による長期抑制には新たなタンパク質の合成が必要であることが知られている2)(図1a).Oligophrenin 1がこの長期抑制に必須であるという結果をふまえ,代謝型グルタミン酸受容体の活性化によりOligophrenin 1の発現が制御されるかどうかを検討した.その結果,代謝型グルタミン酸受容体の活性化によりOligophrenin 1のタンパク質量が劇的に増大すること,この増加は翻訳に依存的であることを見い出した.さらに,このOligophrenin 1の新規の合成が代謝型グルタミン酸受容体の活性化による長期抑制に必須であるかどうかを検討するため,Oligophrenin 1 mRNAを標的にしたsiRNAを30分間から1時間という短時間だけ処置することで,存在する内在性のOligophrenin 1のタンパク質レベルに影響をあたえることなく新規のOligophrenin 1の合成のみを抑制する実験を試みた.その結果,このsiRNAは代謝型グルタミン酸受容体によるAMPA型グルタミン酸受容体のエンドサイトーシスの亢進を阻害し長期抑制を抑制することが明らかになった.以上の結果より,Oligophrenin 1は代謝型グルタミン酸受容体の活性化により新規に翻訳され長期抑制に機能することが示された.
4.Oligophrenin 1の翻訳はFMRPに非依存的でありmGluR1に依存的である
脆弱性X染色体連鎖症候群(fragile X-syndrome)の原因遺伝子FMR1のコードするFMRPはRNA結合タンパク質であり,代謝型グルタミン酸受容体の活性化により翻訳されるmRNAに特異的に結合し,通常の状態ではその翻訳を負に制御しているものと考えられている5)(図1b).FMRPノックアウトマウスでは長期抑制に必須のタンパク質の通常状態での発現レベルの上昇,および,代謝型グルタミン酸受容体の活性化による長期抑制の亢進が観察されており9)(図1b),長期抑制の異常と認知障害および学習障害などの疾患との関連が示唆されている4).
そこで,代謝型グルタミン酸受容体の活性化によるOligophrenin 1の新規の合成がFMRPにより制御されているかどうか,FMRPノックアウトマウスを用いて解析した.その結果,野生型マウスと同様にFMRPノックアウトマウスにおいても代謝型グルタミン酸受容体の活性化によりOligophrenin 1の発現が誘導されたことから,その合成はFMRPに非依存的であることが示された.代謝型グルタミン酸受容体の活性化により新規に翻訳される長期抑制に必須の一群のタンパク質のうち,FMRPに依存しないことが明らかにされたのはOligophrenin 1がはじめてであった.
I型に属する代謝型グルタミン酸受容体にはmGluR1とmGluR5があり両方とも代謝型グルタミン酸受容体の活性化による長期抑制に必須であるが,とくにFMRPの欠損による数々の表現型がmGluR5を阻害あるいは抑制することにより相補されるという知見からmGluR5が大きく脚光をあびている10).しかしながら,I型代謝型グルタミン酸受容体アゴニストによるOligophrenin 1の発現上昇は,mGluR5に特異的な阻害剤ではなく,mGluR1に特異的な阻害剤により抑制されることが見い出だされ,Oligophrenin 1の翻訳制御はmGluR1に依存的であることが明らかになった.これらの結果は,従来のmGluR5-FMRPシグナル伝達経路とは異なる新規の分子機構の存在を示すものであった.
おわりに
この研究は,X連鎖性精神遅滞の原因遺伝子の産物であるOligophrenin 1が代謝型グルタミン酸受容体の活性化により新規に翻訳される長期抑制に必須のタンパク質であり,Endophilinとの結合を介してこの長期抑制に機能することを示した.また,Oligophrenin 1のRho-GAP活性およびHomer1との結合能は定常状態におけるシナプス伝達に必要である一方で,Endophilinとの結合はAMPA型グルタミン酸受容体のエンドサイトーシスを介した代謝型グルタミン酸受容体の活性化による長期抑制に特異的に機能していることが明らかになった(図2).
従来,代謝型グルタミン酸受容体の活性化による長期抑制の分子機構として,FMRPノックアウトマウスより得られた知見からmGluR5-FMRPシグナル伝達経路が大きく注目されていたが,この論文で示されたOligophrenin 1はmGluR1に依存的かつFMRPに非依存的な経路で新規に合成されることが明らかになったはじめてのタンパク質となった.この論文は,Oligophrenin 1遺伝子の変異による定常状態におけるシナプス伝達の低下,また,代謝型グルタミン酸受容体の活性化による長期抑制の抑制などのニューロンの機能の変化が,学習障害や認知障害というOligophrenin 1遺伝子に変異をもつX染色体連鎖性精神遅滞患者における病態へどのようにつながるかについて洞察をあたえただけでなく,代謝型グルタミン酸受容体の活性化による長期抑制において新規の分子機構のあることを明らかにしたという点で,この研究領域に新たな切り口をあたえたといえよう.
文 献
- Luscher, C. & Huber, K. M.: Group 1 mGluR-dependent synaptic long-term depression: mechanisms and implications for circuitry and disease. Neuron, 65, 445-459 (2010)[PubMed]
- Huber, K. M., Kayser, M. S. & Bear, M. F.: Role for rapid dendritic protein synthesis in hippocampal mGluR-dependent long-term depression. Science, 288, 1254-1257 (2000)[PubMed]
- Snyder, E. M., Philpot, B. D., Huber, K. M. et al.: Internalization of ionotropic glutamate receptors in response to mGluR activation. Nat. Neurosci., 4, 1079-1085 (2001)[PubMed]
- Waung, M. W. & Huber, K. M.: Protein translation in synaptic plasticity: mGluR-LTD, Fragile X. Curr. Opin. Neurobiol., 19, 319-326 (2009)[PubMed]
- Billuart, P., Bienvenu, T., Ronce, N. et al.: Oligophrenin-1 encodes a rhoGAP protein involved in X-linked mental retardation. Nature, 392, 923-926 (1998)[PubMed]
- Nadif Kasri, N., Nakano-Kobayashi, A., Malinow, R. et al.: The Rho-linked mental retardation protein oligophrenin-1 controls synapse maturation and plasticity by stabilizing AMPA receptors. Genes Dev., 23, 1289-1302 (2009)[PubMed]
- Govek, E. E., Newey, S. E., Akerman, C. J. et al.: The X-linked mental retardation protein oligophrenin-1 is required for dendritic spine morphogenesis. Nat. Neurosci., 7, 364-372 (2004)[PubMed]
- Nakano-Kobayashi, A., Kasri, N. N., Newey, S. E. et al.: The Rho-linked mental retardation protein OPHN1 controls synaptic vesicle endocytosis via endophilin A1. Curr. Biol., 19, 1133-1139 (2009)[PubMed]
- Huber, K. M., Gallagher, S. M., Warren, S. T. et al.: Altered synaptic plasticity in a mouse model of fragile X mental retardation. Proc. Natl. Acad. Sci. USA, 99, 7746-7750 (2002)[PubMed]
- Bear, M. F., Huber, K. M., Warren, S. T.: The mGluR theory of fragile X mental retardation. Trends Neurosci., 27, 370-377 (2004)[PubMed]
著者プロフィール
略歴:2006年 東京大学大学院薬学系研究科博士課程 修了,同年 筑波大学大学院人間総合科学研究科 博士研究員を経て,2007年より米国Cold Spring Harbor Laboratory博士研究員.
研究テーマ:精神遅滞の原因遺伝子産物であるOligophrenin 1のシナプス伝達における機能解析.
© 2011 小林 亜希子 Licensed under CC 表示 2.1 日本