遺伝暗号の解読に必須な2-アグマチニルシチジンはRNAとタンパク質の両方をリン酸化する酵素により生合成される
鈴木 勉
(東京大学大学院工学系研究科 化学生命工学専攻)
email:鈴木 勉
DOI: 10.7875/first.author.2011.164
Biogenesis of 2-agmatinylcytidine catalyzed by the dual protein and RNA kinase TiaS.
Naohiro Terasaka, Satoshi Kimura, Takuo Osawa, Tomoyuki Numata, Tsutomu Suzuki
Nature Structural & Molecular Biology, 18, 1268-1274 (2011)
DNAに書き込まれた遺伝暗号を正確に読み取ることは,すべての生命に課せられたもっとも根本的で重要なタスクである.2010年,筆者らは,アーキアに由来するtRNAIleのアンチコドン領域から新規の修飾シチジンを発見した.2-アグマチニルシチジンと名づけられたこの修飾塩基はシチジンの2位にアグマチンが結合したものであり,この修飾によりイソロイシンをコードするAUAコドンを正確に解読する機構が明らかになった.また同時に,2-アグマチニルシチジンを合成する酵素TiaSを同定し,試験管内での2-アグマチニルシチジン修飾の再構成にも成功した.つづくこの研究において,2-アグマチニルシチジン修飾の詳細な反応機構を解析した結果,TiaSはそれ自体をリン酸化する活性とtRNAをリン酸化する活性をあわせもつユニークなリン酸化酵素であり,これまでに例のない,まったく新しい酵素触媒反応により2-アグマチニルシチジン修飾の形成されるしくみが明らかになった.
あらゆる生物はDNAに書き込まれた遺伝情報をもとにタンパク質を生合成する.4種類の塩基が3つ組でひとつのコドンとなりアミノ酸を指定するという考え方は半世紀前に確立され,セントラルドクマ(中心教義)として生命科学の根幹を貫くもっともエレガントで美しい原理のひとつである.ところが,64通りの遺伝暗号がどのようなしくみで正確に解読されるかについては,古典的なテーマであるものの,いまだ完全には解明されていない.
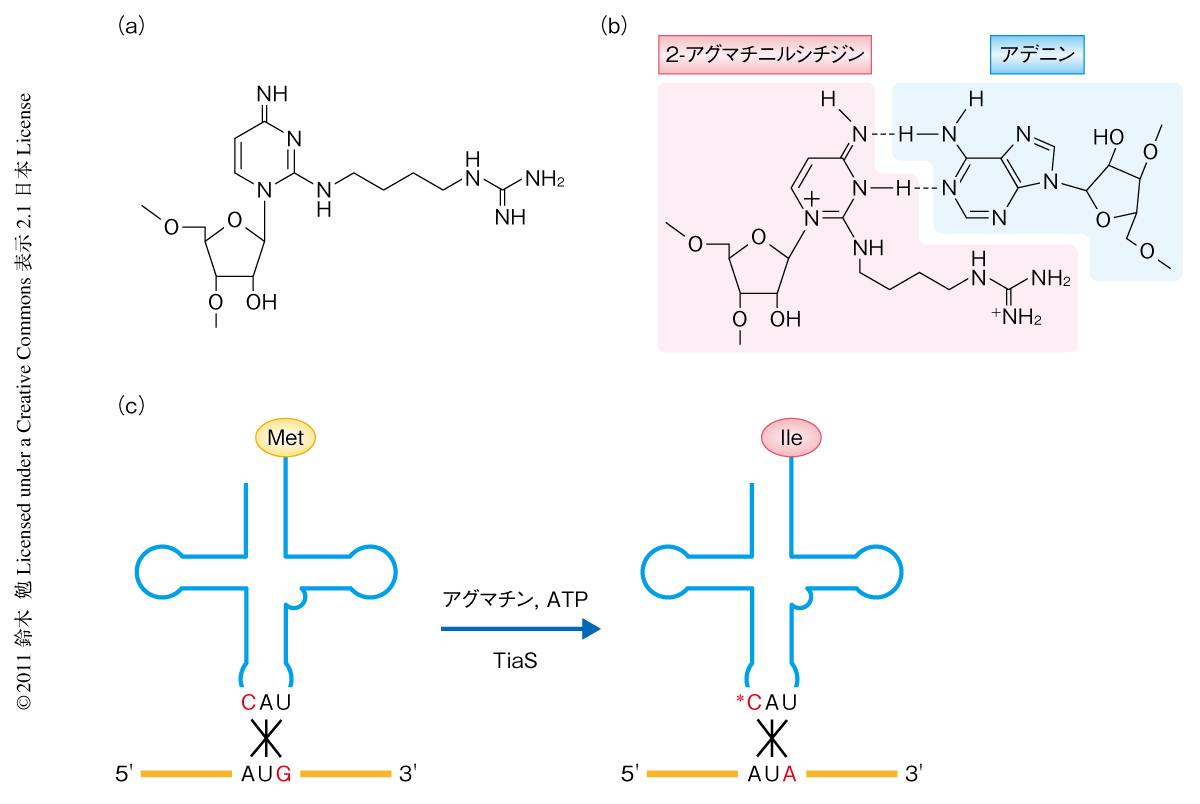
アーキア(古細菌)において,イソロイシンをコードするAUAコドンがどのように解読されるかについては,長年,この分野の研究者にとり大きな課題であった1).2010年,筆者らのグループは,アーキアに由来するtRNAIleのアンチコドン領域から新規の修飾塩基である2-アグマチニルシチジン(agm2C)を発見した2)(図1a).この2-アグマチニルシチジンは,シチジンの2位にアグマチン(アルギニンが脱炭酸したもの)が結合したものであり,この修飾によりシトシン環が互変異性化し,グアニンとは対合できずアデニンと対合することでAUAコドンが解読されるものと考えられた(図1b).また,このたった1箇所の修飾によりtRNAのアミノ酸受容能がメチオニンからイソロイシンへとスイッチする(図1c)ことから,2-アグマチニルシチジン修飾はAUAコドンの翻訳に必須の役割を担っているものと思われた.2-アグマチニルシチジンの生合成酵素は比較ゲノムの手法を用いて同定され,TiaS(tRNAIle-2-アグマチニルシチジン合成酵素)と命名された.TiaSはアグマチンとATPを基質としてtRNAIleのアンチコドン1字目のシチジン(C34)を修飾し,2-アグマチニルシチジン修飾の形成を触媒する(図1c).
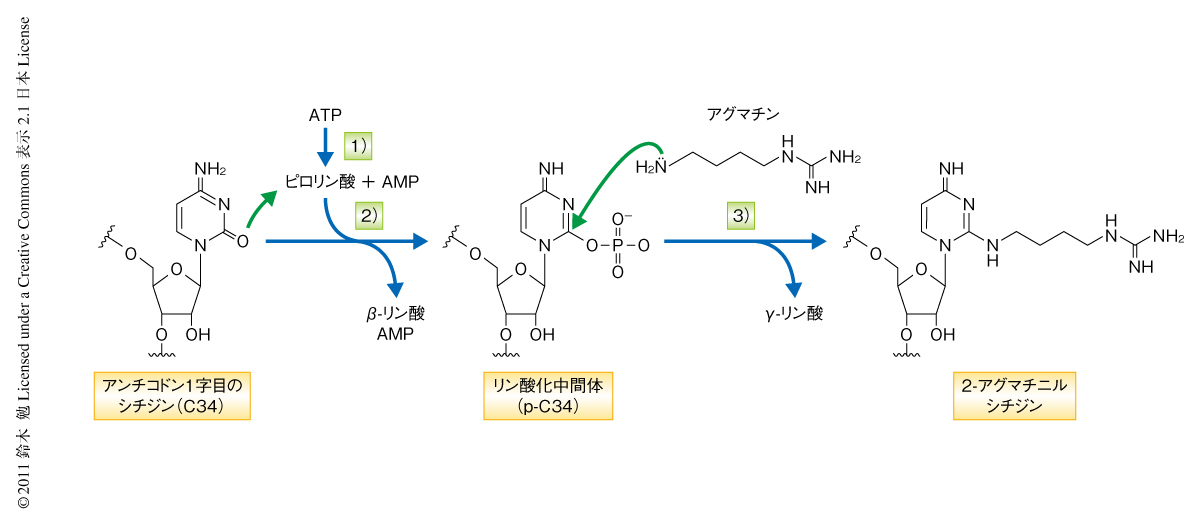
2-アグマチニルシチジン修飾反応を詳細に解析したところ,TiaSは3段階の酵素反応を触媒することが明らかになった(図2).はじめに,ATPをAMPとピロリン酸とに加水分解する.つぎに,tRNAIleのC34の2位のカルボニル基をγ-リン酸基でリン酸化することにより活性化する.最後に,アグマチンのアミノ基がC34の2位の炭素を求核置換攻撃することでリン酸基が脱離し2-アグマチニルシチジン修飾が形成される.TiaSが触媒する2-アグマチニルシチジン修飾の形成反応において驚くべきことは,TiaSがリン酸化にさきだちATPをAMPとピロリン酸とに加水分解する点であった(図2).この反応はTiaSとATPとを混合するだけで進行し,基質であるtRNAIleの存在しない場合もつねに生じることからアイドリング反応と呼ぶ.なぜ,このようにいっけんエネルギーのむだづかいのような反応が生じるのかは未解明であるが,ATPのα-β間のエステル結合をメチレン基に置換したATPの非加水分解アナログであるAMPCPPを基質とした際には2-アグマチニルシチジン修飾が形成されず,かつ,2-アグマチニルシチジン修飾の形成の強力な阻害剤になること,ATPのα-β間の結合を加水分解できないTiaS変異体は2-アグマチニルシチジン修飾の形成活性をもたないこと,反応産物としてADPを生じるTiaS変異体が見い出せないこと,などから,アイドリング反応は2-アグマチニルシチジン修飾の形成に必須であると考えられた.
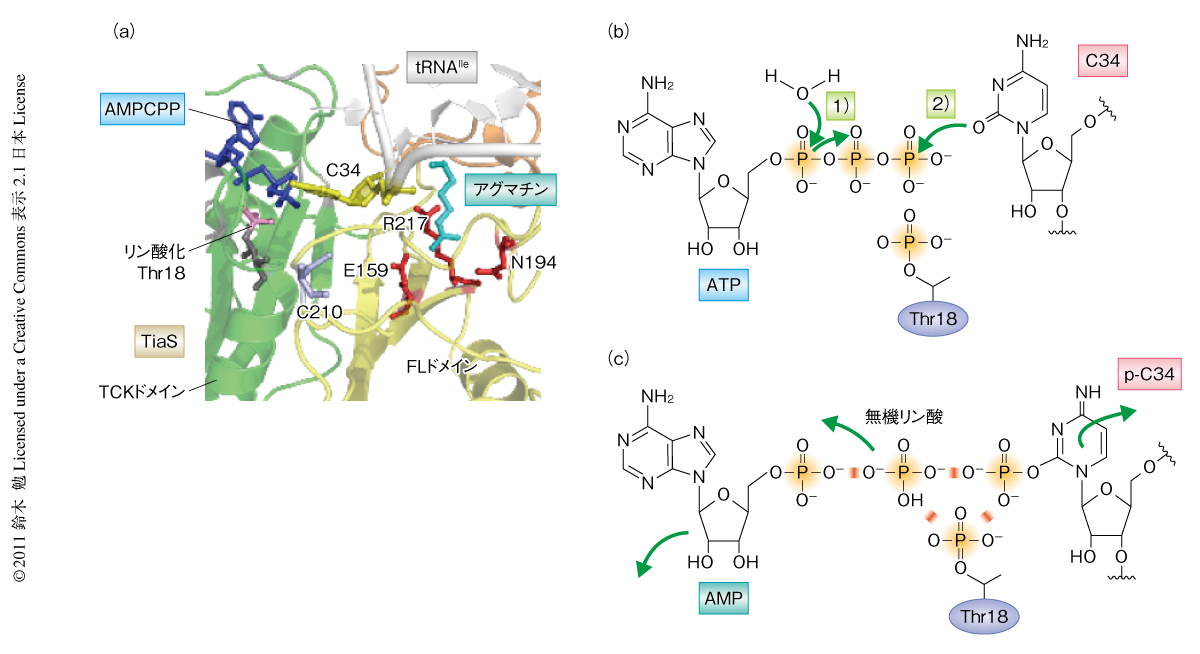
TiaSはそれ自体のもつ保存された18番目のThr残基(Thr18)をATPのγ-リン酸基により自己リン酸化することを見い出した.tRNAをリン酸化しないTiaS変異体は自己リン酸化能も失ったことから,同一の触媒部位を用いてtRNAのリン酸化と自己リン酸化を行っていると考えられた.自己リン酸化の意義として,2-アグマチニルシチジン修飾反応の過程で,リン酸基がいったんThr18に移ったのちtRNAへと転移する可能性,また,その逆に,活性化されたC34のリン酸基がThr18に転移する可能性について検討したところ,リン酸化Thr18は2-アグマチニルシチジン修飾反応の過程でターンオーバーすることはなく,修飾反応に直接的には関与しないことが判明した.しかし,Thr18は必須の残基であることから,リン酸化Thr18はTiaSの活性中心の形成に必須の翻訳後修飾であるものと考えられた.筆者を含む共同研究者によりNature Structural & Molecular Biology誌に同時に発表された,TiaS-tRNAIle-AMPCPP-アグマチン四者複合体の結晶構造(PDB ID:3AMU)からも,TiaSはRNA(C34)とタンパク質(Thr18)という異なる基質をリン酸化する新規のドメインをもつことが明らかとなり3)(新着論文レビュー でも掲載),これをTCK(Thr18-Cyt34キナーゼ)ドメインと命名した(図3a).
TCKドメインはATPのα-β結合のあいだを加水分解し,つづいてC34の2位のカルボニル基をγ-リン酸基でリン酸化することにより活性化した(図2).リン酸化Thr18はATPのβ-リン酸基およびγ-リン酸基の近傍に位置していた(図3a)ことから,リン酸化Thr18とγ-リン酸基とのあいだで電気的な反発が生じ,ピロリン酸からのC34のリン酸化を効率よく促進している可能性が考えられた(図3b).さらに,C34のリン酸化ののちリン酸化Thr18とリン酸化C34とのあいだで負電荷どうしの反発が生じ,これによりリン酸化C34がアグマチン結合ポケットまで移動している可能性があるとも考えられた(図3c).
アーキアのうちユーリアーキオータであるThermococcus kodakaraensisではアルギニン脱炭酸酵素(PdaD)が生育に必須であることが知られている4).pdaD欠損株にアグマチンを添加することにより生育が回復することから,T. kodakaraensisにおいてアグマチンは必須である.アグマチンはプトレシンやスペルミジンなどのポリアミンの生合成の前駆体である.アーキアには高温や高塩濃度など極限環境に適応した種が多くみられるが,ポリアミンによるDNAやRNAの安定化は高温環境の適応において重要な役割を担っているものと考えられている.しかし,プトレシンの添加ではpdaD欠損株の生育は回復しないことが判明している4).したがって,アーキアではアグマチンが2-アグマチニルシチジン修飾の形成に必須であり,イソロイシンをコードするAUAコドンの解読を行っているものと結論できる.実際,Haloferax volcaniiにおいてTiaSをコードする遺伝子は必須遺伝子であることも示されている5).もし,細胞内のアグマチン濃度に応じて2-アグマチニルシチジンの修飾効率が変化しているとすれば,タンパク質の合成速度や細胞の増殖速度をtRNAIleの2-アグマチニルシチジン含有量により制御するしくみがあるかもしれない.アグマチンを生育に必須なtRNA修飾の部品として用いることで,極限環境に適応するしくみを獲得したととらえることもできよう.
略歴:1996年 東京工業大学大学院生命理工学研究科博士課程 修了,同年 三菱化学横浜総合研究所 研究員,1997年 東京大学大学院工学系研究科 助手,1999年 東京大学大学院新領域創成科学研究科 講師,2004年 東京大学大学院工学系研究科 助教授を経て,2008年より同 教授.
研究テーマ:RNA修飾の機能と生合成,翻訳調節の分子機構.
抱負:自分にしかできないことをやる.
研究室URL:http://rna.chem.t.u-tokyo.ac.jp/index_j.html
© 2011 鈴木 勉 Licensed under CC 表示 2.1 日本
(東京大学大学院工学系研究科 化学生命工学専攻)
email:鈴木 勉
DOI: 10.7875/first.author.2011.164
Biogenesis of 2-agmatinylcytidine catalyzed by the dual protein and RNA kinase TiaS.
Naohiro Terasaka, Satoshi Kimura, Takuo Osawa, Tomoyuki Numata, Tsutomu Suzuki
Nature Structural & Molecular Biology, 18, 1268-1274 (2011)
要 約
DNAに書き込まれた遺伝暗号を正確に読み取ることは,すべての生命に課せられたもっとも根本的で重要なタスクである.2010年,筆者らは,アーキアに由来するtRNAIleのアンチコドン領域から新規の修飾シチジンを発見した.2-アグマチニルシチジンと名づけられたこの修飾塩基はシチジンの2位にアグマチンが結合したものであり,この修飾によりイソロイシンをコードするAUAコドンを正確に解読する機構が明らかになった.また同時に,2-アグマチニルシチジンを合成する酵素TiaSを同定し,試験管内での2-アグマチニルシチジン修飾の再構成にも成功した.つづくこの研究において,2-アグマチニルシチジン修飾の詳細な反応機構を解析した結果,TiaSはそれ自体をリン酸化する活性とtRNAをリン酸化する活性をあわせもつユニークなリン酸化酵素であり,これまでに例のない,まったく新しい酵素触媒反応により2-アグマチニルシチジン修飾の形成されるしくみが明らかになった.
はじめに
あらゆる生物はDNAに書き込まれた遺伝情報をもとにタンパク質を生合成する.4種類の塩基が3つ組でひとつのコドンとなりアミノ酸を指定するという考え方は半世紀前に確立され,セントラルドクマ(中心教義)として生命科学の根幹を貫くもっともエレガントで美しい原理のひとつである.ところが,64通りの遺伝暗号がどのようなしくみで正確に解読されるかについては,古典的なテーマであるものの,いまだ完全には解明されていない.
アーキア(古細菌)において,イソロイシンをコードするAUAコドンがどのように解読されるかについては,長年,この分野の研究者にとり大きな課題であった1).2010年,筆者らのグループは,アーキアに由来するtRNAIleのアンチコドン領域から新規の修飾塩基である2-アグマチニルシチジン(agm2C)を発見した2)(図1a).この2-アグマチニルシチジンは,シチジンの2位にアグマチン(アルギニンが脱炭酸したもの)が結合したものであり,この修飾によりシトシン環が互変異性化し,グアニンとは対合できずアデニンと対合することでAUAコドンが解読されるものと考えられた(図1b).また,このたった1箇所の修飾によりtRNAのアミノ酸受容能がメチオニンからイソロイシンへとスイッチする(図1c)ことから,2-アグマチニルシチジン修飾はAUAコドンの翻訳に必須の役割を担っているものと思われた.2-アグマチニルシチジンの生合成酵素は比較ゲノムの手法を用いて同定され,TiaS(tRNAIle-2-アグマチニルシチジン合成酵素)と命名された.TiaSはアグマチンとATPを基質としてtRNAIleのアンチコドン1字目のシチジン(C34)を修飾し,2-アグマチニルシチジン修飾の形成を触媒する(図1c).
1.TiaSはtRNAをリン酸化により活性化する
2-アグマチニルシチジン修飾反応を詳細に解析したところ,TiaSは3段階の酵素反応を触媒することが明らかになった(図2).はじめに,ATPをAMPとピロリン酸とに加水分解する.つぎに,tRNAIleのC34の2位のカルボニル基をγ-リン酸基でリン酸化することにより活性化する.最後に,アグマチンのアミノ基がC34の2位の炭素を求核置換攻撃することでリン酸基が脱離し2-アグマチニルシチジン修飾が形成される.TiaSが触媒する2-アグマチニルシチジン修飾の形成反応において驚くべきことは,TiaSがリン酸化にさきだちATPをAMPとピロリン酸とに加水分解する点であった(図2).この反応はTiaSとATPとを混合するだけで進行し,基質であるtRNAIleの存在しない場合もつねに生じることからアイドリング反応と呼ぶ.なぜ,このようにいっけんエネルギーのむだづかいのような反応が生じるのかは未解明であるが,ATPのα-β間のエステル結合をメチレン基に置換したATPの非加水分解アナログであるAMPCPPを基質とした際には2-アグマチニルシチジン修飾が形成されず,かつ,2-アグマチニルシチジン修飾の形成の強力な阻害剤になること,ATPのα-β間の結合を加水分解できないTiaS変異体は2-アグマチニルシチジン修飾の形成活性をもたないこと,反応産物としてADPを生じるTiaS変異体が見い出せないこと,などから,アイドリング反応は2-アグマチニルシチジン修飾の形成に必須であると考えられた.
2.TiaSは自己をリン酸化する
TiaSはそれ自体のもつ保存された18番目のThr残基(Thr18)をATPのγ-リン酸基により自己リン酸化することを見い出した.tRNAをリン酸化しないTiaS変異体は自己リン酸化能も失ったことから,同一の触媒部位を用いてtRNAのリン酸化と自己リン酸化を行っていると考えられた.自己リン酸化の意義として,2-アグマチニルシチジン修飾反応の過程で,リン酸基がいったんThr18に移ったのちtRNAへと転移する可能性,また,その逆に,活性化されたC34のリン酸基がThr18に転移する可能性について検討したところ,リン酸化Thr18は2-アグマチニルシチジン修飾反応の過程でターンオーバーすることはなく,修飾反応に直接的には関与しないことが判明した.しかし,Thr18は必須の残基であることから,リン酸化Thr18はTiaSの活性中心の形成に必須の翻訳後修飾であるものと考えられた.筆者を含む共同研究者によりNature Structural & Molecular Biology誌に同時に発表された,TiaS-tRNAIle-AMPCPP-アグマチン四者複合体の結晶構造(PDB ID:3AMU)からも,TiaSはRNA(C34)とタンパク質(Thr18)という異なる基質をリン酸化する新規のドメインをもつことが明らかとなり3)(新着論文レビュー でも掲載),これをTCK(Thr18-Cyt34キナーゼ)ドメインと命名した(図3a).
3.TCKドメインによるATPaseの共役したリン酸化機構
TCKドメインはATPのα-β結合のあいだを加水分解し,つづいてC34の2位のカルボニル基をγ-リン酸基でリン酸化することにより活性化した(図2).リン酸化Thr18はATPのβ-リン酸基およびγ-リン酸基の近傍に位置していた(図3a)ことから,リン酸化Thr18とγ-リン酸基とのあいだで電気的な反発が生じ,ピロリン酸からのC34のリン酸化を効率よく促進している可能性が考えられた(図3b).さらに,C34のリン酸化ののちリン酸化Thr18とリン酸化C34とのあいだで負電荷どうしの反発が生じ,これによりリン酸化C34がアグマチン結合ポケットまで移動している可能性があるとも考えられた(図3c).
おわりに
アーキアのうちユーリアーキオータであるThermococcus kodakaraensisではアルギニン脱炭酸酵素(PdaD)が生育に必須であることが知られている4).pdaD欠損株にアグマチンを添加することにより生育が回復することから,T. kodakaraensisにおいてアグマチンは必須である.アグマチンはプトレシンやスペルミジンなどのポリアミンの生合成の前駆体である.アーキアには高温や高塩濃度など極限環境に適応した種が多くみられるが,ポリアミンによるDNAやRNAの安定化は高温環境の適応において重要な役割を担っているものと考えられている.しかし,プトレシンの添加ではpdaD欠損株の生育は回復しないことが判明している4).したがって,アーキアではアグマチンが2-アグマチニルシチジン修飾の形成に必須であり,イソロイシンをコードするAUAコドンの解読を行っているものと結論できる.実際,Haloferax volcaniiにおいてTiaSをコードする遺伝子は必須遺伝子であることも示されている5).もし,細胞内のアグマチン濃度に応じて2-アグマチニルシチジンの修飾効率が変化しているとすれば,タンパク質の合成速度や細胞の増殖速度をtRNAIleの2-アグマチニルシチジン含有量により制御するしくみがあるかもしれない.アグマチンを生育に必須なtRNA修飾の部品として用いることで,極限環境に適応するしくみを獲得したととらえることもできよう.
文 献
- Suzuki, T.: Biosynthesis and function of tRNA wobble modifications. in Fine-Tuning of RNA Functions by Modification and Editing (Grosjean, H. ed.). pp. 24-69, Springer-Verlag, New York (2005)
- Ikeuchi, Y., Kimura, S., Numata, T. et al.: Agmatine-conjugated cytidine in a tRNA anticodon is essential for AUA decoding in archaea. Nat. Chem. Biol., 6, 277-282 (2010)[PubMed]
- Osawa, T., Kimura, S., Terasaka, N. et al.: Structural basis of tRNA agmatinylation essential for AUA codon decoding. Nat. Struct. Mol. Biol., 18, 1275-1280 (2011)[PubMed] [新着論文レビュー]
- Fukuda, W., Morimoto, N., Imanaka, T. et al.: Agmatine is essential for the cell growth of Thermococcus kodakaraensis. FEMS Microbiol. Lett., 287, 113-120 (2008)[PubMed]
- Blaby, I. K., Phillips, G., Blaby-Haas. C. E. et al.: Towards a systems approach in the genetic analysis of archaea: Accelerating mutant construction and phenotypic analysis in Haloferax volcanii. Archaea, 426-239 (2010)[PubMed]
著者プロフィール
略歴:1996年 東京工業大学大学院生命理工学研究科博士課程 修了,同年 三菱化学横浜総合研究所 研究員,1997年 東京大学大学院工学系研究科 助手,1999年 東京大学大学院新領域創成科学研究科 講師,2004年 東京大学大学院工学系研究科 助教授を経て,2008年より同 教授.
研究テーマ:RNA修飾の機能と生合成,翻訳調節の分子機構.
抱負:自分にしかできないことをやる.
研究室URL:http://rna.chem.t.u-tokyo.ac.jp/index_j.html
© 2011 鈴木 勉 Licensed under CC 表示 2.1 日本