Criptoは低酸素ニッチにおいてGRP78陽性の造血幹細胞を制御する
三原田賢一・Stefan Karlsson
(スウェーデンLund大学Laboratory of Molecular Medicine and Gene Therapy)
email:三原田賢一
DOI: 10.7875/first.author.2011.161
Cripto regulates hematopoietic stem cells as a hypoxic-niche-related factor through cell surface receptor GRP78.
Kenichi Miharada, Göran Karlsson, Matilda Rehn, Emma Rörby, Kavitha Siva, Jörg Cammenga, Stefan Karlsson
Cell Stem Cell, 9, 330-344 (2011)
CriptoはES細胞および腫瘍細胞に関与する液性タンパク質あるいは細胞膜タンパク質として知られている.この研究では,Criptoが造血系においても重要な機能をもつことを明らかにした.Criptoは培養系において造血幹細胞の機能を維持したが,その受容体であるGRP78は造血幹細胞の画分の一部にのみ発現しており,GRP78陽性とGRP78陰性の細胞では機能に差のあることも示された.造血幹細胞はおもに内骨膜に存在する低酸素ニッチに維持されているが,Criptoは内骨膜細胞に多く発現しておりGRP78陽性細胞はこの領域に偏在していた.また,Cripto-GRP78シグナル伝達系は解糖系の代謝酵素を上昇させ,相対的にミトコンドリアの活性を抑制することで造血幹細胞を休眠状態に保持するものと考えられた.低酸素応答において重要なタンパク質であるHIF-1αを欠損したマウスが内骨膜のCripto産生細胞およびGRP78陽性細胞の減少を示したことから,Criptoは低酸素ニッチにおいてHIF-1αの下流タンパク質として造血幹細胞を制御しているものと考えられた.
造血幹細胞は生涯にわたり全血球系の細胞を供給しつづける能力(多分化能)をもつとともに,細胞分裂のときに同等の細胞を産み出す能力(自己複製能)をもつ細胞として定義される1).近年,造血幹細胞は骨髄の内部に存在するニッチとよばれる微小な細胞環境に保持されており,種々のニッチ構成タンパク質あるいはニッチ構成細胞により静止期に保たれていることが明らかにされてきている2).とくに,内骨膜領域は低酸素環境であることから“低酸素ニッチ”とよばれており,造血幹細胞が低酸素状態にあること,また,それにともなう低いミトコンドリア活性をもつことが明らかにされてきた3,4).一方で,低酸素ニッチに特異的にはたらくタンパク質,とくに,細胞外タンパク質に関しては依然として不明な点が多かった.
この研究において,筆者らは,多能性幹細胞や腫瘍細胞に関連する遺伝子の産物として知られていたCripto(TDGF-1)が低酸素ニッチにおける重要な細胞外タンパク質としてはたらいていることを明らかにした.CriptoはEGF-CFCファミリーのメンバーであり,分泌型と細胞膜型の2種類が知られているがその機能の違いは明らかになっていない5).TGFβおよびTGFβ受容体に結合しそのシグナルを抑制することが知られており,それとは別に,Criptoは細胞膜に発現するGRP78と結合してMAPキナーゼ-PI3キナーゼ-Aktシグナル伝達系を刺激することも知られている5,6).GRP78は熱ショックタンパク質であるHSP70の一種であり通常は小胞体膜に存在しているが,乳がん細胞などの腫瘍細胞はこのタンパク質を細胞膜に発現しておりCriptoを含む複数のリガンドに対する受容体としてはたらいている6).造血幹細胞では一部の細胞がGRP78を細胞膜に発現しており,GRP78陽性細胞とGRP78陰性細胞はどちらも長期の骨髄再構築能をもつものの,その分化能力には差のあることもわかった.さらに,内骨膜領域の解析と網羅的なタンパク質解析の結果,Criptoは低酸素ニッチを構成する細胞から産生されており,解糖系の代謝を制御することで造血幹細胞の維持に関与していることが示唆された.
CriptoをコードするmRNAのES細胞における発現はその未分化性を反映することが知られており,たとえば,培養液からLIF(leukemia inhibitory factor,白血病阻害因子)を除去するとその発現レベルは急速に低下する7).驚くべきことに,Cripto遺伝子の発現は血液細胞においても造血幹細胞においてもっとも高く,分化段階に応じて低下していくことがわかった.
液性タンパク質としてのCriptoの機能を調べるため,マウス組換えCriptoを用いて造血幹細胞の培養実験を行った.SCF(stem cell factor,幹細胞因子),トロンボポエチンにくわえて,マウス組換えCriptoを添加した細胞は培養開始7日後および14日後において細胞数の顕著な増加を示し,培養ののちの細胞の分化能力および分裂能力を評価するコロニー形成法では混合コロニー(赤芽球,巨核球,好中球,マクロファージの混在コロニー)の有意な増加がみられた.さらに,幹細胞としての能力を評価するため14日間培養した細胞を致死量の放射線を照射したマウスへ移植したところ,Criptoを添加しなかった細胞では移植した細胞に由来する末梢細胞は観察されなかったのに対し,Cripto添加をした細胞では移植した細胞に由来する末梢血細胞が観察された.
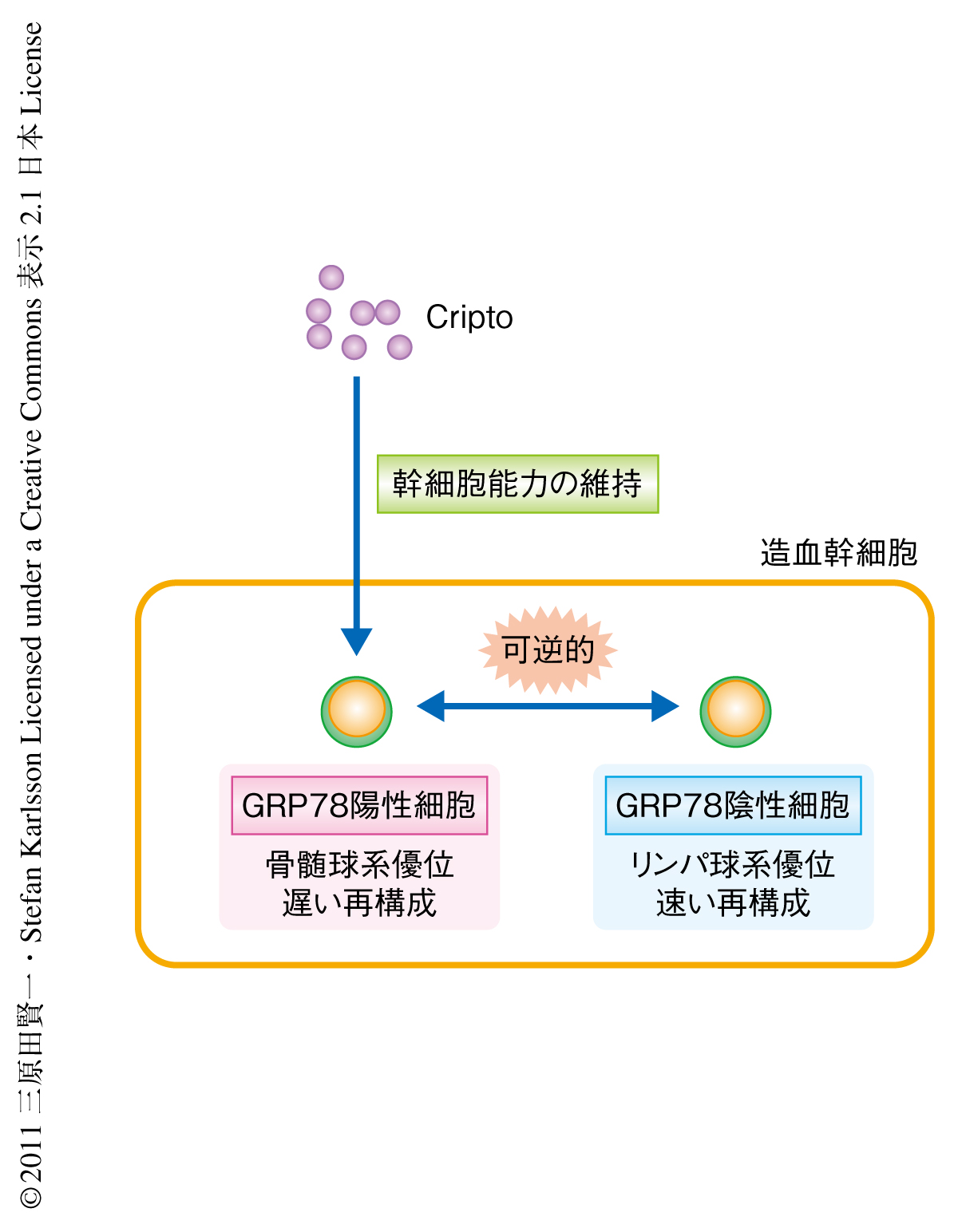
Criptoに対する受容体のひとつとして報告されているGRP78は,おもに腫瘍細胞など高い増殖能力を備えた細胞の細胞膜に存在することが知られているため,造血幹細胞において細胞膜に存在するGRP78の発現をフローサイトメトリーにより解析した.すると,造血幹細胞が高頻度に存在する画分として知られるCD34陰性c-kit陽性Sca-I陽性Lin陰性画分(CD34- KSL画分)はGRP78陽性細胞とGRP78陰性細胞とに分けられることがわかった.この画分における造血幹細胞の頻度は高いものの100%ではないため,GRP78陽性細胞とGRP78陰性細胞のどちらが幹細胞画分であるかを調べるため,それぞれの細胞を別々に移植して解析を行った.その結果,GRP78陽性細胞とGRP78陰性細胞のどちらも長期の骨髄再構築能をもつ幹細胞であることがわかった.ところが,GRP78陽性細胞とGRP78陰性細胞は末梢血におけるドナー細胞に由来する細胞の割合(キメリズム)において異なる傾向を示し,GRP78陽性細胞に由来する細胞は骨髄球系の割合が高くかつキメリズムは低い値から時間とともにゆるやかに上昇した.一方で,GRP78陰性細胞は移植ののちの早い段階で高いキメリズムを示し,GRP78陽性細胞と比較してリンパ球の割合も高かったがのちのキメリズムは上昇しなかった.移植後16週目の解析では,GRP78陽性細胞とGRP78陰性細胞とに有意な差は認められなかった(図1).
Criptoの機能とGRP78との関連を調べるため,GRP78陽性細胞とGRP78陰性細胞をそれぞれ単離してマウス組換えCriptoのもと14日間培養し移植実験を行ったところ,GRP78陽性細胞のみがCriptoに反応して骨髄の再構築がみられた.一方で,抗GRP78中和抗体を添加したところCriptoによる影響は消失した.以上のことから,GRP78は造血幹細胞におけるCriptoに対する機能的な受容体であることが示された.
Criptoによる影響の機序を明らかにするためシグナル伝達系の解析を行った.CriptoはTGFβシグナル伝達系とMAPキナーゼ-PI3キナーゼ-Aktシグナル伝達系に関与することが示されているため,細胞内タンパク質染色法を用いてリン酸化タンパク質の解析を行った.興味深いことに,培養を行うまえのリン酸化タンパク質のレベルにはGRP78陽性細胞とGRP78陰性細胞とで明確な差があり,これらの細胞が異なる転写制御の状態をもつことが示唆された.マウス組換えCriptoの添加と非添加とで比較した結果,CriptoがGRP78陽性細胞においてリン酸化Akt,リン酸化4E-BP1,リン酸化S6の細胞内濃度を上昇させることがわかった.この現象はGRP78陰性細胞では認められなかった.一方で,リン酸化Smad2/3に関してはGRP78陽性細胞とGRP78陰性細胞のどちらでも有意な差は認められなかった.これらの結果から,CriptoとGRP78の結合によるシグナル伝達系はAktを介していることが示唆された.
造血幹細胞でみられた影響に直接に関与するタンパク質を調べるため,二次元ディファレンシャル電気泳動技術を用いたプロテオミクス解析を行った.解析にあたって造血幹細胞様の細胞株として知られているLhx2細胞を用いた.この細胞はマウス骨髄細胞にホメオボックス遺伝子であるLhx2遺伝子を導入することで樹立された細胞株で,免疫学的な表現型はCD34陰性c-kit陽性Sca-I陽性Lin陰性(ただし,骨髄球およびマクロファージのマーカーであるCD11bは陽性)であり移植実験により骨髄の再構築能のあることも確認されている.興味深いことに,培養細胞株であるにもかかわらずこの細胞にはGRP78陽性細胞とGRP78陰性細胞の両方が存在した.GRP78陽性細胞の単離ののち,マウス組換えCriptoの添加あるいは非添加の条件で24時間培養し,細胞溶解液よりタンパク質を回収した.タンパク質サンプルを二次元電気泳動により分離し,Criptoを添加したときのみ上昇したタンパク質を同定した.その結果,増加した多くのタンパク質は,ピルビン酸キナーゼ,ホスホグリセリン酸キナーゼ,トリオースリン酸イソメラーゼなど,解糖系の代謝に関与する酵素であった.いくつかのスポットにおいて同じタンパク質が複数同定され,これらのタンパク質がリン酸化されたことが示唆された.また,そのほかの代謝酵素やアクチン重合に関与するタンパク質もいくつか同定された.
プロテオミクス解析の結果,Cripto-GRP78シグナル伝達系が解糖系の代謝に関与する可能性が示唆された.解糖系は代謝経路の基本だが,とくに低酸素状態で重要となる.造血幹細胞の多くは低酸素状態にあることがすでに示されているが8),低酸素マーカーであるピモニダゾールを用いた解析の結果,GRP78陽性であるCD34陰性c-kit陽性Sca-I陽性Lin陰性画分は,とくに低酸素細胞の割合の高いことがわかった.
造血幹細胞の保持されている低酸素ニッチはおもに内骨膜領域に存在すると考えられているため,骨髄腔の内部と内骨膜の近傍領域の違いに関して調べた.骨髄腔の内部の造血幹細胞と内骨膜の近傍に付着した造血幹細胞を分離解析する手法を用いたところ9),内骨膜の近傍領域ではGRP78陽性を示す造血幹細胞の割合が高いことが明らかになった.また,造血幹細胞は骨髄細胞のうちミトコンドリア活性の低い細胞に高い比率で存在することが報告されているが4),ミトコンドリア活性のマーカーであるMitoTrackerを用いた染色の結果,内骨膜領域のGRP78陽性細胞はミトコンドリア活性がより低い(間接的に解糖系の代謝の高いことを示す)ことがわかった.
重要なことに,通常は造血幹細胞を培養するとミトコンドリア活性は上昇する傾向にあるが,マウス組換えCriptoを添加した場合にはその上昇が抑えられることがわかった.骨髄の内部の造血幹細胞と異なり,ミトコンドリア活性の低い細胞が非常に少ない胎仔の肝臓や脾臓に由来する造血幹細胞ではCriptoの添加の影響が低いあるいはみられないことから,Criptoの機能とミトコンドリアの活性および解糖系の代謝活性は密接に関連しているものと考えられた.
GRP78陽性細胞が内骨膜領域により多く存在していたことから,この領域の細胞,つまり,低酸素ニッチを構成する細胞がCriptoを多く産生しているのではないかと考えた.分泌型Criptoは細胞膜型CriptoのGPIアンカー領域が切断されることにより放出されるため,細胞膜型Criptoの解析を行うことでその近傍の領域におけるCriptoのタンパク質濃度を推測できると考えた.内骨膜の付着性の非血液細胞はALCAMとSca-Iの2つのマーカーを用いて骨芽細胞系細胞と間葉系細胞とに分けることができる10).解析の結果,とくにSca-I陽性の間葉系細胞に細胞膜型Criptoが存在することがわかった.
内骨膜領域におけるCripto-GRP78シグナル伝達系の重要性を調べるため,抗GRP78中和抗体をマウスに注射してCriptoとの結合を阻害する実験を行ったところ,内骨膜領域におけるGRP78陽性細胞の頻度が低下した.この結果は,CriptoとGRP78との結合およびCripto-GRP78シグナル伝達系が低酸素ニッチにおける造血幹細胞の維持に重要な役割を担っていることを強く示唆していた.一方で,末梢血や脾臓における造血幹細胞の頻度に変化はなかったことから,この現象は内骨膜領域に限定的なものであり,たとえば,G-CSFによる造血幹細胞の末梢血への動員などとは異なるものと考えられた.
低酸素応答の中心的な制御タンパク質はHIF-1αである.HIF-1αは低酸素の状態では安定化しHIF-1βとヘテロ二量体を形成して下流遺伝子の発現を制御するが,通常の酸素分圧ではユビキチンリガーゼVHLにより分解される.HIF-1αコンディショナルノックアウトマウスを用いた研究により,HIF-1αを欠損した造血幹細胞は過剰な細胞周期の回転により早期に幹細胞プールの枯渇をむかえることが明らかにされている8).Cripto遺伝子のプロモーター領域にはHIF-1複合体の結合部位である低酸素応答配列(hypoxia responsive element:HRE)が存在しており,その発現を正に制御していると考えられる5).HIF-1αの欠損がCripto-GRP78シグナル伝達系においてどれほど重要であるかを明らかにするため,同じHIF-1αコンディショナルノックアウトマウスを用いてその影響を調べた.
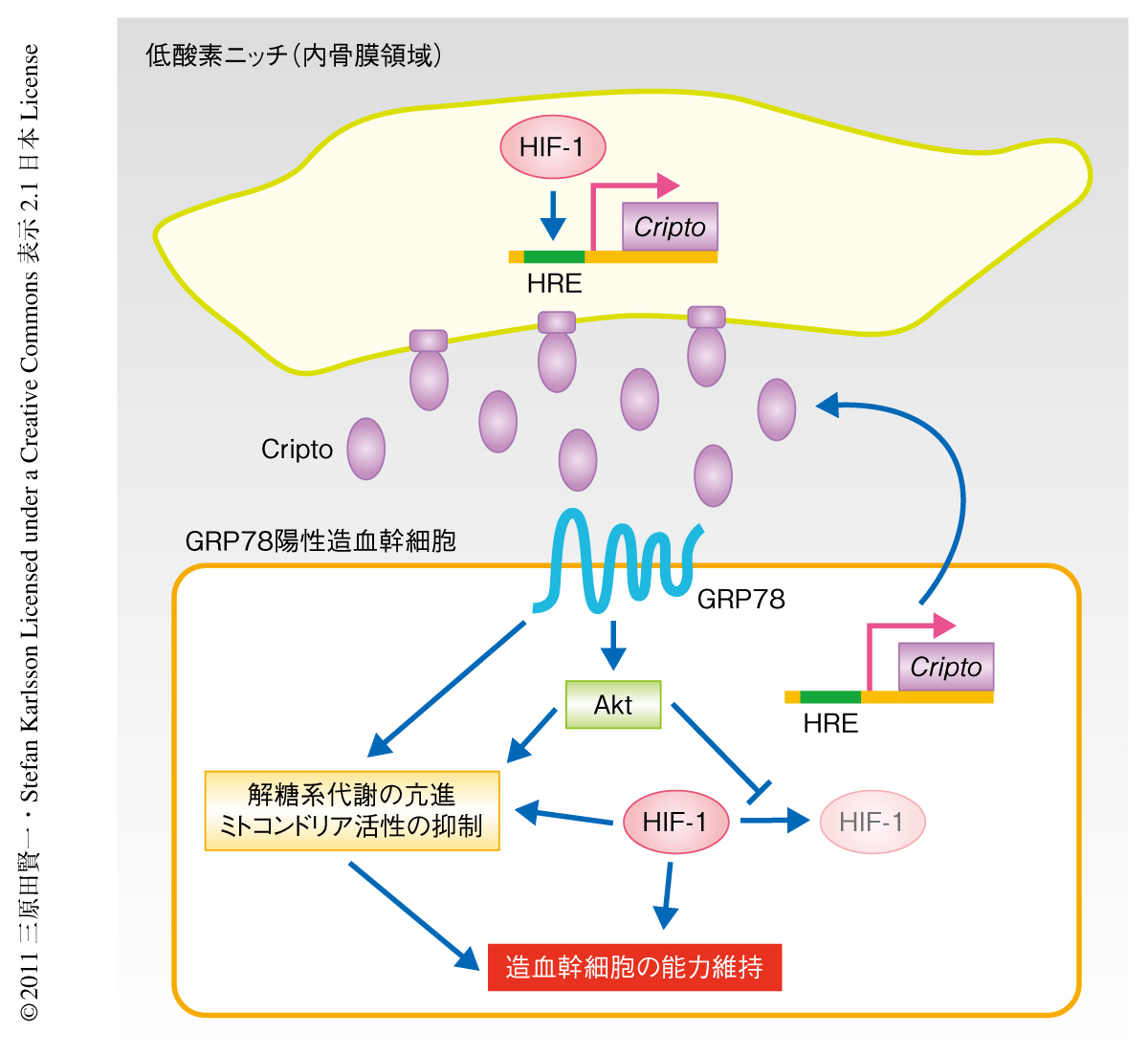
内骨膜細胞の解析手法を用いてHIF-1αコンディショナルノックアウトマウスの低酸素ニッチを構成する細胞を調べたところ,ALCAM陽性細胞とSca-I陽性細胞の頻度が低下していた.また,細胞膜にCriptoを発現している細胞の頻度も低下しており,HIF-1αコンディショナルノックアウトマウスにおいて細胞膜型Criptoを発現する細胞の割合は正常マウスと比較して顕著に減少していた.そこで,内骨膜の近傍の造血幹細胞について調べてみると,正常マウスではより高い頻度で存在するGRP78陽性細胞の割合は骨髄腔の内部の造血幹細胞と同じ程度にまで低下していた.これらの結果から,造血組織においてもCriptoの発現はHIF-1αにより制御されているものと考えられた(図2).
低酸素環境はそれ自体が代謝などを制御し細胞に対して重要な影響を及ぼす.HIF-1αは造血幹細胞を含めた多くの細胞にとり低酸素応答における中心的なタンパク質であり,その下流には多くの被制御タンパク質が存在しているが,今回の研究では,Criptoがそのひとつとして造血幹細胞を制御していることが明らかになった.Cripto遺伝子のプロモーター領域には低酸素応答配列のほかにSmad複合体の結合領域やWntシグナル伝達系の下流タンパク質であるTCF/LEF複合体の結合領域が存在しており,多くの幹細胞シグナルがCriptoの発現を制御している5).一方で,受容体であるGRP78は熱ショックタンパク質のひとつであり,その発現や細胞膜への移行に低酸素が関与しているという報告もある.報告のとおりGRP78陽性細胞とGRP78陰性細胞とではその細胞内環境および細胞外環境に大きな差があり,CriptoとGRP78は低酸素環境に適応するための,いわば実行役ではないかと考えられる.
この研究ではCriptoの機能を細胞外タンパク質として検討したが,Cripto遺伝子の発現が造血幹細胞において高かったことやES細胞および腫瘍細胞での高い発現を考えると細胞内タンパク質としての機能をもつことも考えられる.現在,この点に関する研究を進めており,あわせて造血腫瘍における役割について研究を開始している.
略歴:2007年 筑波大学大学院人間総合科学研究科 修了,同年 理化学研究所 基礎科学特別研究員を経て,2009年よりスウェーデンLund大学 研究員.
研究テーマ:造血幹細胞および赤血球の体外増幅技術の開発,新規の造血制御タンパク質の同定および解析.
抱負:視野は広く,フットワークは軽く.
Stefan Karlsson
スウェーデンLund大学 教授.
© 2011 三原田賢一・Stefan Karlsson Licensed under CC 表示 2.1 日本
(スウェーデンLund大学Laboratory of Molecular Medicine and Gene Therapy)
email:三原田賢一
DOI: 10.7875/first.author.2011.161
Cripto regulates hematopoietic stem cells as a hypoxic-niche-related factor through cell surface receptor GRP78.
Kenichi Miharada, Göran Karlsson, Matilda Rehn, Emma Rörby, Kavitha Siva, Jörg Cammenga, Stefan Karlsson
Cell Stem Cell, 9, 330-344 (2011)
要 約
CriptoはES細胞および腫瘍細胞に関与する液性タンパク質あるいは細胞膜タンパク質として知られている.この研究では,Criptoが造血系においても重要な機能をもつことを明らかにした.Criptoは培養系において造血幹細胞の機能を維持したが,その受容体であるGRP78は造血幹細胞の画分の一部にのみ発現しており,GRP78陽性とGRP78陰性の細胞では機能に差のあることも示された.造血幹細胞はおもに内骨膜に存在する低酸素ニッチに維持されているが,Criptoは内骨膜細胞に多く発現しておりGRP78陽性細胞はこの領域に偏在していた.また,Cripto-GRP78シグナル伝達系は解糖系の代謝酵素を上昇させ,相対的にミトコンドリアの活性を抑制することで造血幹細胞を休眠状態に保持するものと考えられた.低酸素応答において重要なタンパク質であるHIF-1αを欠損したマウスが内骨膜のCripto産生細胞およびGRP78陽性細胞の減少を示したことから,Criptoは低酸素ニッチにおいてHIF-1αの下流タンパク質として造血幹細胞を制御しているものと考えられた.
はじめに
造血幹細胞は生涯にわたり全血球系の細胞を供給しつづける能力(多分化能)をもつとともに,細胞分裂のときに同等の細胞を産み出す能力(自己複製能)をもつ細胞として定義される1).近年,造血幹細胞は骨髄の内部に存在するニッチとよばれる微小な細胞環境に保持されており,種々のニッチ構成タンパク質あるいはニッチ構成細胞により静止期に保たれていることが明らかにされてきている2).とくに,内骨膜領域は低酸素環境であることから“低酸素ニッチ”とよばれており,造血幹細胞が低酸素状態にあること,また,それにともなう低いミトコンドリア活性をもつことが明らかにされてきた3,4).一方で,低酸素ニッチに特異的にはたらくタンパク質,とくに,細胞外タンパク質に関しては依然として不明な点が多かった.
この研究において,筆者らは,多能性幹細胞や腫瘍細胞に関連する遺伝子の産物として知られていたCripto(TDGF-1)が低酸素ニッチにおける重要な細胞外タンパク質としてはたらいていることを明らかにした.CriptoはEGF-CFCファミリーのメンバーであり,分泌型と細胞膜型の2種類が知られているがその機能の違いは明らかになっていない5).TGFβおよびTGFβ受容体に結合しそのシグナルを抑制することが知られており,それとは別に,Criptoは細胞膜に発現するGRP78と結合してMAPキナーゼ-PI3キナーゼ-Aktシグナル伝達系を刺激することも知られている5,6).GRP78は熱ショックタンパク質であるHSP70の一種であり通常は小胞体膜に存在しているが,乳がん細胞などの腫瘍細胞はこのタンパク質を細胞膜に発現しておりCriptoを含む複数のリガンドに対する受容体としてはたらいている6).造血幹細胞では一部の細胞がGRP78を細胞膜に発現しており,GRP78陽性細胞とGRP78陰性細胞はどちらも長期の骨髄再構築能をもつものの,その分化能力には差のあることもわかった.さらに,内骨膜領域の解析と網羅的なタンパク質解析の結果,Criptoは低酸素ニッチを構成する細胞から産生されており,解糖系の代謝を制御することで造血幹細胞の維持に関与していることが示唆された.
1.Criptoは体外培養系で造血幹細胞の機能を維持する
CriptoをコードするmRNAのES細胞における発現はその未分化性を反映することが知られており,たとえば,培養液からLIF(leukemia inhibitory factor,白血病阻害因子)を除去するとその発現レベルは急速に低下する7).驚くべきことに,Cripto遺伝子の発現は血液細胞においても造血幹細胞においてもっとも高く,分化段階に応じて低下していくことがわかった.
液性タンパク質としてのCriptoの機能を調べるため,マウス組換えCriptoを用いて造血幹細胞の培養実験を行った.SCF(stem cell factor,幹細胞因子),トロンボポエチンにくわえて,マウス組換えCriptoを添加した細胞は培養開始7日後および14日後において細胞数の顕著な増加を示し,培養ののちの細胞の分化能力および分裂能力を評価するコロニー形成法では混合コロニー(赤芽球,巨核球,好中球,マクロファージの混在コロニー)の有意な増加がみられた.さらに,幹細胞としての能力を評価するため14日間培養した細胞を致死量の放射線を照射したマウスへ移植したところ,Criptoを添加しなかった細胞では移植した細胞に由来する末梢細胞は観察されなかったのに対し,Cripto添加をした細胞では移植した細胞に由来する末梢血細胞が観察された.
2.Criptoの受容体GRP78は一部の造血幹細胞に発現しその特性に関与する
Criptoに対する受容体のひとつとして報告されているGRP78は,おもに腫瘍細胞など高い増殖能力を備えた細胞の細胞膜に存在することが知られているため,造血幹細胞において細胞膜に存在するGRP78の発現をフローサイトメトリーにより解析した.すると,造血幹細胞が高頻度に存在する画分として知られるCD34陰性c-kit陽性Sca-I陽性Lin陰性画分(CD34- KSL画分)はGRP78陽性細胞とGRP78陰性細胞とに分けられることがわかった.この画分における造血幹細胞の頻度は高いものの100%ではないため,GRP78陽性細胞とGRP78陰性細胞のどちらが幹細胞画分であるかを調べるため,それぞれの細胞を別々に移植して解析を行った.その結果,GRP78陽性細胞とGRP78陰性細胞のどちらも長期の骨髄再構築能をもつ幹細胞であることがわかった.ところが,GRP78陽性細胞とGRP78陰性細胞は末梢血におけるドナー細胞に由来する細胞の割合(キメリズム)において異なる傾向を示し,GRP78陽性細胞に由来する細胞は骨髄球系の割合が高くかつキメリズムは低い値から時間とともにゆるやかに上昇した.一方で,GRP78陰性細胞は移植ののちの早い段階で高いキメリズムを示し,GRP78陽性細胞と比較してリンパ球の割合も高かったがのちのキメリズムは上昇しなかった.移植後16週目の解析では,GRP78陽性細胞とGRP78陰性細胞とに有意な差は認められなかった(図1).
Criptoの機能とGRP78との関連を調べるため,GRP78陽性細胞とGRP78陰性細胞をそれぞれ単離してマウス組換えCriptoのもと14日間培養し移植実験を行ったところ,GRP78陽性細胞のみがCriptoに反応して骨髄の再構築がみられた.一方で,抗GRP78中和抗体を添加したところCriptoによる影響は消失した.以上のことから,GRP78は造血幹細胞におけるCriptoに対する機能的な受容体であることが示された.
3.CriptoはGRP78を介して解糖系の代謝酵素を制御する
Criptoによる影響の機序を明らかにするためシグナル伝達系の解析を行った.CriptoはTGFβシグナル伝達系とMAPキナーゼ-PI3キナーゼ-Aktシグナル伝達系に関与することが示されているため,細胞内タンパク質染色法を用いてリン酸化タンパク質の解析を行った.興味深いことに,培養を行うまえのリン酸化タンパク質のレベルにはGRP78陽性細胞とGRP78陰性細胞とで明確な差があり,これらの細胞が異なる転写制御の状態をもつことが示唆された.マウス組換えCriptoの添加と非添加とで比較した結果,CriptoがGRP78陽性細胞においてリン酸化Akt,リン酸化4E-BP1,リン酸化S6の細胞内濃度を上昇させることがわかった.この現象はGRP78陰性細胞では認められなかった.一方で,リン酸化Smad2/3に関してはGRP78陽性細胞とGRP78陰性細胞のどちらでも有意な差は認められなかった.これらの結果から,CriptoとGRP78の結合によるシグナル伝達系はAktを介していることが示唆された.
造血幹細胞でみられた影響に直接に関与するタンパク質を調べるため,二次元ディファレンシャル電気泳動技術を用いたプロテオミクス解析を行った.解析にあたって造血幹細胞様の細胞株として知られているLhx2細胞を用いた.この細胞はマウス骨髄細胞にホメオボックス遺伝子であるLhx2遺伝子を導入することで樹立された細胞株で,免疫学的な表現型はCD34陰性c-kit陽性Sca-I陽性Lin陰性(ただし,骨髄球およびマクロファージのマーカーであるCD11bは陽性)であり移植実験により骨髄の再構築能のあることも確認されている.興味深いことに,培養細胞株であるにもかかわらずこの細胞にはGRP78陽性細胞とGRP78陰性細胞の両方が存在した.GRP78陽性細胞の単離ののち,マウス組換えCriptoの添加あるいは非添加の条件で24時間培養し,細胞溶解液よりタンパク質を回収した.タンパク質サンプルを二次元電気泳動により分離し,Criptoを添加したときのみ上昇したタンパク質を同定した.その結果,増加した多くのタンパク質は,ピルビン酸キナーゼ,ホスホグリセリン酸キナーゼ,トリオースリン酸イソメラーゼなど,解糖系の代謝に関与する酵素であった.いくつかのスポットにおいて同じタンパク質が複数同定され,これらのタンパク質がリン酸化されたことが示唆された.また,そのほかの代謝酵素やアクチン重合に関与するタンパク質もいくつか同定された.
4.GRP78陽性細胞は内骨膜領域に偏在し低いミトコンドリア活性をもつ
プロテオミクス解析の結果,Cripto-GRP78シグナル伝達系が解糖系の代謝に関与する可能性が示唆された.解糖系は代謝経路の基本だが,とくに低酸素状態で重要となる.造血幹細胞の多くは低酸素状態にあることがすでに示されているが8),低酸素マーカーであるピモニダゾールを用いた解析の結果,GRP78陽性であるCD34陰性c-kit陽性Sca-I陽性Lin陰性画分は,とくに低酸素細胞の割合の高いことがわかった.
造血幹細胞の保持されている低酸素ニッチはおもに内骨膜領域に存在すると考えられているため,骨髄腔の内部と内骨膜の近傍領域の違いに関して調べた.骨髄腔の内部の造血幹細胞と内骨膜の近傍に付着した造血幹細胞を分離解析する手法を用いたところ9),内骨膜の近傍領域ではGRP78陽性を示す造血幹細胞の割合が高いことが明らかになった.また,造血幹細胞は骨髄細胞のうちミトコンドリア活性の低い細胞に高い比率で存在することが報告されているが4),ミトコンドリア活性のマーカーであるMitoTrackerを用いた染色の結果,内骨膜領域のGRP78陽性細胞はミトコンドリア活性がより低い(間接的に解糖系の代謝の高いことを示す)ことがわかった.
重要なことに,通常は造血幹細胞を培養するとミトコンドリア活性は上昇する傾向にあるが,マウス組換えCriptoを添加した場合にはその上昇が抑えられることがわかった.骨髄の内部の造血幹細胞と異なり,ミトコンドリア活性の低い細胞が非常に少ない胎仔の肝臓や脾臓に由来する造血幹細胞ではCriptoの添加の影響が低いあるいはみられないことから,Criptoの機能とミトコンドリアの活性および解糖系の代謝活性は密接に関連しているものと考えられた.
5.内骨膜細胞はCriptoを細胞膜に発現している
GRP78陽性細胞が内骨膜領域により多く存在していたことから,この領域の細胞,つまり,低酸素ニッチを構成する細胞がCriptoを多く産生しているのではないかと考えた.分泌型Criptoは細胞膜型CriptoのGPIアンカー領域が切断されることにより放出されるため,細胞膜型Criptoの解析を行うことでその近傍の領域におけるCriptoのタンパク質濃度を推測できると考えた.内骨膜の付着性の非血液細胞はALCAMとSca-Iの2つのマーカーを用いて骨芽細胞系細胞と間葉系細胞とに分けることができる10).解析の結果,とくにSca-I陽性の間葉系細胞に細胞膜型Criptoが存在することがわかった.
内骨膜領域におけるCripto-GRP78シグナル伝達系の重要性を調べるため,抗GRP78中和抗体をマウスに注射してCriptoとの結合を阻害する実験を行ったところ,内骨膜領域におけるGRP78陽性細胞の頻度が低下した.この結果は,CriptoとGRP78との結合およびCripto-GRP78シグナル伝達系が低酸素ニッチにおける造血幹細胞の維持に重要な役割を担っていることを強く示唆していた.一方で,末梢血や脾臓における造血幹細胞の頻度に変化はなかったことから,この現象は内骨膜領域に限定的なものであり,たとえば,G-CSFによる造血幹細胞の末梢血への動員などとは異なるものと考えられた.
6.Criptoの発現はHIF-1αにより制御されている
低酸素応答の中心的な制御タンパク質はHIF-1αである.HIF-1αは低酸素の状態では安定化しHIF-1βとヘテロ二量体を形成して下流遺伝子の発現を制御するが,通常の酸素分圧ではユビキチンリガーゼVHLにより分解される.HIF-1αコンディショナルノックアウトマウスを用いた研究により,HIF-1αを欠損した造血幹細胞は過剰な細胞周期の回転により早期に幹細胞プールの枯渇をむかえることが明らかにされている8).Cripto遺伝子のプロモーター領域にはHIF-1複合体の結合部位である低酸素応答配列(hypoxia responsive element:HRE)が存在しており,その発現を正に制御していると考えられる5).HIF-1αの欠損がCripto-GRP78シグナル伝達系においてどれほど重要であるかを明らかにするため,同じHIF-1αコンディショナルノックアウトマウスを用いてその影響を調べた.
内骨膜細胞の解析手法を用いてHIF-1αコンディショナルノックアウトマウスの低酸素ニッチを構成する細胞を調べたところ,ALCAM陽性細胞とSca-I陽性細胞の頻度が低下していた.また,細胞膜にCriptoを発現している細胞の頻度も低下しており,HIF-1αコンディショナルノックアウトマウスにおいて細胞膜型Criptoを発現する細胞の割合は正常マウスと比較して顕著に減少していた.そこで,内骨膜の近傍の造血幹細胞について調べてみると,正常マウスではより高い頻度で存在するGRP78陽性細胞の割合は骨髄腔の内部の造血幹細胞と同じ程度にまで低下していた.これらの結果から,造血組織においてもCriptoの発現はHIF-1αにより制御されているものと考えられた(図2).
おわりに
低酸素環境はそれ自体が代謝などを制御し細胞に対して重要な影響を及ぼす.HIF-1αは造血幹細胞を含めた多くの細胞にとり低酸素応答における中心的なタンパク質であり,その下流には多くの被制御タンパク質が存在しているが,今回の研究では,Criptoがそのひとつとして造血幹細胞を制御していることが明らかになった.Cripto遺伝子のプロモーター領域には低酸素応答配列のほかにSmad複合体の結合領域やWntシグナル伝達系の下流タンパク質であるTCF/LEF複合体の結合領域が存在しており,多くの幹細胞シグナルがCriptoの発現を制御している5).一方で,受容体であるGRP78は熱ショックタンパク質のひとつであり,その発現や細胞膜への移行に低酸素が関与しているという報告もある.報告のとおりGRP78陽性細胞とGRP78陰性細胞とではその細胞内環境および細胞外環境に大きな差があり,CriptoとGRP78は低酸素環境に適応するための,いわば実行役ではないかと考えられる.
この研究ではCriptoの機能を細胞外タンパク質として検討したが,Cripto遺伝子の発現が造血幹細胞において高かったことやES細胞および腫瘍細胞での高い発現を考えると細胞内タンパク質としての機能をもつことも考えられる.現在,この点に関する研究を進めており,あわせて造血腫瘍における役割について研究を開始している.
文 献
- Orkin, S. H. & Li, L.: Hematopoiesis: an evolving paradigm for stem cell biology. Cell, 132, 631-644 (2008)[PubMed]
- Scadden, D. T.: The stem-cell niche as an entity of action. Nature, 441, 1075-1079 (2006)[PubMed]
- Parmar, K., Mauch, P., Vergilio, J. A. et al.: Distribution of hematopoietic stem cells in the bone marrow according to regional hypoxia. Proc. Natl. Acad. Sci. USA, 104, 5431-5436 (2007)[PubMed]
- Simsek, T., Kocabas, F., Zheng, J. et al.: The distinct metabolic profile of hematopoietic stem cells reflects their location in a hypoxic niche. Cell Stem Cell, 7, 380-390 (2010)[PubMed]
- Bianco, C., Rangel, M. C., Castro, N. P. et al.: Role of Cripto-1 in stem cell maintenance and malignant progression. Am. J. Pathol., 177, 532-540 (2010)[PubMed]
- Kelber, J. A., Panopoulos, A. D., Shani, G. et al.: Blockade of Cripto binding to cell surface GRP78 inhibits oncogenic Cripto signaling via MAPK/PI3K and Smad2/3 pathways. Oncogene, 28, 2324-2336 (2009)[PubMed]
- Hough, S. R., Laslett, A. L., Grimmond, S. B. et al.: A continuum of cell states spans pluripotency and lineage commitment in human embryonic stem cells. PLoS ONE, 4, e7708 (2009)[PubMed]
- Takubo, K., Goda, N., Yamada, W. et al.: Regulation of HIF-1α level is essential for hematopoietic stem cells. Cell Stem Cell, 7, 391-402 (2010)[PubMed] [新着論文レビュー]
- Grassinger, J., Haylock, D. N., Williams, B. et al.: Phenotypically identical hematopoietic stem cells isolated from different regions of bone marrow have different biologic potential. Blood, 116, 3185-3196 (2010)[PubMed]
- Nakamura, Y., Arai, F., Iwasaki, H. et al.: Isolation and characterization of endosteal niche cell populations that regulate hematopoietic stem cells. Blood, 116, 1422-1432 (2010)[PubMed]
著者プロフィール
略歴:2007年 筑波大学大学院人間総合科学研究科 修了,同年 理化学研究所 基礎科学特別研究員を経て,2009年よりスウェーデンLund大学 研究員.
研究テーマ:造血幹細胞および赤血球の体外増幅技術の開発,新規の造血制御タンパク質の同定および解析.
抱負:視野は広く,フットワークは軽く.
Stefan Karlsson
スウェーデンLund大学 教授.
© 2011 三原田賢一・Stefan Karlsson Licensed under CC 表示 2.1 日本