臓器の形成における化学的な刺激と機械的な刺激の役割
萬本 忠徳
(米国Harvard Medical School,Vascular Biology Program)
萬本忠徳
DOI: 10.7875/first.author.2011.159
Mechanochemical control of mesenchymal condensation and embryonic tooth organ formation.
Tadanori Mammoto, Akiko Mammoto, Yu-suke Torisawa, Tracy Tat, Ashley Gibbs, Ratmir Derda, Robert Mannix, Marlieke de Bruijn, Chong Wing Yung, Dongeun Huh, Donald E. Ingber
Developmental Cell, 21, 758-769 (2011)
固形臓器は上皮組織と間葉組織との経時的な相互作用により形成されることが知られている.筆者らは,胎生期において歯牙の上皮組織が化学物質の濃度勾配により間葉細胞の相反する遊走(誘引と反発)をひき起こす結果,近接する間葉細胞の凝集を誘起すること,また,間葉細胞の臓器に特異的な分化が凝集による細胞の大きさの減少により誘起されることを発見した.また,このような細胞の大きさの減少による分化の誘導は,凝集に依存して間葉細胞において合成され再構築される特異的な細胞外マトリックスにより維持されることもあわせて発見した.これらの知見は,生体における固形臓器の形成は上皮組織と間葉組織との化学的および機械的な刺激の相互作用によるドミノ反応により生じることを示唆した.
ヒトあるいはマウスにおいてiPS細胞(induced pluripotent stem cell,人工多能性幹細胞)が発明され1,2),倫理的な問題がなく拒絶反応の少ない幹細胞の移植療法に期待がもたれているが,多能性をもつ幹細胞から移植が可能で機能的な三次元構造をもつ臓器を作製することはいまだ困難である.この困難を克服し幹細胞から移植の可能な固形臓器を作製するためには,個々の固形臓器が胎生期においていかに形成されているかを詳細に観察しその分子機構を明らかにすることが必須である.そのうえで,そこで得た原理を用いて幹細胞をプログラムし三次元的で移植の可能な臓器を作製することが合理的であると考えられる.ほとんどの固形臓器は上皮組織と間葉組織との相互作用から形成され,臓器の形成における初期の過程で上皮組織が間葉細胞の凝集を誘起し,凝集した間葉細胞が臓器に特異的な細胞へと分化し臓器が形成されることが知られているが,この間葉細胞の凝集の機能についてはいまだ明らかではない.筆者らは,この固形臓器の形成に必須である間葉細胞の凝集が化学的な刺激と機械的な刺激の相互作用3) により誘起されることを,マウスを用いた歯牙の形成モデルを用いて明らかにした.
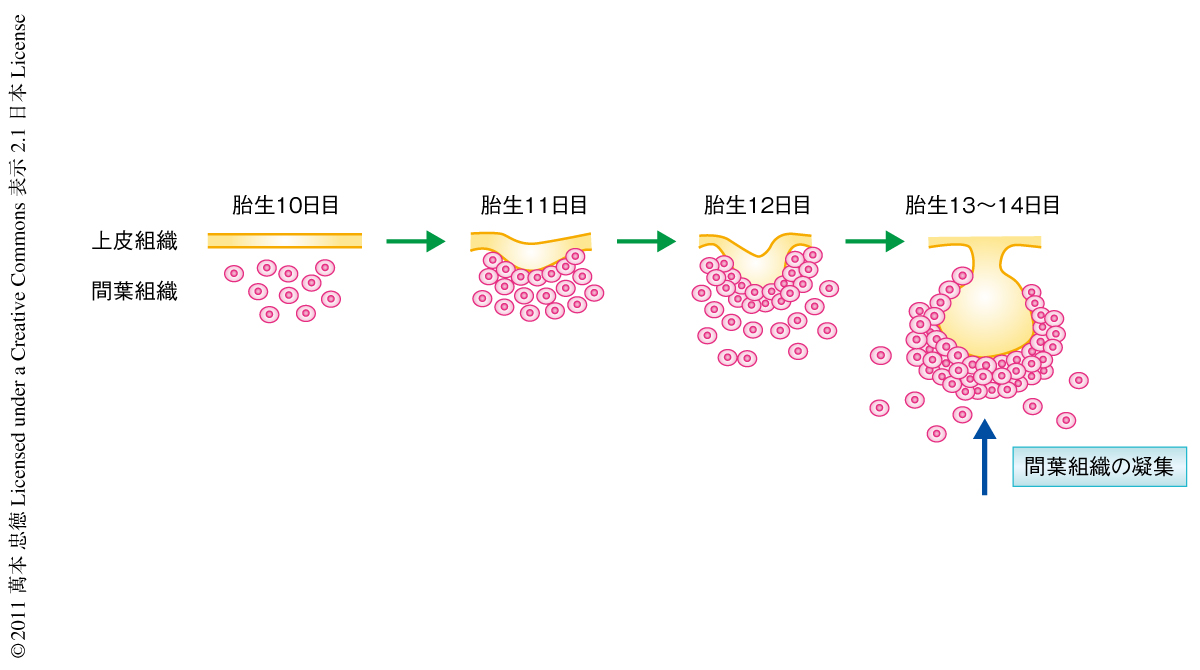
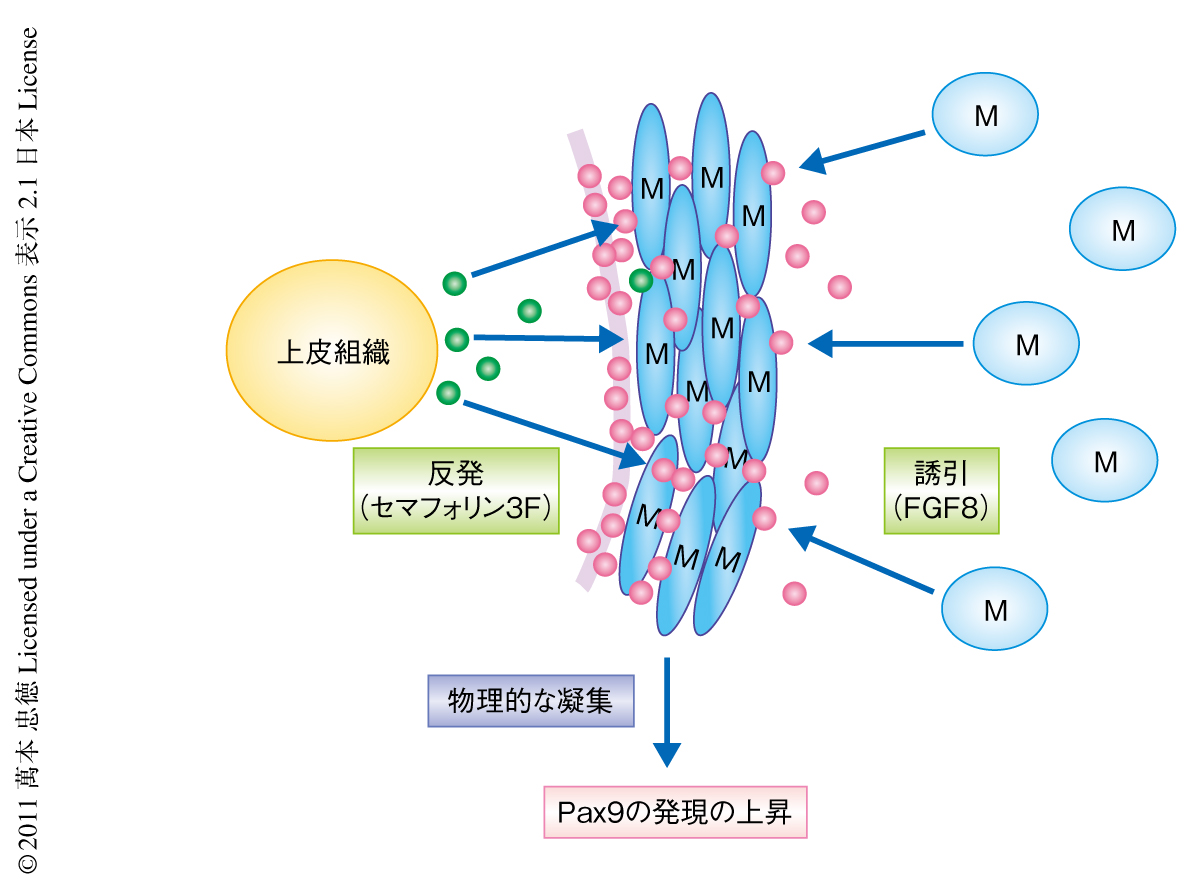
胎生期のマウスにおける歯牙の初期形成は,上皮組織の肥厚(胎生10日目~11日目),肥厚した上皮組織の間葉組織への陥入(胎生12日目),陥入した上皮組織の周囲に誘起される間葉細胞の凝集(胎生12日目~13日目),凝集した間葉細胞の臓器に特異的な細胞への分化(胎生15日以後),により構成される(図1).注目すべきことに,肺,腎臓,肝臓,骨,軟骨,乳腺,毛根,皮膚など,ほとんどの臓器がこのような上皮組織により誘起される間葉細胞の凝集をへて形成されているが4),その分子機構は明らかにされていない.筆者らは,歯牙の形成における間葉細胞の凝集の分子機構を模索するため,以下のようなin vitroの系を構築した.胎生10日目の未分化の間葉細胞を分離し初期培養系を樹立したのち,レトロウイルスを用いGFPの遺伝子を導入することで間葉細胞を標識した.酵素より分離した胎生10日目,胎生11日目,胎生13日目の歯牙の上皮組織をディッシュにおいて培養した間葉細胞に重層した結果,胎生11日目の上皮組織を重層した場合にのみ,in vivoと同様の著明な間葉細胞の凝集が観察された.経時的な観察により,このような間葉細胞の凝集は間葉細胞の増殖ではなく,この時期の歯牙の上皮組織が間葉細胞を誘引しかつ反発することにより誘起されていることが明らかになった(図2).さらに,遺伝子解析と機能解析により,歯牙の上皮組織に由来するFGF8とセマフォリン3Fが,おのおの,間葉細胞の誘引と反発に関与していることが明らかになった.同時に,in vitroの系で凝集した間葉細胞において,歯牙の形成に特異的なマーカーであるPax9,Msx1,BMP4などの発現が上昇することも明らかになった(図2).
つづいて,in vitroの系およびin vivoにおいて,凝集した間葉細胞の大きさは周囲の凝集していない間葉細胞に比べ20%~30%ほど小さいこと,これらの間葉細胞における歯牙の形成に特異的なマーカーの誘起が細胞の大きさの変化により起こることが見い出された.この知見を確認するため,凝集した間葉細胞と同じ大きさに作製した細胞外マトリックスのマイクロパターンを用い5),分離した胎生10日目の未分化な間葉細胞をin vitroにおいて生理的な間葉細胞の凝集で観察される間葉細胞の大きさへと操作したところ,化学的な刺激なしに,細胞の大きさの減少のみで歯牙の形成に特異的なマーカーの誘起されることが観察された.濃度勾配をもたない化学的な刺激のみでは歯牙の形成に特異的なマーカーは誘起されないことから,歯牙の上皮組織に由来するこれらの化学的な刺激は,その濃度勾配により間葉細胞の相反する遊走能(誘引と反発)を制御することにより細胞の凝集をひき起こし,結果として,細胞の大きさが機械的に変化することにより歯牙の形成に特異的なマーカーが誘起されていることが明らかになった.
また,このin vitroにおける細胞の大きさの減少による歯牙の形成に特異的なマーカーの誘起は,細胞の大きさを再び増大させることにより消失した.これらの結果は,このような細胞の大きさに依存的な分化が可逆的であることを示唆し,上皮組織に由来する化学的な濃度勾配によりひき起こされた間葉細胞の凝集は,in vivoではなんらかのかたちで維持される必要性のあることを示唆した.そして,遺伝子解析により細胞外マトリックスの構成タンパク質としてコラーゲンVIが間葉細胞の密度と大きさに依存的に合成および分泌され,間葉細胞の凝集および細胞の大きさの維持にはたらいていることが見い出された.これらの結果は,上皮組織に由来する化学的な刺激が間葉細胞の相反する遊走能を調節することにより間葉細胞の凝集および大きさの減少をひき起こし,間葉細胞の大きさの変化に応じて臓器に特異的な分化が誘起され,同時に,間葉細胞の凝集による細胞外マトリックスの合成および再構築が起こり間葉細胞の大きさおよびそれにともなう分化が保持されることを示唆した.このように,生体における固形臓器の形成は化学的および機械的な刺激の相互作用によるドミノ反応により形成されることが明らかになった.
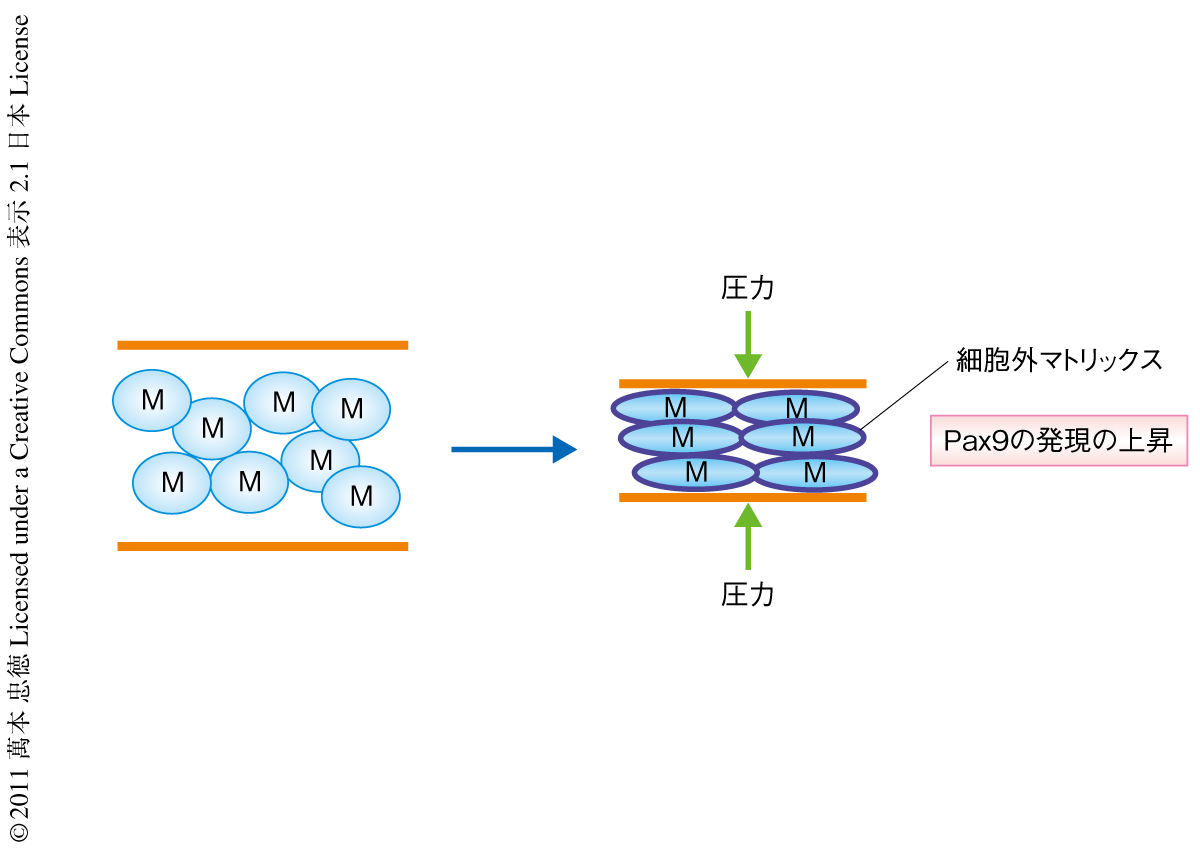
この原理を三次元構造の構築に応用するため,分離した胎生10日目の未分化な間葉組織から工学的な手法を用いて人工的な間葉細胞の凝集を再現することを試みた.具体的には,分離した間葉組織にさまざまな圧力をくわえることで,細胞密度や細胞の大きさが生理的な間葉細胞の凝集と同一となるように圧縮した.その結果,歯牙の上皮組織の存在なしに,歯牙の形成に特異的なマーカーの誘起およびin vivoにおいて観察されたと同様の細胞外マトリックスの再構築が観察された(図3).これらの結果は,間葉組織の機械的な圧縮が上皮組織によりひき起こされる間葉細胞の凝集を代替できる可能性を示唆していた.筆者らは,現在,このように得た情報をもとにして,化学的な刺激と機械的な刺激により幹細胞を臓器に特異的に三次元的にプログラムすることを試みている.
固形臓器の形成に際しては上皮組織と間葉組織とが経時的に相互作用し,ある時期には上皮組織が間葉組織を,ある時期には間葉組織が上皮組織を,臓器に特異的にプログラムすることが知られている.歯牙の形成においては,胎生10日目~11日目には歯牙の上皮組織が間葉組織をプログラムし,その結果として,胎生13日目~14日目には間葉組織が上皮組織をプログラムすることが知られている.筆者らは,上皮組織が凝集を誘起することにより間葉細胞をプログラムし,そののち,凝集した間葉細胞が上皮組織をプログラムする能力を得るものと考えている.筆者らの最終的な目標は,化学的および機械的な手法を用いて,成人に由来する口腔粘膜などの上皮組織を歯牙に特異的にプログラムできるような間葉組織を,iPS細胞あるいは成人に由来する幹細胞から作製して,成人に由来する組織のみから特定の臓器を作製することである.
略歴:1995年 大阪大学大学院医学研究科 修了,同年 大阪府立成人病センター 診療主任,2006年 米国Union Memorial Hospitalインターンを経て,2008年より米国Harvard Medical School.
© 2011 萬本 忠徳 Licensed under CC 表示 2.1 日本
(米国Harvard Medical School,Vascular Biology Program)
萬本忠徳
DOI: 10.7875/first.author.2011.159
Mechanochemical control of mesenchymal condensation and embryonic tooth organ formation.
Tadanori Mammoto, Akiko Mammoto, Yu-suke Torisawa, Tracy Tat, Ashley Gibbs, Ratmir Derda, Robert Mannix, Marlieke de Bruijn, Chong Wing Yung, Dongeun Huh, Donald E. Ingber
Developmental Cell, 21, 758-769 (2011)
要 約
固形臓器は上皮組織と間葉組織との経時的な相互作用により形成されることが知られている.筆者らは,胎生期において歯牙の上皮組織が化学物質の濃度勾配により間葉細胞の相反する遊走(誘引と反発)をひき起こす結果,近接する間葉細胞の凝集を誘起すること,また,間葉細胞の臓器に特異的な分化が凝集による細胞の大きさの減少により誘起されることを発見した.また,このような細胞の大きさの減少による分化の誘導は,凝集に依存して間葉細胞において合成され再構築される特異的な細胞外マトリックスにより維持されることもあわせて発見した.これらの知見は,生体における固形臓器の形成は上皮組織と間葉組織との化学的および機械的な刺激の相互作用によるドミノ反応により生じることを示唆した.
はじめに
ヒトあるいはマウスにおいてiPS細胞(induced pluripotent stem cell,人工多能性幹細胞)が発明され1,2),倫理的な問題がなく拒絶反応の少ない幹細胞の移植療法に期待がもたれているが,多能性をもつ幹細胞から移植が可能で機能的な三次元構造をもつ臓器を作製することはいまだ困難である.この困難を克服し幹細胞から移植の可能な固形臓器を作製するためには,個々の固形臓器が胎生期においていかに形成されているかを詳細に観察しその分子機構を明らかにすることが必須である.そのうえで,そこで得た原理を用いて幹細胞をプログラムし三次元的で移植の可能な臓器を作製することが合理的であると考えられる.ほとんどの固形臓器は上皮組織と間葉組織との相互作用から形成され,臓器の形成における初期の過程で上皮組織が間葉細胞の凝集を誘起し,凝集した間葉細胞が臓器に特異的な細胞へと分化し臓器が形成されることが知られているが,この間葉細胞の凝集の機能についてはいまだ明らかではない.筆者らは,この固形臓器の形成に必須である間葉細胞の凝集が化学的な刺激と機械的な刺激の相互作用3) により誘起されることを,マウスを用いた歯牙の形成モデルを用いて明らかにした.
1.上皮組織と間葉組織との相互作用のin vitro系
胎生期のマウスにおける歯牙の初期形成は,上皮組織の肥厚(胎生10日目~11日目),肥厚した上皮組織の間葉組織への陥入(胎生12日目),陥入した上皮組織の周囲に誘起される間葉細胞の凝集(胎生12日目~13日目),凝集した間葉細胞の臓器に特異的な細胞への分化(胎生15日以後),により構成される(図1).注目すべきことに,肺,腎臓,肝臓,骨,軟骨,乳腺,毛根,皮膚など,ほとんどの臓器がこのような上皮組織により誘起される間葉細胞の凝集をへて形成されているが4),その分子機構は明らかにされていない.筆者らは,歯牙の形成における間葉細胞の凝集の分子機構を模索するため,以下のようなin vitroの系を構築した.胎生10日目の未分化の間葉細胞を分離し初期培養系を樹立したのち,レトロウイルスを用いGFPの遺伝子を導入することで間葉細胞を標識した.酵素より分離した胎生10日目,胎生11日目,胎生13日目の歯牙の上皮組織をディッシュにおいて培養した間葉細胞に重層した結果,胎生11日目の上皮組織を重層した場合にのみ,in vivoと同様の著明な間葉細胞の凝集が観察された.経時的な観察により,このような間葉細胞の凝集は間葉細胞の増殖ではなく,この時期の歯牙の上皮組織が間葉細胞を誘引しかつ反発することにより誘起されていることが明らかになった(図2).さらに,遺伝子解析と機能解析により,歯牙の上皮組織に由来するFGF8とセマフォリン3Fが,おのおの,間葉細胞の誘引と反発に関与していることが明らかになった.同時に,in vitroの系で凝集した間葉細胞において,歯牙の形成に特異的なマーカーであるPax9,Msx1,BMP4などの発現が上昇することも明らかになった(図2).
2.in vitroにおける細胞の大きさの減少による歯牙の形成
つづいて,in vitroの系およびin vivoにおいて,凝集した間葉細胞の大きさは周囲の凝集していない間葉細胞に比べ20%~30%ほど小さいこと,これらの間葉細胞における歯牙の形成に特異的なマーカーの誘起が細胞の大きさの変化により起こることが見い出された.この知見を確認するため,凝集した間葉細胞と同じ大きさに作製した細胞外マトリックスのマイクロパターンを用い5),分離した胎生10日目の未分化な間葉細胞をin vitroにおいて生理的な間葉細胞の凝集で観察される間葉細胞の大きさへと操作したところ,化学的な刺激なしに,細胞の大きさの減少のみで歯牙の形成に特異的なマーカーの誘起されることが観察された.濃度勾配をもたない化学的な刺激のみでは歯牙の形成に特異的なマーカーは誘起されないことから,歯牙の上皮組織に由来するこれらの化学的な刺激は,その濃度勾配により間葉細胞の相反する遊走能(誘引と反発)を制御することにより細胞の凝集をひき起こし,結果として,細胞の大きさが機械的に変化することにより歯牙の形成に特異的なマーカーが誘起されていることが明らかになった.
また,このin vitroにおける細胞の大きさの減少による歯牙の形成に特異的なマーカーの誘起は,細胞の大きさを再び増大させることにより消失した.これらの結果は,このような細胞の大きさに依存的な分化が可逆的であることを示唆し,上皮組織に由来する化学的な濃度勾配によりひき起こされた間葉細胞の凝集は,in vivoではなんらかのかたちで維持される必要性のあることを示唆した.そして,遺伝子解析により細胞外マトリックスの構成タンパク質としてコラーゲンVIが間葉細胞の密度と大きさに依存的に合成および分泌され,間葉細胞の凝集および細胞の大きさの維持にはたらいていることが見い出された.これらの結果は,上皮組織に由来する化学的な刺激が間葉細胞の相反する遊走能を調節することにより間葉細胞の凝集および大きさの減少をひき起こし,間葉細胞の大きさの変化に応じて臓器に特異的な分化が誘起され,同時に,間葉細胞の凝集による細胞外マトリックスの合成および再構築が起こり間葉細胞の大きさおよびそれにともなう分化が保持されることを示唆した.このように,生体における固形臓器の形成は化学的および機械的な刺激の相互作用によるドミノ反応により形成されることが明らかになった.
3.人工的な間葉細胞の凝集の再現
この原理を三次元構造の構築に応用するため,分離した胎生10日目の未分化な間葉組織から工学的な手法を用いて人工的な間葉細胞の凝集を再現することを試みた.具体的には,分離した間葉組織にさまざまな圧力をくわえることで,細胞密度や細胞の大きさが生理的な間葉細胞の凝集と同一となるように圧縮した.その結果,歯牙の上皮組織の存在なしに,歯牙の形成に特異的なマーカーの誘起およびin vivoにおいて観察されたと同様の細胞外マトリックスの再構築が観察された(図3).これらの結果は,間葉組織の機械的な圧縮が上皮組織によりひき起こされる間葉細胞の凝集を代替できる可能性を示唆していた.筆者らは,現在,このように得た情報をもとにして,化学的な刺激と機械的な刺激により幹細胞を臓器に特異的に三次元的にプログラムすることを試みている.
おわりに
固形臓器の形成に際しては上皮組織と間葉組織とが経時的に相互作用し,ある時期には上皮組織が間葉組織を,ある時期には間葉組織が上皮組織を,臓器に特異的にプログラムすることが知られている.歯牙の形成においては,胎生10日目~11日目には歯牙の上皮組織が間葉組織をプログラムし,その結果として,胎生13日目~14日目には間葉組織が上皮組織をプログラムすることが知られている.筆者らは,上皮組織が凝集を誘起することにより間葉細胞をプログラムし,そののち,凝集した間葉細胞が上皮組織をプログラムする能力を得るものと考えている.筆者らの最終的な目標は,化学的および機械的な手法を用いて,成人に由来する口腔粘膜などの上皮組織を歯牙に特異的にプログラムできるような間葉組織を,iPS細胞あるいは成人に由来する幹細胞から作製して,成人に由来する組織のみから特定の臓器を作製することである.
文 献
- Takahashi, K., Tanabe, K., Ohnuki, M. et al.: Induction of pluripotent stem cells from adult human fibroblasts by defined factors. Cell, 131, 861-872 (2007)[PubMed]
- Takahashi, K. & Yamanaka, S.: Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. Cell, 126, 663-676 (2006)[PubMed]
- Mammoto, T. & Ingber, D. E.: Mechanical control of tissue and organ development. Development, 137, 1407-1420 (2010)[PubMed]
- Thesleff, I., Vaahtokari, A. & Partanen, A. M.: Regulation of organogenesis. Common molecular mechanisms regulating the development of teeth and other organs. Int. J. Dev. Biol., 39, 35-50 (1995)[PubMed]
- Chen, C. S., Mrksich, M., Huang, S. et al.: Geometric control of cell life and death. Science, 276, 1425-1428 (1997)[PubMed]
著者プロフィール
略歴:1995年 大阪大学大学院医学研究科 修了,同年 大阪府立成人病センター 診療主任,2006年 米国Union Memorial Hospitalインターンを経て,2008年より米国Harvard Medical School.
© 2011 萬本 忠徳 Licensed under CC 表示 2.1 日本