シロイヌナズナにおけるゲノムインプリンティングとDNAの脱メチル化の制御にはHMGドメインを含むタンパク質SSRP1をコードする遺伝子が必要である
池田陽子・木下 哲
(奈良先端科学技術大学院大学バイオサイエンス研究科 植物生殖遺伝学研究グループ)
email:池田陽子,木下 哲
DOI: 10.7875/first.author.2011.151
HMG domain containing SSRP1 is required for DNA demethylation and genomic imprinting in Arabidopsis.
Yoko Ikeda, Yuki Kinoshita, Daichi Susaki, Yuriko Ikeda, Megumi Iwano, Seiji Takayama, Tetsuya Higashiyama, Tetsuji Kakutani, Tetsu Kinoshita
Developmental Cell, 21, 589-596 (2011)
シロイヌナズナを用いた遺伝学的な解析により,DNAの脱メチル化の過程には雌性配偶体の中央細胞においてDEMETER(DME)とよばれるDNA脱メチル化酵素が必要であることが明らかにされている.しかしながら,DNA脱メチル化酵素のほかのタンパク質に関してはその多くが不明である.今回,筆者らは,シロイヌナズナの中央細胞において,FACTヒストンシャペロン複合体の構成タンパク質として知られるHMGドメインを含むタンパク質SSRP1をコードする遺伝子がDNAの脱メチル化やインプリント遺伝子の制御に必要であることを明らかにした.さらに,DNAメチル基転移酵素MET1,DNA脱メチル化酵素DME,ならびに,SSRP1のそれぞれの変異体を用いて遺伝学的な解析を行った.dme変異体では中央細胞におけるDNAの脱メチル化が起こらずインプリント遺伝子FWAは活性化されなかったが,この表現型はmet1変異により抑圧された.一方で,met1変異とssrp1変異との二重変異体の中央細胞ではssrp1変異による表現型はmet1変異によりほとんど抑圧されなかった.しかしながら,met1変異により誘導された低メチル化したFWA遺伝子が受精ののちの複製にしたがい徐々に活性化されるという興味深い現象が観察された.したがって,これまでに報告されているSSRP1の機能も合わせて,DMEとSSRP1はDNAの脱メチル化に対して,塩基除去修復とクロマチン機能の制御という本質的に異なる機構をつうじ,協調してDNAの脱メチル化の制御を行っているものと考えられた.
DNAのメチル化は遺伝子の発現やゲノムの安定化に寄与している.これまで,DNAにメチル基がどのように付与され維持されるかについては比較的明らかになっているのに対し,メチル基がいかに消去されるかに関しては謎が多い1).DNA脱メチル化酵素の発見にはシロイヌナズナのゲノムインプリンティングの研究が大きく貢献した.片親に由来する遺伝子が選択的に発現するゲノムインプリンティングの確立にはDNAの脱メチル化が必要であることが知られている.インプリント遺伝子を活性化できないDEMETER(DME)とよばれるDNA脱メチル化酵素の変異体の解析から,このDMEは塩基除去修復の最初のステップを触媒する活性,すなわち,メチルシトシンを切り出しDNA鎖にニックを入れるという活性をもつことが示された.このことから,DNAの脱メチル化は,まず塩基が除去され(メチルシトシンの切り出し),そののちの修復合成でメチル基のないシトシンが取り込まれることにより完了するというモデルが提唱された2).
筆者らはこれまで,シロイヌナズナのインプリント遺伝子FWAの解析を行ってきた3).FWA遺伝子は胚乳組織(胚発生を助ける植物種子の組織で,発芽ののちに退化する)において,母親(雌性配偶体の中央細胞)から遺伝したときのみ発現する.一方で,父親(雄性配偶体の精細胞)から遺伝した対立遺伝子は不活性な状態に保たれる.FWA遺伝子のプロモーター領域にはSINEレトロトランスポゾンに由来する反復配列が挿入されており,この領域がDNAのメチル化をうけつねに発現抑制されている4).ところが,雌性配偶体の中央細胞ではこの領域がDMEによるDNAの脱メチル化をうけて活性化される.このことが引き金となり受精ののちの胚乳において母親に由来する遺伝子が選択的に発現する.したがって,FWA遺伝子はDNAの脱メチル化制御を遺伝学的に解析するためのモデル系として有効であると考えた.
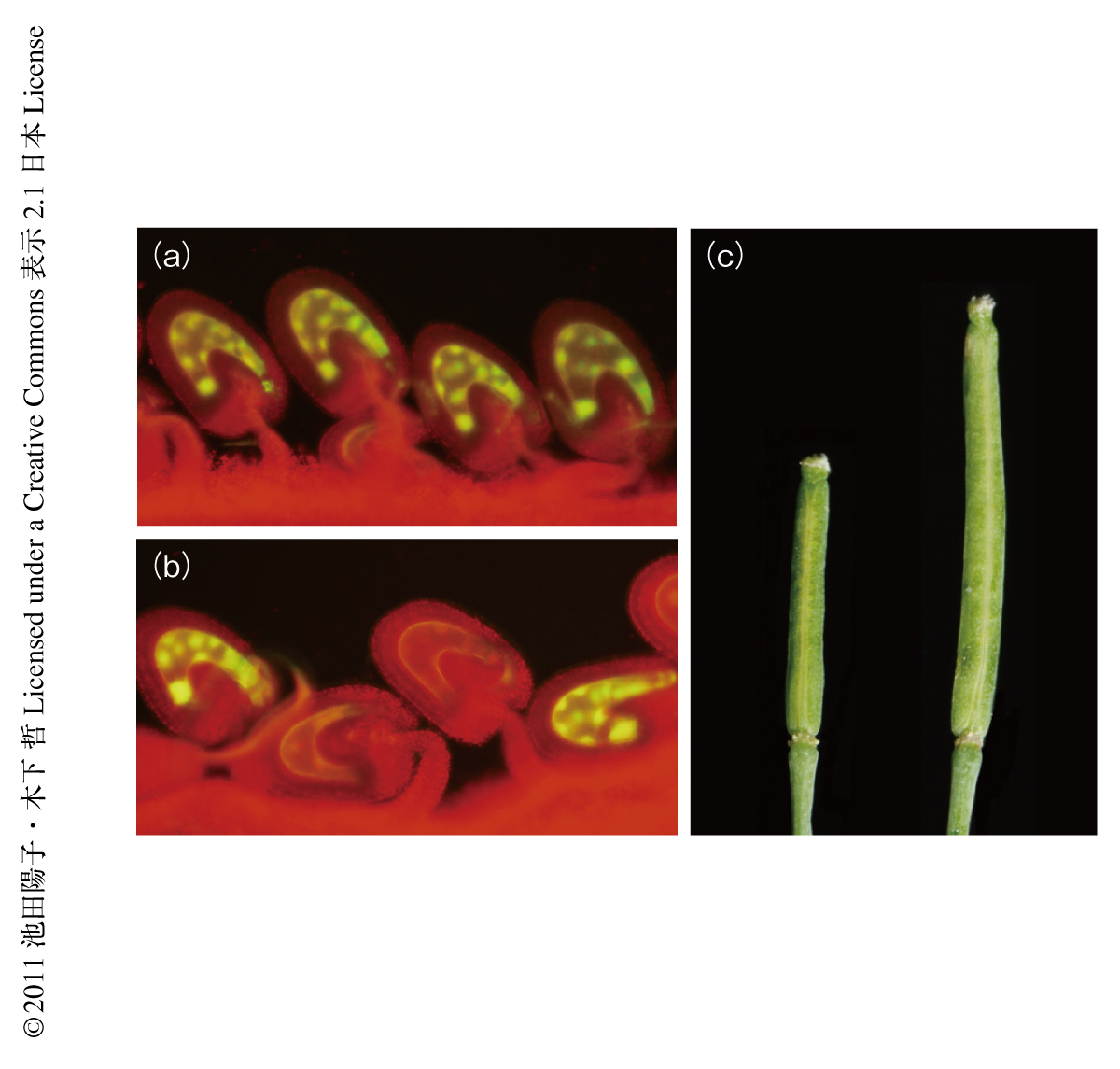
DNAの脱メチル化の過程に必要なタンパク質を明らかにするため,FWA遺伝子に蛍光タンパク質GFPをコードする遺伝子をつないでゲノムインプリンティングを可視化する系を利用した(図1a).このコンストラクトをもつ植物を変異原により処理し,中央細胞および受精ののちの胚乳においてGFPの蛍光のみられない変異体を選抜した(図1b).得られた変異体のポジショナルクローニングの結果,HMG(high mobility group)ドメインを含むタンパク質SSRP1(structure specific recognition protein 1)をコードする遺伝子に変異がみつかった.SSRP1は酵母から哺乳類まで広く保存されたヒストンシャペロン複合体FACT(facilitates chromatin transcription/transaction)の構成タンパク質であり,ヒストンH2AおよびヒストンH2Bに結合し転写開始や転写伸長などの際に機能していることが報告されている.ssrp1変異体では受精に依存しない自律的な胚乳の核の分裂の開始と,それにともなう鞘の伸長がみられた(図1c).これらの特徴はほかのインプリント遺伝子の変異体においても高頻度でみられる表現型であり,SSRP1遺伝子はFWA遺伝子以外にも多くのインプリント遺伝子を制御している可能性があった.実際,定量RT-PCR法などによる解析から,ssrp1変異はインプリント遺伝子ではないDME遺伝子およびFIE遺伝子の発現には影響しない一方で,インプリント遺伝子であるFWA遺伝子,MEA遺伝子,FIS2遺伝子などの発現には影響することが明らかになった.
ssrp1変異体におけるインプリント遺伝子FWAの発現異常がDNAの脱メチル化の異常によるものであるかどうかを調べるため,さきに述べたSINEレトロトランスポゾンに由来するFWA遺伝子のプロモーター領域のDNAメチル化のレベルをバイサルファイトシークエンス法により解析した.その結果,野生型の胚乳ではこの領域が母親から由来した場合には低メチル化状態であるのに対して,ssrp1変異体では母親に由来する場合も高メチル化状態であることが判明した.また,メチル化されたゲノム領域を認識し切断する制限酵素McrBCで消化したのちPCRを行う方法によりほかの領域のDNAメチル化のレベルを調べたところ,ssrp1変異体の胚乳ではインプリント遺伝子MEAの5’側の領域および3’側の領域のDNAメチル化のレベルが野生型より高いことが明らかになった.以上のことより,SSRP1遺伝子は多くの母親特異的なインプリント遺伝子の発現に影響し,DNAの脱メチル化にも影響することが明らかになった.
さらに,HMGドメインを含むタンパク質SSRP1とDNA脱メチル化酵素のひとつDMEとの関係を明らかにするため,dme変異体とssrp1変異体のそれぞれについて,維持型DNAメチル化酵素であるMET1の変異体との二重ヘテロ変異体を作製し,さきに述べたインプリント遺伝子FWAのマーカーであるFWA-GFP融合遺伝子の活性化に対する影響を遺伝学的に解析した.この解析では,あらかじめ維持型DNAメチル化酵素MET1の変異により低メチル化したゲノムを誘導しておけば,DMEとSSRP1のDNAの脱メチル化に関するそれぞれの役割がうかびあがるだろうと考えた.まず対照として,met1変異体,dme変異体,ssrp1変異体のそれぞれのヘテロ変異体でのFWA-GFP融合遺伝子の活性化を検討した.その結果,維持型DNAメチル化酵素の変異体であるmet1変異体ではすべての胚珠でGFPの蛍光が観察されたのに対して,dme変異体およびssrp1変異体のヘテロ接合体ではGFPが活性化された胚珠と活性化されない胚珠とが1対1に分離した(中央細胞は減数分裂をへた半数体世代であり,変異はヘテロ変異体では半数の中央細胞に受け継がれ,dme変異またはssrp1変異をもった中央細胞ではDNAの脱メチル化が起こらずFWA-GFP融合遺伝子が活性化されないためこのような分離比を示す).つぎに,dme変異とmet1変異との二重ヘテロ変異体について調べた.dme変異体におけるDNAを脱メチル化できないという表現型をmet1変異が抑圧するのならば,中央細胞においてFWA-GFP融合遺伝子が活性化する胚珠が50%から75%に上昇するものと期待された.実験の結果,受精の前後ともにFWA-GFP融合遺伝子の活性化された胚珠は予想どおりほぼ75%であった.この結果は,維持型DNAメチル化酵素MET1の欠損によりDNAメチル化のレベルが維持されなければ,脱メチル化酵素DMEの有無によらずインプリント遺伝子FWAは活性化されることを意味した.なお,met1変異がdme変異を抑圧する関係はインプリント遺伝子MEAの遺伝子座においても報告されている5).
一方で,ssrp1変異とmet1変異との二重ヘテロ変異体では興味深い結果が得られた.dme変異の場合のように,ssrp1変異でもmet1変異による抑圧により75%の胚珠でFWA-GFP融合遺伝子が活性化されるものと予想したが,実際には予想とは異なり,ssrp1変異とmet1変異との二重ヘテロ変異体では受精のまえにFWA-GFP融合遺伝子が完全に活性化された胚珠は50%にとどまり,通常はみられない弱いFWA-GFP融合遺伝子の発現を示す胚珠が2割ほどみられた.受粉ののち時間をおって観察すると,受精ののちに弱い発現を示した胚珠が強い発現へと変化していくようにみえ,3日目には活性化したFWA-GFP融合遺伝子を含む胚珠は75%に達した.このような弱い発現が強い発現へと変化する傾向は受精に依存しない胚乳の核の分裂でもみられた.
これらの現象で鍵となるのは,メチル化したDNA領域の複製の過程にあると考えられた.中央細胞の核は受精してから3日目までにほぼ同調して6~7回の分裂を行う.また,受精に依存しないssrp1変異体の自律的な胚乳の核の分裂も3回程度まで観察される.複製の過程ではDNAのメチル化とクロマチンの状態は相互に依存していることが知られており,DNAのメチル化が維持されないとクロマチンの状態も不活性な状態から活性な状態へと変化する6).したがって,受精のまえのssrp1変異とmet1変異との二重ヘテロ変異体では,ゲノムが低メチル化状態であってもFACTヒストンシャペロン複合体の構成タンパク質であるSSRP1が中央細胞で機能しないとインプリント遺伝子FWAの発現は十分に活性化されないものと考えられた.一方,受精ののちに弱い発現から強い発現へ徐々にシフトする現象については,DNAメチル化のレベルが低下したまま受精ののちに複製が開始し,クロマチンの状態が不活性な状態から活性な状態へと徐々に変化したためと考えられた.この研究の結果と,これまでに報告されているSSRP1の機能を考え合わせると,DMEとSSRP1はDNAの脱メチル化に対して,塩基除去修復とクロマチン機能の制御という本質的に異なる機構をつうじ,協調してDNAの脱メチル化の制御を行っているものと考えられた.
今後は,中央細胞や胚乳の核を回収してクロマチンを解析することで,遺伝学的な解析から得られるモデルを検証したいと考えている.
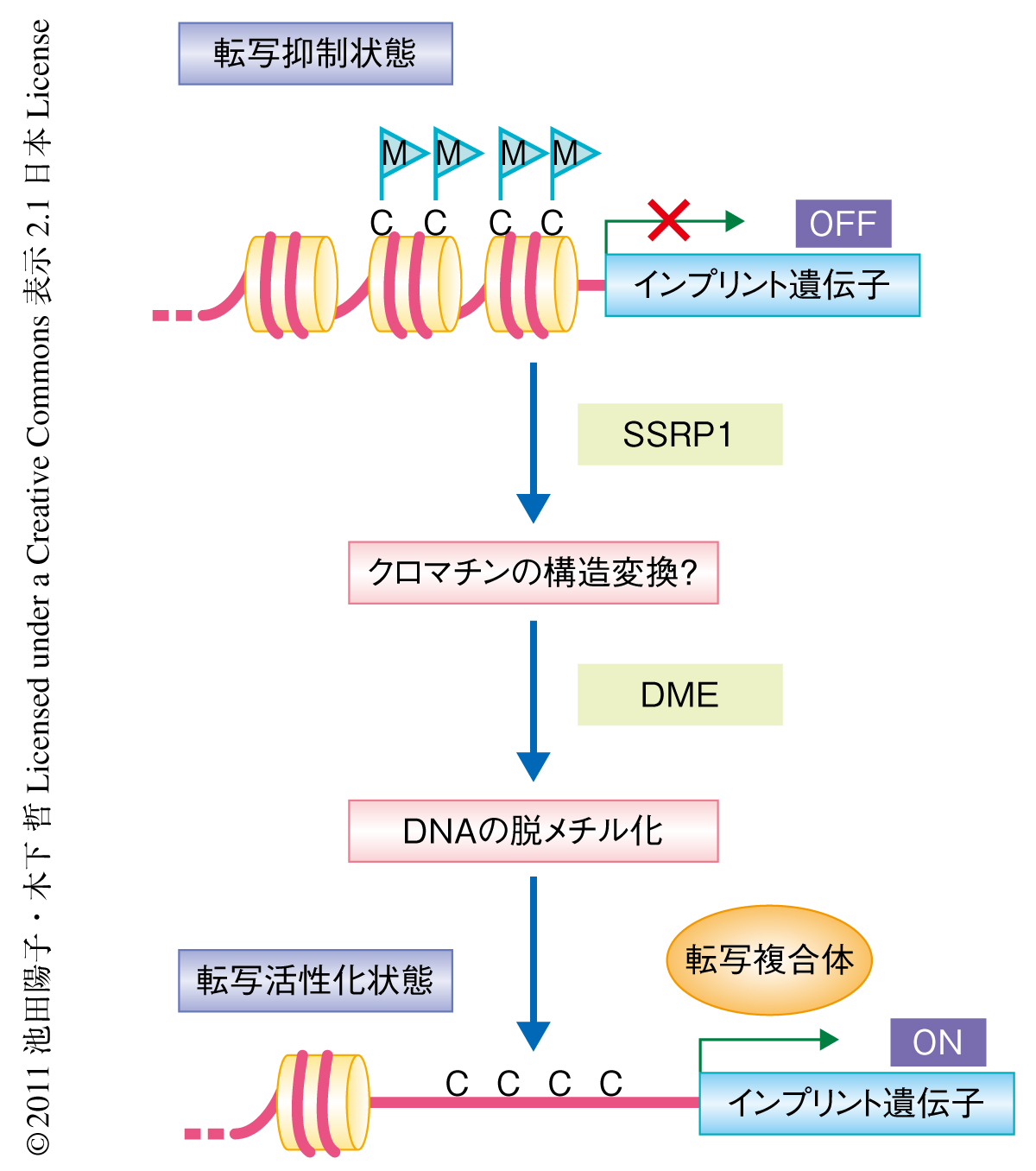
今回の筆者らの解析から,DNAの脱メチル化やゲノムインプリンティングの制御においてHMGドメインを含むタンパク質をコードするSSRP1遺伝子が必要であるいう新たな知見が得られた.また,遺伝学的な解析の結果を総合し,DNAの脱メチル化に際してはクロマチンの構造変換が必要であるというモデルを提唱した(図2).これは,これまでDNAの脱メチル化にかかわる酵素のみが明らかになっていた従来の知見を大幅に進展させるものである.クロマチンの状態とDNAのメチル化とは互いに相互作用して遺伝子の発現あるいは抑制の状態を保っていることが知られているが,筆者らの結果はDNAの脱メチル化における新しいモデルとなりうる.今後,SSRP1遺伝子がどのような機構でDNAの脱メチル化に関与しているのか,さらなる詳細な解析が待たれる.
奈良先端科学技術大学院大学バイオサイエンス研究科 特任助教.
研究テーマ:植物におけるエピジェネティックな情報の制御機構.
抱負:生命が遺伝情報を次世代に正確に伝えるしくみを明らかにしていきたい.
木下 哲(Tetsu Kinoshita)
奈良先端科学技術大学院大学バイオサイエンス研究科 特任准教授.
研究テーマ:ゲノムインプリンティングの制御機構とその生物学的な意義の解明.
抱負:つぎにブレイクしそうな研究シーズをみつけたい.
© 2011 池田陽子・木下 哲 Licensed under CC 表示 2.1 日本
(奈良先端科学技術大学院大学バイオサイエンス研究科 植物生殖遺伝学研究グループ)
email:池田陽子,木下 哲
DOI: 10.7875/first.author.2011.151
HMG domain containing SSRP1 is required for DNA demethylation and genomic imprinting in Arabidopsis.
Yoko Ikeda, Yuki Kinoshita, Daichi Susaki, Yuriko Ikeda, Megumi Iwano, Seiji Takayama, Tetsuya Higashiyama, Tetsuji Kakutani, Tetsu Kinoshita
Developmental Cell, 21, 589-596 (2011)
要 約
シロイヌナズナを用いた遺伝学的な解析により,DNAの脱メチル化の過程には雌性配偶体の中央細胞においてDEMETER(DME)とよばれるDNA脱メチル化酵素が必要であることが明らかにされている.しかしながら,DNA脱メチル化酵素のほかのタンパク質に関してはその多くが不明である.今回,筆者らは,シロイヌナズナの中央細胞において,FACTヒストンシャペロン複合体の構成タンパク質として知られるHMGドメインを含むタンパク質SSRP1をコードする遺伝子がDNAの脱メチル化やインプリント遺伝子の制御に必要であることを明らかにした.さらに,DNAメチル基転移酵素MET1,DNA脱メチル化酵素DME,ならびに,SSRP1のそれぞれの変異体を用いて遺伝学的な解析を行った.dme変異体では中央細胞におけるDNAの脱メチル化が起こらずインプリント遺伝子FWAは活性化されなかったが,この表現型はmet1変異により抑圧された.一方で,met1変異とssrp1変異との二重変異体の中央細胞ではssrp1変異による表現型はmet1変異によりほとんど抑圧されなかった.しかしながら,met1変異により誘導された低メチル化したFWA遺伝子が受精ののちの複製にしたがい徐々に活性化されるという興味深い現象が観察された.したがって,これまでに報告されているSSRP1の機能も合わせて,DMEとSSRP1はDNAの脱メチル化に対して,塩基除去修復とクロマチン機能の制御という本質的に異なる機構をつうじ,協調してDNAの脱メチル化の制御を行っているものと考えられた.
はじめに
DNAのメチル化は遺伝子の発現やゲノムの安定化に寄与している.これまで,DNAにメチル基がどのように付与され維持されるかについては比較的明らかになっているのに対し,メチル基がいかに消去されるかに関しては謎が多い1).DNA脱メチル化酵素の発見にはシロイヌナズナのゲノムインプリンティングの研究が大きく貢献した.片親に由来する遺伝子が選択的に発現するゲノムインプリンティングの確立にはDNAの脱メチル化が必要であることが知られている.インプリント遺伝子を活性化できないDEMETER(DME)とよばれるDNA脱メチル化酵素の変異体の解析から,このDMEは塩基除去修復の最初のステップを触媒する活性,すなわち,メチルシトシンを切り出しDNA鎖にニックを入れるという活性をもつことが示された.このことから,DNAの脱メチル化は,まず塩基が除去され(メチルシトシンの切り出し),そののちの修復合成でメチル基のないシトシンが取り込まれることにより完了するというモデルが提唱された2).
筆者らはこれまで,シロイヌナズナのインプリント遺伝子FWAの解析を行ってきた3).FWA遺伝子は胚乳組織(胚発生を助ける植物種子の組織で,発芽ののちに退化する)において,母親(雌性配偶体の中央細胞)から遺伝したときのみ発現する.一方で,父親(雄性配偶体の精細胞)から遺伝した対立遺伝子は不活性な状態に保たれる.FWA遺伝子のプロモーター領域にはSINEレトロトランスポゾンに由来する反復配列が挿入されており,この領域がDNAのメチル化をうけつねに発現抑制されている4).ところが,雌性配偶体の中央細胞ではこの領域がDMEによるDNAの脱メチル化をうけて活性化される.このことが引き金となり受精ののちの胚乳において母親に由来する遺伝子が選択的に発現する.したがって,FWA遺伝子はDNAの脱メチル化制御を遺伝学的に解析するためのモデル系として有効であると考えた.
1.ゲノムインプリンティングに異常をもつssrp1変異体の単離
DNAの脱メチル化の過程に必要なタンパク質を明らかにするため,FWA遺伝子に蛍光タンパク質GFPをコードする遺伝子をつないでゲノムインプリンティングを可視化する系を利用した(図1a).このコンストラクトをもつ植物を変異原により処理し,中央細胞および受精ののちの胚乳においてGFPの蛍光のみられない変異体を選抜した(図1b).得られた変異体のポジショナルクローニングの結果,HMG(high mobility group)ドメインを含むタンパク質SSRP1(structure specific recognition protein 1)をコードする遺伝子に変異がみつかった.SSRP1は酵母から哺乳類まで広く保存されたヒストンシャペロン複合体FACT(facilitates chromatin transcription/transaction)の構成タンパク質であり,ヒストンH2AおよびヒストンH2Bに結合し転写開始や転写伸長などの際に機能していることが報告されている.ssrp1変異体では受精に依存しない自律的な胚乳の核の分裂の開始と,それにともなう鞘の伸長がみられた(図1c).これらの特徴はほかのインプリント遺伝子の変異体においても高頻度でみられる表現型であり,SSRP1遺伝子はFWA遺伝子以外にも多くのインプリント遺伝子を制御している可能性があった.実際,定量RT-PCR法などによる解析から,ssrp1変異はインプリント遺伝子ではないDME遺伝子およびFIE遺伝子の発現には影響しない一方で,インプリント遺伝子であるFWA遺伝子,MEA遺伝子,FIS2遺伝子などの発現には影響することが明らかになった.
2.ssrp1変異はDNAの脱メチル化に影響する
ssrp1変異体におけるインプリント遺伝子FWAの発現異常がDNAの脱メチル化の異常によるものであるかどうかを調べるため,さきに述べたSINEレトロトランスポゾンに由来するFWA遺伝子のプロモーター領域のDNAメチル化のレベルをバイサルファイトシークエンス法により解析した.その結果,野生型の胚乳ではこの領域が母親から由来した場合には低メチル化状態であるのに対して,ssrp1変異体では母親に由来する場合も高メチル化状態であることが判明した.また,メチル化されたゲノム領域を認識し切断する制限酵素McrBCで消化したのちPCRを行う方法によりほかの領域のDNAメチル化のレベルを調べたところ,ssrp1変異体の胚乳ではインプリント遺伝子MEAの5’側の領域および3’側の領域のDNAメチル化のレベルが野生型より高いことが明らかになった.以上のことより,SSRP1遺伝子は多くの母親特異的なインプリント遺伝子の発現に影響し,DNAの脱メチル化にも影響することが明らかになった.
3.維持型DNAメチル化酵素の変異体による低メチル化したゲノムを利用した遺伝学的な解析
さらに,HMGドメインを含むタンパク質SSRP1とDNA脱メチル化酵素のひとつDMEとの関係を明らかにするため,dme変異体とssrp1変異体のそれぞれについて,維持型DNAメチル化酵素であるMET1の変異体との二重ヘテロ変異体を作製し,さきに述べたインプリント遺伝子FWAのマーカーであるFWA-GFP融合遺伝子の活性化に対する影響を遺伝学的に解析した.この解析では,あらかじめ維持型DNAメチル化酵素MET1の変異により低メチル化したゲノムを誘導しておけば,DMEとSSRP1のDNAの脱メチル化に関するそれぞれの役割がうかびあがるだろうと考えた.まず対照として,met1変異体,dme変異体,ssrp1変異体のそれぞれのヘテロ変異体でのFWA-GFP融合遺伝子の活性化を検討した.その結果,維持型DNAメチル化酵素の変異体であるmet1変異体ではすべての胚珠でGFPの蛍光が観察されたのに対して,dme変異体およびssrp1変異体のヘテロ接合体ではGFPが活性化された胚珠と活性化されない胚珠とが1対1に分離した(中央細胞は減数分裂をへた半数体世代であり,変異はヘテロ変異体では半数の中央細胞に受け継がれ,dme変異またはssrp1変異をもった中央細胞ではDNAの脱メチル化が起こらずFWA-GFP融合遺伝子が活性化されないためこのような分離比を示す).つぎに,dme変異とmet1変異との二重ヘテロ変異体について調べた.dme変異体におけるDNAを脱メチル化できないという表現型をmet1変異が抑圧するのならば,中央細胞においてFWA-GFP融合遺伝子が活性化する胚珠が50%から75%に上昇するものと期待された.実験の結果,受精の前後ともにFWA-GFP融合遺伝子の活性化された胚珠は予想どおりほぼ75%であった.この結果は,維持型DNAメチル化酵素MET1の欠損によりDNAメチル化のレベルが維持されなければ,脱メチル化酵素DMEの有無によらずインプリント遺伝子FWAは活性化されることを意味した.なお,met1変異がdme変異を抑圧する関係はインプリント遺伝子MEAの遺伝子座においても報告されている5).
一方で,ssrp1変異とmet1変異との二重ヘテロ変異体では興味深い結果が得られた.dme変異の場合のように,ssrp1変異でもmet1変異による抑圧により75%の胚珠でFWA-GFP融合遺伝子が活性化されるものと予想したが,実際には予想とは異なり,ssrp1変異とmet1変異との二重ヘテロ変異体では受精のまえにFWA-GFP融合遺伝子が完全に活性化された胚珠は50%にとどまり,通常はみられない弱いFWA-GFP融合遺伝子の発現を示す胚珠が2割ほどみられた.受粉ののち時間をおって観察すると,受精ののちに弱い発現を示した胚珠が強い発現へと変化していくようにみえ,3日目には活性化したFWA-GFP融合遺伝子を含む胚珠は75%に達した.このような弱い発現が強い発現へと変化する傾向は受精に依存しない胚乳の核の分裂でもみられた.
これらの現象で鍵となるのは,メチル化したDNA領域の複製の過程にあると考えられた.中央細胞の核は受精してから3日目までにほぼ同調して6~7回の分裂を行う.また,受精に依存しないssrp1変異体の自律的な胚乳の核の分裂も3回程度まで観察される.複製の過程ではDNAのメチル化とクロマチンの状態は相互に依存していることが知られており,DNAのメチル化が維持されないとクロマチンの状態も不活性な状態から活性な状態へと変化する6).したがって,受精のまえのssrp1変異とmet1変異との二重ヘテロ変異体では,ゲノムが低メチル化状態であってもFACTヒストンシャペロン複合体の構成タンパク質であるSSRP1が中央細胞で機能しないとインプリント遺伝子FWAの発現は十分に活性化されないものと考えられた.一方,受精ののちに弱い発現から強い発現へ徐々にシフトする現象については,DNAメチル化のレベルが低下したまま受精ののちに複製が開始し,クロマチンの状態が不活性な状態から活性な状態へと徐々に変化したためと考えられた.この研究の結果と,これまでに報告されているSSRP1の機能を考え合わせると,DMEとSSRP1はDNAの脱メチル化に対して,塩基除去修復とクロマチン機能の制御という本質的に異なる機構をつうじ,協調してDNAの脱メチル化の制御を行っているものと考えられた.
今後は,中央細胞や胚乳の核を回収してクロマチンを解析することで,遺伝学的な解析から得られるモデルを検証したいと考えている.
おわりに
今回の筆者らの解析から,DNAの脱メチル化やゲノムインプリンティングの制御においてHMGドメインを含むタンパク質をコードするSSRP1遺伝子が必要であるいう新たな知見が得られた.また,遺伝学的な解析の結果を総合し,DNAの脱メチル化に際してはクロマチンの構造変換が必要であるというモデルを提唱した(図2).これは,これまでDNAの脱メチル化にかかわる酵素のみが明らかになっていた従来の知見を大幅に進展させるものである.クロマチンの状態とDNAのメチル化とは互いに相互作用して遺伝子の発現あるいは抑制の状態を保っていることが知られているが,筆者らの結果はDNAの脱メチル化における新しいモデルとなりうる.今後,SSRP1遺伝子がどのような機構でDNAの脱メチル化に関与しているのか,さらなる詳細な解析が待たれる.
文 献
- Ikeda, Y. & Kinoshita, T.: DNA demethylation: a lesson from the garden. Chromosoma, 118, 37-41 (2009)[PubMed]
- Gehring, M., Huh, J. H., Hsieh, T. F. et al.: DEMETER DNA glycosylase establishes MEDEA polycomb gene self-imprinting by allele-specific demethylation. Cell, 124, 495-506 (2006)[PubMed]
- Kinoshita, T., Miura, A., Choi, Y. et al.: One-way control of FWA imprinting in Arabidopsis endosperm by DNA methylation. Science, 303, 521-523 (2004)[PubMed]
- Kinoshita, Y., Saze, H., Kinoshita, T. et al.: Control of FWA gene silencing in Arabidopsis thaliana by SINE-related direct repeats. Plant J., 49, 38-45 (2007)[PubMed]
- Xiao, W., Gehring, M., Choi, Y. et al.: Imprinting of the MEA Polycomb gene is controlled by antagonism between MET1 methyltransferase and DME glycosylase. Dev. Cell., 5, 891-901 (2003)[PubMed]
- Groth, A., Rocha, W., Verreault, A. et al.: Chromatin challenges during DNA replication and repair. Cell, 128, 721-733 (2007)[PubMed]
著者プロフィール
奈良先端科学技術大学院大学バイオサイエンス研究科 特任助教.
研究テーマ:植物におけるエピジェネティックな情報の制御機構.
抱負:生命が遺伝情報を次世代に正確に伝えるしくみを明らかにしていきたい.
木下 哲(Tetsu Kinoshita)
奈良先端科学技術大学院大学バイオサイエンス研究科 特任准教授.
研究テーマ:ゲノムインプリンティングの制御機構とその生物学的な意義の解明.
抱負:つぎにブレイクしそうな研究シーズをみつけたい.
© 2011 池田陽子・木下 哲 Licensed under CC 表示 2.1 日本