細胞骨格によるCD36の重合化とシグナル伝達の制御
桑田啓貴・Sergio Grinstein
(カナダHospital for Sick Children,Program in Cell Biology)
email:桑田啓貴
DOI: 10.7875/first.author.2011.150
Cytoskeletal control of CD36 diffusion promotes its receptor and signaling function.
Khuloud Jaqaman, Hirotaka Kuwata, Nicolas Touret, Richard Collins, William S. Trimble, Gaudenz Danuser, Sergio Grinstein
Cell, 146, 593-606 (2011)
細胞膜に存在する受容体は外部からの刺激をうけるとしばしば多量体を形成する.この受容体の重合化はシグナル伝達において必要なステップであるが,その分子機構はあまり理解されていない.筆者らは,1分子イメージング法により変性したリポタンパク質の受容体であるCD36の細胞膜におけるダイナミズムを調べた.その結果,細胞膜におけるCD36の重合化はアクチンなどの細胞骨格により厳密に制御されていることを見い出した.また,そのときのCD36のとる軌跡は直線型の拡散運動を示し,CD36どうしの衝突確率を上げることにより重合化を促進していた.細胞骨格に作用する各種の阻害剤の処理によりこの直線型の軌跡の形成は消滅し重合化も阻害され,さらに,リガンドのエンドサイトーシスおよび下流のシグナル伝達も阻害された.以上より,細胞骨格が細胞膜において受容体のクラスタリングを制御することによりその機能を制御していることが明らかになった.
細胞膜における受容体の重合化はシグナル伝達において重要なプロセスである.かつて,多価のリガンドの場合には受容体の重合化はリガンドとの結合によりひき起こされると考えられていたが,一方で,リガンドとの結合よりまえに重合化されているという観察も増えつつある1).これまで,受容体の重合化にかかわる因子として脂質ラフトなどの細胞膜に存在するマイクロドメイン,あるいは,細胞骨格などの関与が知られていたが2-6),受容体の重合化の分子機構とシグナル伝達における相互作用についてはまだあまりわかっていない.
CD36はB型スカベンジャー受容体に属し,血小板や血管内皮細胞,マクロファージなどの細胞膜に発現している.とくに,マクロファージにおいては酸化LDL(low density lipoprotein,低密度リポタンパク質)やアポトーシスを起こした細胞,マラリアに感染した赤血球などに結合することが知られており,脂質代謝,自然免疫,あるいは,組織の再構成など,幅広い生命現象において重要である.生化学的な解析から,CD36が多価のリガンドに結合することでシグナル伝達が誘導され,リガンドとCD36との複合体が細胞に取り込まれることがわかっている7).しかし,リガンドに結合していないCD36が単量体として存在するのか,あるいは,重合化して多量体として存在しているのかについては不明であった.受容体の重合化は細胞膜においてリガンドに対する反応性を高めているものと考えられる8).では,どのような分子機構によりCD36の重合化はなされているのであろうか? この疑問に答えるため,生細胞における定量的な1分子イメージング法と生化学的な解析を組み合わせ,ヒトのマクロファージにおけるCD36のダイナミクスと重合化,あるいは,シグナル伝達について調べた.
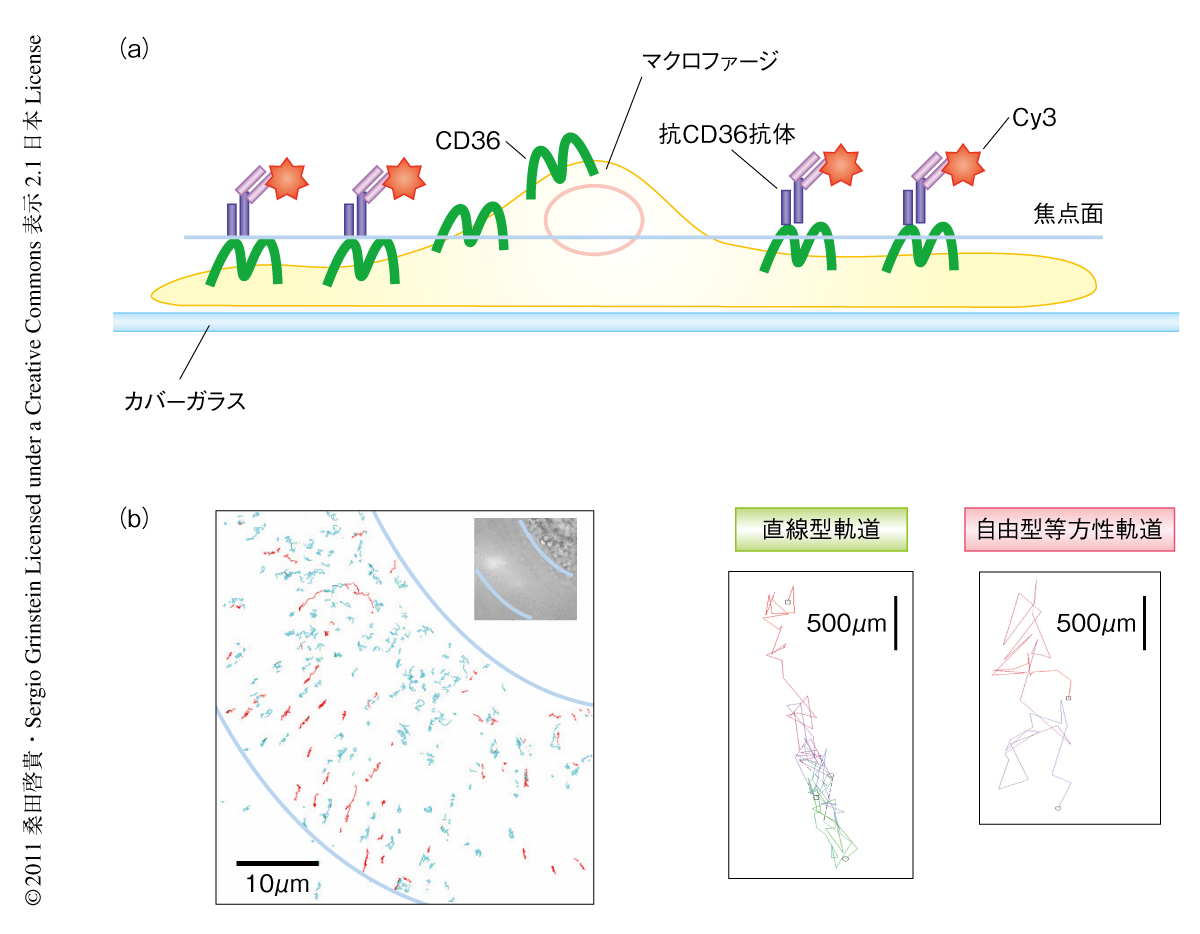
ヒトの末梢血から採取したモノサイトをM-CSFをくわえて培養することによりマクロファージを誘導できる.このマクロファージは1週間ほど培養すると細胞の辺縁部が広く進展する.この辺縁部のガラス接着面とは反対側のなだらかな細胞平面においてCD36を可視化することにより,倒立蛍光顕微鏡を用いて1分子解析に適した画像を得た.細胞膜のCD36はモノクローナル抗CD36抗体(Fab断片)と1分子のCy3で標識した抗マウス抗体(Fab断片)により標識した.CD36の精密な平面位置と蛍光強度の強さはガウス関数フィッティング法によりサブピクセルレベルの精度で測定した9)(図1a).この系を用いて生細胞におけるCD36のダイナミクスを測定しCD36どうしの解離や衝突をとらえた.CD36の軌跡は2つの基準を用いて分類した.すなわち,方向性の有無と,分子移動度のMSS(moment scaling spectrum)解析である10).MSS解析では純粋分散(pure diffusive)は0.5を示し,0.5以下は低拡散(sub-diffusive),0.5以上1以下は超拡散(super diffusive),1以上は被加速拡散(accelerated directed motion)と分類される.これら2つの基準の組み合わせによりCD36の軌跡を分類した結果,以下の3つの型に分けることができた.方向性をもつ軌跡は直線型軌道と分類され,全体の約27%であった.ブラウン運動を示した軌跡は自由型等方性軌道と閉じ込め型等方性軌道に分類され,それぞれ全体の18%と55%であった(図1b).
CD36は重合したあとも解離と衝突とをくり返す“メタステーブル”な状態を示した.重合の前後での速度の変化を調べたところ,約65%で重合による速度の低下が観察された.重合化の起こる頻度は軌道型ごとに異なった.直線型軌道ではほかより衝突解離の頻度が高く,閉じ込め型等方性軌道ではこれがもっとも低かった.これらのことから,直線型軌道はCD36の重合化を促進していることがわかった.
CD36のとる直線型軌道についてより詳細な解析を行った.まず,軌道の軸を決定し,中心軸,および,さらに2つのパラメーター,フレームのあいだの軸に対し平行な軸の移動距離と,同一方向への連続ステップ数(ランタイム)を決定した.その結果,CD36が細胞の外へむかう場合と細胞の内部へむかう場合とで違いはみられなかった.また,ランタイムの分布は一次元のブラウン運動と同一(2のN乗に反比例する)であった.これらの結果から,CD36のとる直線型軌道はキネシンなどのモータータンパク質による動きではなく,一次元のブラウン運動によるものだと考えられた.
さらに詳細な解析を行うために,より長時間かつ高いサンプリングレート(33 Hz,62.5 Hz,125 Hz)で画像を取得した.蛍光色素としてはCy3の代わりに明るさと退色への耐性のよりすぐれた量子ドットを用いた.その結果,1)フレームのあいだの移動距離は時間の平方根に比例する,2)ランタイムの分布はフレームレートにより変化しない,3)高いサンプリングレートで画像を取得した場合には軸に対し平行な動きと垂直な動きとで移動速度は同じ,4)軌道のなかで移動の可能な範囲は軌跡の全域にわたっており端の部分により高い確率で存在する,ことが明らかになった.これらの結果より,マクロファージの細胞膜におけるCD36のとる直線型軌道は,直線状の隔離された領域における拡散運動であることが確認された.
直線型軌道,自由型等方性軌道,閉じ込め型等方性軌道の類似性について検討した.興味深いことに,直線型軌道の幅と閉じ込め型等方向軌道の幅とを比較したところ,いずれもその平均はほぼ190 nmであった.直線型軌道を軸方向に対し平行方向の成分と垂直方向の成分とに分解し,平行方向の拡散係数を計測したところ0.1μm2/s以下であった.これは,これまでに計測された細胞膜における拡散係数と同じであった.また,重要なことに,垂直方向の拡散係数は閉じ込め型等方性軌道における拡散係数と同じであった.すなわち,直線型軌道と閉じ込め型等方性軌道との違いは,線状型の領域に閉じ込められているか,もしくは,狭い領域に閉じ込められているかによりつくりだされており,どちらも本質的には閉じ込め型の拡散運動であった.自由型等方性軌道における拡散係数もまた0.1μm2/s以下であったことから,これも真の拡散運動ではなく,10 Hz程度のサンプリングレートでは観測することのできない無数の短い閉じ込め型自由軌道の集合体であるものと考えられた.
細胞膜に存在するマイクロドメインである脂質ラフトがCD36の重合化に重要であるかどうかを調べた.脂質ラフトのマーカーであるCTBを用いてそのダイナミクスを解析した結果,ほとんどの脂質ラフトのとる軌跡は閉じ込め型等方性軌道に分類された.コレステロールを除去するはたらきをもつシクロデキストリンで処理した場合,脂質ラフトの動きは破壊されたにもかかわらずCD36の軌跡に変化はなかった.このことから,CD36のとる直線型軌道は脂質ラフトなどのマイクロドメインには依存していないことがわかった.
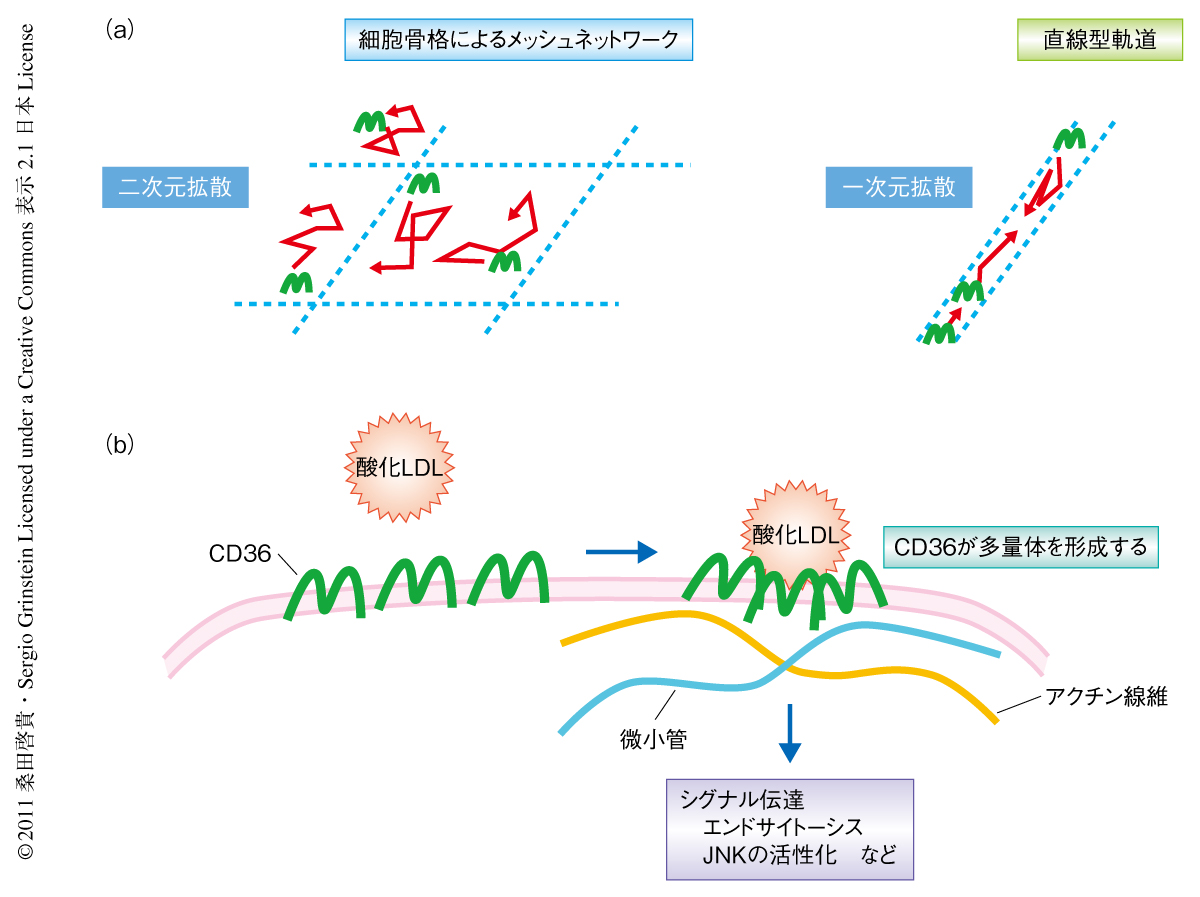
これまでにも,数多くの膜タンパク質のダイナミクスにアクチン線維や微小管などの細胞骨格のかかわっていることが報告されている1,6).それゆえ,CD36の動きと細胞骨格とのかかわりについて調べた.まず,アクチン重合化の阻害剤であるラトランキュリンBで処理した場合,CD36が直線型軌道をとる割合は顕著に減少した.また,ミオシンの阻害剤であるブレビスタチンによる処理でも直線型軌道の割合は顕著に減少した.これらのように,CD36の動きはアクトミオシン系細胞骨格およびその輸送に強く関連していた.同様に,微小管の重合阻害剤であるノコダゾールによる処理の結果,直線型軌道の割合が顕著に減少した.このことから,微小管もCD36のとる直線型軌道に重要であることが示唆された.これらの阻害剤のCD36の重合化にあたえる影響について調べたところ,すべてが重合化を阻害した.以上より,アクチン線維および微小管などの細胞骨格は細胞膜におけるCD36のダイナミズムを規定し,かつ,重合化の効率に影響をあたえているものと考えられた.
生化学的なデータからCD36の重合化はそのシグナル伝達に必須であることが知られている.リガンドのない状態でのCD36の可逆的な重合状態は,リガンド刺激に対する即応性のしくみを提供しているものと考えられる7).CD36の生理的なリガンドである酸化LDLを用いてマクロファージの反応性を検討した.酸化LDLは1分子にCD36への結合領域を多数もつ多価のリガンドである.マクロファージに酸化LDLをくわえ,そのエンドサイトーシスと下流のタンパク質のひとつであるJNKの活性化を調べた.酸化LDLはマクロファージの細胞膜にすばやく結合し,5分以内に酸化LDLとCD36との複合体の形成が観察された.蛍光標識した酸化LDLを用いてマクロファージの細胞膜における酸化LDL-CD36複合体の軌跡を調べたところ,全体の約25%はCD36と同様の直線型軌道をとった.さらに20分後には全体の60%程度の酸化LDLはマクロファージの内部に取り込まれておりもはや直線型軌道は認められなかった.また,細胞骨格に作用する阻害剤で前処理した場合,酸化LDLのエンドサイトーシスは強く阻害された一方で,これらの阻害剤はトランスフェリンのエンドサイトーシスは阻害しなかった.
酸化LDLの結合と取り込みはJNKの活性化と関連している.抗体を用いてJNKによるリン酸化の基質であるc-Junのリン酸化を調べたところ,細胞骨格に作用するさきの阻害剤の処理によりリン酸化は強く阻害されていた.とくに,ブレビスタチンとノコダゾールはc-Junのリン酸化を強く阻害した(ラトランキュリンBでは未刺激の状態でc-Junのリン酸化をひき起こしてしまった).c-Junのリン酸化は活性酸素の産生をひき起こすが,これらの阻害剤により活性酸素の産生も阻害されていることが観測された.
以上の結果より,細胞骨格を介したCD36の重合化は効率のよいリガンドのエンドサイトーシスと下流へのシグナル伝達をもたらしているものと考えられた(図2).
受容体の重合化が安定化し多量体となってそのサイズが大きくなることにより,受容体を介した活性はより強くなる.とくに,マクロファージなどの自然免疫にかかわる細胞は体内の微量なリガンドを認識し異常を即座に感知する必要がある.受容体が一次元のブラウン運動を起こすことで受容体をより効率よく機能させるしくみの存在することが明らかになった.CD36はマクロファージのほかにも血管内皮細胞や血小板などに発現しており,循環器系の疾患,とくにアテローム性動脈硬化症などに関連して内因性のリガンドなど,さまざまな分子の認識にかかわっている.たとえば,自然免疫のキーファクターであるToll様受容体の補助タンパク質として機能している.そのほかにも,テトラスパニンやインテグリンなどの共役タンパク質としても知られているが,これらの膜タンパク質とCD36とがどのように相互作用しているのかについてはいまだ謎につつまれている.CD36のマクロファージの細胞膜におけるダイナミクスの解明がこれら疑問の解明の端緒になるのではないかと考えている.また今後,さらにこの研究を進めていくことで,未知のシグナル伝達機構やリガンド認識機構の発見あるいは解明につながるのではないかと考えている.
略歴:2001年 大阪大学大学院歯学研究科 修了,同年 大阪大学微生物病研究所 研究員,2002年 理化学研究所免疫・アレルギー科学総合研究センター 研究員,2004年 九州大学生体防御医学研究所 助手,2007年 カナダHospital for Sick Children研究員を経て,2010年より京都大学ウイルス研究所 特定助教.
研究テーマ:マクロファージなどの貪食系細胞における細胞機能の解明.
Sergio Grinstein
カナダHospital for Sick ChildrenにてSenior Scientist.
© 2011 桑田啓貴・Sergio Grinstein Licensed under CC 表示 2.1 日本
(カナダHospital for Sick Children,Program in Cell Biology)
email:桑田啓貴
DOI: 10.7875/first.author.2011.150
Cytoskeletal control of CD36 diffusion promotes its receptor and signaling function.
Khuloud Jaqaman, Hirotaka Kuwata, Nicolas Touret, Richard Collins, William S. Trimble, Gaudenz Danuser, Sergio Grinstein
Cell, 146, 593-606 (2011)
要 約
細胞膜に存在する受容体は外部からの刺激をうけるとしばしば多量体を形成する.この受容体の重合化はシグナル伝達において必要なステップであるが,その分子機構はあまり理解されていない.筆者らは,1分子イメージング法により変性したリポタンパク質の受容体であるCD36の細胞膜におけるダイナミズムを調べた.その結果,細胞膜におけるCD36の重合化はアクチンなどの細胞骨格により厳密に制御されていることを見い出した.また,そのときのCD36のとる軌跡は直線型の拡散運動を示し,CD36どうしの衝突確率を上げることにより重合化を促進していた.細胞骨格に作用する各種の阻害剤の処理によりこの直線型の軌跡の形成は消滅し重合化も阻害され,さらに,リガンドのエンドサイトーシスおよび下流のシグナル伝達も阻害された.以上より,細胞骨格が細胞膜において受容体のクラスタリングを制御することによりその機能を制御していることが明らかになった.
はじめに
細胞膜における受容体の重合化はシグナル伝達において重要なプロセスである.かつて,多価のリガンドの場合には受容体の重合化はリガンドとの結合によりひき起こされると考えられていたが,一方で,リガンドとの結合よりまえに重合化されているという観察も増えつつある1).これまで,受容体の重合化にかかわる因子として脂質ラフトなどの細胞膜に存在するマイクロドメイン,あるいは,細胞骨格などの関与が知られていたが2-6),受容体の重合化の分子機構とシグナル伝達における相互作用についてはまだあまりわかっていない.
CD36はB型スカベンジャー受容体に属し,血小板や血管内皮細胞,マクロファージなどの細胞膜に発現している.とくに,マクロファージにおいては酸化LDL(low density lipoprotein,低密度リポタンパク質)やアポトーシスを起こした細胞,マラリアに感染した赤血球などに結合することが知られており,脂質代謝,自然免疫,あるいは,組織の再構成など,幅広い生命現象において重要である.生化学的な解析から,CD36が多価のリガンドに結合することでシグナル伝達が誘導され,リガンドとCD36との複合体が細胞に取り込まれることがわかっている7).しかし,リガンドに結合していないCD36が単量体として存在するのか,あるいは,重合化して多量体として存在しているのかについては不明であった.受容体の重合化は細胞膜においてリガンドに対する反応性を高めているものと考えられる8).では,どのような分子機構によりCD36の重合化はなされているのであろうか? この疑問に答えるため,生細胞における定量的な1分子イメージング法と生化学的な解析を組み合わせ,ヒトのマクロファージにおけるCD36のダイナミクスと重合化,あるいは,シグナル伝達について調べた.
1.マクロファージの細胞膜におけるCD36の1分子イメージング
ヒトの末梢血から採取したモノサイトをM-CSFをくわえて培養することによりマクロファージを誘導できる.このマクロファージは1週間ほど培養すると細胞の辺縁部が広く進展する.この辺縁部のガラス接着面とは反対側のなだらかな細胞平面においてCD36を可視化することにより,倒立蛍光顕微鏡を用いて1分子解析に適した画像を得た.細胞膜のCD36はモノクローナル抗CD36抗体(Fab断片)と1分子のCy3で標識した抗マウス抗体(Fab断片)により標識した.CD36の精密な平面位置と蛍光強度の強さはガウス関数フィッティング法によりサブピクセルレベルの精度で測定した9)(図1a).この系を用いて生細胞におけるCD36のダイナミクスを測定しCD36どうしの解離や衝突をとらえた.CD36の軌跡は2つの基準を用いて分類した.すなわち,方向性の有無と,分子移動度のMSS(moment scaling spectrum)解析である10).MSS解析では純粋分散(pure diffusive)は0.5を示し,0.5以下は低拡散(sub-diffusive),0.5以上1以下は超拡散(super diffusive),1以上は被加速拡散(accelerated directed motion)と分類される.これら2つの基準の組み合わせによりCD36の軌跡を分類した結果,以下の3つの型に分けることができた.方向性をもつ軌跡は直線型軌道と分類され,全体の約27%であった.ブラウン運動を示した軌跡は自由型等方性軌道と閉じ込め型等方性軌道に分類され,それぞれ全体の18%と55%であった(図1b).
2.CD36のとる直線型軌道は重合化を促進する
CD36は重合したあとも解離と衝突とをくり返す“メタステーブル”な状態を示した.重合の前後での速度の変化を調べたところ,約65%で重合による速度の低下が観察された.重合化の起こる頻度は軌道型ごとに異なった.直線型軌道ではほかより衝突解離の頻度が高く,閉じ込め型等方性軌道ではこれがもっとも低かった.これらのことから,直線型軌道はCD36の重合化を促進していることがわかった.
3.CD36のとる直線型軌道は一次元のブラウン運動である
CD36のとる直線型軌道についてより詳細な解析を行った.まず,軌道の軸を決定し,中心軸,および,さらに2つのパラメーター,フレームのあいだの軸に対し平行な軸の移動距離と,同一方向への連続ステップ数(ランタイム)を決定した.その結果,CD36が細胞の外へむかう場合と細胞の内部へむかう場合とで違いはみられなかった.また,ランタイムの分布は一次元のブラウン運動と同一(2のN乗に反比例する)であった.これらの結果から,CD36のとる直線型軌道はキネシンなどのモータータンパク質による動きではなく,一次元のブラウン運動によるものだと考えられた.
さらに詳細な解析を行うために,より長時間かつ高いサンプリングレート(33 Hz,62.5 Hz,125 Hz)で画像を取得した.蛍光色素としてはCy3の代わりに明るさと退色への耐性のよりすぐれた量子ドットを用いた.その結果,1)フレームのあいだの移動距離は時間の平方根に比例する,2)ランタイムの分布はフレームレートにより変化しない,3)高いサンプリングレートで画像を取得した場合には軸に対し平行な動きと垂直な動きとで移動速度は同じ,4)軌道のなかで移動の可能な範囲は軌跡の全域にわたっており端の部分により高い確率で存在する,ことが明らかになった.これらの結果より,マクロファージの細胞膜におけるCD36のとる直線型軌道は,直線状の隔離された領域における拡散運動であることが確認された.
4.3種類の軌道の共通性
直線型軌道,自由型等方性軌道,閉じ込め型等方性軌道の類似性について検討した.興味深いことに,直線型軌道の幅と閉じ込め型等方向軌道の幅とを比較したところ,いずれもその平均はほぼ190 nmであった.直線型軌道を軸方向に対し平行方向の成分と垂直方向の成分とに分解し,平行方向の拡散係数を計測したところ0.1μm2/s以下であった.これは,これまでに計測された細胞膜における拡散係数と同じであった.また,重要なことに,垂直方向の拡散係数は閉じ込め型等方性軌道における拡散係数と同じであった.すなわち,直線型軌道と閉じ込め型等方性軌道との違いは,線状型の領域に閉じ込められているか,もしくは,狭い領域に閉じ込められているかによりつくりだされており,どちらも本質的には閉じ込め型の拡散運動であった.自由型等方性軌道における拡散係数もまた0.1μm2/s以下であったことから,これも真の拡散運動ではなく,10 Hz程度のサンプリングレートでは観測することのできない無数の短い閉じ込め型自由軌道の集合体であるものと考えられた.
5.CD36のとる直線型軌道は脂質ラフトに依存しない
細胞膜に存在するマイクロドメインである脂質ラフトがCD36の重合化に重要であるかどうかを調べた.脂質ラフトのマーカーであるCTBを用いてそのダイナミクスを解析した結果,ほとんどの脂質ラフトのとる軌跡は閉じ込め型等方性軌道に分類された.コレステロールを除去するはたらきをもつシクロデキストリンで処理した場合,脂質ラフトの動きは破壊されたにもかかわらずCD36の軌跡に変化はなかった.このことから,CD36のとる直線型軌道は脂質ラフトなどのマイクロドメインには依存していないことがわかった.
6.CD36のとる直線型軌跡およびその重合化の効率は細胞骨格に依存している
これまでにも,数多くの膜タンパク質のダイナミクスにアクチン線維や微小管などの細胞骨格のかかわっていることが報告されている1,6).それゆえ,CD36の動きと細胞骨格とのかかわりについて調べた.まず,アクチン重合化の阻害剤であるラトランキュリンBで処理した場合,CD36が直線型軌道をとる割合は顕著に減少した.また,ミオシンの阻害剤であるブレビスタチンによる処理でも直線型軌道の割合は顕著に減少した.これらのように,CD36の動きはアクトミオシン系細胞骨格およびその輸送に強く関連していた.同様に,微小管の重合阻害剤であるノコダゾールによる処理の結果,直線型軌道の割合が顕著に減少した.このことから,微小管もCD36のとる直線型軌道に重要であることが示唆された.これらの阻害剤のCD36の重合化にあたえる影響について調べたところ,すべてが重合化を阻害した.以上より,アクチン線維および微小管などの細胞骨格は細胞膜におけるCD36のダイナミズムを規定し,かつ,重合化の効率に影響をあたえているものと考えられた.
7.多価のリガンドによるCD36の重合化と下流へのシグナル伝達
生化学的なデータからCD36の重合化はそのシグナル伝達に必須であることが知られている.リガンドのない状態でのCD36の可逆的な重合状態は,リガンド刺激に対する即応性のしくみを提供しているものと考えられる7).CD36の生理的なリガンドである酸化LDLを用いてマクロファージの反応性を検討した.酸化LDLは1分子にCD36への結合領域を多数もつ多価のリガンドである.マクロファージに酸化LDLをくわえ,そのエンドサイトーシスと下流のタンパク質のひとつであるJNKの活性化を調べた.酸化LDLはマクロファージの細胞膜にすばやく結合し,5分以内に酸化LDLとCD36との複合体の形成が観察された.蛍光標識した酸化LDLを用いてマクロファージの細胞膜における酸化LDL-CD36複合体の軌跡を調べたところ,全体の約25%はCD36と同様の直線型軌道をとった.さらに20分後には全体の60%程度の酸化LDLはマクロファージの内部に取り込まれておりもはや直線型軌道は認められなかった.また,細胞骨格に作用する阻害剤で前処理した場合,酸化LDLのエンドサイトーシスは強く阻害された一方で,これらの阻害剤はトランスフェリンのエンドサイトーシスは阻害しなかった.
酸化LDLの結合と取り込みはJNKの活性化と関連している.抗体を用いてJNKによるリン酸化の基質であるc-Junのリン酸化を調べたところ,細胞骨格に作用するさきの阻害剤の処理によりリン酸化は強く阻害されていた.とくに,ブレビスタチンとノコダゾールはc-Junのリン酸化を強く阻害した(ラトランキュリンBでは未刺激の状態でc-Junのリン酸化をひき起こしてしまった).c-Junのリン酸化は活性酸素の産生をひき起こすが,これらの阻害剤により活性酸素の産生も阻害されていることが観測された.
以上の結果より,細胞骨格を介したCD36の重合化は効率のよいリガンドのエンドサイトーシスと下流へのシグナル伝達をもたらしているものと考えられた(図2).
おわりに
受容体の重合化が安定化し多量体となってそのサイズが大きくなることにより,受容体を介した活性はより強くなる.とくに,マクロファージなどの自然免疫にかかわる細胞は体内の微量なリガンドを認識し異常を即座に感知する必要がある.受容体が一次元のブラウン運動を起こすことで受容体をより効率よく機能させるしくみの存在することが明らかになった.CD36はマクロファージのほかにも血管内皮細胞や血小板などに発現しており,循環器系の疾患,とくにアテローム性動脈硬化症などに関連して内因性のリガンドなど,さまざまな分子の認識にかかわっている.たとえば,自然免疫のキーファクターであるToll様受容体の補助タンパク質として機能している.そのほかにも,テトラスパニンやインテグリンなどの共役タンパク質としても知られているが,これらの膜タンパク質とCD36とがどのように相互作用しているのかについてはいまだ謎につつまれている.CD36のマクロファージの細胞膜におけるダイナミクスの解明がこれら疑問の解明の端緒になるのではないかと考えている.また今後,さらにこの研究を進めていくことで,未知のシグナル伝達機構やリガンド認識機構の発見あるいは解明につながるのではないかと考えている.
文 献
- Chung, I., Akita, R., Vandlen, R. et al.: Spatial control of EGF receptor activation by reversible dimerization on living cells. Nature, 464, 783-787 (2010)[PubMed]
- Douglass, A. D. & Vale, R. D.: Single-molecule microscopy reveals plasma membrane microdomains created by protein-protein networks that exclude or trap signaling molecules in T cells. Cell, 121, 937-950 (2005)[PubMed]
- Gambin, Y., Lopez-Esparza, R., Reffay, M. et al.: Lateral mobility of proteins in liquid membranes revisited. Proc. Natl. Acad. Sci. USA, 103, 2098-2102 (2006)[PubMed]
- Kusumi, A., Ike, H., Nakada, C. et al.: Single-molecule tracking of membrane molecules: plasma membrane compartmentalization and dynamic assembly of raft-philic signaling molecules. Semin. Immunol., 17 , 3-21 (2005)[PubMed]
- Kusumi, A., Nakada, C., Ritchie, K. et al.: Paradigm shift of the plasma membrane concept from the two-dimensional continuum fluid to the partitioned fluid: high-speed single-molecule tracking of membrane molecules. Annu. Rev. Biophys. Biomol. Struct., 34, 351-378 (2005)[PubMed]
- Suzuki, K. G., Fujiwara, T. K., Sanematsu, F. et al.: GPI-anchored receptor clusters transiently recruit Lyn and Gα for temporary cluster immobilization and Lyn activation: single-molecule tracking study 1. J. Cell Biol., 177, 717-730 (2007)[PubMed]
- Collins, R. F., Touret. N., Kuwata, H. et al.: Uptake of oxidized low density lipoprotein by CD36 occurs by an actin-dependent pathway distinct from macropinocytosis. J. Biol. Chem., 284, 30288-30297 (2009)[PubMed]
- Kasai, R. S., Suzuki, K. G., Prossnitz, E. R. et al.: Full characterization of GPCR monomer-dimer dynamic equilibrium by single molecule imaging. J. Cell Biol., 192, 463-480 (2011)[PubMed]
- Jaqaman, K., Loerke, D., Mettlen, M. et al.: Robust single-particle tracking in live-cell time-lapse sequences. Nat. Methods, 5, 695-702 (2008)[PubMed]
- Ewers, H., Smith, A. E., Sbalzarini, I F. et al.: Single-particle tracking of murine polyoma virus-like particles on live cells and artificial membranes. Proc. Natl. Acad. Sci. USA, 102, 15110-15115 (2005)[PubMed]
著者プロフィール
略歴:2001年 大阪大学大学院歯学研究科 修了,同年 大阪大学微生物病研究所 研究員,2002年 理化学研究所免疫・アレルギー科学総合研究センター 研究員,2004年 九州大学生体防御医学研究所 助手,2007年 カナダHospital for Sick Children研究員を経て,2010年より京都大学ウイルス研究所 特定助教.
研究テーマ:マクロファージなどの貪食系細胞における細胞機能の解明.
Sergio Grinstein
カナダHospital for Sick ChildrenにてSenior Scientist.
© 2011 桑田啓貴・Sergio Grinstein Licensed under CC 表示 2.1 日本