TRPA1チャネルが担う生体における新しいO2センサー機構
高橋重成・森 泰生
(京都大学大学院工学研究科 合成・生物化学専攻分子生物化学分野)
email:森 泰生
DOI: 10.7875/first.author.2011.148
TRPA1 underlies a sensing mechanism for O2.
Nobuaki Takahashi, Tomoyuki Kuwaki, Shigeki Kiyonaka, Tomohiro Numata, Daisuke Kozai, Yusuke Mizuno, Shinichiro Yamamoto, Shinji Naito, Ellen Knevels, Peter Carmeliet, Toru Oga, Shuji Kaneko, Seiji Suga, Toshiki Nokami, Jun-ichi Yoshida, Yasuo Mori
Nature Chemical Biology, 7, 701-711 (2011)
分子状酸素O2はわれわれ好気性生物の生存に必須の物質である.体内に取り込まれたO2は電子受容体としておもにミトコンドリアにおいて呼吸鎖で水に変換され,生体エネルギーの通貨と称されるATPの産生を制御する.しかし,O2は過酸化水素や超酸化物イオンなど活性酸素種の産生基質としてもはたらくことで“酸素毒性”を示し,高濃度O2の吸引はヒトでは呼吸器疾患や未熟児網膜症などをひき起こし最悪の場合には死に至らしめる.O2が示すこのような生物学的な両義性に対応するため,好気性生物は体内に取り込むO2の分圧を鋭敏に感知し,組織へのO2の供給を厳密に制御するしくみを備えている.今回,筆者らは,イオンチャネルTRPA1が呼吸気におけるO2の過剰や不足を感知する“O2センサー”として機能していることをつきとめた.
旧来より,生体におけるO2分圧の感知には動脈の血中O2濃度を感知する頸動脈小体のグロムス細胞が重要であると考えられてきた.グロムス細胞ではヘムオキシゲナーゼによるCOの産生やミトコンドリアにおけるATPの産生の減少など複数の経路が,K+チャネルの活性抑制を介して低O2環境の感知を担うという仮説が提唱されている1).気管,肺,心臓においては感覚神経や迷走神経が低O2環境あるいは虚血時の組織におけるO2の低下を感知することが報告されているが,その重要性は十分には認識されていない.
一方,微生物,線虫,昆虫などいわゆる原初的な生物は“酸素忌避”(oxygen avoidance)という応答あるいは行動を示すことが知られている.たとえば,線虫は感覚神経を介してO2を感知し高O2環境を避ける行動様式を示す.また,昆虫はO2毒性を最小限にするため断続的な呼吸を行っている.このように,無脊椎動物が高O2環境を感受する機能を備えていることは広く認められているが,哺乳動物を含めた脊椎動物において研究はまったく進められていない.脊椎動物における高O2感受機能を担う分子実体の探索はきわめて重要なのである.
trp(transient receptor potential)遺伝子は1989年,ショウジョウバエにおいて光受容器の電位変化が一過的(transient)となる変異の原因遺伝子として同定された.以来,脊椎動物にも多くのTRPホモログが発見され,現在では,遺伝子の相同性から6つのファミリー,canonical(C),vanilloid(V),melastatin(M),polysistic kidney disease(P),mucolipin(ML),ankyrin(A)に分類されている.それらTRPのホモ四量体あるいはヘテロ四量体がイオンチャネルを形成することで,細胞内外のさまざまな環境変化を感知するセンサーとして機能することが知られている2).筆者らのグループは,これまでに細胞において酸化還元状態を感知する一群のTRPチャネルを明らかにした3-5).とくに,TRPC5およびTRPV1を含むTRPチャネルが,システイン残基のスルフヒドリル基(-SH)の酸化反応によりNO,活性酸素種,活性化ジスルフィド化合物などを感知することを見い出した4).そののち,低温刺激(17℃以下)やマスタードオイル辛味成分のアリルイソチオシアネートを感知するTRPA1も,システイン残基の酸化的な修飾反応により活性化することが明らかにされた6-8).また,感覚神経および迷走神経の末梢側の神経終末に発現するTRPV1とTRPA1は,活性酸素種を含む内因性の炎症関連物質や外因性の侵害物質を感知し,疼痛,咳,呼吸活動の変化などの生体防御反応を惹起させることが知られている.このようなTRPチャネルはそれぞれが固有の酸化感受性をもち,特定の酸化還元的な生体反応に関与しているものと考えられる.今回,筆者らは,O2など弱い酸化力しかもたない酸化物質に反応するTRPチャネルの探索および同定から研究を開始した.
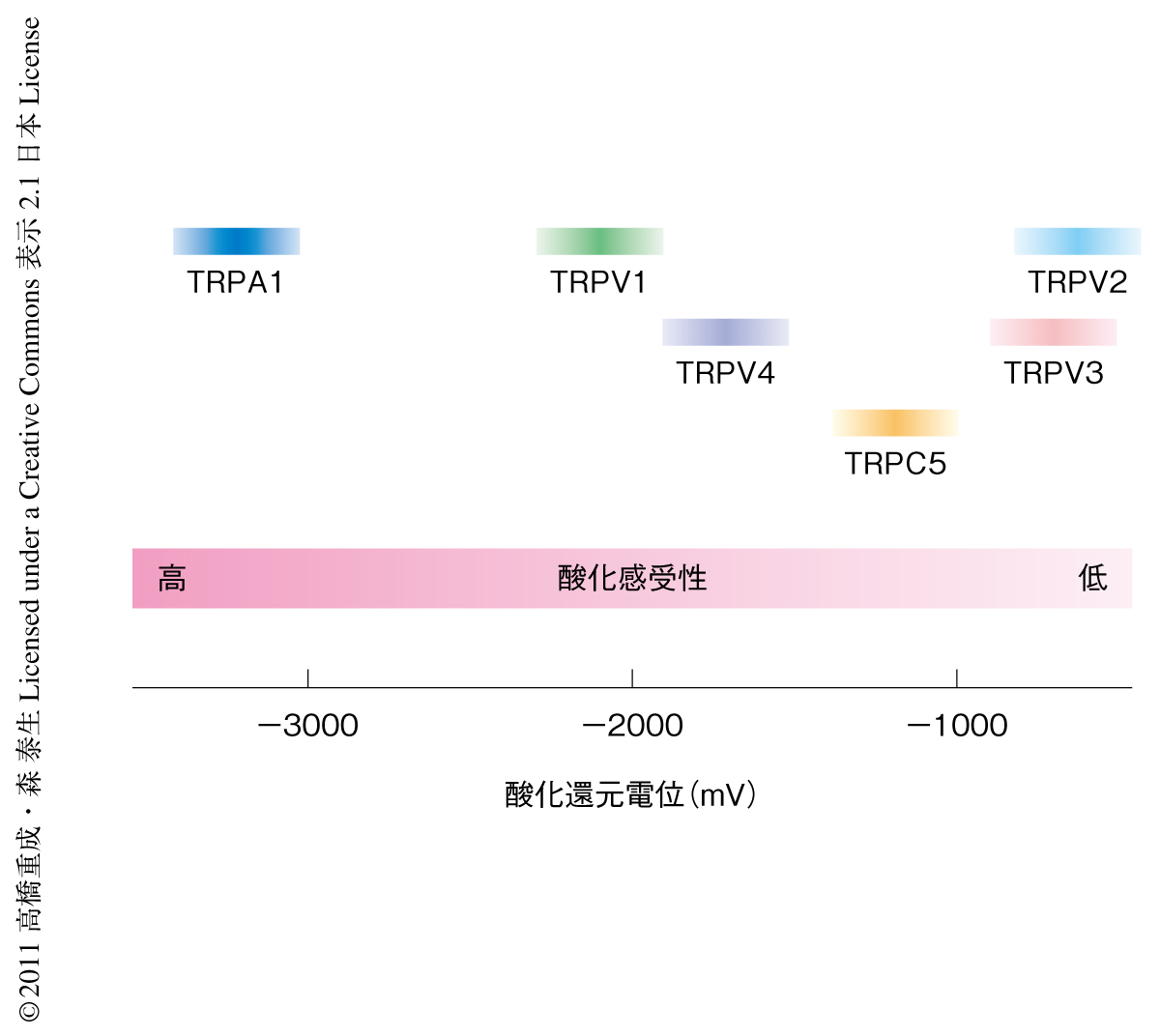
異なった酸化力を示す活性ジスルフィド化合物を合成しTRPチャネルの酸化感受性を定量化したところ,酸化感受性TRPチャネルは固有の酸化感受性をもつことが明らかになった(図1).TRPA1はもっとも高い酸化感受性を示し,酸化力の弱いジアリルジスルフィド(酸化還元電位は-2950 mV)などにも反応する.酸化力の弱いO2の酸化還元電位は同様の-2765 mVであるが,この値はTRPA1の酸化による活性化の閾値よりも十分に高いことから(図1),TRPA1のO2に対する応答性が予測された.そこで,実際にTRPA1を発現させた細胞に高濃度O2溶液を添加したところ,TRPA1を介したカチオン電流が観察された.この高濃度O2による活性化は,細胞からひきはがした膜小片のTRPA1についてもパッチクランプ法により単一チャネル電流として観察された.すなわち,高濃度O2によるTRPA1の活性化は細胞内の因子を介したものではなく,O2の直接的な作用によるものと考えられた.
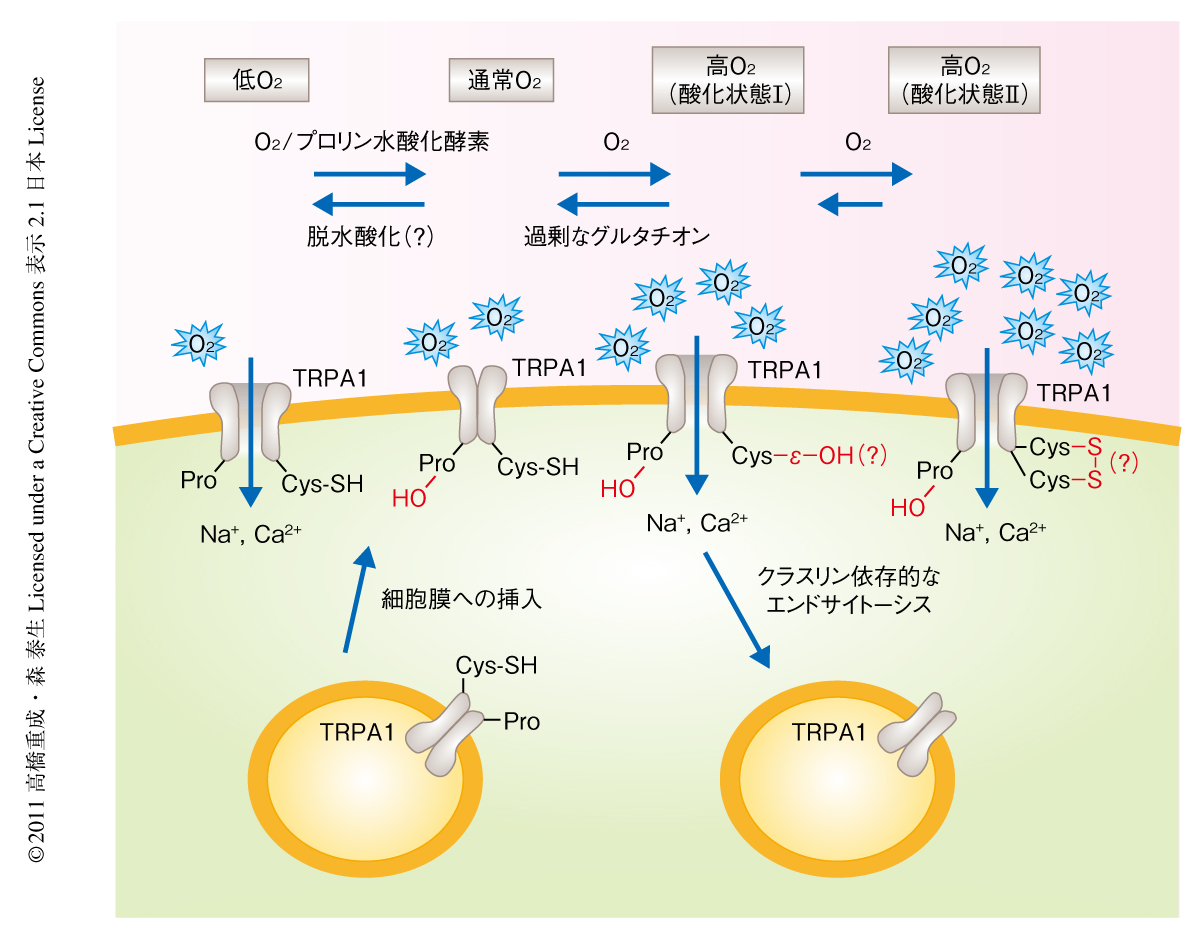
ヒトTRPA1に存在する29個のシステイン残基をそれぞれセリン残基に置換した点変異体を作製し高濃度O2に対する応答を評価した.その結果,TRPA1の活性化には細胞質領域に存在するCys633とCys856が重要であることを見い出した.これらのシステイン残基は側鎖であるスルフヒドリル基(-SH)がO2により酸化されると,まずスルフェン酸(-SOH)へと変換され(酸化状態I),そののちジスルフィド結合(S-S)を形成する(酸化状態II)ものと考えられた(図2).どちらの状態もTRPA1を活性化しこれを開口させたが,酸化状態Iは還元タンパク質であるグルタチオンにより容易に還元されてしまうため不安定な活性化状態であり,酸化状態IIはグルタチオンに抵抗性の安定な活性化状態であると考えられた.また,野生型TRPA1とCys633およびCys856をセリン残基に置換した変異型TRPA1とを等量ずつ遺伝子導入した細胞においては高濃度O2による活性化がほぼ消失したことから,TRPA1の活性化には四量体を構成するすべてのTRPA1のシステイン残基が必要であると考えられた.
N2を通気させた低濃度O2溶液をTRPA1を発現させた細胞に処理すると,TRPA1を介したカチオンの流入が確認された.TRPA1のO2に対する容量-反応曲線は逆ベル型を示し,TRPA1の活性化のもっとも低いO2分圧は137 mmHgと,通常の大気圧におけるO2分圧(152 mmHg)より少し低かった.また,膜小片のTRPA1についてパッチクランプ法により評価したところ,低濃度O2による有意な活性化は認められなかった.すなわち,低濃度O2によるTRPA1の活性化は細胞に存在するなんらかのO2感受性因子を介している可能性が示唆された.
プロリン水酸化酵素はO2を基質としてプロリン残基を水酸化する酸素添加酵素であり,低O2状態に対する生体応答の制御にもっとも重要な転写因子HIF-1αの活性制御を担っている.プロリン水酸化酵素のO2に対するミカエリス定数は大気圧における溶存O2濃度の付近であることから,生理的な範囲におけるO2濃度の低下がプロリン水酸化酵素の活性を低下させ,その結果,水酸化されたHIF-1αの割合が低下するものと考えられている9).
TRPA1のN末端領域に存在するアンキリンリピートドメインはプロリン水酸化モチーフをもっていた.通常のO2濃度ではプロリン水酸化酵素によりこのモチーフのプロリン残基は水酸化されTRPA1の活性は抑えられた.しかし,低O2濃度ではプロリン水酸化酵素による反応が進行せずTRPA1が活性化し開口することを見い出した(図2).また,高O2状態において,システイン残基の酸化による活性促進はプロリン残基の水酸化による活性阻害を凌駕しTRPA1を活性化することもわかった.これらはまったく前例のない新しいイオンチャネルの活性化および開口の機構を示すものであった.また,プロリン残基が水酸化されていない状態(低O2状態)では,クラスリンに依存的なエンドサイトーシスが抑制されることによりTRPA1の細胞膜での発現が上昇しており,プロリン残基の水酸化は細胞膜におけるTRPA1の発現を制御していると考えられた.
野生型マウスの節状神経節から単離した迷走ニューロンや後根神経節から単離した感覚ニューロンに高濃度および低濃度のO2溶液を処理したところカチオン電流が確認された.一方,Trpa1遺伝子を欠損させたマウスから単離した場合にはそれぞれのニューロンにおけるイオン電流は有意に減弱していた.また,プロリン水酸化酵素のノックアウトマウスから単離した細胞において自発的なイオン電流は増大し,低濃度O2に対する応答は有意に減弱していた一方,高濃度O2に対する応答は正常であった.以上のように,迷走ニューロンや感覚ニューロンにおいて高O2環境および低O2環境を感知しそれをカチオン電流という生体情報に変換するためには,TRPA1やプロリン水酸化酵素が必要であることが明らかになった.
マウス個体の迷走神経の活動をin vivo で計測したところ,TRPA1ノックアウトマウスでは高濃度O2(100%O2)および低濃度O2(15%O2)の吸入にともなう迷走神経の活動の増強がともに抑制されていた.つまり,高O2環境および15%O2程度の低O2環境における迷走神経の活動の興奮にはTRPA1が重要であることが示された.その一方で,O2不足が進行し10%O2程度となった低O2環境では,TRPA1ノックアウトマウスは野生型マウスと同様の迷走神経の活動の増強をみせた.このように,比較的おだやかな低O2環境ではTRPA1を中心としたO2センサー機構が,より厳しい低O2環境ではK+チャネルなどが関与するほかのO2センサー機構が重要であると考えられた.
この研究は,生命活動の根幹をなすO2に対する新たな生物学的な理解をあたえ,感覚生物学においてはとくに飛躍的な進歩をもたらすものと考える.哺乳動物における動脈の血中O2濃度の感知に関しては,旧来より化学受容器のなかでも頸動脈小体のグロムス細胞がきわだって重要であると考えられ,さまざまなO2センサー機構が提唱されてきた.この研究は,肺や気管に投射する感覚神経や迷走神経などの化学受容器がTRPA1を介して呼吸気におけるO2の感知にはたす重要な役割をはじめて示した.また,低O2環境の感知に比べるといままで見過ごされてきたO2毒性を避けるための高O2環境の感知にも光をあてることになった.微生物,線虫,昆虫などの原初的な生物に広くみられる酸素忌避につながる高O2環境のセンサー機構を哺乳類も備えていることを示唆し,非常に興味深い進化生物学的な知見を得たといえる.ところで,海抜ゼロ地点における大気のO2分圧については,およそ137 mmHgから170 mmHgまで変動したという記録が残っている10).この137 mmHgはTRPA1の活性がもっとも低くなるO2分圧と一致していることから,海抜ゼロ地点における大気のO2分圧の変動を感知できる高感度なO2センサーとしてTRPA1が機能する可能性が示された.
迷走神経は全身すべての組織の状態を監視しており,その情報をたえず中枢に送っている.また,迷走神経の活動の増大は呼吸,心拍,血圧を変化させることが知られている.この論文が提唱するTRPA1を介したO2センサー機構の確立のためには,TRPA1ノックアウトマウスを用いて高濃度および低濃度のO2の吸入時におけるこれらの生理学的なパラメーターの変化や,高O2環境における急性肺障害や低O2環境における肺高血圧症の発症についてさらに詳細を評価する必要がある.
略歴:2010年 京都大学大学院工学研究科博士課程 修了,同年より京都大学先端医工学研究ユニット 特定助教.
研究テーマ:活性酸素種シグナルとTRPチャネル.
森 泰生(Yasuo Mori)
京都大学大学院工学研究科 教授.
研究室URL:http://www.sbchem.kyoto-u.ac.jp/mori-lab/index.html
© 2011 高橋重成・森 泰生 Licensed under CC 表示 2.1 日本
(京都大学大学院工学研究科 合成・生物化学専攻分子生物化学分野)
email:森 泰生
DOI: 10.7875/first.author.2011.148
TRPA1 underlies a sensing mechanism for O2.
Nobuaki Takahashi, Tomoyuki Kuwaki, Shigeki Kiyonaka, Tomohiro Numata, Daisuke Kozai, Yusuke Mizuno, Shinichiro Yamamoto, Shinji Naito, Ellen Knevels, Peter Carmeliet, Toru Oga, Shuji Kaneko, Seiji Suga, Toshiki Nokami, Jun-ichi Yoshida, Yasuo Mori
Nature Chemical Biology, 7, 701-711 (2011)
要 約
分子状酸素O2はわれわれ好気性生物の生存に必須の物質である.体内に取り込まれたO2は電子受容体としておもにミトコンドリアにおいて呼吸鎖で水に変換され,生体エネルギーの通貨と称されるATPの産生を制御する.しかし,O2は過酸化水素や超酸化物イオンなど活性酸素種の産生基質としてもはたらくことで“酸素毒性”を示し,高濃度O2の吸引はヒトでは呼吸器疾患や未熟児網膜症などをひき起こし最悪の場合には死に至らしめる.O2が示すこのような生物学的な両義性に対応するため,好気性生物は体内に取り込むO2の分圧を鋭敏に感知し,組織へのO2の供給を厳密に制御するしくみを備えている.今回,筆者らは,イオンチャネルTRPA1が呼吸気におけるO2の過剰や不足を感知する“O2センサー”として機能していることをつきとめた.
はじめに
旧来より,生体におけるO2分圧の感知には動脈の血中O2濃度を感知する頸動脈小体のグロムス細胞が重要であると考えられてきた.グロムス細胞ではヘムオキシゲナーゼによるCOの産生やミトコンドリアにおけるATPの産生の減少など複数の経路が,K+チャネルの活性抑制を介して低O2環境の感知を担うという仮説が提唱されている1).気管,肺,心臓においては感覚神経や迷走神経が低O2環境あるいは虚血時の組織におけるO2の低下を感知することが報告されているが,その重要性は十分には認識されていない.
一方,微生物,線虫,昆虫などいわゆる原初的な生物は“酸素忌避”(oxygen avoidance)という応答あるいは行動を示すことが知られている.たとえば,線虫は感覚神経を介してO2を感知し高O2環境を避ける行動様式を示す.また,昆虫はO2毒性を最小限にするため断続的な呼吸を行っている.このように,無脊椎動物が高O2環境を感受する機能を備えていることは広く認められているが,哺乳動物を含めた脊椎動物において研究はまったく進められていない.脊椎動物における高O2感受機能を担う分子実体の探索はきわめて重要なのである.
trp(transient receptor potential)遺伝子は1989年,ショウジョウバエにおいて光受容器の電位変化が一過的(transient)となる変異の原因遺伝子として同定された.以来,脊椎動物にも多くのTRPホモログが発見され,現在では,遺伝子の相同性から6つのファミリー,canonical(C),vanilloid(V),melastatin(M),polysistic kidney disease(P),mucolipin(ML),ankyrin(A)に分類されている.それらTRPのホモ四量体あるいはヘテロ四量体がイオンチャネルを形成することで,細胞内外のさまざまな環境変化を感知するセンサーとして機能することが知られている2).筆者らのグループは,これまでに細胞において酸化還元状態を感知する一群のTRPチャネルを明らかにした3-5).とくに,TRPC5およびTRPV1を含むTRPチャネルが,システイン残基のスルフヒドリル基(-SH)の酸化反応によりNO,活性酸素種,活性化ジスルフィド化合物などを感知することを見い出した4).そののち,低温刺激(17℃以下)やマスタードオイル辛味成分のアリルイソチオシアネートを感知するTRPA1も,システイン残基の酸化的な修飾反応により活性化することが明らかにされた6-8).また,感覚神経および迷走神経の末梢側の神経終末に発現するTRPV1とTRPA1は,活性酸素種を含む内因性の炎症関連物質や外因性の侵害物質を感知し,疼痛,咳,呼吸活動の変化などの生体防御反応を惹起させることが知られている.このようなTRPチャネルはそれぞれが固有の酸化感受性をもち,特定の酸化還元的な生体反応に関与しているものと考えられる.今回,筆者らは,O2など弱い酸化力しかもたない酸化物質に反応するTRPチャネルの探索および同定から研究を開始した.
1.TRPA1は高O2環境において活性化する
異なった酸化力を示す活性ジスルフィド化合物を合成しTRPチャネルの酸化感受性を定量化したところ,酸化感受性TRPチャネルは固有の酸化感受性をもつことが明らかになった(図1).TRPA1はもっとも高い酸化感受性を示し,酸化力の弱いジアリルジスルフィド(酸化還元電位は-2950 mV)などにも反応する.酸化力の弱いO2の酸化還元電位は同様の-2765 mVであるが,この値はTRPA1の酸化による活性化の閾値よりも十分に高いことから(図1),TRPA1のO2に対する応答性が予測された.そこで,実際にTRPA1を発現させた細胞に高濃度O2溶液を添加したところ,TRPA1を介したカチオン電流が観察された.この高濃度O2による活性化は,細胞からひきはがした膜小片のTRPA1についてもパッチクランプ法により単一チャネル電流として観察された.すなわち,高濃度O2によるTRPA1の活性化は細胞内の因子を介したものではなく,O2の直接的な作用によるものと考えられた.
2.高O2環境におけるTRPA1の活性化にはシステイン残基の酸化が重要である
ヒトTRPA1に存在する29個のシステイン残基をそれぞれセリン残基に置換した点変異体を作製し高濃度O2に対する応答を評価した.その結果,TRPA1の活性化には細胞質領域に存在するCys633とCys856が重要であることを見い出した.これらのシステイン残基は側鎖であるスルフヒドリル基(-SH)がO2により酸化されると,まずスルフェン酸(-SOH)へと変換され(酸化状態I),そののちジスルフィド結合(S-S)を形成する(酸化状態II)ものと考えられた(図2).どちらの状態もTRPA1を活性化しこれを開口させたが,酸化状態Iは還元タンパク質であるグルタチオンにより容易に還元されてしまうため不安定な活性化状態であり,酸化状態IIはグルタチオンに抵抗性の安定な活性化状態であると考えられた.また,野生型TRPA1とCys633およびCys856をセリン残基に置換した変異型TRPA1とを等量ずつ遺伝子導入した細胞においては高濃度O2による活性化がほぼ消失したことから,TRPA1の活性化には四量体を構成するすべてのTRPA1のシステイン残基が必要であると考えられた.
3.TRPA1は低O2環境においても活性化する
N2を通気させた低濃度O2溶液をTRPA1を発現させた細胞に処理すると,TRPA1を介したカチオンの流入が確認された.TRPA1のO2に対する容量-反応曲線は逆ベル型を示し,TRPA1の活性化のもっとも低いO2分圧は137 mmHgと,通常の大気圧におけるO2分圧(152 mmHg)より少し低かった.また,膜小片のTRPA1についてパッチクランプ法により評価したところ,低濃度O2による有意な活性化は認められなかった.すなわち,低濃度O2によるTRPA1の活性化は細胞に存在するなんらかのO2感受性因子を介している可能性が示唆された.
4.低O2環境におけるTRPA1の活性化にはプロリン水酸化酵素が重要である
プロリン水酸化酵素はO2を基質としてプロリン残基を水酸化する酸素添加酵素であり,低O2状態に対する生体応答の制御にもっとも重要な転写因子HIF-1αの活性制御を担っている.プロリン水酸化酵素のO2に対するミカエリス定数は大気圧における溶存O2濃度の付近であることから,生理的な範囲におけるO2濃度の低下がプロリン水酸化酵素の活性を低下させ,その結果,水酸化されたHIF-1αの割合が低下するものと考えられている9).
TRPA1のN末端領域に存在するアンキリンリピートドメインはプロリン水酸化モチーフをもっていた.通常のO2濃度ではプロリン水酸化酵素によりこのモチーフのプロリン残基は水酸化されTRPA1の活性は抑えられた.しかし,低O2濃度ではプロリン水酸化酵素による反応が進行せずTRPA1が活性化し開口することを見い出した(図2).また,高O2状態において,システイン残基の酸化による活性促進はプロリン残基の水酸化による活性阻害を凌駕しTRPA1を活性化することもわかった.これらはまったく前例のない新しいイオンチャネルの活性化および開口の機構を示すものであった.また,プロリン残基が水酸化されていない状態(低O2状態)では,クラスリンに依存的なエンドサイトーシスが抑制されることによりTRPA1の細胞膜での発現が上昇しており,プロリン残基の水酸化は細胞膜におけるTRPA1の発現を制御していると考えられた.
5.高O2環境および低O2環境はTRPA1を介して末梢神経系を興奮させる
野生型マウスの節状神経節から単離した迷走ニューロンや後根神経節から単離した感覚ニューロンに高濃度および低濃度のO2溶液を処理したところカチオン電流が確認された.一方,Trpa1遺伝子を欠損させたマウスから単離した場合にはそれぞれのニューロンにおけるイオン電流は有意に減弱していた.また,プロリン水酸化酵素のノックアウトマウスから単離した細胞において自発的なイオン電流は増大し,低濃度O2に対する応答は有意に減弱していた一方,高濃度O2に対する応答は正常であった.以上のように,迷走ニューロンや感覚ニューロンにおいて高O2環境および低O2環境を感知しそれをカチオン電流という生体情報に変換するためには,TRPA1やプロリン水酸化酵素が必要であることが明らかになった.
マウス個体の迷走神経の活動をin vivo で計測したところ,TRPA1ノックアウトマウスでは高濃度O2(100%O2)および低濃度O2(15%O2)の吸入にともなう迷走神経の活動の増強がともに抑制されていた.つまり,高O2環境および15%O2程度の低O2環境における迷走神経の活動の興奮にはTRPA1が重要であることが示された.その一方で,O2不足が進行し10%O2程度となった低O2環境では,TRPA1ノックアウトマウスは野生型マウスと同様の迷走神経の活動の増強をみせた.このように,比較的おだやかな低O2環境ではTRPA1を中心としたO2センサー機構が,より厳しい低O2環境ではK+チャネルなどが関与するほかのO2センサー機構が重要であると考えられた.
おわりに
この研究は,生命活動の根幹をなすO2に対する新たな生物学的な理解をあたえ,感覚生物学においてはとくに飛躍的な進歩をもたらすものと考える.哺乳動物における動脈の血中O2濃度の感知に関しては,旧来より化学受容器のなかでも頸動脈小体のグロムス細胞がきわだって重要であると考えられ,さまざまなO2センサー機構が提唱されてきた.この研究は,肺や気管に投射する感覚神経や迷走神経などの化学受容器がTRPA1を介して呼吸気におけるO2の感知にはたす重要な役割をはじめて示した.また,低O2環境の感知に比べるといままで見過ごされてきたO2毒性を避けるための高O2環境の感知にも光をあてることになった.微生物,線虫,昆虫などの原初的な生物に広くみられる酸素忌避につながる高O2環境のセンサー機構を哺乳類も備えていることを示唆し,非常に興味深い進化生物学的な知見を得たといえる.ところで,海抜ゼロ地点における大気のO2分圧については,およそ137 mmHgから170 mmHgまで変動したという記録が残っている10).この137 mmHgはTRPA1の活性がもっとも低くなるO2分圧と一致していることから,海抜ゼロ地点における大気のO2分圧の変動を感知できる高感度なO2センサーとしてTRPA1が機能する可能性が示された.
迷走神経は全身すべての組織の状態を監視しており,その情報をたえず中枢に送っている.また,迷走神経の活動の増大は呼吸,心拍,血圧を変化させることが知られている.この論文が提唱するTRPA1を介したO2センサー機構の確立のためには,TRPA1ノックアウトマウスを用いて高濃度および低濃度のO2の吸入時におけるこれらの生理学的なパラメーターの変化や,高O2環境における急性肺障害や低O2環境における肺高血圧症の発症についてさらに詳細を評価する必要がある.
文 献
- Weir, E. K., Lopez-Barneo, J., Buckler, K. J. et al.: Acute oxygen-sensing mechanisms. N. Engl. J. Med., 353, 2042-2055 (2005)[PubMed]
- Voets, T., Talavera, K., Owsianik, G. et al.: Sensing with TRP channels. Nat. Chem. Biol., 1, 85-92 (2005)[PubMed]
- Hara, Y., Wakamori, M., Ishii, M. et al.: LTRPC2 Ca2+-permeable channel activated by changes in redox status confers susceptibility to cell death. Mol. Cell, 9, 163-173 (2002)[PubMed]
- Yoshida, T., Inoue, R., Morii, T. et al.: Nitric oxide activates TRP channels by cysteine S-nitrosylation. Nat. Chem. Biol., 2, 596-607 (2006)[PubMed]
- Xu, S. Z., Sukumar, P., Zeng, F. et al.: TRPC channel activation by extracellular thioredoxin. Nature, 451, 69-72 (2008)[PubMed]
- Hinman, A., Chuang, H. H., Bautista, D. M. et al.: TRP channel activation by reversible covalent modification. Proc. Natl. Acad. Sci. USA, 103, 19564-19568 (2006)[PubMed]
- Macpherson, L. J., Dubin, A. E., Evans, M. J. et al.: Noxious compounds activate TRPA1 ion channels through covalent modification of cysteines. Nature, 445, 541-545 (2007)[PubMed]
- Takahashi, N., Mizuno, Y., Kozai, D. et al.: Molecular characterization of TRPA1 channel activation by cysteine-reactive inflammatory mediators. Channels, 2, 287-298 (2008)[PubMed]
- Schofield, C. J. & Ratcliffe, P. J.: Oxygen sensing by HIF hydroxylases. Nat. Rev. Mol. Cell Biol., 5, 343-354 (2004)[PubMed]
- Mcelroy, M. B.: The Atmospheric Environment: Effects of Human Activity. Princeton University Press, Princeton (2002)
著者プロフィール
略歴:2010年 京都大学大学院工学研究科博士課程 修了,同年より京都大学先端医工学研究ユニット 特定助教.
研究テーマ:活性酸素種シグナルとTRPチャネル.
森 泰生(Yasuo Mori)
京都大学大学院工学研究科 教授.
研究室URL:http://www.sbchem.kyoto-u.ac.jp/mori-lab/index.html
© 2011 高橋重成・森 泰生 Licensed under CC 表示 2.1 日本