β2アドレナリン受容体を介した慢性的なストレス反応はβアレスチン1とp53のかかわるシグナル伝達によりDNA損傷を蓄積する
原 誠
(米国Duke大学Medical Center,Department of Medicine)
email:原 誠
DOI: 10.7875/first.author.2011.146
A stress response pathway regulates DNA damage through β2-adrenoreceptors and β-arrestin-1.
Makoto R. Hara, Jeffrey J. Kovacs, Erin J. Whalen, Sudarshan Rajagopal, Ryan T. Strachan, Wayne Grant, Aaron J. Towers, Barbara Williams, Christopher M. Lam, Kunhong Xiao, Sudha K. Shenoy, Simon G. Gregory, Seungkirl Ahn, Derek R. Duckett, Robert J. Lefkowitz
Nature, 477, 349-353 (2011)
ヒトはストレス状況において,交感神経系を刺激しアドレナリンを放出することなどにより対応している.こういったストレス反応は概来は一過性の反応であり,免疫または成長を抑制するなどの作用をもつため長時間にわたり持続すると身体に悪影響をおよぼす.また,疫学的な調査から慢性的なストレスによりDNA損傷を生じることが示唆されているが,ストレスがどのようにしてDNA損傷をひき起こすのか,これまでその分子機構はわかっていなかった.筆者らは,アドレナリン様カテコラミンによる刺激が,Gsタンパク質-プロテインキナーゼA経路,および,βアレスチン1によるp53の低下という2つのシグナル伝達の同調をひき起こし,DNA損傷の蓄積をうながすことを示した.これらの結果より,慢性的なストレスのもと,どのようにしてDNA損傷の蓄積がひき起こされるのか,ひとつの分子機構が明らかにされた.
ヒトを含めた哺乳動物は生命に危険の及ぶような身体的なストレスをうけると,交感神経系が刺激されアドレナリンおよびノルアドレナリンが放出されることにより,血圧や心拍数を上げて敵を攻撃あるいは退避するような行動をとる(攻撃逃避反応).これらの反応は野生動物が自然界で生き残るための重要なストレス反応のひとつであるが,一過性のものであり長時間にわたり持続することはまれである.一方,精神的なストレスは身体的なストレスと違い長時間にわたり刺激が持続し,場合によっては何カ月あるいは何年も続くことがある.興味深いことに,このような精神的なストレスに対する反応も身体的なストレスに対する反応と同じように交感神経を刺激し,アドレナリンおよびノルアドレナリンを放出する反応をひき起こすことが知られている1).この慢性的に持続したストレス反応により身体症状の出現する例として,胃十二指腸潰瘍や高血圧,不整脈などの心身症がある1).また,持続したストレスによりDNA損傷がひき起こされ2,3),老化,腫瘍,精神疾患,また,流産など多岐にわたる現象あるいは疾患の原因となっていることも示唆されている.しかし,どのようにして慢性ストレスがDNAに影響を及ぼすのか,その分子機構はこれまで解明されていなかった.
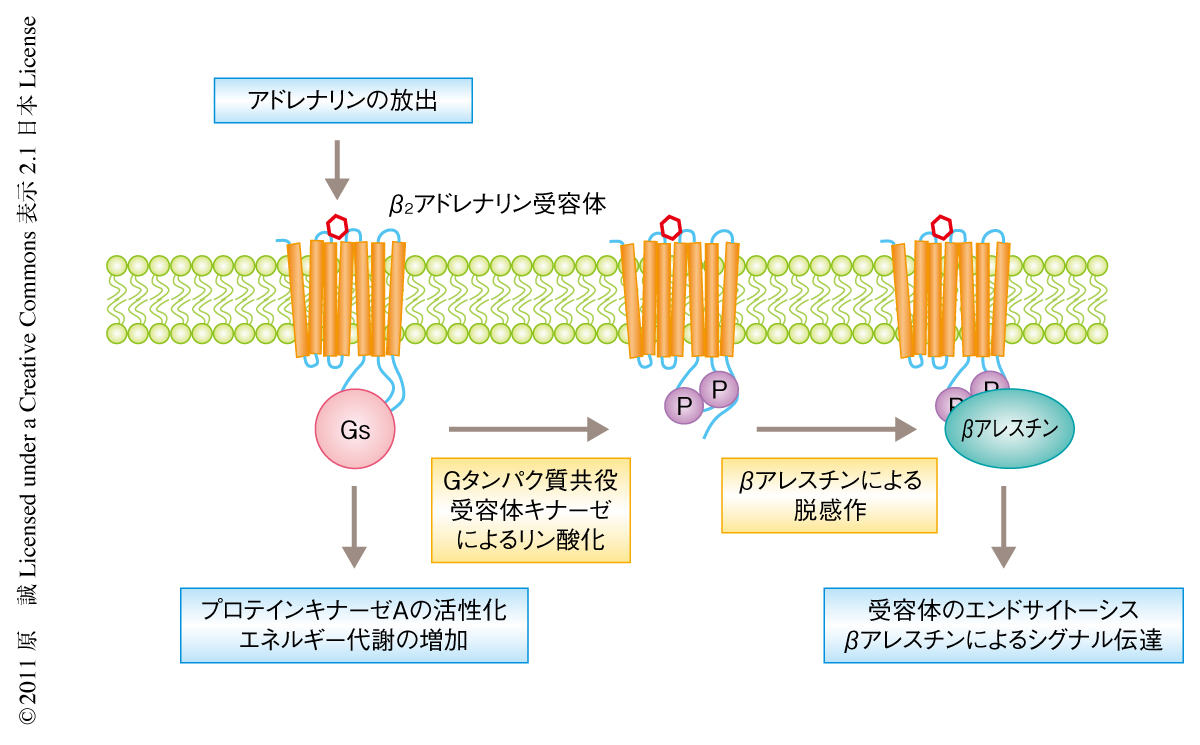
ストレスホルモンのひとつであるアドレナリンは,生殖細胞や受精卵をふくめ身体のあらゆる部位に発現しているβ2アドレナリン受容体を刺激する.活性化されたβ2アドレナリン受容体は,Gsタンパク質を介してプロテインキナーゼAを活性化し,また,そののちβアレスチンにより脱感作される(図1).最近の研究から,このβアレスチン自体もGタンパク質と同様にさまざまなシグナル伝達を誘導することもわかってきた4).
今回の研究では,アドレナリンとその受容体に注目し,慢性的にストレスホルモンにさらされた場合,どのような分子機構でDNAに影響が及ぶのかを検討した.
β2アドレナリン受容体を持続的に刺激する慢性ストレスモデルのひとつとして5,6),野生型マウスにβ2アドレナリン受容体のアゴニストであるアドレナリン様カテコラミン(イソプロテレノール)を4週間にわたり持続注入した.このマウスモデルがDNA損傷をひき起こすかどうか調べるため,アドレナリン様カテコラミンの持続注入ののちストレスに顕著に反応する器官のひとつである胸腺7) を採取し,DNA損傷マーカーのひとつであるヒストンH2AXのリン酸化の有無を調べた.興味深いことに,アドレナリン様カテコラミンを注入されたマウスは生理食塩水を注入されたマウスに比べ,ヒストンH2AXのリン酸化の量がおよそ2倍に増大しDNA損傷の蓄積が確認された.p53はゲノムの守護神(the Guardian of the Genome)とよばれており,その機能はDNAの維持に深くかかわっている.アドレナリン様カテコラミンの持続注入がDNA損傷の蓄積を起こす分子機構を調べるため,胸腺組織におけるp53の量を調べたところ生理食塩水を注入されたマウスと比較して半分近くにまで減少しており,p53の低下はDNA損傷の蓄積を誘導することが予想された.そこで,いくつかの細胞株を用いてそのシグナル伝達を解析したところ,β2アドレナリン受容体の持続刺激はβアレスチン1を介したPI3K-AKT経路を活性化し,ユビキチンリガーゼのひとつであるMDM2のリン酸化と活性化を誘導することがわかった.
最近の研究により,βアレスチンはユビキチンリガーゼ複合体のアダプタータンパク質としてはたらくことがわかってきた8).ここで明らかになったMDM2の活性化はβアレスチン1を介したシグナル伝達であるため,βアレスチンがMDM2とp53との結合を補助するアダプタータンパク質としてはたらくかどうかを調べた.細胞質と核の両方に局在するβアレスチン1は,細胞質に局在するβアレスチン2に比べ,より多くのp53と結合することが免疫沈降実験において示された.さらに,in vitroにおいても精製したβアレスチン1とp53とは結合した.共焦点顕微鏡を用いた実験においてはβアレスチン1とp53は核において共局在していた.これらのデータはβアレスチン1が核においてp53とMDM2との結合を補助する役割をもつことを示唆しているのかもしれないと考え,βアレスチン1を強発現させたところp53とMDM2との結合は増大したが,核外移行シグナルを導入した変異βアレスチン1を強発現させるとその増大は失われた.
βアレスチン1によるp53とMDM2との結合の補助はアドレナリン様カテコラミンにより誘発されたp53の分解にかかわっているかどうか調べた.アドレナリン様カテコラミンの持続刺激のもと,野生型の線維芽細胞ではp53の分解が促進されるが,βアレスチン1を欠損した線維芽細胞ではp53の分解はみられなかった.さらに,p53のMDM2への結合,また,p53の分解を促すポリユビキチン化は,野生型の線維芽細胞ではアドレナリン様カテコラミンの持続刺激により増大していたが,βアレスチン1を欠損した線維芽細胞ではこれらの増大は確認されなかった.これは,アドレナリン様カテコラミンにより活性化されたMDM2によるp53の低下をβアレスチン1が補助していることを示唆していた.βアレスチン1ノックアウトマウスに4週間にわたりアドレナリン様カテコラミンを持続注入したところ,野生型マウスの胸腺組織においてみられたp53の低下やDNA損傷の蓄積は認められなかった.
p53の低下とDNA損傷との関連性をくわしく調べた.ヒトに由来するp53を欠損した細胞をアドレナリン様カテコラミンで持続的に刺激するとヒストンH2AXのリン酸化の増大が認められ,DNA損傷の発生それ自体はp53に依存していないことが示唆された.β2アドレナリン受容体のシグナル伝達におけるGsタンパク質を介したプロテインキナーゼAの活性は,DNA損傷をひき起こす活性酸素を産生することが知られている9).そこで,プロテインキナーゼA阻害剤を投与したのち,ヒトに由来するp53を欠損した細胞をアドレナリン様カテコラミンで持続的に刺激するとヒストンH2AXのリン酸化が減少し,さらにp53を再発現させるとヒストンH2AXのリン酸化はほぼ検出されなくなった.これは,β2アドレナリン受容体の持続的な刺激が,DNA損傷の引き金となるGsタンパク質-プロテインキナーゼA経路,および,βアレスチン1によるp53の低下という2つのシグナル伝達の同調をひき起こし,DNA損傷の蓄積を促すことを示していた.
つぎに,β2アドレナリン受容体の持続刺激によるDNA損傷の蓄積がゲノムに影響を及ぼしているかどうかを調べた.胸腺の細胞においてDNAに損傷が生じたとき,T細胞受容体γ遺伝子とT細胞受容体β遺伝子とのあいだで染色体間の組換えの起こることが知られている10).そこで,4週間にわたりアドレナリン様カテコラミンを持続注入した野生型マウスとβアレスチン1ノックアウトマウスについて胸腺の細胞を比較したところ,野生型マウスではこの組換えが認められたがβアレスチン1ノックアウトマウスでは認められなかった.これは,慢性的なストレス状況において生じるDNA損傷の蓄積がゲノムの組換えをひき起こす可能性のあることを示していた.
親のうけた慢性的なストレスがさらに子の遺伝子にまで影響する可能性があるかどうかを検討するため,父親のストレスホルモンの影響をうける精巣内の精子を用いた実験を行った.4週間にわたりアドレナリン様カテコラミンを持続注入した慢性ストレスモデルマウスを用い,野生型マウスとβアレスチン1ノックアウトマウスのゲノムを解析した.精巣で起こる減数分裂性の組換えを検出せずアドレナリン様カテコラミンの持続注入によるDNA損傷により生じたゲノムの組換えだけを検出するために胸腺も同時に解析し,2つの異なる臓器で生じたゲノムの組換えのうち一致しているものをDNA損傷により生じたゲノムの組換えであるとした.興味深いことに,野生型マウスの精巣では第4染色体においてDNA損傷によるゲノムの組換えが起こり,これはp53の低下と相関していたのに対し,βアレスチン1ノックアウトマウスではゲノムの組換えはみられなかった.これは,慢性的なストレスホルモンへの暴露が精子のゲノムに影響を及ぼすかもしれないことを示唆していた.
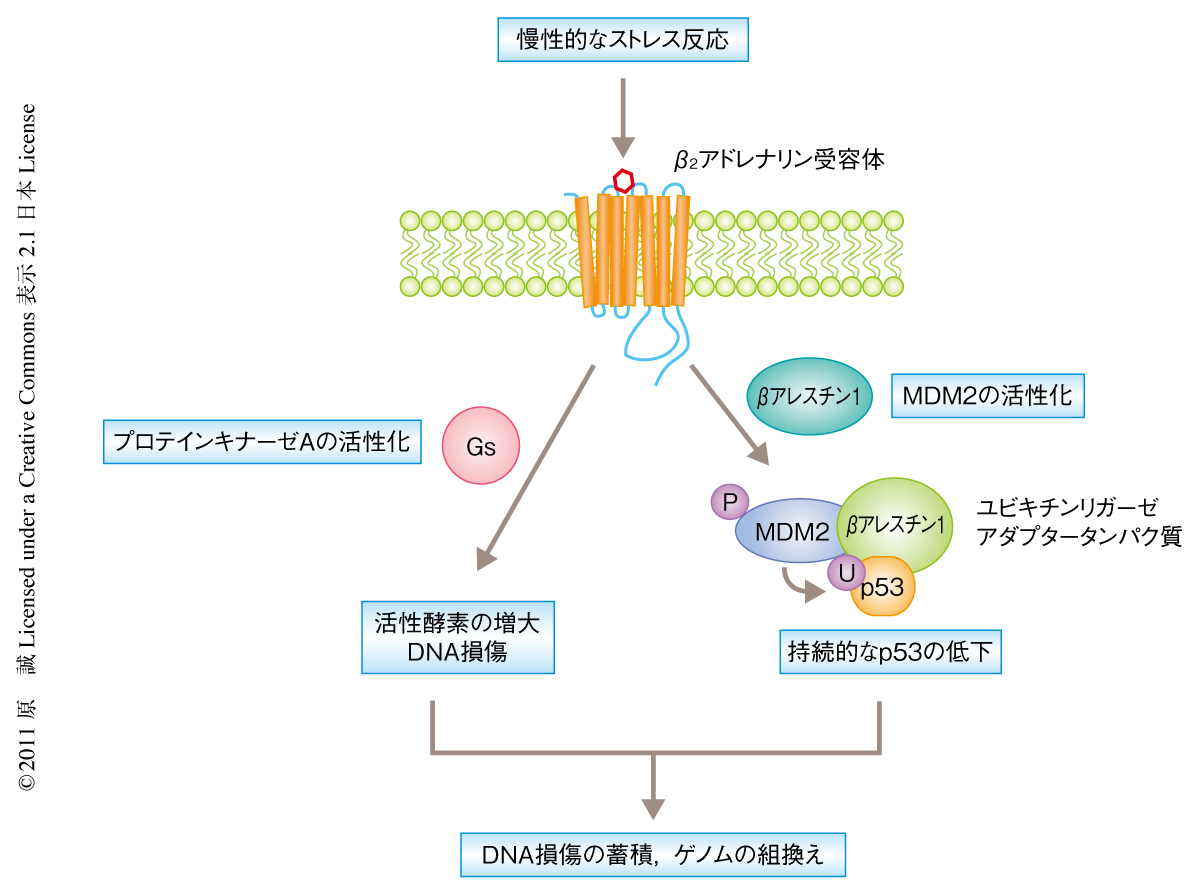
ストレス反応は野生動物が自然界で生き残るための重要な反応である.ところが,文明が発達したゆえに起こるヒトの精神的なストレスとそれに対する反応は,何カ月あるいは何年も継続して起こりうるため身体にはマイナスの影響のあるものと考えられる.DNA損傷はそういった影響のひとつであると疫学的に示されていたが,その分子機構はわかっていなかった.今回の研究において,筆者らは,ストレス反応のひとつである攻撃逃避反応を担うアドレナリン様カテコラミンを持続的に暴露することにより,DNA損傷の蓄積することを示した.この分子機構として,持続的なアドレナリン様カテコラミンによる刺激はβ2アドレナリン受容体を介してβアレスチン1のシグナル伝達によりp53の低下をもたらし,p53の低下がさらにGsタンパク質が引き金となり起こるDNA損傷の蓄積を促進させることを明らかにした(図2).
今後は,グルココルチコイドなどほかのストレスホルモンも同様にDNAに影響を及ぼすか,また,その分子機構を解明することが課題である.今回の研究では,アドレナリン様カテコラミンの持続注入を慢性的ストレスのモデルとして用いたが,行動的なストレスを用いた実験でも同様な分子機構がはたらいているかどうかを解明することも課題である.
略歴:2005年 米国Johns Hopkins大学School of Medicine博士課程 修了,2006年より米国Duke大学Medical Center博士研究員.
研究テーマ:7回膜貫通受容体とシグナル伝達.
関心事:DNA損傷と神経変性疾患とのかかわり.
© 2011 原 誠 Licensed under CC 表示 2.1 日本
(米国Duke大学Medical Center,Department of Medicine)
email:原 誠
DOI: 10.7875/first.author.2011.146
A stress response pathway regulates DNA damage through β2-adrenoreceptors and β-arrestin-1.
Makoto R. Hara, Jeffrey J. Kovacs, Erin J. Whalen, Sudarshan Rajagopal, Ryan T. Strachan, Wayne Grant, Aaron J. Towers, Barbara Williams, Christopher M. Lam, Kunhong Xiao, Sudha K. Shenoy, Simon G. Gregory, Seungkirl Ahn, Derek R. Duckett, Robert J. Lefkowitz
Nature, 477, 349-353 (2011)
この論文に出現する遺伝子・タンパク質のUniprot ID
β2アドレナリン受容体(P18762), βアレスチン1(Q8BWG8), p53(P02340), β2-adrenoreceptors(P18762), β-arrestin-1(Q8BWG8), Gsタンパク質, プロテインキナーゼA, βアレスチン, ヒストンH2AX(P27661), PI3K, AKT, ユビキチンリガーゼ, MDM2(P23804), βアレスチン2(Q91YI4), T細胞受容体γ, T細胞受容体β, Gタンパク質共役受容体キナーゼ
要 約
ヒトはストレス状況において,交感神経系を刺激しアドレナリンを放出することなどにより対応している.こういったストレス反応は概来は一過性の反応であり,免疫または成長を抑制するなどの作用をもつため長時間にわたり持続すると身体に悪影響をおよぼす.また,疫学的な調査から慢性的なストレスによりDNA損傷を生じることが示唆されているが,ストレスがどのようにしてDNA損傷をひき起こすのか,これまでその分子機構はわかっていなかった.筆者らは,アドレナリン様カテコラミンによる刺激が,Gsタンパク質-プロテインキナーゼA経路,および,βアレスチン1によるp53の低下という2つのシグナル伝達の同調をひき起こし,DNA損傷の蓄積をうながすことを示した.これらの結果より,慢性的なストレスのもと,どのようにしてDNA損傷の蓄積がひき起こされるのか,ひとつの分子機構が明らかにされた.
はじめに
ヒトを含めた哺乳動物は生命に危険の及ぶような身体的なストレスをうけると,交感神経系が刺激されアドレナリンおよびノルアドレナリンが放出されることにより,血圧や心拍数を上げて敵を攻撃あるいは退避するような行動をとる(攻撃逃避反応).これらの反応は野生動物が自然界で生き残るための重要なストレス反応のひとつであるが,一過性のものであり長時間にわたり持続することはまれである.一方,精神的なストレスは身体的なストレスと違い長時間にわたり刺激が持続し,場合によっては何カ月あるいは何年も続くことがある.興味深いことに,このような精神的なストレスに対する反応も身体的なストレスに対する反応と同じように交感神経を刺激し,アドレナリンおよびノルアドレナリンを放出する反応をひき起こすことが知られている1).この慢性的に持続したストレス反応により身体症状の出現する例として,胃十二指腸潰瘍や高血圧,不整脈などの心身症がある1).また,持続したストレスによりDNA損傷がひき起こされ2,3),老化,腫瘍,精神疾患,また,流産など多岐にわたる現象あるいは疾患の原因となっていることも示唆されている.しかし,どのようにして慢性ストレスがDNAに影響を及ぼすのか,その分子機構はこれまで解明されていなかった.
ストレスホルモンのひとつであるアドレナリンは,生殖細胞や受精卵をふくめ身体のあらゆる部位に発現しているβ2アドレナリン受容体を刺激する.活性化されたβ2アドレナリン受容体は,Gsタンパク質を介してプロテインキナーゼAを活性化し,また,そののちβアレスチンにより脱感作される(図1).最近の研究から,このβアレスチン自体もGタンパク質と同様にさまざまなシグナル伝達を誘導することもわかってきた4).
今回の研究では,アドレナリンとその受容体に注目し,慢性的にストレスホルモンにさらされた場合,どのような分子機構でDNAに影響が及ぶのかを検討した.
1.β2アドレナリン受容体の持続的な刺激はp53の低下とDNA損傷の蓄積をひき起こす
β2アドレナリン受容体を持続的に刺激する慢性ストレスモデルのひとつとして5,6),野生型マウスにβ2アドレナリン受容体のアゴニストであるアドレナリン様カテコラミン(イソプロテレノール)を4週間にわたり持続注入した.このマウスモデルがDNA損傷をひき起こすかどうか調べるため,アドレナリン様カテコラミンの持続注入ののちストレスに顕著に反応する器官のひとつである胸腺7) を採取し,DNA損傷マーカーのひとつであるヒストンH2AXのリン酸化の有無を調べた.興味深いことに,アドレナリン様カテコラミンを注入されたマウスは生理食塩水を注入されたマウスに比べ,ヒストンH2AXのリン酸化の量がおよそ2倍に増大しDNA損傷の蓄積が確認された.p53はゲノムの守護神(the Guardian of the Genome)とよばれており,その機能はDNAの維持に深くかかわっている.アドレナリン様カテコラミンの持続注入がDNA損傷の蓄積を起こす分子機構を調べるため,胸腺組織におけるp53の量を調べたところ生理食塩水を注入されたマウスと比較して半分近くにまで減少しており,p53の低下はDNA損傷の蓄積を誘導することが予想された.そこで,いくつかの細胞株を用いてそのシグナル伝達を解析したところ,β2アドレナリン受容体の持続刺激はβアレスチン1を介したPI3K-AKT経路を活性化し,ユビキチンリガーゼのひとつであるMDM2のリン酸化と活性化を誘導することがわかった.
2.βアレスチン1はp53とMDM2との結合を補助する
最近の研究により,βアレスチンはユビキチンリガーゼ複合体のアダプタータンパク質としてはたらくことがわかってきた8).ここで明らかになったMDM2の活性化はβアレスチン1を介したシグナル伝達であるため,βアレスチンがMDM2とp53との結合を補助するアダプタータンパク質としてはたらくかどうかを調べた.細胞質と核の両方に局在するβアレスチン1は,細胞質に局在するβアレスチン2に比べ,より多くのp53と結合することが免疫沈降実験において示された.さらに,in vitroにおいても精製したβアレスチン1とp53とは結合した.共焦点顕微鏡を用いた実験においてはβアレスチン1とp53は核において共局在していた.これらのデータはβアレスチン1が核においてp53とMDM2との結合を補助する役割をもつことを示唆しているのかもしれないと考え,βアレスチン1を強発現させたところp53とMDM2との結合は増大したが,核外移行シグナルを導入した変異βアレスチン1を強発現させるとその増大は失われた.
3.β2アドレナリン受容体の持続刺激のもとMDM2によるp53の低下をβアレスチン1が補助する
βアレスチン1によるp53とMDM2との結合の補助はアドレナリン様カテコラミンにより誘発されたp53の分解にかかわっているかどうか調べた.アドレナリン様カテコラミンの持続刺激のもと,野生型の線維芽細胞ではp53の分解が促進されるが,βアレスチン1を欠損した線維芽細胞ではp53の分解はみられなかった.さらに,p53のMDM2への結合,また,p53の分解を促すポリユビキチン化は,野生型の線維芽細胞ではアドレナリン様カテコラミンの持続刺激により増大していたが,βアレスチン1を欠損した線維芽細胞ではこれらの増大は確認されなかった.これは,アドレナリン様カテコラミンにより活性化されたMDM2によるp53の低下をβアレスチン1が補助していることを示唆していた.βアレスチン1ノックアウトマウスに4週間にわたりアドレナリン様カテコラミンを持続注入したところ,野生型マウスの胸腺組織においてみられたp53の低下やDNA損傷の蓄積は認められなかった.
4.β2アドレナリン受容体の持続刺激はβアレスチン1とp53に依存したDNA損傷の蓄積を促しゲノムの組換えに影響を及ぼす
p53の低下とDNA損傷との関連性をくわしく調べた.ヒトに由来するp53を欠損した細胞をアドレナリン様カテコラミンで持続的に刺激するとヒストンH2AXのリン酸化の増大が認められ,DNA損傷の発生それ自体はp53に依存していないことが示唆された.β2アドレナリン受容体のシグナル伝達におけるGsタンパク質を介したプロテインキナーゼAの活性は,DNA損傷をひき起こす活性酸素を産生することが知られている9).そこで,プロテインキナーゼA阻害剤を投与したのち,ヒトに由来するp53を欠損した細胞をアドレナリン様カテコラミンで持続的に刺激するとヒストンH2AXのリン酸化が減少し,さらにp53を再発現させるとヒストンH2AXのリン酸化はほぼ検出されなくなった.これは,β2アドレナリン受容体の持続的な刺激が,DNA損傷の引き金となるGsタンパク質-プロテインキナーゼA経路,および,βアレスチン1によるp53の低下という2つのシグナル伝達の同調をひき起こし,DNA損傷の蓄積を促すことを示していた.
つぎに,β2アドレナリン受容体の持続刺激によるDNA損傷の蓄積がゲノムに影響を及ぼしているかどうかを調べた.胸腺の細胞においてDNAに損傷が生じたとき,T細胞受容体γ遺伝子とT細胞受容体β遺伝子とのあいだで染色体間の組換えの起こることが知られている10).そこで,4週間にわたりアドレナリン様カテコラミンを持続注入した野生型マウスとβアレスチン1ノックアウトマウスについて胸腺の細胞を比較したところ,野生型マウスではこの組換えが認められたがβアレスチン1ノックアウトマウスでは認められなかった.これは,慢性的なストレス状況において生じるDNA損傷の蓄積がゲノムの組換えをひき起こす可能性のあることを示していた.
親のうけた慢性的なストレスがさらに子の遺伝子にまで影響する可能性があるかどうかを検討するため,父親のストレスホルモンの影響をうける精巣内の精子を用いた実験を行った.4週間にわたりアドレナリン様カテコラミンを持続注入した慢性ストレスモデルマウスを用い,野生型マウスとβアレスチン1ノックアウトマウスのゲノムを解析した.精巣で起こる減数分裂性の組換えを検出せずアドレナリン様カテコラミンの持続注入によるDNA損傷により生じたゲノムの組換えだけを検出するために胸腺も同時に解析し,2つの異なる臓器で生じたゲノムの組換えのうち一致しているものをDNA損傷により生じたゲノムの組換えであるとした.興味深いことに,野生型マウスの精巣では第4染色体においてDNA損傷によるゲノムの組換えが起こり,これはp53の低下と相関していたのに対し,βアレスチン1ノックアウトマウスではゲノムの組換えはみられなかった.これは,慢性的なストレスホルモンへの暴露が精子のゲノムに影響を及ぼすかもしれないことを示唆していた.
おわりに
ストレス反応は野生動物が自然界で生き残るための重要な反応である.ところが,文明が発達したゆえに起こるヒトの精神的なストレスとそれに対する反応は,何カ月あるいは何年も継続して起こりうるため身体にはマイナスの影響のあるものと考えられる.DNA損傷はそういった影響のひとつであると疫学的に示されていたが,その分子機構はわかっていなかった.今回の研究において,筆者らは,ストレス反応のひとつである攻撃逃避反応を担うアドレナリン様カテコラミンを持続的に暴露することにより,DNA損傷の蓄積することを示した.この分子機構として,持続的なアドレナリン様カテコラミンによる刺激はβ2アドレナリン受容体を介してβアレスチン1のシグナル伝達によりp53の低下をもたらし,p53の低下がさらにGsタンパク質が引き金となり起こるDNA損傷の蓄積を促進させることを明らかにした(図2).
今後は,グルココルチコイドなどほかのストレスホルモンも同様にDNAに影響を及ぼすか,また,その分子機構を解明することが課題である.今回の研究では,アドレナリン様カテコラミンの持続注入を慢性的ストレスのモデルとして用いたが,行動的なストレスを用いた実験でも同様な分子機構がはたらいているかどうかを解明することも課題である.
文 献
- Goldstein, D. S.: Catecholamines and stress. Endocr. Regul., 37, 69-80 (2003)[PubMed]
- Antoni, M. H., Lutgendorf, S. K., Cole, S. W. et al.: The influence of bio-behavioural factors on tumour biology: pathways and mechanisms. Nat. Rev. Cancer, 6, 240-248 (2006)[PubMed]
- Flint, M. S., Baum, A., Chambers, W. H. et al.: Induction of DNA damage, alteration of DNA repair and transcriptional activation by stress hormones. Psychoneuroendocrinology, 32, 470-479 (2007)[PubMed]
- DeWire, S. M., Ahn, S., Lefkowitz, R. J. et al.: β-arrestins and cell signaling. Annu. Rev. Physiol., 69, 483-510 (2007)[PubMed]
- Thaker, P. H., Han, L. Y., Kamat, A. A. et al.: Chronic stress promotes tumor growth and angiogenesis in a mouse model of ovarian carcinoma. Nat. Med., 12, 939-944 (2006)[PubMed]
- Ni, Y., Zhao, X., Bao, G. et al.: Activation of β2-adrenergic receptor stimulates gamma-secretase activity and accelerates amyloid plaque formation. Nature Med., 12, 1390-1396 (2006)[PubMed]
- Selye, H.: A syndrome produced by diverse nocuous agents. Nature, 138, 32 (1936)[PubMed]
- Kovacs, J. J., Hara, M. R., Davenport, C. L. et al.: Arrestin development: emerging roles for β-arrestins in developmental signaling pathways. Dev. Cell, 17, 443-458 (2009)[PubMed]
- Yan, L., Vatner, D. E., O'Connor, J. P. et al.: Type 5 adenylyl cyclase disruption increases longevity and protects against stress. Cell, 130, 247-258 (2007)[PubMed]
- Lista, F., Bertness, V., Guidos, C. J. et al.: The absolute number of trans-rearrangements between the TCRG and TCRB loci is predictive of lymphoma risk: a severe combined immune deficiency (SCID) murine model. Cancer Res., 57, 4408-4413 (1997)[PubMed]
著者プロフィール
略歴:2005年 米国Johns Hopkins大学School of Medicine博士課程 修了,2006年より米国Duke大学Medical Center博士研究員.
研究テーマ:7回膜貫通受容体とシグナル伝達.
関心事:DNA損傷と神経変性疾患とのかかわり.
© 2011 原 誠 Licensed under CC 表示 2.1 日本