慢性リンパ球性白血病において造血幹細胞が獲得した異常が腫瘍の発症および進展に関与する
菊繁吉謙・赤司浩一
(九州大学大学院医学研究院 病態修復内科学)
email:菊繁吉謙
DOI: 10.7875/first.author.2011.145
Self-renewing hematopoietic stem cell is the primary target in pathogenesis of human chronic lymphocytic leukemia.
Yoshikane Kikushige, Fumihiko Ishikawa, Toshihiro Miyamoto, Takahiro Shima, Shingo Urata, Goichi Yoshimoto, Yasuo Mori, Tadafumi Iino, Takuji Yamauchi, Tetsuya Eto, Hiroaki Niiro, Hiromi Iwasaki, Katsuto Takenaka, Koichi Akashi
Cancer Cell, 20, 246-259 (2011)
ヒトの造血幹細胞系において,造血幹細胞は自己複製能と多分化能をもち生涯にわたり造血器系の細胞を維持し供給しているが,造血幹細胞は種々の遺伝子異常の蓄積されうる細胞でもある.造血幹細胞のレベルで獲得される遺伝子異常は,骨髄系の造血器の悪性腫瘍において腫瘍化に直接的に関与していることが明らかになっている.その一方で,リンパ球系の造血器の悪性腫瘍においては造血幹細胞のレベルで獲得された遺伝子異常が腫瘍化に関与しているかどうかは検討されていなかった.今回,筆者らは,成熟B細胞性の腫瘍である慢性リンパ球性白血病において,造血幹細胞のレベルで獲得された異常が腫瘍の発症および進展に関与していることを異種移植の実験系を用いて見い出した.
ヒトの造血幹細胞系において,造血幹細胞は自己複製能と多分化能をもち一生涯にわたり造血器系の細胞を維持および供給している.すなわち,自己複製能をもつ造血幹細胞は長期間にわたり遺伝子異常の蓄積されうる環境にある.さらには,遺伝子異常を獲得した造血幹細胞は遺伝子異常をもったまま前駆細胞そして成熟細胞へと分化していくことが可能であり,これらの細胞にさらなる遺伝子異常が生じることで,最終的に造血器の腫瘍へと進展する可能性がある.腫瘍化の分子機構がもっともくわしく検討されている骨髄系の造血器の悪性腫瘍においては,種々の遺伝子異常が造血幹細胞のレベルで蓄積されていることが明らかになってきている.その一方で,リンパ球系の造血器の悪性腫瘍,とくに,成熟B細胞性の腫瘍における造血幹細胞の腫瘍化への関与についてはこれまで検討がなされていなかった.今回,筆者らは,成熟B細胞性の腫瘍である慢性リンパ球性白血病において,造血幹細胞のレベルで獲得された異常が腫瘍の進展に関与しているという知見を得た.
慢性リンパ球性白血病はCD5陽性CD19陽性という表面形質をもつ成熟B細胞性の腫瘍であり,欧米では約30%をしめる最多の白血病であるが,わが国を含めたアジア諸国では白血病のうち1~3%と少なく人種差が認められる.若年者にはまれで60歳以上の高齢者に好発する.形態学的には,小型の成熟した形態をもつB細胞がクローン性に増殖し末梢血,骨髄,リンパ節,脾臓などに浸潤する.慢性リンパ球性白血病と診断されるためには末梢血におけるクローン性リンパ球の数が5×109/リットル以上である必要があり,この基準を満たさないものはモノクローナルB細胞増加症とされる1).少数例(約1%)のモノクローナルB細胞増加症のみが慢性リンパ球性白血病へと移行し,大多数は移行することなく慢性に経過する.また,モノクローナルB細胞増加症を経由して進展する慢性リンパ球性白血病の症例の割合も不明であったため,モノクローナルB細胞増加症が慢性リンパ球性白血病の前白血病状態であるかどうかについて一定の見解は得られていなかった.
しかしながら近年,慢性リンパ球性白血病のほぼ全例はモノクローナルB細胞増加症という前白血病状態をへて進展することが大規模な前方視的な臨床研究により証明され2,3),慢性リンパ球性白血病の進展におけるモノクローナルB細胞増加症の位置づけが明確にされた.さらに,モノクローナルB細胞増加症のB細胞はモノクローナルなB細胞集団により構成されているのではなく,その多く(20~70%)でオリゴクローナルなB細胞集団により構成されることが明らかになってきた4).実際,慢性リンパ球性白血病においても2つ以上の独立したB細胞クローンの検出されることが報告されている5).慢性リンパ球性白血病およびその前白血病状態であるモノクローナルB細胞増加症において複数のB細胞クローンが同時に存在する事実から,少なくとも,免疫グロブリン遺伝子の再構成の生じる以前の未分化な細胞レベルにおいてクローナルなB細胞の増殖を可能にするような異常が獲得されている可能性が考えられたため,筆者らは,慢性リンパ球性白血病の症例の造血幹細胞および前駆細胞について詳細な解析を行った.
慢性リンパ球性白血病患者の骨髄について,CD34陽性細胞画分におけるCD34陽性CD38陰性Lin陰性の造血幹細胞,および,もっとも未分化なB細胞であるCD34陽性CD38陽性CD10陽性CD19陽性のプロB細胞の割合を検討した.健常成人の骨髄と比較して,患者の骨髄におけるCD34陽性CD38陰性の造血幹細胞の割合に明らかな差は認められなかった.興味深いことに,CD34陽性CD38陽性CD10陽性CD19陽性のプロB細胞は,健常人と比較し患者において有意に増加していた.PCR法による免疫グロブリン重鎖の再構成の解析から,健常人と同様に患者のCD34陽性CD38陰性Lin陰性の造血幹細胞には免疫グロブリン重鎖遺伝子の再構成は生じていなかった.また,健常人と比較して明らかに増加している患者のプロB細胞はポリクローナルなB細胞集団であった.すなわち,慢性リンパ球性白血病の患者では,骨髄におけるCD34陽性CD38陰性Lin陰性の造血幹細胞がより多数のポリクローナルなB細胞の前駆細胞を生じていた.このことから,慢性リンパ球性白血病では造血幹細胞のレベルにおいてB細胞系へのかたよったコミットメントを生じうるような遺伝子変化の起こっている可能性が示唆された.
免疫不全マウスへの異種移植において慢性リンパ球性白血病患者の細胞は生着の困難であることが知られていた.そこで,ヒトの造血系を高効率に再構築することが可能なNOD/SCID/γcnull(NSG)マウス6) およびNOD/RAG1null/γcnull(NRG)マウス7) への異種移植系を用いることで患者の細胞の生着が可能かどうか検討した.放射線を照射したレシピエントマウスに患者の末梢から得たCD5陽性CD19陽性の細胞を静脈をへて移植した.移植後24週を経過した時点でマウスの骨髄および脾臓を解析したが,すべての症例において患者の細胞の生着は認められなかった.つぎに,患者の骨髄のCD34陽性CD38陰性の造血幹細胞画分およびCD34陽性CD38陽性の前駆細胞画分を蛍光セルソーターにて純化しマウスに異種移植を行った.対照となる健常人の造血幹細胞の移植の結果と同じく,患者のCD34陽性CD38陰性の造血幹細胞を移植したマウスのみに生着を認めた.対照となる造血幹細胞を移植したマウスでは98%以上のB細胞がCD45陽性CD5陰性CD19陽性であった.マウスに再構築されたヒトB細胞において免疫グロブリン重鎖遺伝子の再構成を評価したところ,CD5の発現にかかわらずすべての例においてポリクローナルな細胞集団であった.しかしながら驚くべきことに,患者のCD34陽性CD38陰性の造血幹細胞を移植したマウスではCD5陽性CD19陽性の患者に類似した表現型を示すB細胞集団が出現しており,これらのCD5陽性のB細胞はクローナルな免疫グロブリン重鎖遺伝子の再構成を認めた.また,症例によってはCD5陰性CD19陽性のB細胞についてもクローナルなB細胞集団で構成される例も認められ,造血幹細胞からのB細胞の分化過程における異常が想定された.
免疫不全マウスに再構築されたクローナルなB細胞と慢性リンパ球性白血病患者のクローンとの関連性を検討した.PCR産物のクローニングにより免疫グロブリン重鎖遺伝子の再構成における塩基配列およびアミノ酸配列を決定しすべてのB細胞クローンを確定した.その結果,マウスに出現したB細胞クローンと患者のB細胞クローンはすべての症例において異なっていた.同一の症例のCD34陽性CD38陰性の造血幹細胞を同時に3匹のマウスに移植した場合においても,それぞれのマウスにおいてまったく異なるモノクローナルあるいはオリゴクローナルなB細胞が出現した.したがって,免疫グロブリン重鎖遺伝子の再構成の生じていないCD34陽性CD38陰性の造血幹細胞が,マウスにおいてB細胞の分化の過程で新規に免疫グロブリン重鎖遺伝子の再構成を起こし,その結果として生じたB細胞が成熟B細胞の分化段階でクローナルな異常増殖をしているものと考えられた.これらの結果から,造血幹細胞のレベルで獲得されたなんらかの遺伝子異常がマウスにおけるモノクローナルあるいはオリゴクローナルなB細胞の出現の原因であることが示唆された.
異種移植の実験およびクローンの詳細な解析結果から,クローナルなB細胞の増殖が可能となるような遺伝子異常は造血幹細胞において獲得されているが,実際にクローナルなB細胞の増殖が生じるのは免疫グロブリン重鎖遺伝子の再構成をおえて機能的なB細胞受容体を細胞の表面に発現する成熟B細胞に分化した段階であると考えられた.そこで,免疫グロブリン重鎖遺伝子の再構成の解析とは異なる方法でクローン性を証明するため,染色体異常をもつ慢性リンパ球性白血病の症例を解析した.蛍光in situハイブリダイゼーション法にて慢性リンパ球性白血病において高頻度に認められる染色体異常を探索し,そのB細胞に検出される染色体異常がB細胞以外の血球系統および造血幹細胞に認められるかどうか検討した.4つの症例において,慢性リンパ球性白血病のB細胞で検出される染色体異常はCD34陽性CD38陰性の造血幹細胞,CD33陽性の骨髄系細胞,CD3陽性のT細胞では検出されなかった.しかしながら,これらの染色体異常を検出しないCD34陽性CD38陰性の造血幹細胞を免疫不全マウスに移植すると,その骨髄にはクローナルなB細胞が出現し,再構築されたヒトの細胞には染色体異常は検出されなかった.したがってこれらの結果から,慢性リンパ球性白血病に代表的な染色体異常は造血幹細胞からの異常なB細胞の分化に必須ではなく,患者におけるクローナルな進化の過程で獲得されることが示唆された.慢性リンパ球性白血病における前方視的な臨床研究においても,診断のときには検出されなかった染色体異常が5年以上の観察期間において新規に獲得される症例が27%にのぼることが報告されており8),これとは矛盾しない結果であるものと考えられた.
慢性リンパ球性白血病患者の造血幹細胞の遺伝子プロファイリングを定量PCR法にて検討したところ,IKZF1,TCF3,IRF8などの初期のリンパ球系の転写因子,とくにB細胞系への分化に重要な転写因子が高発現していることが判明した.つぎに,1細胞定量PCR法によりこれらのリンパ球系の転写因子を発現する細胞集団がCD34陽性CD38陰性画分に存在する頻度を検討した.患者のCD34陽性CD38陰性の造血幹細胞ではすでに約50~60%の細胞がリンパ球系の転写因子を発現していた.一方で,健常人のCD34陽性CD38陰性の造血幹細胞において同様の遺伝子発現プロファイリングを示す細胞は約15~20%であった.これらの結果から,慢性リンパ球性白血病患者の造血幹細胞ではリンパ球系へのなんらかのかたよったコミットメントを生じるような遺伝子変化の生じている可能性が示唆された.
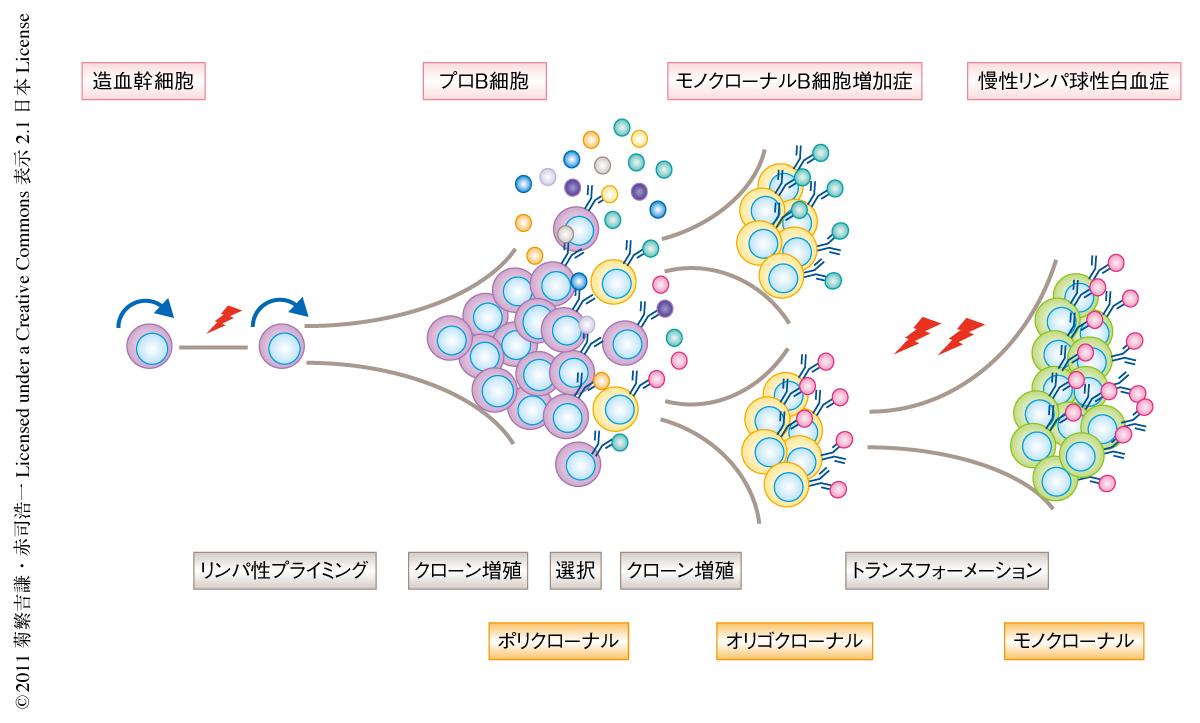
慢性リンパ球性白血病の発症と進展に関する仮説を示す(図1).慢性リンパ球性白血病患者の造血幹細胞においては腫瘍化にかかわる最初の遺伝子異常が獲得されているが,このような遺伝子異常が単独では慢性リンパ球性白血病へと直接には進展しない.しかしながら,遺伝子異常を獲得した造血幹細胞から分化したB細胞では,B細胞受容体を介する抗原刺激の生じる成熟B細胞の段階で異常なクローナルな進化が生じる.慢性リンパ球性白血病患者の造血幹細胞を移植したマウスで再構築された病態は,異常なモノクローナルあるいはオリゴクローナルなB細胞の増殖であり,慢性リンパ球性白血病そのものではなくその前白血病状態であるモノクローナルB細胞増加症様の病態であると考えられる.そして,この前白血病状態の異常なB細胞クローンに付加的な遺伝子異常が起こり,最終的に生存および増殖に有利な遺伝子変異を獲得したB細胞クローンにクローナルな進化が生じ,臨床的に慢性リンパ球性白血病へと進展するものと想定された.
今回の実験結果から,成熟B細胞性の腫瘍である慢性リンパ球性白血病においても,そのほかの造血器の腫瘍と同様に,造血幹細胞のレベルで生じた遺伝子異常が発症に関与している可能性が示唆された.
略歴:2009年 九州大学大学院医学系学府博士課程 修了,同年 九州大学病院 医員を経て,2011年より同 助教.
研究テーマ:ヒトの正常および悪性の造血幹細胞.
抱負:分子生物学的な手法を用いたヒトの造血器の疾患,とくに,白血病幹細胞の解析により,白血病の発症機構を明らかにし,造血器の悪性腫瘍の克服をめざす.
赤司 浩一(Koichi Akashi)
九州大学大学院医学研究院 教授.
研究室URL:http://www.med.kyushu-u.ac.jp/intmed1/
© 2011 菊繁吉謙・赤司浩一 Licensed under CC 表示 2.1 日本
(九州大学大学院医学研究院 病態修復内科学)
email:菊繁吉謙
DOI: 10.7875/first.author.2011.145
Self-renewing hematopoietic stem cell is the primary target in pathogenesis of human chronic lymphocytic leukemia.
Yoshikane Kikushige, Fumihiko Ishikawa, Toshihiro Miyamoto, Takahiro Shima, Shingo Urata, Goichi Yoshimoto, Yasuo Mori, Tadafumi Iino, Takuji Yamauchi, Tetsuya Eto, Hiroaki Niiro, Hiromi Iwasaki, Katsuto Takenaka, Koichi Akashi
Cancer Cell, 20, 246-259 (2011)
要 約
ヒトの造血幹細胞系において,造血幹細胞は自己複製能と多分化能をもち生涯にわたり造血器系の細胞を維持し供給しているが,造血幹細胞は種々の遺伝子異常の蓄積されうる細胞でもある.造血幹細胞のレベルで獲得される遺伝子異常は,骨髄系の造血器の悪性腫瘍において腫瘍化に直接的に関与していることが明らかになっている.その一方で,リンパ球系の造血器の悪性腫瘍においては造血幹細胞のレベルで獲得された遺伝子異常が腫瘍化に関与しているかどうかは検討されていなかった.今回,筆者らは,成熟B細胞性の腫瘍である慢性リンパ球性白血病において,造血幹細胞のレベルで獲得された異常が腫瘍の発症および進展に関与していることを異種移植の実験系を用いて見い出した.
はじめに
ヒトの造血幹細胞系において,造血幹細胞は自己複製能と多分化能をもち一生涯にわたり造血器系の細胞を維持および供給している.すなわち,自己複製能をもつ造血幹細胞は長期間にわたり遺伝子異常の蓄積されうる環境にある.さらには,遺伝子異常を獲得した造血幹細胞は遺伝子異常をもったまま前駆細胞そして成熟細胞へと分化していくことが可能であり,これらの細胞にさらなる遺伝子異常が生じることで,最終的に造血器の腫瘍へと進展する可能性がある.腫瘍化の分子機構がもっともくわしく検討されている骨髄系の造血器の悪性腫瘍においては,種々の遺伝子異常が造血幹細胞のレベルで蓄積されていることが明らかになってきている.その一方で,リンパ球系の造血器の悪性腫瘍,とくに,成熟B細胞性の腫瘍における造血幹細胞の腫瘍化への関与についてはこれまで検討がなされていなかった.今回,筆者らは,成熟B細胞性の腫瘍である慢性リンパ球性白血病において,造血幹細胞のレベルで獲得された異常が腫瘍の進展に関与しているという知見を得た.
1.慢性リンパ球性白血病の臨床像
慢性リンパ球性白血病はCD5陽性CD19陽性という表面形質をもつ成熟B細胞性の腫瘍であり,欧米では約30%をしめる最多の白血病であるが,わが国を含めたアジア諸国では白血病のうち1~3%と少なく人種差が認められる.若年者にはまれで60歳以上の高齢者に好発する.形態学的には,小型の成熟した形態をもつB細胞がクローン性に増殖し末梢血,骨髄,リンパ節,脾臓などに浸潤する.慢性リンパ球性白血病と診断されるためには末梢血におけるクローン性リンパ球の数が5×109/リットル以上である必要があり,この基準を満たさないものはモノクローナルB細胞増加症とされる1).少数例(約1%)のモノクローナルB細胞増加症のみが慢性リンパ球性白血病へと移行し,大多数は移行することなく慢性に経過する.また,モノクローナルB細胞増加症を経由して進展する慢性リンパ球性白血病の症例の割合も不明であったため,モノクローナルB細胞増加症が慢性リンパ球性白血病の前白血病状態であるかどうかについて一定の見解は得られていなかった.
しかしながら近年,慢性リンパ球性白血病のほぼ全例はモノクローナルB細胞増加症という前白血病状態をへて進展することが大規模な前方視的な臨床研究により証明され2,3),慢性リンパ球性白血病の進展におけるモノクローナルB細胞増加症の位置づけが明確にされた.さらに,モノクローナルB細胞増加症のB細胞はモノクローナルなB細胞集団により構成されているのではなく,その多く(20~70%)でオリゴクローナルなB細胞集団により構成されることが明らかになってきた4).実際,慢性リンパ球性白血病においても2つ以上の独立したB細胞クローンの検出されることが報告されている5).慢性リンパ球性白血病およびその前白血病状態であるモノクローナルB細胞増加症において複数のB細胞クローンが同時に存在する事実から,少なくとも,免疫グロブリン遺伝子の再構成の生じる以前の未分化な細胞レベルにおいてクローナルなB細胞の増殖を可能にするような異常が獲得されている可能性が考えられたため,筆者らは,慢性リンパ球性白血病の症例の造血幹細胞および前駆細胞について詳細な解析を行った.
2.慢性リンパ球性白血病患者の造血幹細胞および前駆細胞の解析
慢性リンパ球性白血病患者の骨髄について,CD34陽性細胞画分におけるCD34陽性CD38陰性Lin陰性の造血幹細胞,および,もっとも未分化なB細胞であるCD34陽性CD38陽性CD10陽性CD19陽性のプロB細胞の割合を検討した.健常成人の骨髄と比較して,患者の骨髄におけるCD34陽性CD38陰性の造血幹細胞の割合に明らかな差は認められなかった.興味深いことに,CD34陽性CD38陽性CD10陽性CD19陽性のプロB細胞は,健常人と比較し患者において有意に増加していた.PCR法による免疫グロブリン重鎖の再構成の解析から,健常人と同様に患者のCD34陽性CD38陰性Lin陰性の造血幹細胞には免疫グロブリン重鎖遺伝子の再構成は生じていなかった.また,健常人と比較して明らかに増加している患者のプロB細胞はポリクローナルなB細胞集団であった.すなわち,慢性リンパ球性白血病の患者では,骨髄におけるCD34陽性CD38陰性Lin陰性の造血幹細胞がより多数のポリクローナルなB細胞の前駆細胞を生じていた.このことから,慢性リンパ球性白血病では造血幹細胞のレベルにおいてB細胞系へのかたよったコミットメントを生じうるような遺伝子変化の起こっている可能性が示唆された.
3.慢性リンパ球性白血病患者の造血幹細胞は免疫不全マウスにおいてクローナルなB細胞を再構築する
免疫不全マウスへの異種移植において慢性リンパ球性白血病患者の細胞は生着の困難であることが知られていた.そこで,ヒトの造血系を高効率に再構築することが可能なNOD/SCID/γcnull(NSG)マウス6) およびNOD/RAG1null/γcnull(NRG)マウス7) への異種移植系を用いることで患者の細胞の生着が可能かどうか検討した.放射線を照射したレシピエントマウスに患者の末梢から得たCD5陽性CD19陽性の細胞を静脈をへて移植した.移植後24週を経過した時点でマウスの骨髄および脾臓を解析したが,すべての症例において患者の細胞の生着は認められなかった.つぎに,患者の骨髄のCD34陽性CD38陰性の造血幹細胞画分およびCD34陽性CD38陽性の前駆細胞画分を蛍光セルソーターにて純化しマウスに異種移植を行った.対照となる健常人の造血幹細胞の移植の結果と同じく,患者のCD34陽性CD38陰性の造血幹細胞を移植したマウスのみに生着を認めた.対照となる造血幹細胞を移植したマウスでは98%以上のB細胞がCD45陽性CD5陰性CD19陽性であった.マウスに再構築されたヒトB細胞において免疫グロブリン重鎖遺伝子の再構成を評価したところ,CD5の発現にかかわらずすべての例においてポリクローナルな細胞集団であった.しかしながら驚くべきことに,患者のCD34陽性CD38陰性の造血幹細胞を移植したマウスではCD5陽性CD19陽性の患者に類似した表現型を示すB細胞集団が出現しており,これらのCD5陽性のB細胞はクローナルな免疫グロブリン重鎖遺伝子の再構成を認めた.また,症例によってはCD5陰性CD19陽性のB細胞についてもクローナルなB細胞集団で構成される例も認められ,造血幹細胞からのB細胞の分化過程における異常が想定された.
4.免疫不全マウスに再構築されたクローナルなB細胞と慢性リンパ球性白血病のB細胞とは異なるクローンである
免疫不全マウスに再構築されたクローナルなB細胞と慢性リンパ球性白血病患者のクローンとの関連性を検討した.PCR産物のクローニングにより免疫グロブリン重鎖遺伝子の再構成における塩基配列およびアミノ酸配列を決定しすべてのB細胞クローンを確定した.その結果,マウスに出現したB細胞クローンと患者のB細胞クローンはすべての症例において異なっていた.同一の症例のCD34陽性CD38陰性の造血幹細胞を同時に3匹のマウスに移植した場合においても,それぞれのマウスにおいてまったく異なるモノクローナルあるいはオリゴクローナルなB細胞が出現した.したがって,免疫グロブリン重鎖遺伝子の再構成の生じていないCD34陽性CD38陰性の造血幹細胞が,マウスにおいてB細胞の分化の過程で新規に免疫グロブリン重鎖遺伝子の再構成を起こし,その結果として生じたB細胞が成熟B細胞の分化段階でクローナルな異常増殖をしているものと考えられた.これらの結果から,造血幹細胞のレベルで獲得されたなんらかの遺伝子異常がマウスにおけるモノクローナルあるいはオリゴクローナルなB細胞の出現の原因であることが示唆された.
5.慢性リンパ球性白血病に代表的な染色体異常はクローナルなB細胞の出現に必須ではない
異種移植の実験およびクローンの詳細な解析結果から,クローナルなB細胞の増殖が可能となるような遺伝子異常は造血幹細胞において獲得されているが,実際にクローナルなB細胞の増殖が生じるのは免疫グロブリン重鎖遺伝子の再構成をおえて機能的なB細胞受容体を細胞の表面に発現する成熟B細胞に分化した段階であると考えられた.そこで,免疫グロブリン重鎖遺伝子の再構成の解析とは異なる方法でクローン性を証明するため,染色体異常をもつ慢性リンパ球性白血病の症例を解析した.蛍光in situハイブリダイゼーション法にて慢性リンパ球性白血病において高頻度に認められる染色体異常を探索し,そのB細胞に検出される染色体異常がB細胞以外の血球系統および造血幹細胞に認められるかどうか検討した.4つの症例において,慢性リンパ球性白血病のB細胞で検出される染色体異常はCD34陽性CD38陰性の造血幹細胞,CD33陽性の骨髄系細胞,CD3陽性のT細胞では検出されなかった.しかしながら,これらの染色体異常を検出しないCD34陽性CD38陰性の造血幹細胞を免疫不全マウスに移植すると,その骨髄にはクローナルなB細胞が出現し,再構築されたヒトの細胞には染色体異常は検出されなかった.したがってこれらの結果から,慢性リンパ球性白血病に代表的な染色体異常は造血幹細胞からの異常なB細胞の分化に必須ではなく,患者におけるクローナルな進化の過程で獲得されることが示唆された.慢性リンパ球性白血病における前方視的な臨床研究においても,診断のときには検出されなかった染色体異常が5年以上の観察期間において新規に獲得される症例が27%にのぼることが報告されており8),これとは矛盾しない結果であるものと考えられた.
6.慢性リンパ球性白血病患者の造血幹細胞はリンパ球系の初期の転写因子をすでに高発現している
慢性リンパ球性白血病患者の造血幹細胞の遺伝子プロファイリングを定量PCR法にて検討したところ,IKZF1,TCF3,IRF8などの初期のリンパ球系の転写因子,とくにB細胞系への分化に重要な転写因子が高発現していることが判明した.つぎに,1細胞定量PCR法によりこれらのリンパ球系の転写因子を発現する細胞集団がCD34陽性CD38陰性画分に存在する頻度を検討した.患者のCD34陽性CD38陰性の造血幹細胞ではすでに約50~60%の細胞がリンパ球系の転写因子を発現していた.一方で,健常人のCD34陽性CD38陰性の造血幹細胞において同様の遺伝子発現プロファイリングを示す細胞は約15~20%であった.これらの結果から,慢性リンパ球性白血病患者の造血幹細胞ではリンパ球系へのなんらかのかたよったコミットメントを生じるような遺伝子変化の生じている可能性が示唆された.
おわりに
慢性リンパ球性白血病の発症と進展に関する仮説を示す(図1).慢性リンパ球性白血病患者の造血幹細胞においては腫瘍化にかかわる最初の遺伝子異常が獲得されているが,このような遺伝子異常が単独では慢性リンパ球性白血病へと直接には進展しない.しかしながら,遺伝子異常を獲得した造血幹細胞から分化したB細胞では,B細胞受容体を介する抗原刺激の生じる成熟B細胞の段階で異常なクローナルな進化が生じる.慢性リンパ球性白血病患者の造血幹細胞を移植したマウスで再構築された病態は,異常なモノクローナルあるいはオリゴクローナルなB細胞の増殖であり,慢性リンパ球性白血病そのものではなくその前白血病状態であるモノクローナルB細胞増加症様の病態であると考えられる.そして,この前白血病状態の異常なB細胞クローンに付加的な遺伝子異常が起こり,最終的に生存および増殖に有利な遺伝子変異を獲得したB細胞クローンにクローナルな進化が生じ,臨床的に慢性リンパ球性白血病へと進展するものと想定された.
今回の実験結果から,成熟B細胞性の腫瘍である慢性リンパ球性白血病においても,そのほかの造血器の腫瘍と同様に,造血幹細胞のレベルで生じた遺伝子異常が発症に関与している可能性が示唆された.
文 献
- Marti, G. E., Rawstron, A. C., Ghia, P. et al.: Diagnostic criteria for monoclonal B-cell lymphocytosis. Br. J. Haematol., 130, 325-332 (2005)[PubMed]
- Rawstron, A. C., Bennett, F. L., O'Connor, S. J. et al.: Monoclonal B-cell lymphocytosis and chronic lymphocytic leukemia. N. Engl. J. Med., 359, 575-583 (2008)[PubMed]
- Landgren, O., Albitar, M., Ma, W. et al.: B-cell clones as early markers for chronic lymphocytic leukemia. N. Engl. J. Med., 360, 659-667 (2009)[PubMed]
- Lanasa, M. C., Allgood, S. D., Volkheimer, A. D. et al.: Single-cell analysis reveals oligoclonality among 'low-count' monoclonal B-cell lymphocytosis. Leukemia, 24, 133-140 (2010)[PubMed]
- Sanchez, M. L., Almeida, J., Gonzalez, D. et al.: Incidence and clinicobiologic characteristics of leukemic B-cell chronic lymphoproliferative disorders with more than one B-cell clone. Blood, 102, 2994-3002 (2003)[PubMed]
- Ishikawa, F., Yasukawa, M., Lyons, B. et al.: Development of functional human blood and immune systems in NOD/SCID/IL2 receptor γ chainnull mice. Blood, 106, 1565-1573 (2005)[PubMed]
- Pearson, T., Shultz, L. D., Miller, D. et al. .: Non-obese diabetic-recombination activating gene-1 (NOD-Rag1null) interleukin (IL)-2 receptor common gamma chain (IL2rγnull) null mice: a radioresistant model for human lymphohaematopoietic engraftment. Clin. Exp. Immunol., 154, 270-284 (2008)[PubMed]
- Shanafelt, T. D., Witzig, T E., Fink, S. R. et al.: Prospective evaluation of clonal evolution during long-term follow-up of patients with untreated early-stage chronic lymphocytic leukemia. J. Clin. Oncol., 24, 4634-4641 (2006)[PubMed]
著者プロフィール
略歴:2009年 九州大学大学院医学系学府博士課程 修了,同年 九州大学病院 医員を経て,2011年より同 助教.
研究テーマ:ヒトの正常および悪性の造血幹細胞.
抱負:分子生物学的な手法を用いたヒトの造血器の疾患,とくに,白血病幹細胞の解析により,白血病の発症機構を明らかにし,造血器の悪性腫瘍の克服をめざす.
赤司 浩一(Koichi Akashi)
九州大学大学院医学研究院 教授.
研究室URL:http://www.med.kyushu-u.ac.jp/intmed1/
© 2011 菊繁吉謙・赤司浩一 Licensed under CC 表示 2.1 日本