出芽酵母では選択的なオートファジーによりTy1トランスポゾンの転移が制御されている
鈴木 邦律
(東京工業大学フロンティア研究機構)
email:鈴木邦律
DOI: 10.7875/first.author.2011.143
Selective autophagy regulates insertional mutagenesis by the Ty1 retrotransposon in Saccharomyces cerevisiae.
Kuninori Suzuki, Mayumi Morimoto, Chika Kondo, Yoshinori Ohsumi
Developmental Cell, 21, 358-365 (2011)
真核生物の細胞は栄養飢餓にさらされるとオートファジーとよばれる系を誘導し,自らの細胞質の成分を大規模に分解して再利用することにより環境に適応しようとする.オートファジー系は真核生物において普遍的に保存されており,不要な細胞質の成分やオルガネラを分解することにより細胞の恒常性を維持するためにも役立っている.一方,Ty1/copiaスーパーファミリーに属するTy1トランスポゾンは出芽酵母Saccharomyces cerevisiaeにおいてもっとも多く存在するレトロトランスポゾンである.Ty1トランスポゾンは生活環のなかで宿主の細胞質にTy1ウイルス様粒子を形成して宿主のゲノムに挿入変異を導入する.この論文では,栄養飢餓にさらされたときオートファジー系がTy1ウイルス様粒子を選択的に細胞質から除去することによりTy1トランスポゾンの転移を抑制していることを示した.また,Ty1ウイルス様粒子の選択的オートファジーには受容体であるAtg19が必要であった.選択的オートファジーはトランスポゾンによる過剰な挿入変異からゲノムを守るシステムとしての一面をもつことが明らかになった.
トランスポゾンは細胞内でゲノムでの位置を転移することのできる“動く遺伝子”である.近年のゲノムプロジェクトの進展により,トランスポゾンは真核生物のゲノムにおいてかなりの割合をしめていることが明らかになってきた.たとえば,ヒトゲノムのほぼ半分,高等植物においてはゲノムの70%以上がトランスポゾンに由来する配列によりしめられている.トランスポゾンはそれ自体が宿主のゲノムを動きまわる特性をもつことから,宿主の遺伝子発現を変化させたりゲノムを組み換えたりすることで生物の環境適応や進化に大きく貢献してきたものと考えられている.出芽酵母Saccharomyces cerevisiaeにおいてもっとも多く存在するトランスポゾンはTy1トランスポゾンである.Ty1トランスポゾンはレトロトランスポゾンとよばれるグループに属しており,自らをRNAに転写したのち,DNAに逆転写して転移する.Ty1トランスポゾンの生活環は感染性のないことを除いてはヒト免疫不全ウイルスなどのレトロウイルスと類似していることから,レトロトランスポゾンの生活環を研究する際のモデル系として使用されることも多い.
ゲノムに組み込まれたTy1トランスポゾンの遺伝子からは2種類のタンパク質がつくられる.それらの機能と分子量から,ひとつはTy1 Gag-p49,もうひとつはTy1 Gag-Pol-p199と名づけられている1).Ty1 Gag-p49は翻訳ののちプロテアーゼによりC末端の切断をうけて成熟型のTy1 Gag-p45となりTy1ウイルス様粒子を形成する.RNAからなるTy1トランスポゾンのゲノムはTy1ウイルス様粒子の内部で逆転写される.Ty1ウイルス様粒子は細胞質に集合体を形成することが知られている2).
オートファジーは自食作用ともいわれ,真核生物の細胞が栄養飢餓に応答して細胞質の成分を分解コンパートメントである液胞あるいはリソソームにおいて大規模に分解する系である3).オートファジーにより生じた分解産物は細胞質にもどされ,栄養飢餓環境に適応するための生合成の材料となる.出芽酵母においては,液胞酵素アミノペプチダーゼI(Ape1)がオートファジーにより液胞へと選択的に輸送されることが知られている.アミノペプチダーゼIは前駆型として生合成され,液胞に輸送されたのち成熟型となる.前駆型アミノペプチダーゼIは生合成ののち自己集合してApe1複合体とよばれる集合体を形成し液胞の近傍に局在する4,5).電子顕微鏡による観察からApe1複合体はその周辺に粒子状の構造物をともなうことが示されたことから,Ape1複合体とこの粒子状の構造物とをまとめCvt複合体(Cvt:cytoplasm-to-vacuole targeting)と定義された6).Cvt複合体は富栄養条件においてはCvt小胞により,栄養飢餓条件においてはオートファゴソームにより,液胞へと輸送される.Cvt小胞が成熟型アミノペプチダーゼIの生成に関与しているのに対し,オートファゴソームの内容物は液胞において分解される運命にある.
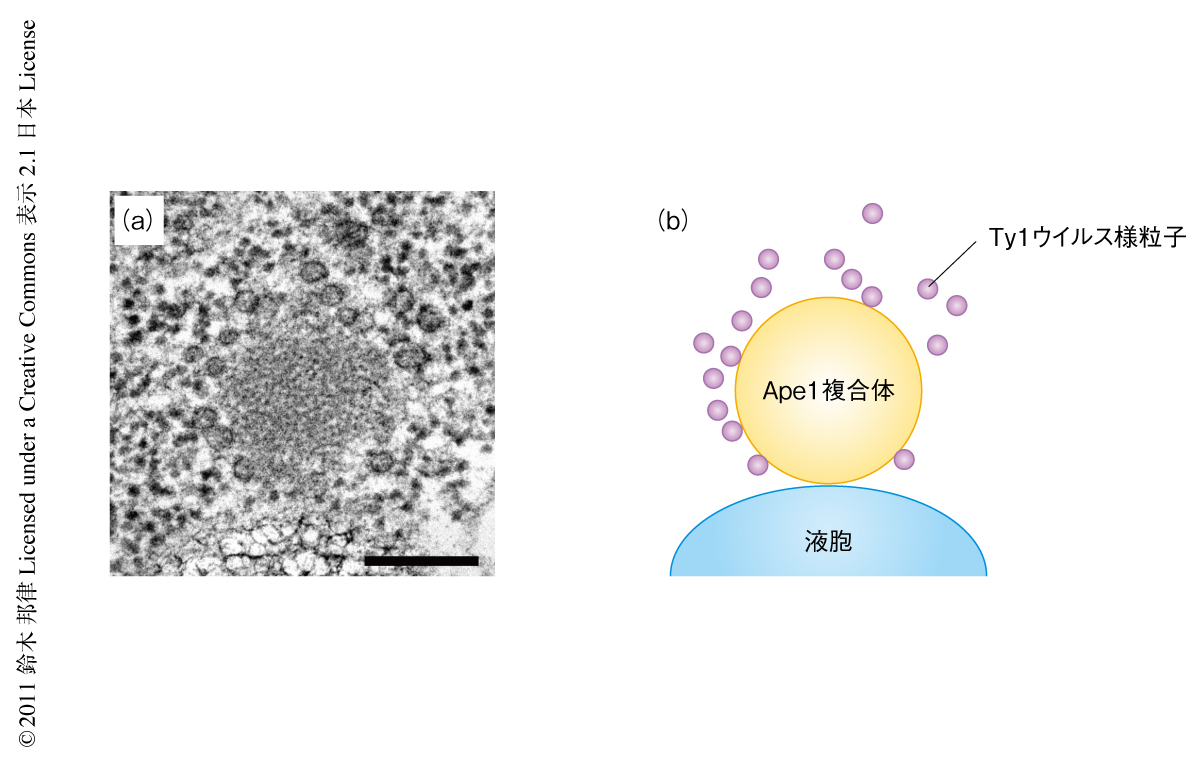
これまで,Ape1複合体もTy1ウイルス様粒子も細胞内の1箇所に局在することは知られていたが4,5,7),Ape1複合体をとりまく粒子状の構造物に関してはその正体すら不明であった.電子顕微鏡による観察ではApe1複合体の周辺の粒子状の構造物はTy1ウイルス様粒子に類似していることから,抗Ty1 Gag抗体を用いた免疫染色を試みた.すると,期待したとおり,Ape1複合体の周辺の粒子状の構造物は抗Ty1 Gag抗体により標識された.つづいて,蛍光顕微鏡による観察を試みた.GFP-Ty1 Gag-p45融合タンパク質を発現することによりTy1ウイルス様粒子を可視化したところ,Ape1複合体にきわめて近接して局在していることがわかった.これらの細胞を電子顕微鏡で観察すると,Ty1ウイルス様粒子はApe1複合体の近傍に局在する構造体であることが明確になった(図1).
オートファジーを誘導するとGFP-Ty1 Gag-p45融合タンパク質を発現する細胞では液胞の内部がGFPの蛍光で標識された.これは,GFP-Ty1 Gag-p45融合タンパク質がオートファジーにより液胞へと運ばれていることを示唆していた.そこで,このGFP-Ty1 Gag-p45融合タンパク質の液胞への輸送を生化学的に解析した.GFP-Ty1 Gag-p45融合タンパク質は液胞に運ばれたのち分解されるが,GFPは液胞内でも比較的安定なことから,GFP-Ty1 Gag-p45融合タンパク質から切り離されたGFPを抗GFP抗体によるウェスタンブロットにより検出することでオートファジー活性を見積ることができた.オートファジーを誘導すると野生株においては遊離のGFPが検出されるが,オートファゴソームの形成不能株においてはこれがみられないことから,GFP-Ty1 Gag-p45融合タンパク質はオートファジーにより液胞へと輸送されていることが示された.
つづいて,Ty1ウイルス様粒子がオートファゴソームの内部に選択的に積み込まれているかどうかをプロテアーゼK保護アッセイ法により調べた.ypt7破壊株ではオートファゴソームは液胞と融合できないため細胞質に蓄積する.これらの細胞を破砕しプロテアーゼKで処理すると,オートファゴソームに積み込まれている前駆型アミノペプチダーゼIやTy1ウイルス様粒子は分解されないが,これらがオートファゴソームの外部に存在する場合にはプロテアーゼKにさらされることにより分解をうける.実験の結果,野生株では約半量の前駆型アミノペプチダーゼIがオートファゴソームに積み込まれていた.また,Ty1ウイルス様粒子は90%以上がオートファゴソームに積み込まれていたことから,Ty1ウイルス様粒子が前駆型アミノペプチダーゼIよりも効率よくオートファゴソームの内部に取り込まれていることが示唆された.
つぎに,Ty1ウイルス様粒子がオートファゴソームに選択的に積み込まれる分子機構について調べた.Atg11とAtg19は前駆型アミノペプチダーゼIを選択的にオートファゴソームに積み込むため必要なタンパク質である.Ty1ウイルス様粒子の輸送をGFP-Ty1 Gag-p45融合タンパク質の切断により見積ると,atg11破壊株とatg19破壊株においてTy1ウイルス様粒子の輸送能は低下していた.また,これらの株ではTy1ウイルス様粒子のオートファゴソームへの積み込みの効率も低下していたことから,Ty1ウイルス様粒子を選択的にオートファゴソームに積み込むためにはAtg11とAtg19が必要であることが明らかになった.
蛍光顕微鏡を用いてTy1ウイルス様粒子とApe1複合体の局在を観察したところ,野生株においては,GFP-Ty1 Gag-p45融合タンパク質の輝点とApe1複合体の輝点はほとんどすべてが共局在していた(94.9%).しかし,atg19破壊株では両者の輝点はほとんど共局在していなかった(13.5%).Atg19はTy1ウイルス様粒子とApe1複合体との共局在に必要だと考えられた.
Atg19は前駆型アミノペプチダーゼIなどの積荷に結合するドメインと,Atgタンパク質に結合するドメインとをもつことから,オートファゴソームの選択的なカーゴの受容体であると考えられている.Atg19は既知のカーゴの輸送にかかわっていない機能未知なドメインをN末端にもつことから,このドメインを欠いたAtg19を作製してTy1ウイルス様粒子の輸送を調べた.N末端ドメインを欠損したAtg19を発現した細胞では前駆型アミノペプチダーゼIは正常に輸送されていたが,Ty1ウイルス様粒子の輸送能は低下していた.この細胞ではTy1ウイルス様粒子のオートファゴソームへの積み込みにも異常がみられた.これらの結果から,Atg19のN末端の領域はTy1ウイルス様粒子の選択的オートファジーに必須であることがわかった(図2).
Ty1トランスポゾンの転移に必須なTy1ウイルス様粒子が選択的オートファジーによる分解をうけることから,Ty1トランスポゾンの転移が選択的オートファジーの有無により影響される可能性を考えた.富栄養条件におけるTy1トランスポゾンの転移率をTy1his3-AI移動性アッセイ8) により定量化したところ,野生株,オートファゴソームの形成不能なatg1破壊株,選択的オートファジーの不能なatg19破壊株とのあいだで有意な差はなかった.つづいて,栄養飢餓条件でのTy1トランスポゾンの転移率を3日間にわたって調べた.野生株では期間をつうじて転移率はほぼ一定だったのに対し,atg1破壊株やatg19破壊株では転移率が継続して上昇しつづけた.これらの結果から,栄養飢餓にさらされた出芽酵母ではTy1トランスポゾンの転移がAtg19に依存的な選択的オートファジーにより抑制されていることが示された.
トランスポゾンは真核生物と原核生物とをとわずあらゆる生物のゲノムに組み込まれており,多種多様な遺伝子のプールをつくりだすことにより生物がさまざまな環境に適応するのに役立っていると考えられている.一方,トランスポゾンは宿主のゲノムに不利益な変異をもたらすこともありうることから,諸刃の剣でもある.この論文により,Ty1トランスポゾンの転移が選択的オートファジーにより抑制され,出芽酵母のゲノムが過剰な変異にさらされることを防いでいることが示された.
高等真核生物ではp62が選択的オートファジーの受容体として機能している.最近の研究では,p62はシンドビスウイルスのウイルス粒子と相互作用してこれを分解に導いていることが示されている9).Ty1ウイルス様粒子の選択的な分解は高等真核生物において細胞質に存在するウイルス粒子を除去する分子機構を調べるうえでのモデル系となりうるだろう.
選択的オートファジーによりトランスポゾンの転移が制御されていることから,選択的オートファジーは真核生物においてゲノムの安定性に寄与していると推測される.たとえば,哺乳動物ではオートファジーの破綻が腫瘍の形成につながることが知られているが,その直接的な原因は明らかになっていなかった10).筆者らの今回の結果から,その原因のひとつがトランスポゾンによるゲノムの不安定化である可能性が考えられる.
この論文は選択的オートファジーが真核生物のゲノムを安定化するという基礎的な知見をもたらしただけではなく,オートファジーによるトランスポゾンの活性制御が腫瘍の形成と関連する可能性を提示したという点で医学的にも大きな意義をもつ.今後の哺乳動物における解析が待たれる.
略歴:2002年 総合研究大学院大学生命科学研究科博士課程 修了,同年 基礎生物学研究所 研究員,2003年 同 助手を経て,2009年より東京工業大学フロンティア研究機構 特任助教.
研究テーマ:出芽酵母のオートファジーの一連のプロセスを可視化する.
抱負:見ることは信じることです.見ることにこだわって研究をしていきたいです.
© 2011 鈴木 邦律 Licensed under CC 表示 2.1 日本
(東京工業大学フロンティア研究機構)
email:鈴木邦律
DOI: 10.7875/first.author.2011.143
Selective autophagy regulates insertional mutagenesis by the Ty1 retrotransposon in Saccharomyces cerevisiae.
Kuninori Suzuki, Mayumi Morimoto, Chika Kondo, Yoshinori Ohsumi
Developmental Cell, 21, 358-365 (2011)
要 約
真核生物の細胞は栄養飢餓にさらされるとオートファジーとよばれる系を誘導し,自らの細胞質の成分を大規模に分解して再利用することにより環境に適応しようとする.オートファジー系は真核生物において普遍的に保存されており,不要な細胞質の成分やオルガネラを分解することにより細胞の恒常性を維持するためにも役立っている.一方,Ty1/copiaスーパーファミリーに属するTy1トランスポゾンは出芽酵母Saccharomyces cerevisiaeにおいてもっとも多く存在するレトロトランスポゾンである.Ty1トランスポゾンは生活環のなかで宿主の細胞質にTy1ウイルス様粒子を形成して宿主のゲノムに挿入変異を導入する.この論文では,栄養飢餓にさらされたときオートファジー系がTy1ウイルス様粒子を選択的に細胞質から除去することによりTy1トランスポゾンの転移を抑制していることを示した.また,Ty1ウイルス様粒子の選択的オートファジーには受容体であるAtg19が必要であった.選択的オートファジーはトランスポゾンによる過剰な挿入変異からゲノムを守るシステムとしての一面をもつことが明らかになった.
はじめに
トランスポゾンは細胞内でゲノムでの位置を転移することのできる“動く遺伝子”である.近年のゲノムプロジェクトの進展により,トランスポゾンは真核生物のゲノムにおいてかなりの割合をしめていることが明らかになってきた.たとえば,ヒトゲノムのほぼ半分,高等植物においてはゲノムの70%以上がトランスポゾンに由来する配列によりしめられている.トランスポゾンはそれ自体が宿主のゲノムを動きまわる特性をもつことから,宿主の遺伝子発現を変化させたりゲノムを組み換えたりすることで生物の環境適応や進化に大きく貢献してきたものと考えられている.出芽酵母Saccharomyces cerevisiaeにおいてもっとも多く存在するトランスポゾンはTy1トランスポゾンである.Ty1トランスポゾンはレトロトランスポゾンとよばれるグループに属しており,自らをRNAに転写したのち,DNAに逆転写して転移する.Ty1トランスポゾンの生活環は感染性のないことを除いてはヒト免疫不全ウイルスなどのレトロウイルスと類似していることから,レトロトランスポゾンの生活環を研究する際のモデル系として使用されることも多い.
ゲノムに組み込まれたTy1トランスポゾンの遺伝子からは2種類のタンパク質がつくられる.それらの機能と分子量から,ひとつはTy1 Gag-p49,もうひとつはTy1 Gag-Pol-p199と名づけられている1).Ty1 Gag-p49は翻訳ののちプロテアーゼによりC末端の切断をうけて成熟型のTy1 Gag-p45となりTy1ウイルス様粒子を形成する.RNAからなるTy1トランスポゾンのゲノムはTy1ウイルス様粒子の内部で逆転写される.Ty1ウイルス様粒子は細胞質に集合体を形成することが知られている2).
オートファジーは自食作用ともいわれ,真核生物の細胞が栄養飢餓に応答して細胞質の成分を分解コンパートメントである液胞あるいはリソソームにおいて大規模に分解する系である3).オートファジーにより生じた分解産物は細胞質にもどされ,栄養飢餓環境に適応するための生合成の材料となる.出芽酵母においては,液胞酵素アミノペプチダーゼI(Ape1)がオートファジーにより液胞へと選択的に輸送されることが知られている.アミノペプチダーゼIは前駆型として生合成され,液胞に輸送されたのち成熟型となる.前駆型アミノペプチダーゼIは生合成ののち自己集合してApe1複合体とよばれる集合体を形成し液胞の近傍に局在する4,5).電子顕微鏡による観察からApe1複合体はその周辺に粒子状の構造物をともなうことが示されたことから,Ape1複合体とこの粒子状の構造物とをまとめCvt複合体(Cvt:cytoplasm-to-vacuole targeting)と定義された6).Cvt複合体は富栄養条件においてはCvt小胞により,栄養飢餓条件においてはオートファゴソームにより,液胞へと輸送される.Cvt小胞が成熟型アミノペプチダーゼIの生成に関与しているのに対し,オートファゴソームの内容物は液胞において分解される運命にある.
1.Ape1複合体をとりまく粒子状の構造物はTy1ウイルス様粒子である
これまで,Ape1複合体もTy1ウイルス様粒子も細胞内の1箇所に局在することは知られていたが4,5,7),Ape1複合体をとりまく粒子状の構造物に関してはその正体すら不明であった.電子顕微鏡による観察ではApe1複合体の周辺の粒子状の構造物はTy1ウイルス様粒子に類似していることから,抗Ty1 Gag抗体を用いた免疫染色を試みた.すると,期待したとおり,Ape1複合体の周辺の粒子状の構造物は抗Ty1 Gag抗体により標識された.つづいて,蛍光顕微鏡による観察を試みた.GFP-Ty1 Gag-p45融合タンパク質を発現することによりTy1ウイルス様粒子を可視化したところ,Ape1複合体にきわめて近接して局在していることがわかった.これらの細胞を電子顕微鏡で観察すると,Ty1ウイルス様粒子はApe1複合体の近傍に局在する構造体であることが明確になった(図1).
2.Ty1ウイルス様粒子はオートファゴソームの選択的なカーゴである
オートファジーを誘導するとGFP-Ty1 Gag-p45融合タンパク質を発現する細胞では液胞の内部がGFPの蛍光で標識された.これは,GFP-Ty1 Gag-p45融合タンパク質がオートファジーにより液胞へと運ばれていることを示唆していた.そこで,このGFP-Ty1 Gag-p45融合タンパク質の液胞への輸送を生化学的に解析した.GFP-Ty1 Gag-p45融合タンパク質は液胞に運ばれたのち分解されるが,GFPは液胞内でも比較的安定なことから,GFP-Ty1 Gag-p45融合タンパク質から切り離されたGFPを抗GFP抗体によるウェスタンブロットにより検出することでオートファジー活性を見積ることができた.オートファジーを誘導すると野生株においては遊離のGFPが検出されるが,オートファゴソームの形成不能株においてはこれがみられないことから,GFP-Ty1 Gag-p45融合タンパク質はオートファジーにより液胞へと輸送されていることが示された.
つづいて,Ty1ウイルス様粒子がオートファゴソームの内部に選択的に積み込まれているかどうかをプロテアーゼK保護アッセイ法により調べた.ypt7破壊株ではオートファゴソームは液胞と融合できないため細胞質に蓄積する.これらの細胞を破砕しプロテアーゼKで処理すると,オートファゴソームに積み込まれている前駆型アミノペプチダーゼIやTy1ウイルス様粒子は分解されないが,これらがオートファゴソームの外部に存在する場合にはプロテアーゼKにさらされることにより分解をうける.実験の結果,野生株では約半量の前駆型アミノペプチダーゼIがオートファゴソームに積み込まれていた.また,Ty1ウイルス様粒子は90%以上がオートファゴソームに積み込まれていたことから,Ty1ウイルス様粒子が前駆型アミノペプチダーゼIよりも効率よくオートファゴソームの内部に取り込まれていることが示唆された.
つぎに,Ty1ウイルス様粒子がオートファゴソームに選択的に積み込まれる分子機構について調べた.Atg11とAtg19は前駆型アミノペプチダーゼIを選択的にオートファゴソームに積み込むため必要なタンパク質である.Ty1ウイルス様粒子の輸送をGFP-Ty1 Gag-p45融合タンパク質の切断により見積ると,atg11破壊株とatg19破壊株においてTy1ウイルス様粒子の輸送能は低下していた.また,これらの株ではTy1ウイルス様粒子のオートファゴソームへの積み込みの効率も低下していたことから,Ty1ウイルス様粒子を選択的にオートファゴソームに積み込むためにはAtg11とAtg19が必要であることが明らかになった.
蛍光顕微鏡を用いてTy1ウイルス様粒子とApe1複合体の局在を観察したところ,野生株においては,GFP-Ty1 Gag-p45融合タンパク質の輝点とApe1複合体の輝点はほとんどすべてが共局在していた(94.9%).しかし,atg19破壊株では両者の輝点はほとんど共局在していなかった(13.5%).Atg19はTy1ウイルス様粒子とApe1複合体との共局在に必要だと考えられた.
3.Ty1ウイルス様粒子の選択的なオートファジーにはAtg19のN末端ドメインが必要である
Atg19は前駆型アミノペプチダーゼIなどの積荷に結合するドメインと,Atgタンパク質に結合するドメインとをもつことから,オートファゴソームの選択的なカーゴの受容体であると考えられている.Atg19は既知のカーゴの輸送にかかわっていない機能未知なドメインをN末端にもつことから,このドメインを欠いたAtg19を作製してTy1ウイルス様粒子の輸送を調べた.N末端ドメインを欠損したAtg19を発現した細胞では前駆型アミノペプチダーゼIは正常に輸送されていたが,Ty1ウイルス様粒子の輸送能は低下していた.この細胞ではTy1ウイルス様粒子のオートファゴソームへの積み込みにも異常がみられた.これらの結果から,Atg19のN末端の領域はTy1ウイルス様粒子の選択的オートファジーに必須であることがわかった(図2).
4.Ty1トランスポゾンの転移は選択的なオートファジーにより制御されている
Ty1トランスポゾンの転移に必須なTy1ウイルス様粒子が選択的オートファジーによる分解をうけることから,Ty1トランスポゾンの転移が選択的オートファジーの有無により影響される可能性を考えた.富栄養条件におけるTy1トランスポゾンの転移率をTy1his3-AI移動性アッセイ8) により定量化したところ,野生株,オートファゴソームの形成不能なatg1破壊株,選択的オートファジーの不能なatg19破壊株とのあいだで有意な差はなかった.つづいて,栄養飢餓条件でのTy1トランスポゾンの転移率を3日間にわたって調べた.野生株では期間をつうじて転移率はほぼ一定だったのに対し,atg1破壊株やatg19破壊株では転移率が継続して上昇しつづけた.これらの結果から,栄養飢餓にさらされた出芽酵母ではTy1トランスポゾンの転移がAtg19に依存的な選択的オートファジーにより抑制されていることが示された.
おわりに
トランスポゾンは真核生物と原核生物とをとわずあらゆる生物のゲノムに組み込まれており,多種多様な遺伝子のプールをつくりだすことにより生物がさまざまな環境に適応するのに役立っていると考えられている.一方,トランスポゾンは宿主のゲノムに不利益な変異をもたらすこともありうることから,諸刃の剣でもある.この論文により,Ty1トランスポゾンの転移が選択的オートファジーにより抑制され,出芽酵母のゲノムが過剰な変異にさらされることを防いでいることが示された.
高等真核生物ではp62が選択的オートファジーの受容体として機能している.最近の研究では,p62はシンドビスウイルスのウイルス粒子と相互作用してこれを分解に導いていることが示されている9).Ty1ウイルス様粒子の選択的な分解は高等真核生物において細胞質に存在するウイルス粒子を除去する分子機構を調べるうえでのモデル系となりうるだろう.
選択的オートファジーによりトランスポゾンの転移が制御されていることから,選択的オートファジーは真核生物においてゲノムの安定性に寄与していると推測される.たとえば,哺乳動物ではオートファジーの破綻が腫瘍の形成につながることが知られているが,その直接的な原因は明らかになっていなかった10).筆者らの今回の結果から,その原因のひとつがトランスポゾンによるゲノムの不安定化である可能性が考えられる.
この論文は選択的オートファジーが真核生物のゲノムを安定化するという基礎的な知見をもたらしただけではなく,オートファジーによるトランスポゾンの活性制御が腫瘍の形成と関連する可能性を提示したという点で医学的にも大きな意義をもつ.今後の哺乳動物における解析が待たれる.
文 献
- Voytas, D. & Boeke, J. D.: Ty1 and Ty5 of Saccharomyces cerevisiae. in Mobile DNA II (Craig, N. L., Craigie, R., Gellert, M. & Lambowitz, A. M. eds.), pp. 631-661, ASM Press, Washington, D.C. (2002)
- Garfinkel, D. J., Boeke, J. D. & Fink, G. R.: Ty element transposition: reverse transcriptase and virus-like particles. Cell, 42, 507-517 (1985)[PubMed]
- Suzuki, K. & Ohsumi, Y.: Molecular machinery of autophagosome formation in yeast, Saccharomyces cerevisiae. FEBS Lett., 581, 2156-2161 (2007)[PubMed]
- Suzuki, K., Kamada, Y. & Ohsumi, Y.: Studies of cargo delivery to the vacuole mediated by autophagosomes in Saccharomyces cerevisiae. Dev. Cell, 3, 815-824 (2002)[PubMed]
- Shintani, T., Huang, W. P., Stromhaug, P. E. et al.: Mechanism of cargo selection in the cytoplasm to vacuole targeting pathway. Dev. Cell, 3, 825-837 (2002)[PubMed]
- Baba, M., Osumi, M., Scott, S. V. et al.: Two distinct pathways for targeting proteins from the cytoplasm to the vacuole/lysosome. J. Cell Biol., 139, 1687-1695 (1997)[PubMed]
- Checkley, M. A., Nagashima, K., Lockett, S. J. et al.: P-body components are required for Ty1 retrotransposition during assembly of retrotransposition-competent virus-like particles. Mol. Cell. Biol., 30, 382-398 (2010)[PubMed]
- Mou, Z., Kenny, A. E. & Curcio, M. J.: Hos2 and Set3 promote integration of Ty1 retrotransposons at tRNA genes in Saccharomyces cerevisiae. Genetics, 172, 2157-2167 (2006)[PubMed]
- Orvedahl, A., MacPherson, S., Sumpter, R., Jr. et al.: Autophagy protects against Sindbis virus infection of the central nervous system. Cell Host Microbe, 7, 115-127 (2010)[PubMed]
- Takamura, A., Komatsu, M., Hara, T. et al.: Autophagy-deficient mice develop multiple liver tumors. Genes Dev., 25, 795-800 (2011)[PubMed]
著者プロフィール
略歴:2002年 総合研究大学院大学生命科学研究科博士課程 修了,同年 基礎生物学研究所 研究員,2003年 同 助手を経て,2009年より東京工業大学フロンティア研究機構 特任助教.
研究テーマ:出芽酵母のオートファジーの一連のプロセスを可視化する.
抱負:見ることは信じることです.見ることにこだわって研究をしていきたいです.
© 2011 鈴木 邦律 Licensed under CC 表示 2.1 日本