マウスの胚において細胞膜表面のヘパラン硫酸鎖はFGFシグナルの局所的な受容にはたらく
下川佳世・木村-吉田千春・松尾 勲
(大阪府立母子保健総合医療センター研究所 病因病態部門)
email:松尾 勲
DOI: 10.7875/first.author.2011.140
Cell surface heparan sulfate chains regulate local reception of FGF signaling in the mouse embryo.
Kayo Shimokawa, Chiharu Kimura-Yoshida, Naoko Nagai, Kazuhiro Mukai, Kazumi Matsubara, Hideto Watanabe, Yoichi Matsuda, Kyoko Mochida, Isao Matsuo
Developmental Cell, 21, 257-272 (2011)
ヘパラン硫酸プロテオグリカンは細胞膜の表面や細胞外マトリックスにおいてさまざまな拡散性の成長因子の活性を調節していることが知られている.しかし,哺乳動物の形態形成の過程において,成長因子の標的細胞への移動や受容にヘパラン硫酸鎖がどのようにはたらいているのかについては不明な点が多い.この研究では,ヘパラン硫酸鎖を合成できないExt2遺伝子を欠損したマウス胚は胚体外外胚葉の形成不全を示すこと,その原因はFGFシグナルの伝達能の不全によることを見い出した.さらに,分子マーカーを用いた発現解析から,ヘパラン硫酸鎖は胚体外外胚葉におけるFGF4リガンドおよびFGF8リガンドの局所的な保持に必須であることがわかった.単一細胞レベルでのキメラ解析,および,ヘパラン硫酸鎖の移動の過程を特異的に阻害する薬剤を用いた解析から,ヘパラン硫酸プロテオグリカンのコアタンパク質の側が切断されることにより隣接した細胞にFGFシグナルが伝達されていることが示唆された.また,機能的なヘパラン硫酸鎖は細胞外マトリックスではなく,細胞膜の表面に局在するタイプであることがわかった.以上の結果から,哺乳動物の胚の発生過程において,細胞膜の表面に係留されたヘパラン硫酸鎖の時空間的な発現はFGFの標的細胞への局所的な受容に必須であり,FGFシグナルを安定的に伝達する重要な分子機構となっていることが想定された.
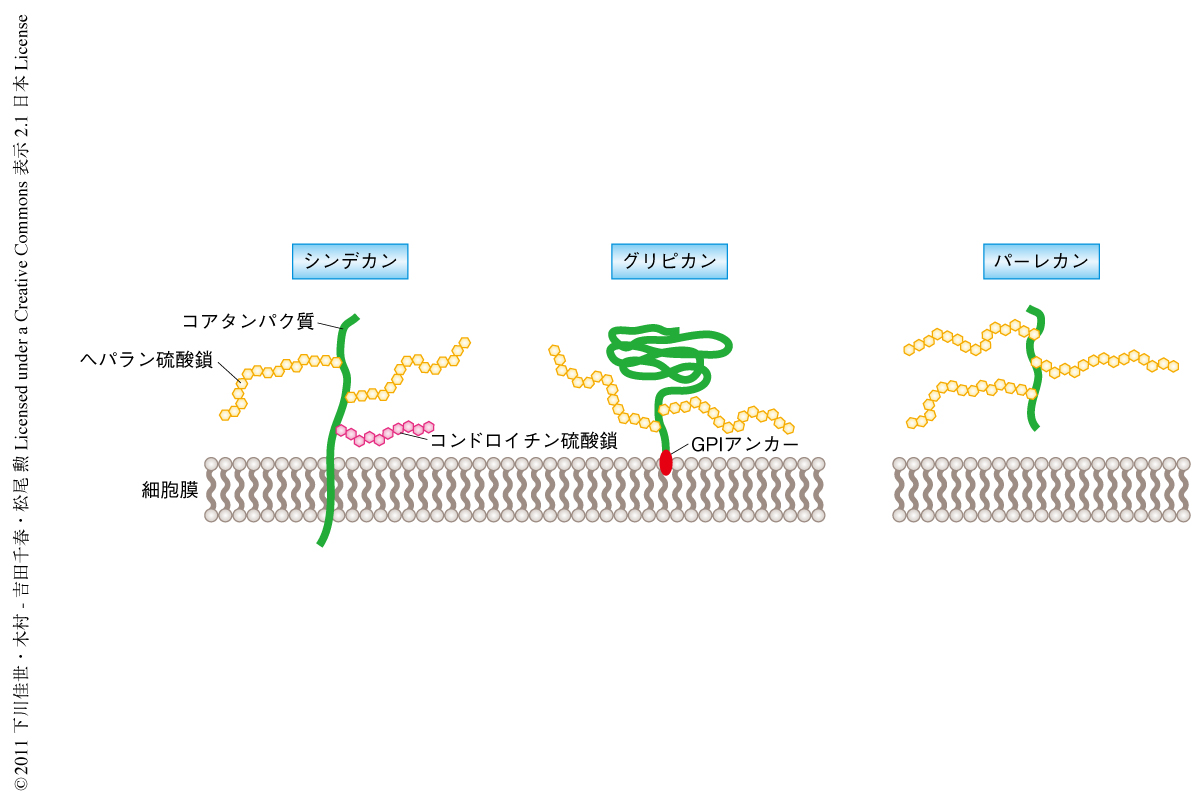
ヘパラン硫酸プロテオグリカンは発生や成長の過程にある細胞膜の表面や細胞外マトリックスにおいて,FGF,BMP,TGFβ,SHH,WNTといった拡散性の成長因子の安定性,移動,受容を制御していることが示唆されている1-3).ヘパラン硫酸プロテオグリカンはコアタンパク質から複数の糖鎖付加反応および修飾反応をへて合成される.とくに,EXT1とEXT2はヘテロ二量体として,ヘパラン硫酸鎖の2糖くり返し構造を20~150個付加するという酵素活性を担っている4).合成されたヘパラン硫酸プロテオグリカンはコアタンパク質の側の局在に依存して,シンデカンやグリピカンなどのように細胞膜の表面に係留されるか,あるいは,パーレカンやアグリンなどのように細胞外マトリックスに局在する(図1).ヘパラン硫酸鎖の合成過程に影響をあたえるような遺伝子変異は,優性遺伝または劣性遺伝によりヒトの疾患をひき起こす.実際に,EXT1遺伝子とEXT2遺伝子はヒト遺伝性多発性外骨腫の原因遺伝子である5,6).また,マウスにおいてもExt1遺伝子やExt2遺伝子を欠損した胚では原条の形成異常を示す7,8).このように,ヘパラン硫酸プロテオグリカンは哺乳動物の発生および成長に必須な機能をはたしている.しかし一方で,哺乳動物の形態形成の過程において,拡散性の成長因子の標的細胞への移動や受容にヘパラン硫酸鎖がどのようにはたらいているのか,その詳細はまったく明らかにされていない.
この研究では,ヘパラン硫酸鎖による拡散性の成長因子のシグナル活性の制御機構を明らかにするため,Ext2遺伝子を欠損したマウス胚の表現型を詳細に解析した.その結果,マウスの発生過程において,細胞膜の表面に係留されたヘパラン硫酸鎖の時空間特異的な発現が局所的なFGFリガンドの受容およびFGFシグナルの活性化にはたらいていることが明らかになった.
まず,劣性胚性致死の表現型を示すトランス遺伝子挿入変異マウスについて,その表現型の解析を行った.形態学的な解析およびマーカーを用いた解析から,ホモ変異胚では胚体外外胚葉の形成不全を示した.実際,受精後6.5日目のホモ変異胚では胚体外外胚葉に特異的なマーカーであるERRβやCDX2の発現がみられなかった.つぎに,このトランス遺伝子挿入変異マウスの原因遺伝子を特定するため染色体解析ならびにゲノムのクローニングなどを行った結果,ヘパラン硫酸鎖合成酵素のひとつであるExt2をコードする遺伝子座にトランス遺伝子が挿入されていることがわかった.実際,野生型胚の胚体外外胚葉ではExt2遺伝子の発現は顕著に認められたが,ホモ変異胚ではまったくみられなかった.さらに,この異常がExt2遺伝子の欠損によるのかどうかを明らかにするためExt2遺伝子のcDNAをユビキタスに発現させたところ,胚の劣性致死はレスキューされ発生は正常となった.以上の結果から,このトランス遺伝子挿入変異マウスのホモ変異はExt2遺伝子のヌル変異であることがわかった.
Ext2はヘパラン硫酸鎖の合成に関与することから,ヘパラン硫酸鎖を特異的に認識する抗体を用いて発現を検討した.受精後5.5日目の野生型胚ではヘパラン硫酸鎖は細胞膜の表面(細胞膜)および細胞外マトリックス(基底膜)に認められた.とくにExt2 mRNAの発現と呼応して胚体外外胚葉の細胞膜の表面において顕著に観察されたが,エピブラスト側の細胞膜の表面にはほとんどみられなかった.受精後6.25日目以降は,Ext2 mRNAの発現およびヘパラン硫酸鎖の発現とも中胚葉を含むエピブラスト領域で昂進していた.一方,Ext2遺伝子を欠損した胚ではヘパラン硫酸鎖の発現はほとんどみられなかった.しかし,コンドロイチン硫酸についてはExt2遺伝子を欠損した胚でも野生型胚とほぼ同じ程度の発現が観察された.糖鎖の合成状態をより正確に調べるため,高感度HPLC法を用いて2糖の解析を行った.その結果,野生型胚では6種類のヘパラン硫酸鎖が検出されたが,Ext2遺伝子を欠損した胚ではその全種類ともまったく検出されなかった.しかし,コンドロイチン硫酸についてはExt2遺伝子を欠損した胚でも野生型と同種すべてが検出された.さらに,シンデカン1やパーレカンといったプロテオグリカンのコアタンパク質はExt2遺伝子を欠損した胚でもほぼ正常に局在していた.以上の結果から,Ext2遺伝子を欠損した胚ではプロテオグリカンのもつヘパラン硫酸鎖に特異的に合成不全を示していることがわかった.
Ext2遺伝子を欠損した胚でみられた胚体外外胚葉の形成不全の表現型に関してはFGFシグナルがはたらいていることが知られているため,FGFシグナルの下流のマーカーについて発現解析を行った.野生型胚では胚体外外胚葉においてリン酸化ERKの発現が認められるが,Ext2遺伝子を欠損した胚ではその発現は失われていた.同様に,Spry4遺伝子やDusp6/Mkp3遺伝子といったほかのFGF標的マーカーの発現もExt2遺伝子を欠損した胚では顕著に低下していることがわかった.つぎに,Ext2遺伝子を欠損した胚で観察されたFGFシグナルの不全がヘパラン硫酸鎖の欠損によるものかどうかを検討するため,in vitroにおいて全胚培養を行い,FGFの下流の遺伝子の発現解析を行った.その結果,受精後5.5日目のExt2遺伝子を欠損した胚では,野生型胚では維持されている胚体外外胚葉マーカーの発現が顕著に低下していた.一方,ヘパラン硫酸鎖と構造的にも機能的にも類似しているヘパリンを添加して培養を行うと,Ext2遺伝子を欠損した胚における胚体外外胚葉マーカーの発現が回復することがわかった.
さらに,ヘパラン硫酸鎖がFGFリガンドに対する反応性に関与しているかどうかを詳細に検討するため,受精後7.5日目の胚の外植体とFGFを含むビーズとの共培養実験を行った.野生型胚に由来する外植体ではFGF4リガンドおよびFGF8リガンドを含むビーズによりFGF標的マーカーであるSpry4遺伝子やリン酸化ERKが誘導された.一方,Ext2遺伝子を欠損した胚ではいずれのFGFリガンドによってもFGF標的マーカーは誘導されなかった.しかし,培養液にヘパリンを添加することによりExt2遺伝子を欠損した胚であってもFGF標的マーカーの発現が誘導されるようになった.以上の結果により,Ext2遺伝子を欠損した胚でみられたFGFシグナルの伝達不全はヘパラン硫酸鎖の合成異常が原因であること,また,Ext2遺伝子を欠損した胚ではFGFリガンドに対する反応性が顕著に低下していることが示唆された.
ヘパラン硫酸鎖がどのようにFGFシグナルに関与しているのかを明らかにするため,受精後5.5日目の胚体外外胚葉の形成期において,FGFリガンド,FGF受容体,ヘパラン硫酸鎖,および,細胞膜の表面に係留されるタイプのプロテオグリカンであるシンデカン1の発現解析を行った.野生型胚ではFgf4 mRNAとFgf8 mRNAは胚性外胚葉(エピブラスト)の側でのみ発現が認められるのに対し,タンパク質レベルでは胚体外外胚葉のみで顕著に発現が検出され,むしろ,エピブラストではほとんど発現がみられなかった.また,Ext2遺伝子を欠損した胚ではFgf4 mRNAとFgf8 mRNAの発現は野生型胚と同じだが,タンパク質レベルでは発現がまったくみられなかった.
さらに,これらのFGFリガンドの局在がコアタンパク質の側での発現ではなくヘパラン硫酸鎖の胚体外外胚葉における特異的な発現に依存しているかどうかを検討するため,細胞膜の表面に係留されるシンデカン1の発現を解析した.その結果,ヘパラン硫酸鎖は胚体外外胚葉でより顕著に発現するのに対し,シンデカン1は野生型胚では胚体外外胚葉だけでなくエピブラスト側の細胞膜の表面でも発現がみられた.ちなみに,Ext2遺伝子を欠損した胚でもシンデカン1の発現は野生型胚と同様なパターンであった.以上の結果から,コアタンパク質ではなく,むしろ,細胞膜の表面に係留されたヘパラン硫酸鎖がFGFリガンドの保持と細胞内におけるFGFシグナルの活性化に必須な機能をはたしていることが示唆された.
ヘパラン硫酸鎖は細胞自律的および細胞非自律的に拡散性の成長因子の活性を制御しているものと考えられている1).そこで,胚体外外胚葉の形成過程においてヘパラン硫酸鎖のFGFシグナル活性化は,細胞自律的または細胞非自律的のどちらのシステムにより制御されているのか検討を行った.方法としては,Ext2遺伝子を欠損した胚盤胞と野生型ES細胞とのあいだでのインジェクションキメラ,および,8細胞期のExt遺伝子を欠損した胚と野生型胚とのあいだでの凝集キメラを作製することで行った.とくに,野生型の細胞(ヘパラン硫酸鎖をもつ細胞)に対し,同じ野生型の細胞,隣接するExt遺伝子を欠損した細胞,より遠方のExt遺伝子を欠損した細胞のうち,どの細胞でFGFシグナルが活性化されるのかを検討した.実際,これらのキメラ解析により細胞膜の表面に係留されたヘパラン硫酸鎖と細胞外マトリックス(基底膜)に局在するヘパラン硫酸鎖とを区別することが可能になり,野生型の細胞で発現するヘパラン硫酸鎖がヘパラン硫酸鎖を欠損する細胞において機能しうるのかどうかを特定できる.
まず,インジェクションキメラ法を用いて解析を行った.野生型胚にβガラクトシダーゼで標識したES細胞を導入し受精後6.5日目に解析したところ,導入したES細胞はエピブラスト領域にのみに分布し胚体外外胚葉などには分布していなかった.Ext2遺伝子を欠損した胚にβガラクトシダーゼで標識したES細胞を導入すると,細胞膜の表面に係留されたヘパラン硫酸鎖の発現はβガラクトシダーゼ陽性細胞のみに限定されていたが,細胞外マトリックス(基底膜)における発現はβガラクトシダーゼ陽性細胞から分泌および拡散されて胚全体に広く分布していた.細胞自律的あるいは細胞非自律的にヘパラン硫酸鎖が機能しているかどうかを検討するため,FGFシグナルの標的であるERRβおよびリン酸化ERKの発現をキメラ胚において解析した.その結果,Ext2遺伝子を欠損した胚におけるERRβの発現は胚体外外胚葉において完全に失われるのに対し,キメラ胚ではβガラクトシダーゼ陽性のエピブラスト細胞に近接する胚体外外胚葉の細胞において発現が回復した.同様に,Ext2遺伝子を欠損した胚ではみられなかったリン酸化ERKの発現も,βガラクトシダーゼ陽性のエピブラスト細胞に近接した胚体外外胚葉の細胞において発現がみられた.以上の結果は,ヘパラン硫酸鎖はエピブラストと近接した胚体外外胚葉の細胞に対しFGFシグナルを活性化できることを示唆していた.
つぎに,凝集キメラ法を用いてどれくらい離れた細胞においてまでFGFシグナルを活性化できるかを解析した.GFPで標識した野生型の8細胞期胚とExt2遺伝子を欠損した8細胞期胚とを用いた場合,2種類の細胞は完全に混ざり合いごま塩状に分布した.インジェクションキメラ法と同様にERRβとリン酸化ERKの発現を解析したところ,野生型の胚体外外胚葉の細胞と隣接したExt2遺伝子を欠損した細胞でのみFGF標的マーカーの発現が観察され,遠くに離れて存在するExt2遺伝子を欠損した細胞ではFGF標的マーカーの発現はみられなかった.キメラ胚では細胞外マトリックス(基底膜)においてヘパラン硫酸鎖が胚全体に広く認められていたにもかかわらず,野生型の細胞に近接した細胞しかレスキューはされなかった.以上の結果から,ヘパラン硫酸鎖をもつ野生型の細胞により隣接した細胞のFGFシグナルが細胞非自律的に活性化され,さらに,細胞外マトリックス(基底膜)に局在するヘパラン硫酸鎖よりも細胞膜の表面に係留されたヘパラン硫酸鎖のほうがFGFシグナルの活性化に重要な機能をはたしていることが示唆された.
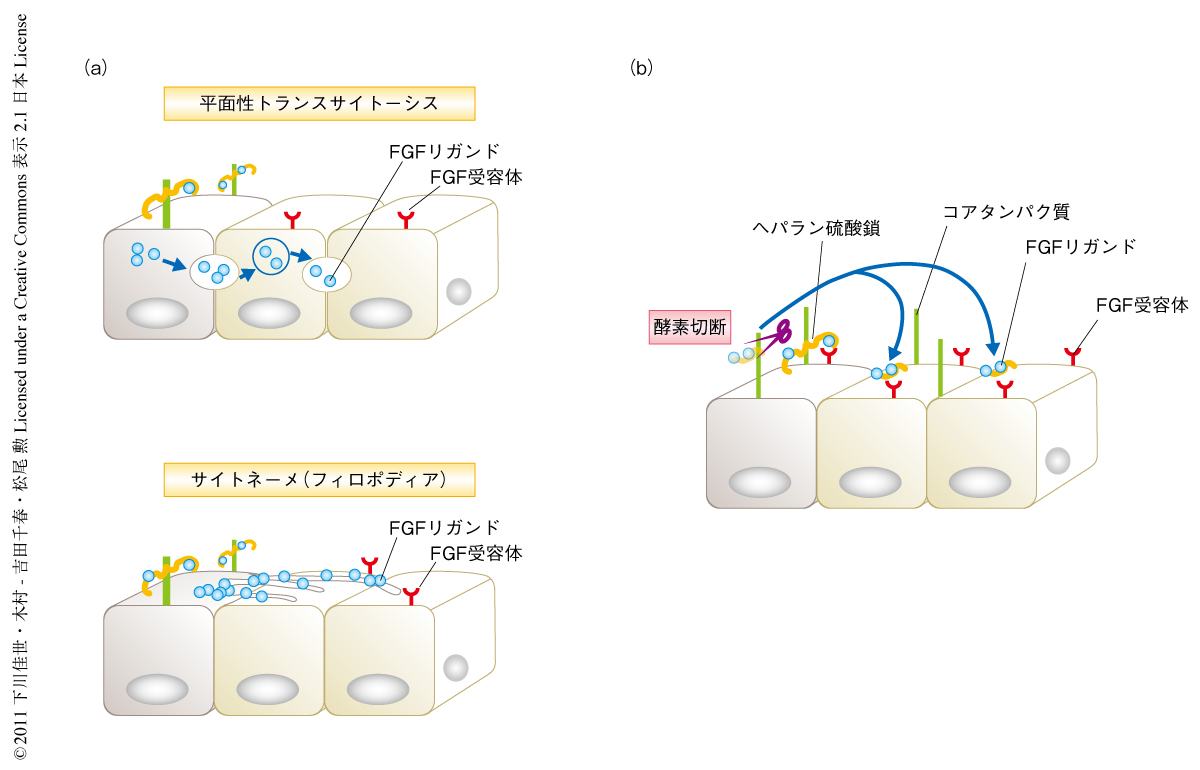
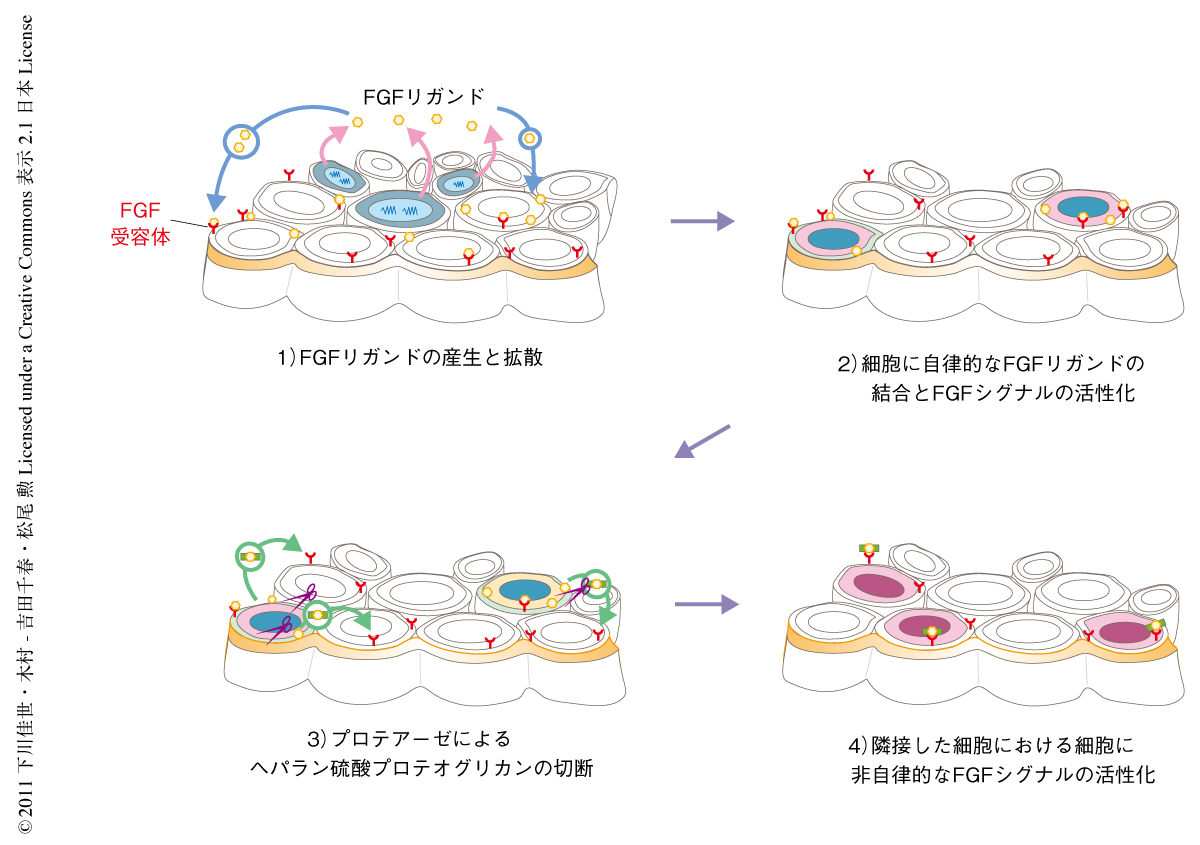
キメラ解析からヘパラン硫酸鎖が近接した細胞に対し細胞非自律的にFGFシグナルを活性化できることがわかった.そこで,この細胞非自律的な現象がどのような分子機構を介しているのか明らかにするため,ヘパラン硫酸鎖の移動の過程を特異的に阻害する薬剤を用いて発現解析を行った.現在,ヘパラン硫酸鎖の移動には,平面性のトランスサイトーシス,サイトネーメ(フィロポディア),プロテアーゼやヘパラナーゼによる酵素切断,などの機構が関与しているものと提唱されている1-3)(図2).平面性のトランスサイトーシスおよびサイトネーメについてはアクチン細胞骨格に依存しているので,アクチン重合を阻害する薬剤であるサイトカラシンDを用いて影響を解析した.しかし,受精後6.5日目の野生型胚をサイトカラシンDにより処理したのち胚体外外胚葉におけるリン酸化ERKの発現を解析したが,発現低下はみられなかった.このことは,ヘパラン硫酸鎖によるFGFシグナルの活性化にはアクチン細胞骨格に依存するタイプのシグナル伝達は関与していないことを意味していた.そこで,コアタンパク質を切断するプロテアーゼ(セリンプロテアーゼ)に対して特異的な2種類の阻害剤により処理したのち胚体外外胚葉におけるリン酸化ERKの発現解析を行ったところ,発現は顕著に失われた.一方で,ヘパラン硫酸鎖を切断するヘパラナーゼの阻害剤や,セリンプロテアーゼ以外のプロテアーゼであるメタロプロテアーゼ,システインプロテアーゼ,アスパラギン酸プロテアーゼ,カルパインなどに対する阻害剤を用いて特異性を検討したが,これらの阻害剤ではリン酸化ERKの発現はまったく低下しなかった.セリンプロテアーゼ阻害剤についてFGFシグナル以外のシグナル,BMPシグナルやTGFβシグナルに対する影響を検討したが,これらのシグナル経路の標的マーカーであるSmad1,Smad5,Smad8,あるいは,Smad2のリン酸化については顕著な低下はみられなかった.以上の結果から,ヘパラン硫酸プロテオグリカンはプロテアーゼによりコアタンパク質が切断されることにより適切なFGFシグナルの活性化をひき起こすこと,このタンパク質の切断機構が細胞非自律的なFGFシグナルの活性化に関与していることが示唆された(図3).
この研究では,哺乳動物の初期胚の発生過程においてExt2に依存して合成されるヘパラン硫酸鎖がFGFシグナルの局所的な受容を制御していることを明らかにした.また,基底膜など細胞外マトリックスに局在するヘパラン硫酸鎖より,むしろ,細胞膜の表面に係留されたヘパラン硫酸鎖が,マウス胚の発生過程においてFGFシグナルを時空間特異的に活性化するはたらきを担っていることも示された.実際,詳細は示さなかったがこの研究において,ヘパラン硫酸鎖に特異的な種々のモノクロナール抗体を用いた染色から,細胞膜の表面に係留されたヘパラン硫酸鎖の微細構造は基底膜に局在するヘパラン硫酸鎖とは異なることも明らかになった.また,ヘパラン硫酸鎖とFGFリガンドとのあいだのアフィニティーがO-6-硫酸化などヘパラン硫酸鎖の微細構造により調整されうることも示唆されている9,10).さらに,特定の脱硫酸化反応はゴルジ体ではなく細胞膜の表面で起こることからも,細胞膜の表面に係留されたヘパラン硫酸鎖が基底膜に局在するヘパラン硫酸鎖とは異なる機能を担いうることが想定される.これまで,FGFシグナルの活性化の時空間的な制御はおもにFGFリガンドとFGF受容体とが複合体を形成することによりなされているものと考えられてきた.今回の研究成果は,FGFリガンドやFGF受容体にくわえ,ヘパラン硫酸鎖が標的細胞の細胞膜の表面で局所的に発現することにより,(哺乳動物の形態形成の過程などで)適切な場所に適切なタイミングでFGFシグナルを活性化するという重要な機能をはたしていることを強く示唆した.また,この機構はFGFシグナルをより安定的に供給および伝達するための機序であると考えられ,FGFを介して形態形成を進行するための重要な分子機構となっていることが想定される.
略歴:2006年より大阪府立母子保健総合医療センター研究所 研究技術員.
木村-吉田千春(Chiharu Kimura-Yoshida)
大阪府立母子保健総合医療センター研究所 研究員,大阪大学大学院歯学系研究科 招へい准教授 兼任.
松尾 勲(Isao Matsuo)
大阪府立母子保健総合医療センター研究所 部長,大阪大学大学院 医学系研究科 招へい教授 兼任.
研究室URL:http://www.med.osaka-u.ac.jp/pub/inst-mch/Byo/Byo.html
© 2011 下川佳世・木村-吉田千春・松尾 勲 Licensed under CC 表示 2.1 日本
(大阪府立母子保健総合医療センター研究所 病因病態部門)
email:松尾 勲
DOI: 10.7875/first.author.2011.140
Cell surface heparan sulfate chains regulate local reception of FGF signaling in the mouse embryo.
Kayo Shimokawa, Chiharu Kimura-Yoshida, Naoko Nagai, Kazuhiro Mukai, Kazumi Matsubara, Hideto Watanabe, Yoichi Matsuda, Kyoko Mochida, Isao Matsuo
Developmental Cell, 21, 257-272 (2011)
要 約
ヘパラン硫酸プロテオグリカンは細胞膜の表面や細胞外マトリックスにおいてさまざまな拡散性の成長因子の活性を調節していることが知られている.しかし,哺乳動物の形態形成の過程において,成長因子の標的細胞への移動や受容にヘパラン硫酸鎖がどのようにはたらいているのかについては不明な点が多い.この研究では,ヘパラン硫酸鎖を合成できないExt2遺伝子を欠損したマウス胚は胚体外外胚葉の形成不全を示すこと,その原因はFGFシグナルの伝達能の不全によることを見い出した.さらに,分子マーカーを用いた発現解析から,ヘパラン硫酸鎖は胚体外外胚葉におけるFGF4リガンドおよびFGF8リガンドの局所的な保持に必須であることがわかった.単一細胞レベルでのキメラ解析,および,ヘパラン硫酸鎖の移動の過程を特異的に阻害する薬剤を用いた解析から,ヘパラン硫酸プロテオグリカンのコアタンパク質の側が切断されることにより隣接した細胞にFGFシグナルが伝達されていることが示唆された.また,機能的なヘパラン硫酸鎖は細胞外マトリックスではなく,細胞膜の表面に局在するタイプであることがわかった.以上の結果から,哺乳動物の胚の発生過程において,細胞膜の表面に係留されたヘパラン硫酸鎖の時空間的な発現はFGFの標的細胞への局所的な受容に必須であり,FGFシグナルを安定的に伝達する重要な分子機構となっていることが想定された.
はじめに
ヘパラン硫酸プロテオグリカンは発生や成長の過程にある細胞膜の表面や細胞外マトリックスにおいて,FGF,BMP,TGFβ,SHH,WNTといった拡散性の成長因子の安定性,移動,受容を制御していることが示唆されている1-3).ヘパラン硫酸プロテオグリカンはコアタンパク質から複数の糖鎖付加反応および修飾反応をへて合成される.とくに,EXT1とEXT2はヘテロ二量体として,ヘパラン硫酸鎖の2糖くり返し構造を20~150個付加するという酵素活性を担っている4).合成されたヘパラン硫酸プロテオグリカンはコアタンパク質の側の局在に依存して,シンデカンやグリピカンなどのように細胞膜の表面に係留されるか,あるいは,パーレカンやアグリンなどのように細胞外マトリックスに局在する(図1).ヘパラン硫酸鎖の合成過程に影響をあたえるような遺伝子変異は,優性遺伝または劣性遺伝によりヒトの疾患をひき起こす.実際に,EXT1遺伝子とEXT2遺伝子はヒト遺伝性多発性外骨腫の原因遺伝子である5,6).また,マウスにおいてもExt1遺伝子やExt2遺伝子を欠損した胚では原条の形成異常を示す7,8).このように,ヘパラン硫酸プロテオグリカンは哺乳動物の発生および成長に必須な機能をはたしている.しかし一方で,哺乳動物の形態形成の過程において,拡散性の成長因子の標的細胞への移動や受容にヘパラン硫酸鎖がどのようにはたらいているのか,その詳細はまったく明らかにされていない.
この研究では,ヘパラン硫酸鎖による拡散性の成長因子のシグナル活性の制御機構を明らかにするため,Ext2遺伝子を欠損したマウス胚の表現型を詳細に解析した.その結果,マウスの発生過程において,細胞膜の表面に係留されたヘパラン硫酸鎖の時空間特異的な発現が局所的なFGFリガンドの受容およびFGFシグナルの活性化にはたらいていることが明らかになった.
1.Ext2に依存して合成されるヘパラン硫酸鎖は胚体外外胚葉の発生に必要である
まず,劣性胚性致死の表現型を示すトランス遺伝子挿入変異マウスについて,その表現型の解析を行った.形態学的な解析およびマーカーを用いた解析から,ホモ変異胚では胚体外外胚葉の形成不全を示した.実際,受精後6.5日目のホモ変異胚では胚体外外胚葉に特異的なマーカーであるERRβやCDX2の発現がみられなかった.つぎに,このトランス遺伝子挿入変異マウスの原因遺伝子を特定するため染色体解析ならびにゲノムのクローニングなどを行った結果,ヘパラン硫酸鎖合成酵素のひとつであるExt2をコードする遺伝子座にトランス遺伝子が挿入されていることがわかった.実際,野生型胚の胚体外外胚葉ではExt2遺伝子の発現は顕著に認められたが,ホモ変異胚ではまったくみられなかった.さらに,この異常がExt2遺伝子の欠損によるのかどうかを明らかにするためExt2遺伝子のcDNAをユビキタスに発現させたところ,胚の劣性致死はレスキューされ発生は正常となった.以上の結果から,このトランス遺伝子挿入変異マウスのホモ変異はExt2遺伝子のヌル変異であることがわかった.
Ext2はヘパラン硫酸鎖の合成に関与することから,ヘパラン硫酸鎖を特異的に認識する抗体を用いて発現を検討した.受精後5.5日目の野生型胚ではヘパラン硫酸鎖は細胞膜の表面(細胞膜)および細胞外マトリックス(基底膜)に認められた.とくにExt2 mRNAの発現と呼応して胚体外外胚葉の細胞膜の表面において顕著に観察されたが,エピブラスト側の細胞膜の表面にはほとんどみられなかった.受精後6.25日目以降は,Ext2 mRNAの発現およびヘパラン硫酸鎖の発現とも中胚葉を含むエピブラスト領域で昂進していた.一方,Ext2遺伝子を欠損した胚ではヘパラン硫酸鎖の発現はほとんどみられなかった.しかし,コンドロイチン硫酸についてはExt2遺伝子を欠損した胚でも野生型胚とほぼ同じ程度の発現が観察された.糖鎖の合成状態をより正確に調べるため,高感度HPLC法を用いて2糖の解析を行った.その結果,野生型胚では6種類のヘパラン硫酸鎖が検出されたが,Ext2遺伝子を欠損した胚ではその全種類ともまったく検出されなかった.しかし,コンドロイチン硫酸についてはExt2遺伝子を欠損した胚でも野生型と同種すべてが検出された.さらに,シンデカン1やパーレカンといったプロテオグリカンのコアタンパク質はExt2遺伝子を欠損した胚でもほぼ正常に局在していた.以上の結果から,Ext2遺伝子を欠損した胚ではプロテオグリカンのもつヘパラン硫酸鎖に特異的に合成不全を示していることがわかった.
2.ヘパラン硫酸鎖はFGFシグナルが細胞において適正に活性化するため必要である
Ext2遺伝子を欠損した胚でみられた胚体外外胚葉の形成不全の表現型に関してはFGFシグナルがはたらいていることが知られているため,FGFシグナルの下流のマーカーについて発現解析を行った.野生型胚では胚体外外胚葉においてリン酸化ERKの発現が認められるが,Ext2遺伝子を欠損した胚ではその発現は失われていた.同様に,Spry4遺伝子やDusp6/Mkp3遺伝子といったほかのFGF標的マーカーの発現もExt2遺伝子を欠損した胚では顕著に低下していることがわかった.つぎに,Ext2遺伝子を欠損した胚で観察されたFGFシグナルの不全がヘパラン硫酸鎖の欠損によるものかどうかを検討するため,in vitroにおいて全胚培養を行い,FGFの下流の遺伝子の発現解析を行った.その結果,受精後5.5日目のExt2遺伝子を欠損した胚では,野生型胚では維持されている胚体外外胚葉マーカーの発現が顕著に低下していた.一方,ヘパラン硫酸鎖と構造的にも機能的にも類似しているヘパリンを添加して培養を行うと,Ext2遺伝子を欠損した胚における胚体外外胚葉マーカーの発現が回復することがわかった.
さらに,ヘパラン硫酸鎖がFGFリガンドに対する反応性に関与しているかどうかを詳細に検討するため,受精後7.5日目の胚の外植体とFGFを含むビーズとの共培養実験を行った.野生型胚に由来する外植体ではFGF4リガンドおよびFGF8リガンドを含むビーズによりFGF標的マーカーであるSpry4遺伝子やリン酸化ERKが誘導された.一方,Ext2遺伝子を欠損した胚ではいずれのFGFリガンドによってもFGF標的マーカーは誘導されなかった.しかし,培養液にヘパリンを添加することによりExt2遺伝子を欠損した胚であってもFGF標的マーカーの発現が誘導されるようになった.以上の結果により,Ext2遺伝子を欠損した胚でみられたFGFシグナルの伝達不全はヘパラン硫酸鎖の合成異常が原因であること,また,Ext2遺伝子を欠損した胚ではFGFリガンドに対する反応性が顕著に低下していることが示唆された.
3.細胞膜の表面のヘパラン硫酸鎖は胚体外外胚葉に局所的にFGFリガンドを保持させる
ヘパラン硫酸鎖がどのようにFGFシグナルに関与しているのかを明らかにするため,受精後5.5日目の胚体外外胚葉の形成期において,FGFリガンド,FGF受容体,ヘパラン硫酸鎖,および,細胞膜の表面に係留されるタイプのプロテオグリカンであるシンデカン1の発現解析を行った.野生型胚ではFgf4 mRNAとFgf8 mRNAは胚性外胚葉(エピブラスト)の側でのみ発現が認められるのに対し,タンパク質レベルでは胚体外外胚葉のみで顕著に発現が検出され,むしろ,エピブラストではほとんど発現がみられなかった.また,Ext2遺伝子を欠損した胚ではFgf4 mRNAとFgf8 mRNAの発現は野生型胚と同じだが,タンパク質レベルでは発現がまったくみられなかった.
さらに,これらのFGFリガンドの局在がコアタンパク質の側での発現ではなくヘパラン硫酸鎖の胚体外外胚葉における特異的な発現に依存しているかどうかを検討するため,細胞膜の表面に係留されるシンデカン1の発現を解析した.その結果,ヘパラン硫酸鎖は胚体外外胚葉でより顕著に発現するのに対し,シンデカン1は野生型胚では胚体外外胚葉だけでなくエピブラスト側の細胞膜の表面でも発現がみられた.ちなみに,Ext2遺伝子を欠損した胚でもシンデカン1の発現は野生型胚と同様なパターンであった.以上の結果から,コアタンパク質ではなく,むしろ,細胞膜の表面に係留されたヘパラン硫酸鎖がFGFリガンドの保持と細胞内におけるFGFシグナルの活性化に必須な機能をはたしていることが示唆された.
4.細胞膜の表面のヘパラン硫酸鎖は隣接する細胞にFGFシグナルを拡散させる
ヘパラン硫酸鎖は細胞自律的および細胞非自律的に拡散性の成長因子の活性を制御しているものと考えられている1).そこで,胚体外外胚葉の形成過程においてヘパラン硫酸鎖のFGFシグナル活性化は,細胞自律的または細胞非自律的のどちらのシステムにより制御されているのか検討を行った.方法としては,Ext2遺伝子を欠損した胚盤胞と野生型ES細胞とのあいだでのインジェクションキメラ,および,8細胞期のExt遺伝子を欠損した胚と野生型胚とのあいだでの凝集キメラを作製することで行った.とくに,野生型の細胞(ヘパラン硫酸鎖をもつ細胞)に対し,同じ野生型の細胞,隣接するExt遺伝子を欠損した細胞,より遠方のExt遺伝子を欠損した細胞のうち,どの細胞でFGFシグナルが活性化されるのかを検討した.実際,これらのキメラ解析により細胞膜の表面に係留されたヘパラン硫酸鎖と細胞外マトリックス(基底膜)に局在するヘパラン硫酸鎖とを区別することが可能になり,野生型の細胞で発現するヘパラン硫酸鎖がヘパラン硫酸鎖を欠損する細胞において機能しうるのかどうかを特定できる.
まず,インジェクションキメラ法を用いて解析を行った.野生型胚にβガラクトシダーゼで標識したES細胞を導入し受精後6.5日目に解析したところ,導入したES細胞はエピブラスト領域にのみに分布し胚体外外胚葉などには分布していなかった.Ext2遺伝子を欠損した胚にβガラクトシダーゼで標識したES細胞を導入すると,細胞膜の表面に係留されたヘパラン硫酸鎖の発現はβガラクトシダーゼ陽性細胞のみに限定されていたが,細胞外マトリックス(基底膜)における発現はβガラクトシダーゼ陽性細胞から分泌および拡散されて胚全体に広く分布していた.細胞自律的あるいは細胞非自律的にヘパラン硫酸鎖が機能しているかどうかを検討するため,FGFシグナルの標的であるERRβおよびリン酸化ERKの発現をキメラ胚において解析した.その結果,Ext2遺伝子を欠損した胚におけるERRβの発現は胚体外外胚葉において完全に失われるのに対し,キメラ胚ではβガラクトシダーゼ陽性のエピブラスト細胞に近接する胚体外外胚葉の細胞において発現が回復した.同様に,Ext2遺伝子を欠損した胚ではみられなかったリン酸化ERKの発現も,βガラクトシダーゼ陽性のエピブラスト細胞に近接した胚体外外胚葉の細胞において発現がみられた.以上の結果は,ヘパラン硫酸鎖はエピブラストと近接した胚体外外胚葉の細胞に対しFGFシグナルを活性化できることを示唆していた.
つぎに,凝集キメラ法を用いてどれくらい離れた細胞においてまでFGFシグナルを活性化できるかを解析した.GFPで標識した野生型の8細胞期胚とExt2遺伝子を欠損した8細胞期胚とを用いた場合,2種類の細胞は完全に混ざり合いごま塩状に分布した.インジェクションキメラ法と同様にERRβとリン酸化ERKの発現を解析したところ,野生型の胚体外外胚葉の細胞と隣接したExt2遺伝子を欠損した細胞でのみFGF標的マーカーの発現が観察され,遠くに離れて存在するExt2遺伝子を欠損した細胞ではFGF標的マーカーの発現はみられなかった.キメラ胚では細胞外マトリックス(基底膜)においてヘパラン硫酸鎖が胚全体に広く認められていたにもかかわらず,野生型の細胞に近接した細胞しかレスキューはされなかった.以上の結果から,ヘパラン硫酸鎖をもつ野生型の細胞により隣接した細胞のFGFシグナルが細胞非自律的に活性化され,さらに,細胞外マトリックス(基底膜)に局在するヘパラン硫酸鎖よりも細胞膜の表面に係留されたヘパラン硫酸鎖のほうがFGFシグナルの活性化に重要な機能をはたしていることが示唆された.
5.胚体外外胚葉におけるFGFシグナルの伝達にはタンパク質の切断が関与する
キメラ解析からヘパラン硫酸鎖が近接した細胞に対し細胞非自律的にFGFシグナルを活性化できることがわかった.そこで,この細胞非自律的な現象がどのような分子機構を介しているのか明らかにするため,ヘパラン硫酸鎖の移動の過程を特異的に阻害する薬剤を用いて発現解析を行った.現在,ヘパラン硫酸鎖の移動には,平面性のトランスサイトーシス,サイトネーメ(フィロポディア),プロテアーゼやヘパラナーゼによる酵素切断,などの機構が関与しているものと提唱されている1-3)(図2).平面性のトランスサイトーシスおよびサイトネーメについてはアクチン細胞骨格に依存しているので,アクチン重合を阻害する薬剤であるサイトカラシンDを用いて影響を解析した.しかし,受精後6.5日目の野生型胚をサイトカラシンDにより処理したのち胚体外外胚葉におけるリン酸化ERKの発現を解析したが,発現低下はみられなかった.このことは,ヘパラン硫酸鎖によるFGFシグナルの活性化にはアクチン細胞骨格に依存するタイプのシグナル伝達は関与していないことを意味していた.そこで,コアタンパク質を切断するプロテアーゼ(セリンプロテアーゼ)に対して特異的な2種類の阻害剤により処理したのち胚体外外胚葉におけるリン酸化ERKの発現解析を行ったところ,発現は顕著に失われた.一方で,ヘパラン硫酸鎖を切断するヘパラナーゼの阻害剤や,セリンプロテアーゼ以外のプロテアーゼであるメタロプロテアーゼ,システインプロテアーゼ,アスパラギン酸プロテアーゼ,カルパインなどに対する阻害剤を用いて特異性を検討したが,これらの阻害剤ではリン酸化ERKの発現はまったく低下しなかった.セリンプロテアーゼ阻害剤についてFGFシグナル以外のシグナル,BMPシグナルやTGFβシグナルに対する影響を検討したが,これらのシグナル経路の標的マーカーであるSmad1,Smad5,Smad8,あるいは,Smad2のリン酸化については顕著な低下はみられなかった.以上の結果から,ヘパラン硫酸プロテオグリカンはプロテアーゼによりコアタンパク質が切断されることにより適切なFGFシグナルの活性化をひき起こすこと,このタンパク質の切断機構が細胞非自律的なFGFシグナルの活性化に関与していることが示唆された(図3).
おわりに
この研究では,哺乳動物の初期胚の発生過程においてExt2に依存して合成されるヘパラン硫酸鎖がFGFシグナルの局所的な受容を制御していることを明らかにした.また,基底膜など細胞外マトリックスに局在するヘパラン硫酸鎖より,むしろ,細胞膜の表面に係留されたヘパラン硫酸鎖が,マウス胚の発生過程においてFGFシグナルを時空間特異的に活性化するはたらきを担っていることも示された.実際,詳細は示さなかったがこの研究において,ヘパラン硫酸鎖に特異的な種々のモノクロナール抗体を用いた染色から,細胞膜の表面に係留されたヘパラン硫酸鎖の微細構造は基底膜に局在するヘパラン硫酸鎖とは異なることも明らかになった.また,ヘパラン硫酸鎖とFGFリガンドとのあいだのアフィニティーがO-6-硫酸化などヘパラン硫酸鎖の微細構造により調整されうることも示唆されている9,10).さらに,特定の脱硫酸化反応はゴルジ体ではなく細胞膜の表面で起こることからも,細胞膜の表面に係留されたヘパラン硫酸鎖が基底膜に局在するヘパラン硫酸鎖とは異なる機能を担いうることが想定される.これまで,FGFシグナルの活性化の時空間的な制御はおもにFGFリガンドとFGF受容体とが複合体を形成することによりなされているものと考えられてきた.今回の研究成果は,FGFリガンドやFGF受容体にくわえ,ヘパラン硫酸鎖が標的細胞の細胞膜の表面で局所的に発現することにより,(哺乳動物の形態形成の過程などで)適切な場所に適切なタイミングでFGFシグナルを活性化するという重要な機能をはたしていることを強く示唆した.また,この機構はFGFシグナルをより安定的に供給および伝達するための機序であると考えられ,FGFを介して形態形成を進行するための重要な分子機構となっていることが想定される.
文 献
- Haecker, U., Nybakken, K. & Perrimon, N.: Heparan sulphate proteoglycans: the sweet side of development. Nat. Rev. Mol. Cell Biol., 6, 530-541 (2005)[PubMed]
- Yan, D. & Lin, X.: Shaping morphogen gradients by proteoglycans. Cold Spring Harb. Perspect. Biol., 1, a002493 (2009)[PubMed]
- Bishop, J. R., Schuksz, M. & Esko, J. D.: Heparan sulphate proteoglycans fine-tune mammalian physiology. Nature, 446, 1030-1037 (2007)[PubMed]
- Lind, T., Tufaro, F., McCormick, C. et al.: The putative tumor suppressors EXT1 and EXT2 are glycosyltransferases required for the biosynthesis of heparan sulfate. J. Biol. Chem., 273, 26265-26268 (1998)[PubMed]
- Wuyts, W., Van Hul, W., Wauters, J. et al.: Positional cloning of a gene involved in hereditary multiple exostoses. Hum. Mol. Genet., 5, 1547-1557 (1996)[PubMed]
- Stickens, D., Clines, G., Burbee, D. et al.: The EXT2 multiple exostoses gene defines a family of putative tumour suppressor genes. Nat. Genet., 14, 25-32 (1996)[PubMed]
- Stickens, D., Zak, B. M., Rougier, N. et al.: Mice deficient in Ext2 lack heparan sulfate and develop exostoses. Development, 132, 5055-5068 (2005)[PubMed]
- Lin, X., Wei, G., Shi, Z. et al.: Disruption of gastrulation and heparan sulfate biosynthesis in EXT1-deficient mice. Dev. Biol., 224, 299-311 (2000)[PubMed]
- Nakato, H. & Kimata, K.: Heparan sulfate fine structure and specificity of proteoglycan functions. Biochim. Biophys. Acta, 1573, 312-318 (2002)[PubMed]
- Lai, J. P., Sandhu, D. S., Yu, C. et al.: Sulfatase 2 up-regulates glypican 3, promotes fibroblast growth factor signaling, and decreases survival in hepatocellular carcinoma. Hepatology, 47, 1211-1222 (2008)[PubMed]
著者プロフィール
略歴:2006年より大阪府立母子保健総合医療センター研究所 研究技術員.
木村-吉田千春(Chiharu Kimura-Yoshida)
大阪府立母子保健総合医療センター研究所 研究員,大阪大学大学院歯学系研究科 招へい准教授 兼任.
松尾 勲(Isao Matsuo)
大阪府立母子保健総合医療センター研究所 部長,大阪大学大学院 医学系研究科 招へい教授 兼任.
研究室URL:http://www.med.osaka-u.ac.jp/pub/inst-mch/Byo/Byo.html
© 2011 下川佳世・木村-吉田千春・松尾 勲 Licensed under CC 表示 2.1 日本