bHLH型転写因子E2aとその抑制タンパク質Id3によるT細胞の分化調節の機構
宮崎正輝・Cornelis Murre
(米国California大学San Diego校,Department of Molecular Biology)
email:宮崎正輝
DOI: 10.7875/first.author.2011.142
The opposing roles of the transcription factor E2A and its antagonist Id3 that orchestrate and enforce the naive fate of T cells.
Masaki Miyazaki, Richard R. Rivera, Kazuko Miyazaki, Yin C. Lin, Yasutoshi Agata, Cornelis Murre
Nature Immunology, 12, 992-1001 (2011)
bHLH型転写因子であるE2Aはおもにエンハンサーとして遺伝子発現に寄与し,T細胞およびB細胞の分化に必須であることが知られている.さらに,その抑制タンパク質であるId3もT細胞の分化のチェックポイントにおいて重要な機能をもつことが報告されている.今回,筆者らは,T細胞の初期分化のチェックポイントにおけるE2Aの結合様式の変化についてゲノムワイド解析を行った.また,Id3ノックアウトマウスの解析によりId3によるE2Aの活性化制御の生物学的な意義を検討した.Id3の欠損によりマウスの胸腺ではナイーブT細胞がエフェクター細胞あるいはメモリー細胞へと分化し,さらにその一部は異所性に濾胞性ヘルパーT細胞様へと分化して,胸腺においてB細胞の濾胞を形成した.以上のことより,E2AはT細胞の初期分化において遺伝子発現プログラムを始動させていること,Id3によるE2Aの活性化制御はナイーブT細胞への分化を促進させ,また,それを維持することに必須であることが示唆された.
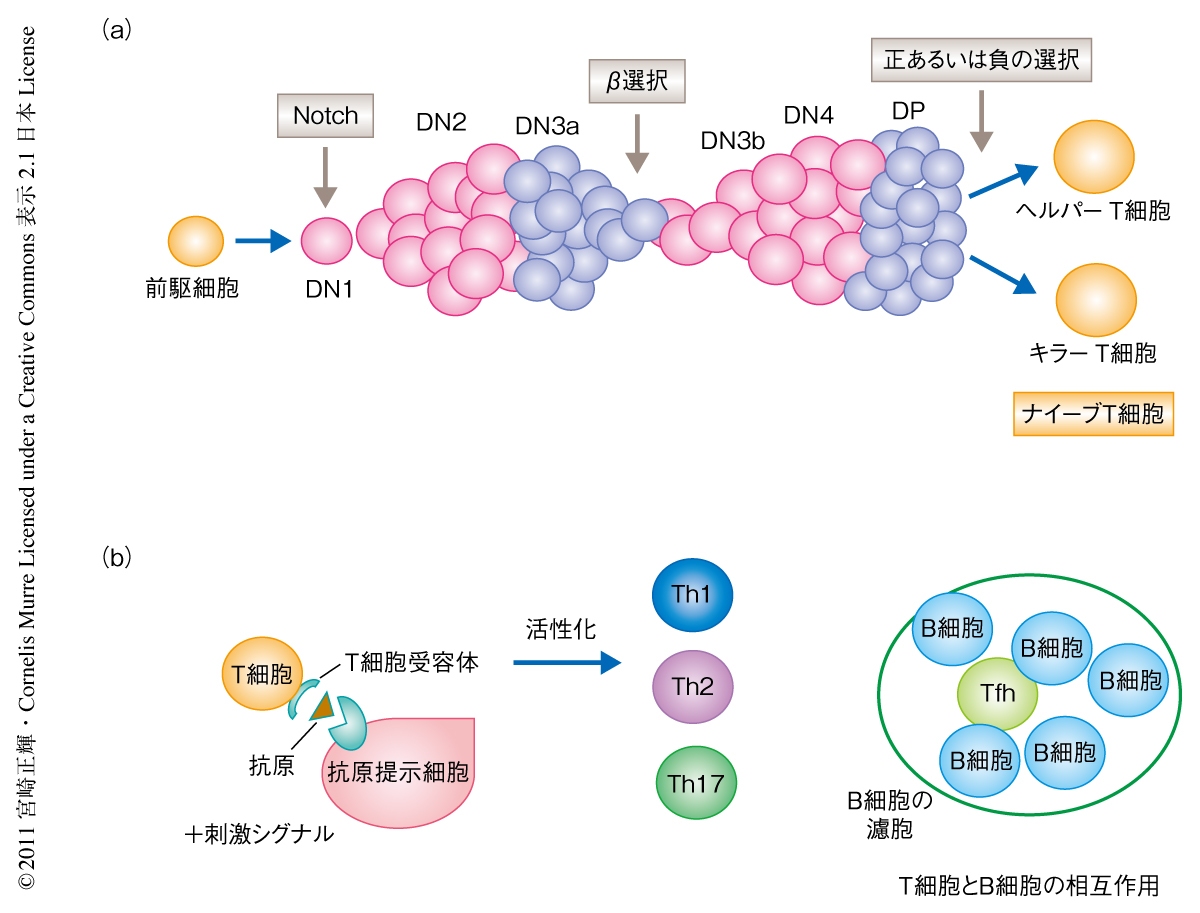
T細胞は感染,自己免疫疾患,がん細胞免疫などの免疫反応において中心的な役割を担うため,その活性化制御の機構解明は非常に重要な課題である.T細胞の分化は骨髄の多能性前駆細胞が胸腺へと移入しT細胞系列を決定することではじまる.それぞれの分化段階は表面マーカーにより規定されている.すなわち,もっとも未熟な段階であるCD4 CD8二重陰性細胞(DN)からCD4 CD8二重陽性細胞(DP),そして,成熟段階であるCD4陽性細胞(SP)またはCD8陽性細胞(SP)に分けられる.DN細胞の段階でT細胞受容体のβ鎖の遺伝子再構成が行われ,機能的なT細胞受容体β鎖をもつようになった前駆細胞はつぎの分化段階であるDP細胞へと進む.このT細胞受容体の選択の過程をβ選択とよぶ.DP細胞へと分化したT細胞はT細胞受容体のもうひとつの鎖であるα鎖の遺伝子再構成を行い,これによりT細胞受容体は完成する.そののち,自己反応性のT細胞や無反応性のT細胞が取り除かれ機能性のT細胞が選択される(正の選択および負の選択).この選択をうけたT細胞は成熟したナイーブT細胞(ヘルパー細胞あるいはキラー細胞)となり胸腺から末梢のリンパ組織へと移行する.そして,末梢リンパ組織において,T細胞受容体を介して抗原提示細胞からの抗原提示をうけると活性化し免疫反応を起こす(図1).このT細胞の分化過程における大きな疑問点は,これらのT細胞の選択はどのような機構で制御されているのか,そして,ナイーブT細胞はどのようにして維持されているのか,という点である.これらの制御機構の破綻は自己免疫疾患やリンパ腫の発生につながるものであり,その解明は免疫学における重要な課題のひとつである.
E2Aは塩基性ヘリックス-ループ-ヘリックス(basic helix-loop-helix:bHLH)構造をもち特定のDNA配列に結合する転写因子である.HEBあるいはE2-2などとともにEタンパク質とよばれ,T細胞およびB細胞の分化において重要な転写因子であり,リンパ腫の発生に関与していることも報告されている1).T細胞の分化においては,E2AはT細胞系列の決定に重要であり,Notchシグナルとの関連性も報告されているが2),詳細な機構についてはいまだ解明されていない.E2AはとくにB細胞の初期分化において必須であり,筆者らのグループは,E2Aの結合とクロマチン修飾,さらに,FOXO1あるいはEBFなどB細胞に特異的な転写因子との関連性についてゲノムワイドな解析を報告している3).一方,T細胞の分化の過程におけるE2Aの結合についてのゲノムワイドな解析はなされておらず,T細胞とB細胞の違いとE2Aの結合様式の変化とのあいだに関連性はあるかなど大きな興味がもたれる.さらに,E2Aはβ選択においても重要な制御タンパク質であることが知られているが,E2Aの機能がゲノムワイドでどのように変化することがβ選択を推進するのかなど非常に興味深い.一方,IdはDNA結合能をもたずEタンパク質とヘテロ二量体を形成することでEタンパク質の機能を阻害するものと考えられている.とくに,Id3は,プレT細胞受容体あるいはT細胞受容体からのシグナルにより誘導され,正の選択および負の選択において機能をもつことが報告されている.そこで,Id3によるE2Aの転写活性化の制御がT細胞の分化においてどのような機能をもつのか,そして,その生物学的な意義はどのようなものなのかについて,クロマチン免疫沈降-シークエンス(ChIP-seq)法によりゲノムワイドに検討し,さらに,Id3ノックアウトマウスを詳細に解析することでその意義を明らかにしようと試みた.
Id3-GFPノックインマウスを用いてId3の遺伝子発現量を,E2A-GFP融合タンパク質ノックインマウスを用いてE2Aのタンパク質量を検討した.その結果,Id3はβ選択を終了した直後のT細胞において発現しはじめ,さらに,正の選択および負の選択を終了したT細胞においてさらに発現が上昇することを発見した.そして,胸腺のナイーブT細胞および末梢リンパ組織のナイーブT細胞では高い発現が維持されるが,メモリー細胞においては高発現と低発現の2種類の細胞を認めた.一方,E2AはCD4 CD8二重陰性細胞までの段階では発現は高く維持されているが,ナイーブT細胞に分化すると発現が低下し胸腺および末梢リンパ組織のナイーブT細胞では非常に低い発現を示すことが明らかとなった.
T細胞の分化におけるE2Aによる遺伝子発現制御についてChIP-seq法によりゲノムワイドに解析した.Rag2ノックアウト胸腺細胞は遺伝子再構成を行えないためβ選択のまえで細胞分化が止まってしまうが,そこに抗CD3抗体によりシグナルを導入することでβ選択を起こし分化することが知られている.この方法を用いて,in vivoにおけるβ選択の前後の細胞を大量に集めChIP-seq法による解析を行った.その結果,約1000個のE2A標的遺伝子を同定し,さらにそれらの多くの遺伝子座においてβ選択シグナルによりE2Aの結合が外れることをみつけた.モチーフ検索によりE2A結合部位の近辺にはRunx結合配列およびEts1結合配列のあることがわかった.さらに,Tal/SclのEボックス配列も認められた.これらの結合配列との結合はβ選択シグナルにより消失することから,β選択シグナルとE2A結合の選択性が明らかになった.Id3はβ選択シグナルにより上昇することから,これらのE2A結合部位の選択はId3によるものであることが示唆された.さらに具体的にE2A標的遺伝子をみてみると,Notch1,Notch3,Hes1,Ptcra,Rag1,Rag2,Cd3e,Rorc,Gfi1などT細胞系列の決定に重要な遺伝子のほとんどがE2Aの標的遺伝子になっていることがわかった.さらに,TCRシグナルの下流においてもっとも重要なタンパク質であるZap70も,E2AおよびId3により調節されていることがノックアウトマウスを用いて証明された.T細胞受容体β鎖遺伝子がE2Aにより調節されているとの以前の報告とあわせて考えると4),E2AはT細胞の初期分化に必須な多くのキーファクターの上流に位置してT細胞系列の遺伝子発現プログラムを始動させていること,さらに,β選択シグナルによる遺伝子発現ネットワークの変化はE2Aの結合様式の変化によることが示唆された.
Id3ノックアウトマウスではγδT細胞が異常に増加すること5),CD8陽性T細胞がイネート様T細胞へと分化していることが報告されている6).そこで,CD4陽性T細胞についても解析を進めた.Id3ノックアウトマウスでは,CD4陽性T細胞は末梢リンパ組織へと移行しなくても胸腺においてすでにCD44を高発現し,さらにTh1細胞のようにインターフェロンγ産生細胞へと分化していた.さらに,PLZFやEomesといったナチュラルキラーT細胞やキラーT細胞に特異的な転写因子を異常に発現していることもわかった.これらのことは,胸腺においてもエフェクターT細胞あるいはメモリーT細胞へと分化しうることを示しており,これは非常に驚くべきことであった.さらに,正常な胸腺ではみられない,濾胞性ヘルパーT細胞様の細胞を認めた.この細胞は,通常,末梢リンパ組織のB細胞における濾胞の形成に必要と考えられている.そして,胸腺におけるB細胞の増加を認め,さらには4~6ヶ月齢のId3ノックアウトマウスにおいて胸腺での明らかなB細胞の濾胞の形成を認めた.さらに,濾胞性ヘルパーT細胞に特異的な転写因子であるBcl6の発現上昇も認めた.胸腺におけるB細胞の濾胞の形成は重症筋無力症や胸腺種などの自己免疫疾患においても認められることから,今回の発見がこうした自己免疫疾患の発症となんらかの関連のあることが期待される.
さらに,こうしたCD4陽性T細胞の異常な分化が完全ではないがE2Aの活性に依存していることを,E2Aコンディショナルノックアウトマウスを用いて証明した.さらにId3ノックアウトCD4陽性T細胞ではメモリーT細胞のマーカーであるCD122が異常に上昇していることをみつけた.そして,濾胞性ヘルパーT細胞のマーカーであるCXCR5とCD122の遺伝子がE2Aの直接の標的遺伝子であること,さらに,Id3の欠損によりこれらの標的遺伝子のエンハンサー領域においてE2Aの結合が上昇していることを見い出した.以上のことから,Id3はE2Aの活性化を制御することで標的遺伝子の適切な発現を調節し,それによりナイーブT細胞がナイーブである状態を維持することに大きく寄与していることを明らかにした(図2).最後に,末梢リンパ組織においても胸腺と同様に,ナイーブCD4陽性T細胞が減少していること,濾胞性ヘルパーT細胞が異常に増加していること,エフェクターT細胞あるいはメモリーT細胞への分化が進んでいることを,蛍光セルソーターおよび組織染色法を用いて示した.しかしながら,胸腺においてすでにエフェクターT細胞あるいはメモリーT細胞へと分化してしまっていることから,末梢リンパ組織におけるCD4陽性T細胞のナイーブな状態はId3によりどのように維持されているのかは明らかではない.
筆者らは,現在,末梢リンパ組織でのナイーブな状態はどのように維持されているのか,そして,T細胞の活性化によりその転写制御機構はどのように変化していくのかについて,末梢リンパ組織に特化したかたちでの解明をめざし研究を進めている.
略歴:2005年 広島大学大学院医歯薬学総合研究科 修了,同年 同 助教を経て,2009年より米国California大学San Diego校.
研究テーマ:リンパ球の分化および活性化における転写制御機構の解明.
抱負:自分の実験データから大きな疑問点をみつけだしそれを解き明かしたい.表面的な物事にとらわれず真実は何なのか追求していきたい.
Cornelis Murre
米国California大学San Diego校にてProfessor.
研究室URL:http://biology.ucsd.edu/labs/murre/
© 2011 宮崎正輝・Cornelis Murre Licensed under CC 表示 2.1 日本
(米国California大学San Diego校,Department of Molecular Biology)
email:宮崎正輝
DOI: 10.7875/first.author.2011.142
The opposing roles of the transcription factor E2A and its antagonist Id3 that orchestrate and enforce the naive fate of T cells.
Masaki Miyazaki, Richard R. Rivera, Kazuko Miyazaki, Yin C. Lin, Yasutoshi Agata, Cornelis Murre
Nature Immunology, 12, 992-1001 (2011)
要 約
bHLH型転写因子であるE2Aはおもにエンハンサーとして遺伝子発現に寄与し,T細胞およびB細胞の分化に必須であることが知られている.さらに,その抑制タンパク質であるId3もT細胞の分化のチェックポイントにおいて重要な機能をもつことが報告されている.今回,筆者らは,T細胞の初期分化のチェックポイントにおけるE2Aの結合様式の変化についてゲノムワイド解析を行った.また,Id3ノックアウトマウスの解析によりId3によるE2Aの活性化制御の生物学的な意義を検討した.Id3の欠損によりマウスの胸腺ではナイーブT細胞がエフェクター細胞あるいはメモリー細胞へと分化し,さらにその一部は異所性に濾胞性ヘルパーT細胞様へと分化して,胸腺においてB細胞の濾胞を形成した.以上のことより,E2AはT細胞の初期分化において遺伝子発現プログラムを始動させていること,Id3によるE2Aの活性化制御はナイーブT細胞への分化を促進させ,また,それを維持することに必須であることが示唆された.
はじめに
T細胞は感染,自己免疫疾患,がん細胞免疫などの免疫反応において中心的な役割を担うため,その活性化制御の機構解明は非常に重要な課題である.T細胞の分化は骨髄の多能性前駆細胞が胸腺へと移入しT細胞系列を決定することではじまる.それぞれの分化段階は表面マーカーにより規定されている.すなわち,もっとも未熟な段階であるCD4 CD8二重陰性細胞(DN)からCD4 CD8二重陽性細胞(DP),そして,成熟段階であるCD4陽性細胞(SP)またはCD8陽性細胞(SP)に分けられる.DN細胞の段階でT細胞受容体のβ鎖の遺伝子再構成が行われ,機能的なT細胞受容体β鎖をもつようになった前駆細胞はつぎの分化段階であるDP細胞へと進む.このT細胞受容体の選択の過程をβ選択とよぶ.DP細胞へと分化したT細胞はT細胞受容体のもうひとつの鎖であるα鎖の遺伝子再構成を行い,これによりT細胞受容体は完成する.そののち,自己反応性のT細胞や無反応性のT細胞が取り除かれ機能性のT細胞が選択される(正の選択および負の選択).この選択をうけたT細胞は成熟したナイーブT細胞(ヘルパー細胞あるいはキラー細胞)となり胸腺から末梢のリンパ組織へと移行する.そして,末梢リンパ組織において,T細胞受容体を介して抗原提示細胞からの抗原提示をうけると活性化し免疫反応を起こす(図1).このT細胞の分化過程における大きな疑問点は,これらのT細胞の選択はどのような機構で制御されているのか,そして,ナイーブT細胞はどのようにして維持されているのか,という点である.これらの制御機構の破綻は自己免疫疾患やリンパ腫の発生につながるものであり,その解明は免疫学における重要な課題のひとつである.
E2Aは塩基性ヘリックス-ループ-ヘリックス(basic helix-loop-helix:bHLH)構造をもち特定のDNA配列に結合する転写因子である.HEBあるいはE2-2などとともにEタンパク質とよばれ,T細胞およびB細胞の分化において重要な転写因子であり,リンパ腫の発生に関与していることも報告されている1).T細胞の分化においては,E2AはT細胞系列の決定に重要であり,Notchシグナルとの関連性も報告されているが2),詳細な機構についてはいまだ解明されていない.E2AはとくにB細胞の初期分化において必須であり,筆者らのグループは,E2Aの結合とクロマチン修飾,さらに,FOXO1あるいはEBFなどB細胞に特異的な転写因子との関連性についてゲノムワイドな解析を報告している3).一方,T細胞の分化の過程におけるE2Aの結合についてのゲノムワイドな解析はなされておらず,T細胞とB細胞の違いとE2Aの結合様式の変化とのあいだに関連性はあるかなど大きな興味がもたれる.さらに,E2Aはβ選択においても重要な制御タンパク質であることが知られているが,E2Aの機能がゲノムワイドでどのように変化することがβ選択を推進するのかなど非常に興味深い.一方,IdはDNA結合能をもたずEタンパク質とヘテロ二量体を形成することでEタンパク質の機能を阻害するものと考えられている.とくに,Id3は,プレT細胞受容体あるいはT細胞受容体からのシグナルにより誘導され,正の選択および負の選択において機能をもつことが報告されている.そこで,Id3によるE2Aの転写活性化の制御がT細胞の分化においてどのような機能をもつのか,そして,その生物学的な意義はどのようなものなのかについて,クロマチン免疫沈降-シークエンス(ChIP-seq)法によりゲノムワイドに検討し,さらに,Id3ノックアウトマウスを詳細に解析することでその意義を明らかにしようと試みた.
1.Id3およびE2Aの発現誘導
Id3-GFPノックインマウスを用いてId3の遺伝子発現量を,E2A-GFP融合タンパク質ノックインマウスを用いてE2Aのタンパク質量を検討した.その結果,Id3はβ選択を終了した直後のT細胞において発現しはじめ,さらに,正の選択および負の選択を終了したT細胞においてさらに発現が上昇することを発見した.そして,胸腺のナイーブT細胞および末梢リンパ組織のナイーブT細胞では高い発現が維持されるが,メモリー細胞においては高発現と低発現の2種類の細胞を認めた.一方,E2AはCD4 CD8二重陰性細胞までの段階では発現は高く維持されているが,ナイーブT細胞に分化すると発現が低下し胸腺および末梢リンパ組織のナイーブT細胞では非常に低い発現を示すことが明らかとなった.
2.E2A結合部位のゲノムワイド解析
T細胞の分化におけるE2Aによる遺伝子発現制御についてChIP-seq法によりゲノムワイドに解析した.Rag2ノックアウト胸腺細胞は遺伝子再構成を行えないためβ選択のまえで細胞分化が止まってしまうが,そこに抗CD3抗体によりシグナルを導入することでβ選択を起こし分化することが知られている.この方法を用いて,in vivoにおけるβ選択の前後の細胞を大量に集めChIP-seq法による解析を行った.その結果,約1000個のE2A標的遺伝子を同定し,さらにそれらの多くの遺伝子座においてβ選択シグナルによりE2Aの結合が外れることをみつけた.モチーフ検索によりE2A結合部位の近辺にはRunx結合配列およびEts1結合配列のあることがわかった.さらに,Tal/SclのEボックス配列も認められた.これらの結合配列との結合はβ選択シグナルにより消失することから,β選択シグナルとE2A結合の選択性が明らかになった.Id3はβ選択シグナルにより上昇することから,これらのE2A結合部位の選択はId3によるものであることが示唆された.さらに具体的にE2A標的遺伝子をみてみると,Notch1,Notch3,Hes1,Ptcra,Rag1,Rag2,Cd3e,Rorc,Gfi1などT細胞系列の決定に重要な遺伝子のほとんどがE2Aの標的遺伝子になっていることがわかった.さらに,TCRシグナルの下流においてもっとも重要なタンパク質であるZap70も,E2AおよびId3により調節されていることがノックアウトマウスを用いて証明された.T細胞受容体β鎖遺伝子がE2Aにより調節されているとの以前の報告とあわせて考えると4),E2AはT細胞の初期分化に必須な多くのキーファクターの上流に位置してT細胞系列の遺伝子発現プログラムを始動させていること,さらに,β選択シグナルによる遺伝子発現ネットワークの変化はE2Aの結合様式の変化によることが示唆された.
3.Id3によりナイーブT細胞はナイーブな状態が維持されている
Id3ノックアウトマウスではγδT細胞が異常に増加すること5),CD8陽性T細胞がイネート様T細胞へと分化していることが報告されている6).そこで,CD4陽性T細胞についても解析を進めた.Id3ノックアウトマウスでは,CD4陽性T細胞は末梢リンパ組織へと移行しなくても胸腺においてすでにCD44を高発現し,さらにTh1細胞のようにインターフェロンγ産生細胞へと分化していた.さらに,PLZFやEomesといったナチュラルキラーT細胞やキラーT細胞に特異的な転写因子を異常に発現していることもわかった.これらのことは,胸腺においてもエフェクターT細胞あるいはメモリーT細胞へと分化しうることを示しており,これは非常に驚くべきことであった.さらに,正常な胸腺ではみられない,濾胞性ヘルパーT細胞様の細胞を認めた.この細胞は,通常,末梢リンパ組織のB細胞における濾胞の形成に必要と考えられている.そして,胸腺におけるB細胞の増加を認め,さらには4~6ヶ月齢のId3ノックアウトマウスにおいて胸腺での明らかなB細胞の濾胞の形成を認めた.さらに,濾胞性ヘルパーT細胞に特異的な転写因子であるBcl6の発現上昇も認めた.胸腺におけるB細胞の濾胞の形成は重症筋無力症や胸腺種などの自己免疫疾患においても認められることから,今回の発見がこうした自己免疫疾患の発症となんらかの関連のあることが期待される.
さらに,こうしたCD4陽性T細胞の異常な分化が完全ではないがE2Aの活性に依存していることを,E2Aコンディショナルノックアウトマウスを用いて証明した.さらにId3ノックアウトCD4陽性T細胞ではメモリーT細胞のマーカーであるCD122が異常に上昇していることをみつけた.そして,濾胞性ヘルパーT細胞のマーカーであるCXCR5とCD122の遺伝子がE2Aの直接の標的遺伝子であること,さらに,Id3の欠損によりこれらの標的遺伝子のエンハンサー領域においてE2Aの結合が上昇していることを見い出した.以上のことから,Id3はE2Aの活性化を制御することで標的遺伝子の適切な発現を調節し,それによりナイーブT細胞がナイーブである状態を維持することに大きく寄与していることを明らかにした(図2).最後に,末梢リンパ組織においても胸腺と同様に,ナイーブCD4陽性T細胞が減少していること,濾胞性ヘルパーT細胞が異常に増加していること,エフェクターT細胞あるいはメモリーT細胞への分化が進んでいることを,蛍光セルソーターおよび組織染色法を用いて示した.しかしながら,胸腺においてすでにエフェクターT細胞あるいはメモリーT細胞へと分化してしまっていることから,末梢リンパ組織におけるCD4陽性T細胞のナイーブな状態はId3によりどのように維持されているのかは明らかではない.
おわりに
筆者らは,現在,末梢リンパ組織でのナイーブな状態はどのように維持されているのか,そして,T細胞の活性化によりその転写制御機構はどのように変化していくのかについて,末梢リンパ組織に特化したかたちでの解明をめざし研究を進めている.
文 献
- Murre C.: Helix-loop-helix proteins and lymphocyte development. Nat. Immunol., 6, 1079-1086 (2005)[PubMed]
- Ikawa, T., Kawamoto, H., Goldrath, A. W. et al.: E proteins and Notch signaling cooperate to promote T cell lineage specification and commitment. J. Exp. Med., 203, 1329-1342 (2006)[PubMed]
- Lin, Y. C., Jhunjhunwala, S., Benner, C. et al.: A global network of transcription factors, involving E2A, EBF1 and Foxo1, that orchestrates B cell fate. Nat. Immunol., 11, 635-643 (2010)[PubMed]
- Agata, Y., Tamaki, N., Sakamoto, S. et al.: Regulation of T cell receptor β gene rearrangements and allelic exclusion by the helix-loop-helix protein, E47. Immunity, 27, 871-884 (2007)[PubMed]
- Ueda-Hayakawa, I., Mahlios, J. & Zhuang, Y.: Id3 restricts the developmental potential of gamma delta lineage during thymopoiesis. J. Immunol., 182, 5306-5316 (2009)[PubMed]
- Verykokakis, M., Boos, M. D., Bendelac, A. et al.: SAP protein-dependent natural killer T-like cells regulate the development of CD8+ T cells with innate lymphocyte characteristics. Immunity, 33, 203-215 (2010)[PubMed]
著者プロフィール
略歴:2005年 広島大学大学院医歯薬学総合研究科 修了,同年 同 助教を経て,2009年より米国California大学San Diego校.
研究テーマ:リンパ球の分化および活性化における転写制御機構の解明.
抱負:自分の実験データから大きな疑問点をみつけだしそれを解き明かしたい.表面的な物事にとらわれず真実は何なのか追求していきたい.
Cornelis Murre
米国California大学San Diego校にてProfessor.
研究室URL:http://biology.ucsd.edu/labs/murre/
© 2011 宮崎正輝・Cornelis Murre Licensed under CC 表示 2.1 日本