動原体の完全な3次元追跡による哺乳類の卵母細胞における相同染色体の両方向性の獲得の解析
北島智也・Jan Ellenberg
(ドイツEuropean Molecular Biology Laboratory,Cell Biology and Biophysics Unit)
email:北島智也
DOI: 10.7875/first.author.2011.137
Complete kinetochore tracking reveals error-prone homologous chromosome biorientation in mammalian oocytes.
Tomoya S. Kitajima, Miho Ohsugi, Jan Ellenberg
Cell, 146, 568-581 (2011)
分裂後期において染色体を娘細胞に均等に分配するためには,それ以前に染色体の動原体ペアが微小管により紡錘体の両極に引っ張られることで,染色体の両方向性が確立していることが必要である.しかしながら,中心体をもたない紡錘体をもつ卵母細胞において,染色体がどのように両方向性を獲得し,また,それがどのように紡錘体の形成や染色体の紡錘体の赤道面への集合といったイベントと協調しているかについては,詳細は明らかになっていない.今回,筆者らは,マウスの卵母細胞の減数第1分裂において,細胞分裂をつうじてすべての動原体の挙動を完全に3次元で追跡することにはじめて成功した.このデータを定量的かつ網羅的に解析することにより以下の知見を得た.染色体の紡錘体の赤道面への集合は両方向性の獲得より早くに起こり,これまで見すごされていた染色体配置である“前中期ベルト”を形成した.そののち,染色体は伸長している紡錘体の中心へ侵入し中期板を形成した.染色体はこの時期に両方向性の獲得の試みを開始したが,9割近くの染色体はいちどの試みでは安定な両方向性を獲得できず,動原体と微小管との接続の修正をへることにより安定な両方向性を獲得することができた.このことは,哺乳類の卵母細胞における相同染色体の両方向性の獲得は誤りやすいという性質をもつことを示しており,ヒトを含めた哺乳類の卵子で染色体数異常の発生率が高いことの理由を説明するかもしれない.
細胞は遺伝情報を維持するため分裂の際に娘細胞に染色体を正確に分配しなくてはならない.ところが,哺乳類の卵母細胞の減数第1分裂においては,染色体が不均等に分配される頻度がほかの分裂に比べ高いことが知られている1).このような失敗により形成された染色体数が異常な卵子は,受精してもその多くが生きられず流産にいたり,出産まで生きたとしてもダウン症など重篤な先天性疾患をひき起こす.この不均等分配の頻度は母体の年齢とともに上昇することがわかっており,そのリスクは現代社会における少子化の一因であるとも考えられるが,なぜ卵母細胞において染色体の不均等分配の頻度が高いのかはわかっていない.
分裂後期に染色体を均等に分配するためには,それ以前の分裂中期のおわりまでに準備が適切に完了している必要がある.すなわち,すべての染色体において動原体ペアが微小管により反対方向から捕捉され,紡錘体の両極に引っ張られて(染色体の両方向性の確立),紡錘体の赤道面に集合していなくてはならない.
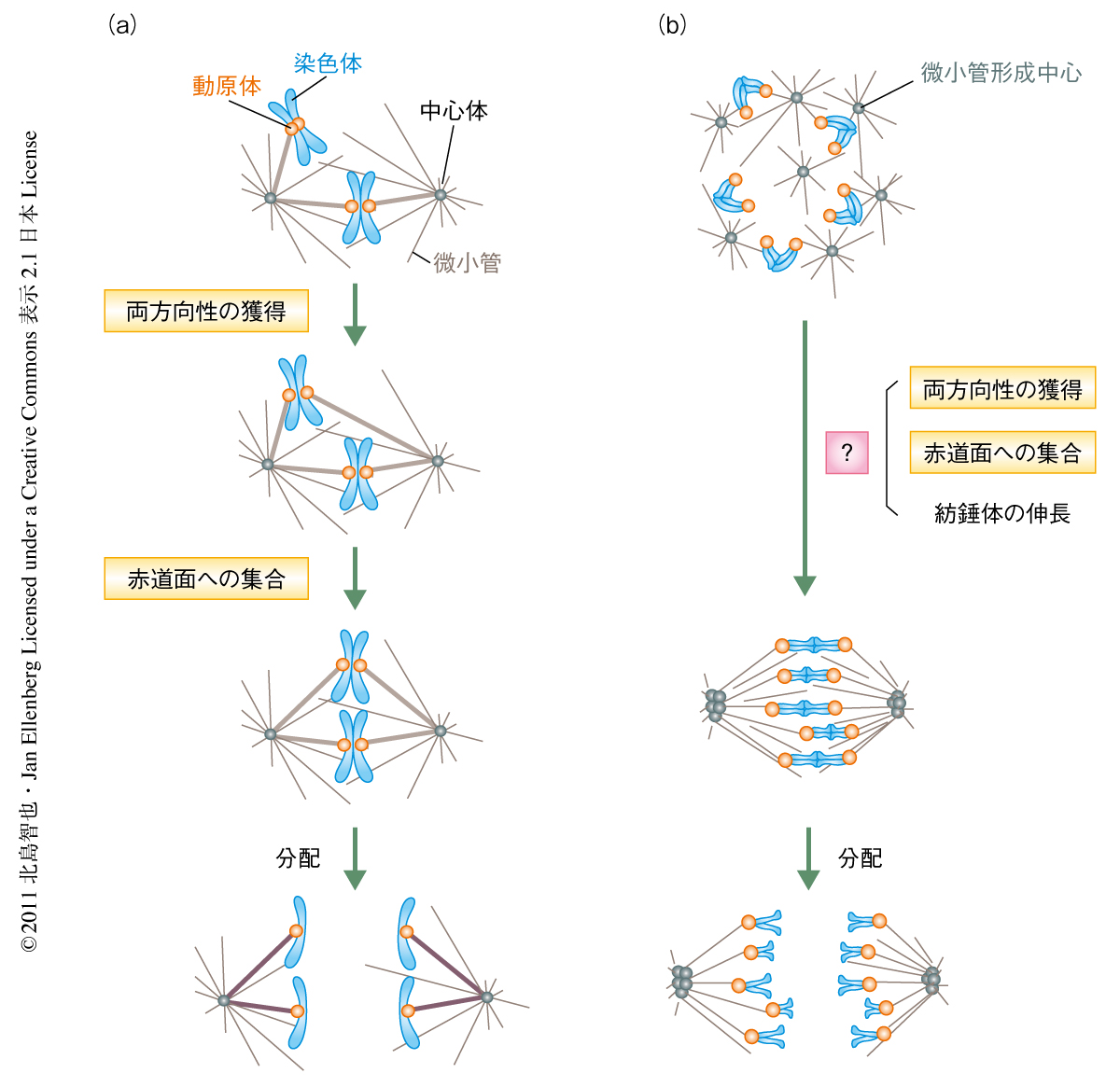
これらの過程の機構については体細胞分裂の研究からの知見が比較的豊富であり,これをもとに,教科書などでも以下のような“探索と捕捉”(search-and-capture)モデルを用いた説明がなされている2-4)(図1a).分裂期に入ると2つの中心体は微小管を伸長させ,これらが紡錘体の極となる.やがて微小管が動原体ペアを反対方向から捕捉すると,この動原体と微小管との接続が安定化され,染色体の両方向性が確立する.両方向性を獲得した染色体は,反対方向からの力がつりあう地点である紡錘体の赤道面へと移動する.すなわちこのモデルにおいては,染色体の両方向性の確立と紡錘体の赤道面への集合のうち,先行するのは前者である.
これに対し,哺乳類の卵母細胞は紡錘体の2極を既定すべき中心体をもっていない.その代わり,細胞質に中心小体を含まない微小管形成中心を80以上もっている5).減数第1分裂に入ると,まずはこれらが自己集合することにより極をもたない球状の紡錘体を形成する.やがて,微小管形成中心が反対極へと移動することで紡錘体が伸長し双極性の紡錘体となる.分裂中期のおわりまでに,染色体は相同染色体の動原体ペアが両極へ引っ張られることで両方向性を獲得し,紡錘体の赤道面に集合する(図1b).このように複雑な紡錘体と染色体の動態をもつ卵母細胞において,体細胞分裂で用いられた単純な探索と捕捉モデルがあてはまることは考えにくく3),大きな3つのイベント,染色体の両方向性の獲得,赤道面への集合,紡錘体の伸長,の機能的な相関はおろか,時間的な順序すら明らかになっていなかった.
哺乳類の卵母細胞における染色体の動態を解析するため,分子遺伝学的な手法が有効でもっともヒトに近いモデルであるマウスの卵母細胞を用いた.減数第1分裂の前期において停止させた卵母細胞に蛍光タンパク質と融合させたマーカータンパク質のmRNAをマイクロインジェクションすることで細胞内における構造を可視化することができる6).ここでは,染色体をヒストン2BとmCherryとの融合タンパク質で,動原体をEGFPとCENP-Cとの融合タンパク質で標識した.卵母細胞の生細胞イメージングにおける技術的な困難は,卵母細胞のサイズが直径約80μmと大きいことと,減数第1分裂が8時間以上と長時間に及ぶことである.これらの問題を解決するため,筆者らの研究室で開発された顕微鏡を自動化させるマクロを利用した5,7).このマクロは細胞のなかで染色体の存在する領域を自動検出し,これをズームしてその領域のみスキャンすることを可能にした.これにより,スキャンに要する時間の短縮および細胞毒性の削減を実現し,可能なかぎりの高解像度で染色体および動原体を4次元で録画することに成功した.長時間に及ぶ高解像度の生細胞イメージングは膨大な画像セットを生成する.これらのデータから染色体の動態を効率よく,かつ,きわめて詳細に解析するため,動原体の挙動を3次元で追跡するコンピューターパイプラインを確立した.これにより,あらゆる細胞分裂で成功していなかったすべての動原体の完全な3次元追跡が,マウス卵母細胞の減数第1分裂においてはじめて実現した.この完全なデータセットは細胞分裂における染色体の動態を理解するための共通のリソースとしてWebで公開されている(http://www.ellenberg.embl.de/apps/KTTracking/).このデータセットを定量的および網羅的に解析することにより,染色体の両方向性の獲得と赤道面への集合について,以下のような新しい知見を得た.
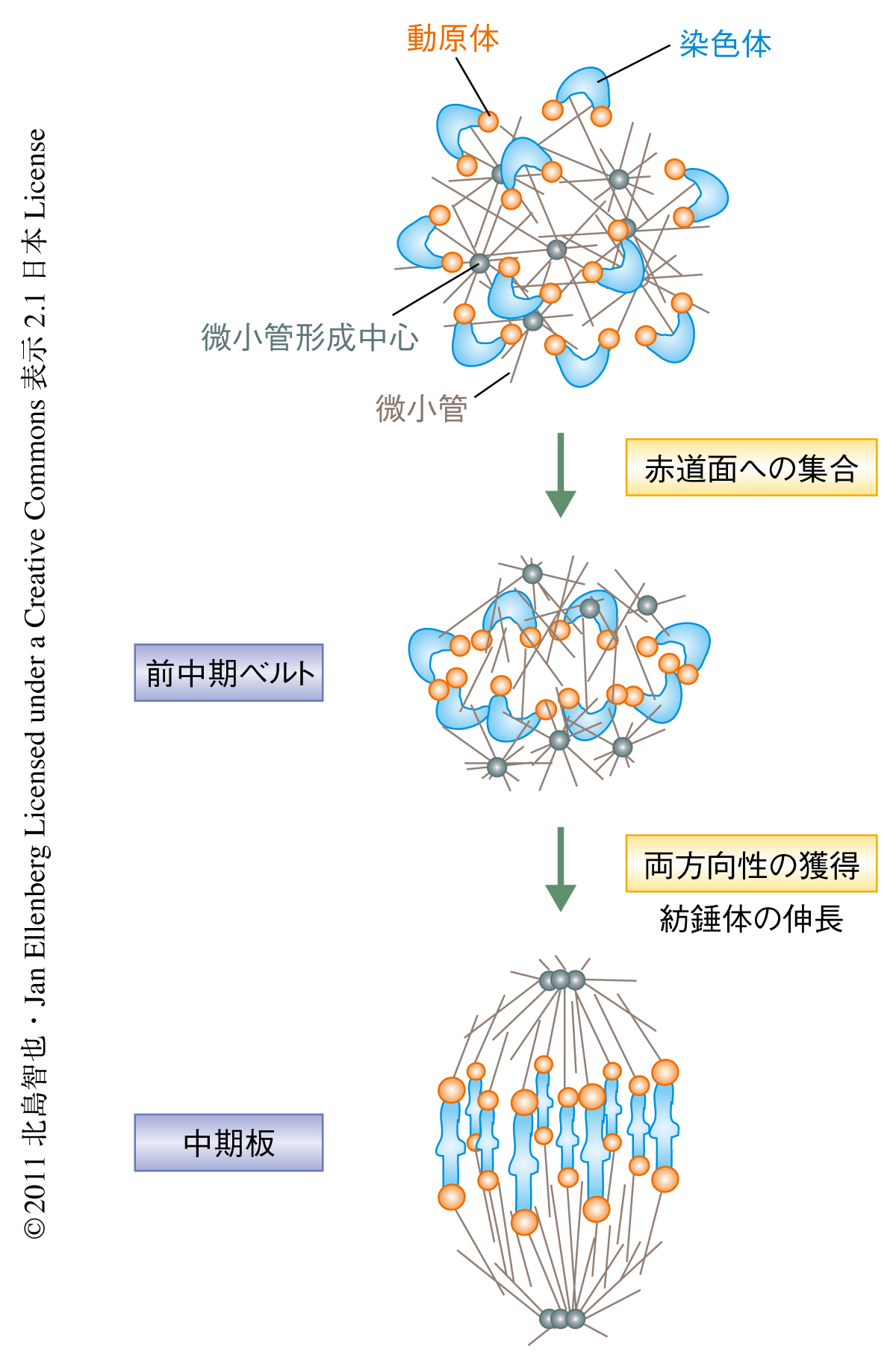
卵母細胞では減数第1分裂に進行したのち,まず複数の微小管形成中心が自己集合することにより極をもたない球状の紡錘体が形成される5).このとき,染色体および動原体は球状の紡錘体の表面にランダムに配置されていた.そののち,染色体は球状の紡錘体の表面をすべるよう徐々に移動し,ひとつの赤道面へと集合していった.このことで形成された染色体の分布を上から見下ろすように観察すると,よく知られた中期板のような板状のかたちではなく,輪のようなかたちをしていることが判明した.筆者らは,これまで見すごされていたこの一過的な染色体の分布を“前中期ベルト”と命名した(図2).
相同染色体の動原体ペアのあいだの距離を測定することで,染色体が両方向性を獲得したかどうかを判断することができる.前中期ベルトに集合した染色体のほとんどは,まだ両方向性を獲得していないことがわかった.染色体が両方向性の獲得のための試みを開始したのは前中期ベルトの形成のあとであり,このとき,前中期ベルトにあった染色体が徐々にその中心部の空間へと侵入し,前中期ベルトをよく知られた染色体の分布である中期板へと変形させた(図2).中心部に移動した染色体は両方向性を獲得したものが多かったことから,微小管が染色体を両極に引っ張ることにより,紡錘極のあいだの最小距離である紡錘体の中心に染色体を移動させたものと考えられた.実際に免疫染色による解析から,この時期に微小管束が動原体に接続しはじめていることがわかった.また,この染色体の両方向性の獲得と時期を同じくして,球状の紡錘体が双極性の紡錘体へと伸長していたことから,これら2つのイベントのあいだに機能的な相関が示唆された.
これらの一連の観察から,紡錘体の赤道面における中期板の形成は2つのステップからなることが判明した(図2).まず,染色体は赤道面に形成される前中期ベルトへと集合し,そののち,紡錘体の伸長と染色体の両方向性の獲得とともに,前中期ベルトは中期板へと変形していた.染色体の赤道面への集合がさきで両方向性の獲得があとという順序は,教科書が体細胞分裂を一般に説明する探索と捕捉モデルとは逆であった.
動原体の完全な3次元追跡のデータセットは,染色体の両方向性の獲得の過程を1本の染色体レベルで詳細かつ網羅的に解析することを可能にした.すべての染色体において相同染色体の動原体ペアのあいだの距離の変化を調べたところ,両方向性の獲得の過程は染色体のあいだで著しく異なっていることが判明した.ある染色体は早い時期から非常にゆっくりと,1時間以上を費やして連続的に両方向性を獲得していたのに対し,別の染色体は遅い時期において急激に,10分以内に両方向性を獲得していた.両方向性の獲得の過程が単純なものではないことをうけ,染色体が安定な両方向性を確立するまでに,両方向性の獲得の試みを何回行っているかをカウントした.その結果,染色体の両方向性の確立には平均して1染色体あたり約3回の試みが必要であることが判明した.
この両方向性の獲得の複数回の試みは,細胞内でのどのような変化を反映しているのだろうか.両方向性の獲得の試みの際,動原体と微小管との接続に誤ったものが含まれており,これを修正するため試みを複数回やり直す必要があったものと考えた(図3).この考えを検証するため,まず免疫染色により動原体と微小管との接続の様式を調べたところ,この時期に微小管束がひとつの動原体に両側から捕捉するという誤った接続が50%近くに達することが判明した.このような誤った接続は,ほとんどの染色体が安定した両方向性の確立したあとにはみられなかった.つぎに,体細胞分裂において動原体と微小管との接続の修正に必要であることが知られているAuroraキナーゼを特異的な薬剤で阻害すると,両方向性の獲得の複数回の試みがみられなくなった.これらのことから,卵母細胞の減数第1分裂においては動原体と微小管との誤った接続が形成されやすく,安定な染色体の両方向性の獲得にはこれらの接続の修正が必要とされることが強く示唆された(図3).
染色体が両方向性の獲得に依存せずに赤道面へ移動されうることは体細胞分裂においても報告されており,動原体に局在するプラス端方向性のキネシンであるCENP-Eが微小管の側面を移動することで染色体を赤道面へ輸送する機構の存在することがわかっている8,9).卵母細胞においては,染色体が移動する時期に微小管束と動原体との接続が免疫染色により検出されなかったことから,むしろ染色体の腕部に局在するクロモキネシンが染色体を輸送しているのかもしれない.
この報告と並行して,培養細胞の体細胞分裂においても中期板にさきがけて前中期ベルトが形成されることが報告された10).したがって,前中期ベルトの形成は卵母細胞の減数第1分裂に特異的な現象ではなく,すべての細胞分裂に共通のものであると考えられる.紡錘体はまず赤道面にベルト状に染色体を配置し,そのあとにベルトの両側から微小管の動原体の捕捉を行うことで,動原体ペアが両側から捕捉される確立を高めているのかもしれない.
それにもかかわらず,卵母細胞における今回の解析は染色体の両方向性の獲得が誤りやすいものであることを示していた.これは,卵母細胞においては多数の微小管形成中心による紡錘体の形成が染色体の両方向性の獲得の試みと同時進行で起こるため,紡錘体極に配置されていない微小管形成中心から伸びた微小管が動原体を誤った方向から捕捉してしまうことに原因があると考えられる.
卵母細胞の減数第1分裂において染色体の不均等な分配が起こりやすく,さらに,その頻度が母体の年齢とともに上昇することは生物学的にも社会的にも大きな問題である.この研究により判明した染色体の両方向性の獲得が誤りがちであるという事実は,その原因を説明する可能性がある.染色体分配の失敗頻度が母体の年齢とともに上昇するのは,染色体の誤った両方向性の獲得を修正する機能に支障がでてくるためなのかもしれない.この研究における動原体の完全な3次元追跡を用いた解析手法は,これまで解析が不可能であったこれらの大問題に挑戦するための基礎となりうるものである.
略歴:2004年 東京大学分子細胞生物学研究所 助手,2006年 東京大学大学院理学系研究科 博士取得,2007年よりドイツEuropean Molecular Biology Laboratory博士研究員.
研究テーマ:細胞分裂における染色体の動態.
抱負:生物学を志したのはなぜですか? 最近になってやっと,この問いに“見えるから”と答えられるようになりました.子どもたちにもおもしろいと思ってもらえるような研究をめざします.
Jan Ellenberg
ドイツEuropean Molecular Biology LaboratoryにてHead of Unit.
研究室URL:http://www.ellenberg.embl.de/index.html
© 2011 北島智也・Jan Ellenberg Licensed under CC 表示 2.1 日本
(ドイツEuropean Molecular Biology Laboratory,Cell Biology and Biophysics Unit)
email:北島智也
DOI: 10.7875/first.author.2011.137
Complete kinetochore tracking reveals error-prone homologous chromosome biorientation in mammalian oocytes.
Tomoya S. Kitajima, Miho Ohsugi, Jan Ellenberg
Cell, 146, 568-581 (2011)
要 約
分裂後期において染色体を娘細胞に均等に分配するためには,それ以前に染色体の動原体ペアが微小管により紡錘体の両極に引っ張られることで,染色体の両方向性が確立していることが必要である.しかしながら,中心体をもたない紡錘体をもつ卵母細胞において,染色体がどのように両方向性を獲得し,また,それがどのように紡錘体の形成や染色体の紡錘体の赤道面への集合といったイベントと協調しているかについては,詳細は明らかになっていない.今回,筆者らは,マウスの卵母細胞の減数第1分裂において,細胞分裂をつうじてすべての動原体の挙動を完全に3次元で追跡することにはじめて成功した.このデータを定量的かつ網羅的に解析することにより以下の知見を得た.染色体の紡錘体の赤道面への集合は両方向性の獲得より早くに起こり,これまで見すごされていた染色体配置である“前中期ベルト”を形成した.そののち,染色体は伸長している紡錘体の中心へ侵入し中期板を形成した.染色体はこの時期に両方向性の獲得の試みを開始したが,9割近くの染色体はいちどの試みでは安定な両方向性を獲得できず,動原体と微小管との接続の修正をへることにより安定な両方向性を獲得することができた.このことは,哺乳類の卵母細胞における相同染色体の両方向性の獲得は誤りやすいという性質をもつことを示しており,ヒトを含めた哺乳類の卵子で染色体数異常の発生率が高いことの理由を説明するかもしれない.
はじめに
細胞は遺伝情報を維持するため分裂の際に娘細胞に染色体を正確に分配しなくてはならない.ところが,哺乳類の卵母細胞の減数第1分裂においては,染色体が不均等に分配される頻度がほかの分裂に比べ高いことが知られている1).このような失敗により形成された染色体数が異常な卵子は,受精してもその多くが生きられず流産にいたり,出産まで生きたとしてもダウン症など重篤な先天性疾患をひき起こす.この不均等分配の頻度は母体の年齢とともに上昇することがわかっており,そのリスクは現代社会における少子化の一因であるとも考えられるが,なぜ卵母細胞において染色体の不均等分配の頻度が高いのかはわかっていない.
分裂後期に染色体を均等に分配するためには,それ以前の分裂中期のおわりまでに準備が適切に完了している必要がある.すなわち,すべての染色体において動原体ペアが微小管により反対方向から捕捉され,紡錘体の両極に引っ張られて(染色体の両方向性の確立),紡錘体の赤道面に集合していなくてはならない.
これらの過程の機構については体細胞分裂の研究からの知見が比較的豊富であり,これをもとに,教科書などでも以下のような“探索と捕捉”(search-and-capture)モデルを用いた説明がなされている2-4)(図1a).分裂期に入ると2つの中心体は微小管を伸長させ,これらが紡錘体の極となる.やがて微小管が動原体ペアを反対方向から捕捉すると,この動原体と微小管との接続が安定化され,染色体の両方向性が確立する.両方向性を獲得した染色体は,反対方向からの力がつりあう地点である紡錘体の赤道面へと移動する.すなわちこのモデルにおいては,染色体の両方向性の確立と紡錘体の赤道面への集合のうち,先行するのは前者である.
これに対し,哺乳類の卵母細胞は紡錘体の2極を既定すべき中心体をもっていない.その代わり,細胞質に中心小体を含まない微小管形成中心を80以上もっている5).減数第1分裂に入ると,まずはこれらが自己集合することにより極をもたない球状の紡錘体を形成する.やがて,微小管形成中心が反対極へと移動することで紡錘体が伸長し双極性の紡錘体となる.分裂中期のおわりまでに,染色体は相同染色体の動原体ペアが両極へ引っ張られることで両方向性を獲得し,紡錘体の赤道面に集合する(図1b).このように複雑な紡錘体と染色体の動態をもつ卵母細胞において,体細胞分裂で用いられた単純な探索と捕捉モデルがあてはまることは考えにくく3),大きな3つのイベント,染色体の両方向性の獲得,赤道面への集合,紡錘体の伸長,の機能的な相関はおろか,時間的な順序すら明らかになっていなかった.
1.動原体の完全な3次元での追跡
哺乳類の卵母細胞における染色体の動態を解析するため,分子遺伝学的な手法が有効でもっともヒトに近いモデルであるマウスの卵母細胞を用いた.減数第1分裂の前期において停止させた卵母細胞に蛍光タンパク質と融合させたマーカータンパク質のmRNAをマイクロインジェクションすることで細胞内における構造を可視化することができる6).ここでは,染色体をヒストン2BとmCherryとの融合タンパク質で,動原体をEGFPとCENP-Cとの融合タンパク質で標識した.卵母細胞の生細胞イメージングにおける技術的な困難は,卵母細胞のサイズが直径約80μmと大きいことと,減数第1分裂が8時間以上と長時間に及ぶことである.これらの問題を解決するため,筆者らの研究室で開発された顕微鏡を自動化させるマクロを利用した5,7).このマクロは細胞のなかで染色体の存在する領域を自動検出し,これをズームしてその領域のみスキャンすることを可能にした.これにより,スキャンに要する時間の短縮および細胞毒性の削減を実現し,可能なかぎりの高解像度で染色体および動原体を4次元で録画することに成功した.長時間に及ぶ高解像度の生細胞イメージングは膨大な画像セットを生成する.これらのデータから染色体の動態を効率よく,かつ,きわめて詳細に解析するため,動原体の挙動を3次元で追跡するコンピューターパイプラインを確立した.これにより,あらゆる細胞分裂で成功していなかったすべての動原体の完全な3次元追跡が,マウス卵母細胞の減数第1分裂においてはじめて実現した.この完全なデータセットは細胞分裂における染色体の動態を理解するための共通のリソースとしてWebで公開されている(http://www.ellenberg.embl.de/apps/KTTracking/).このデータセットを定量的および網羅的に解析することにより,染色体の両方向性の獲得と赤道面への集合について,以下のような新しい知見を得た.
2.前中期ベルトを介した中期板の形成
卵母細胞では減数第1分裂に進行したのち,まず複数の微小管形成中心が自己集合することにより極をもたない球状の紡錘体が形成される5).このとき,染色体および動原体は球状の紡錘体の表面にランダムに配置されていた.そののち,染色体は球状の紡錘体の表面をすべるよう徐々に移動し,ひとつの赤道面へと集合していった.このことで形成された染色体の分布を上から見下ろすように観察すると,よく知られた中期板のような板状のかたちではなく,輪のようなかたちをしていることが判明した.筆者らは,これまで見すごされていたこの一過的な染色体の分布を“前中期ベルト”と命名した(図2).
相同染色体の動原体ペアのあいだの距離を測定することで,染色体が両方向性を獲得したかどうかを判断することができる.前中期ベルトに集合した染色体のほとんどは,まだ両方向性を獲得していないことがわかった.染色体が両方向性の獲得のための試みを開始したのは前中期ベルトの形成のあとであり,このとき,前中期ベルトにあった染色体が徐々にその中心部の空間へと侵入し,前中期ベルトをよく知られた染色体の分布である中期板へと変形させた(図2).中心部に移動した染色体は両方向性を獲得したものが多かったことから,微小管が染色体を両極に引っ張ることにより,紡錘極のあいだの最小距離である紡錘体の中心に染色体を移動させたものと考えられた.実際に免疫染色による解析から,この時期に微小管束が動原体に接続しはじめていることがわかった.また,この染色体の両方向性の獲得と時期を同じくして,球状の紡錘体が双極性の紡錘体へと伸長していたことから,これら2つのイベントのあいだに機能的な相関が示唆された.
これらの一連の観察から,紡錘体の赤道面における中期板の形成は2つのステップからなることが判明した(図2).まず,染色体は赤道面に形成される前中期ベルトへと集合し,そののち,紡錘体の伸長と染色体の両方向性の獲得とともに,前中期ベルトは中期板へと変形していた.染色体の赤道面への集合がさきで両方向性の獲得があとという順序は,教科書が体細胞分裂を一般に説明する探索と捕捉モデルとは逆であった.
3.誤りがちな染色体の両方向性の獲得
動原体の完全な3次元追跡のデータセットは,染色体の両方向性の獲得の過程を1本の染色体レベルで詳細かつ網羅的に解析することを可能にした.すべての染色体において相同染色体の動原体ペアのあいだの距離の変化を調べたところ,両方向性の獲得の過程は染色体のあいだで著しく異なっていることが判明した.ある染色体は早い時期から非常にゆっくりと,1時間以上を費やして連続的に両方向性を獲得していたのに対し,別の染色体は遅い時期において急激に,10分以内に両方向性を獲得していた.両方向性の獲得の過程が単純なものではないことをうけ,染色体が安定な両方向性を確立するまでに,両方向性の獲得の試みを何回行っているかをカウントした.その結果,染色体の両方向性の確立には平均して1染色体あたり約3回の試みが必要であることが判明した.
この両方向性の獲得の複数回の試みは,細胞内でのどのような変化を反映しているのだろうか.両方向性の獲得の試みの際,動原体と微小管との接続に誤ったものが含まれており,これを修正するため試みを複数回やり直す必要があったものと考えた(図3).この考えを検証するため,まず免疫染色により動原体と微小管との接続の様式を調べたところ,この時期に微小管束がひとつの動原体に両側から捕捉するという誤った接続が50%近くに達することが判明した.このような誤った接続は,ほとんどの染色体が安定した両方向性の確立したあとにはみられなかった.つぎに,体細胞分裂において動原体と微小管との接続の修正に必要であることが知られているAuroraキナーゼを特異的な薬剤で阻害すると,両方向性の獲得の複数回の試みがみられなくなった.これらのことから,卵母細胞の減数第1分裂においては動原体と微小管との誤った接続が形成されやすく,安定な染色体の両方向性の獲得にはこれらの接続の修正が必要とされることが強く示唆された(図3).
おわりに
染色体が両方向性の獲得に依存せずに赤道面へ移動されうることは体細胞分裂においても報告されており,動原体に局在するプラス端方向性のキネシンであるCENP-Eが微小管の側面を移動することで染色体を赤道面へ輸送する機構の存在することがわかっている8,9).卵母細胞においては,染色体が移動する時期に微小管束と動原体との接続が免疫染色により検出されなかったことから,むしろ染色体の腕部に局在するクロモキネシンが染色体を輸送しているのかもしれない.
この報告と並行して,培養細胞の体細胞分裂においても中期板にさきがけて前中期ベルトが形成されることが報告された10).したがって,前中期ベルトの形成は卵母細胞の減数第1分裂に特異的な現象ではなく,すべての細胞分裂に共通のものであると考えられる.紡錘体はまず赤道面にベルト状に染色体を配置し,そのあとにベルトの両側から微小管の動原体の捕捉を行うことで,動原体ペアが両側から捕捉される確立を高めているのかもしれない.
それにもかかわらず,卵母細胞における今回の解析は染色体の両方向性の獲得が誤りやすいものであることを示していた.これは,卵母細胞においては多数の微小管形成中心による紡錘体の形成が染色体の両方向性の獲得の試みと同時進行で起こるため,紡錘体極に配置されていない微小管形成中心から伸びた微小管が動原体を誤った方向から捕捉してしまうことに原因があると考えられる.
卵母細胞の減数第1分裂において染色体の不均等な分配が起こりやすく,さらに,その頻度が母体の年齢とともに上昇することは生物学的にも社会的にも大きな問題である.この研究により判明した染色体の両方向性の獲得が誤りがちであるという事実は,その原因を説明する可能性がある.染色体分配の失敗頻度が母体の年齢とともに上昇するのは,染色体の誤った両方向性の獲得を修正する機能に支障がでてくるためなのかもしれない.この研究における動原体の完全な3次元追跡を用いた解析手法は,これまで解析が不可能であったこれらの大問題に挑戦するための基礎となりうるものである.
文 献
- Hassold, T. & Hunt, P.: To err (meiotically) is human: the genesis of human aneuploidy. Nat. Rev. Genet., 2, 280-291 (2001)[PubMed]
- Maiato, H., DeLuca, J., Salmon, E. D. et al.: The dynamic kinetochore-microtubule interface. J. Cell Sci., 117, 5461-5477 (2004)[PubMed]
- Walczak, C. E. & Heald, R.: Mechanisms of mitotic spindle assembly and function. Int. Rev. Cytol., 265, 111-158 (2008)[PubMed]
- Kops, G. J. P. L., Saurin, A. T. & Meraldi, P.: Finding the middle ground: how kinetochores power chromosome congression. Cell. Mol. Life Sci., 67, 2145-2161 (2010)[PubMed]
- Schuh, M. & Ellenberg, J.: Self-organization of MTOCs replaces centrosome function during acentrosomal spindle assembly in live mouse oocytes. Cell, 130, 484-498 (2007)[PubMed]
- Jaffe, L. A. & Terasaki, M.: Quantitative microinjection of oocytes, eggs, and embryos. Methods Cell Biol., 74, 219-242 (2004)[PubMed]
- Rabut, G. & Ellenberg, J.: Automatic real-time three-dimensional cell tracking by fluorescence microscopy. J. Microsc., 216, 131-137 (2004)[PubMed]
- Kapoor, T. M., Lampson, M. A., Hergert, P. et al.: Chromosomes can congress to the metaphase plate before biorientation. Science, 311, 388-391 (2006)[PubMed]
- Cai, S., O'Connell, C. B., Khodjakov, A. et al.: Chromosome congression in the absence of kinetochore fibres. Nat. Cell Biol., 11, 832-838 (2009)[PubMed]
- Magidson, V., O'Connell, C. B., Loncarek, J. et al.: The spatial arrangement of chromosomes during prometaphase facilitates spindle assembly. Cell, 146, 555-567 (2011)[PubMed]
著者プロフィール
略歴:2004年 東京大学分子細胞生物学研究所 助手,2006年 東京大学大学院理学系研究科 博士取得,2007年よりドイツEuropean Molecular Biology Laboratory博士研究員.
研究テーマ:細胞分裂における染色体の動態.
抱負:生物学を志したのはなぜですか? 最近になってやっと,この問いに“見えるから”と答えられるようになりました.子どもたちにもおもしろいと思ってもらえるような研究をめざします.
Jan Ellenberg
ドイツEuropean Molecular Biology LaboratoryにてHead of Unit.
研究室URL:http://www.ellenberg.embl.de/index.html
© 2011 北島智也・Jan Ellenberg Licensed under CC 表示 2.1 日本