LOTUSはNogo受容体1の内在性のアンタゴニストである
佐藤泰史・池谷真澄・竹居光太郎
(横浜市立大学大学院医学研究科 分子薬理神経生物学教室)
email:佐藤泰史,池谷真澄,竹居光太郎
DOI: 10.7875/first.author.2011.136
Cartilage acidic protein-1B (LOTUS), an endogenous Nogo receptor antagonist for axon tract formation.
Yasufumi Sato, Masumi Iketani, Yuji Kurihara, Megumi Yamaguchi, Naoya Yamashita, Fumio Nakamura,Yuko Arie, Takahiko Kawasaki, Tatsumi Hirata, Takaya Abe, Hiroshi Kiyonari, Stephen M. Strittmatter, Yoshio Goshima, Kohtaro Takei
Science, 333, 769-773 (2011)
神経系が高度な情報処理を行うためには複雑な神経回路が正確に形成されることが重要であるが,その機構にはまだ不明な点が多い.筆者らは,マウスの嗅索とよばれる神経束をモデルにユニークな実験系を用いて,機能を阻害したとき嗅索の形成に異常を起こすタンパク質の探索を試みた.その結果,機能を阻害すると嗅索が脱束化する異常をひき起こすような膜タンパク質を同定しLOTUSと命名した.つづいて,LOTUSと結合するタンパク質として軸索の伸長阻害タンパク質であるNogoの受容体として知られるNogo受容体1を同定した.LOTUS,Nogo受容体1,Nogoの関係を検討し,LOTUSが結合したNogo受容体1にはNogoは結合できないことを明らかにした.これらの結果から,LOTUSはNogo受容体1のアンタゴニストとしてはたらきNogoによる軸索の伸長阻害作用を抑制することを明らかにした.
神経回路の形成の分子機構を明らかにするため,筆者らは,マウスの嗅索の形成機構について研究している.マウスの終脳(大脳)の先端に位置する嗅球の神経軸索は,終脳の表層の狭い領域を伸長し嗅索とよばれる軸索の束を形成する.嗅索の形成をモデルとして研究する理由は,嗅索は比較的大きく簡単に可視化しやすいことなどいくつかあるが,その最たるものは,嗅索が形成されるまえの終脳半球を丸ごと器官培養することにより培養下において嗅索を形成させることのできる点にある1).このことから嗅索の形成の際に実験操作を行うことができ,さまざまな解析が可能になる.この利点を生かし,嗅索の形成にかかわる機能タンパク質を探索し同定する目的で,筆者らは,以下のような研究をしてきた.まず,嗅索を抗原として免疫したモノクローナル抗体を作製した.この場合,嗅索に含まれるさまざまなタンパク質に対する抗体を得ることができるものと考えられた.得られたモノクローナル抗体のなかから,培養のとき添加することで嗅索の形成に異常を起こすような抗体をスクリーニングした.この時点では抗原となるタンパク質は不明なので,つづいてスクリーニングされたモノクローナル抗体の抗原を同定した.このようにして,これまでに嗅索の形成にかかわるタンパク質としてM6aを見い出している2).しかしながら,この方法ではスクリーニングの効率が悪いと考えられた.そのため,この研究では抗体のスクリーニングに光照射分子不活性化(fluorophore-assisted light inactivation:FALI)法を導入し,嗅索の形成にかかわるタンパク質を効率よく探索することを試みた.
フルオレセインイソチオシアネート(FITC)は蛍光色素としてなじみ深いが,励起光を照射すると活性酸素(一重項酸素)を発生する.光照射分子不活性化法は,FITCで標識した抗体を抗原に結合させたのち励起光(波長490 nm)を照射し,FITCより生じた活性酸素により近傍(一重項酸素がその半減期のあいだに拡散する距離は40Å)にある抗原を酸化反応により機能阻害する技術である.すなわち,単に結合するだけでは抗原の機能を阻害しない抗体でも,この方法を用いることで抗原の機能を阻害することができる.くわえて,60 W電球といった比較的弱い光を照射することでも効果のあることが報告されており,簡便な装置で実験が可能である3,4).この研究では,メタルハライドライトを用いた光ファイバー光源装置,FITC用蛍光フィルターと平面ライトガイドを用い,6ウェルプレートに最大2000 luxの波長490 nmの青色光を均一に照射できる装置を作製して用いた.
ある組織を抗原としてモノクローナル抗体を作製すると,原理的には抗原とした組織に含まれるすべてのタンパク質に対する抗体のできる可能性がある.対象とする生命現象が培養下において再現できれば,対象とする組織に対し作製されたモノクローナル抗体をくわえて培養する.このとき,対象とした生命現象に異常が生じれば,くわえた抗体の抗原(細胞表面にある膜タンパク質など)はその現象にかかわる機能タンパク質であることが推測される.このような機能スクリーニングをとおして,まずモノクローナル抗体をスクリーニングし,そののち機能タンパク質である抗原を同定する.しかし,この抗体スクリーニングでは抗原の機能を乱すような抗体が選択され,機能タンパク質に対する抗体であっても抗原の機能を乱さない抗体は選択されない.そのため,この研究では抗体のスクリーニングに光照射分子不活性化法を導入し,抗原の機能を“乱さない”抗体により抗原の機能を“乱す”ことで,効率よく機能タンパク質を探索することを試みた.
マウスの嗅索の細胞破砕液を抗原としてアルメニアンハムスターへ免疫しモノクローナル抗体を作製した.作製した抗体のうち生理的な条件において嗅索に結合する抗体を選択した.それらの抗体をFITCで標識したのち培養液にくわえ,波長490 nmの青色光を照射しながら終脳器官培養を行い,形成された嗅索を観察した.その結果,嗅索を構成する軸索が正常よりも広い範囲を伸長し嗅索が脱束化する異常をひき起こすモノクローナル抗体を見い出した.この時点では抗原は不明であったので,まずその同定を試みた.この抗体による免疫染色の結果,抗原は嗅索の軸索に分布していた.そこで,嗅球に由来する発現cDNAライブラリーを作製し,発現させると株細胞に抗体が結合するようなcDNAクローンをライブラリーからスクリーニングすることで抗原遺伝子を同定した5).その結果,このモノクローナル抗体の抗原としてCartilage acidic protein-1Bを同定した.このタンパク質は軟骨のマーカーとしてすでに報告がなされていたが生理機能はまったく不明だったので6),筆者らは,このタンパク質をLOTUS(lateral olfactory tract usher substance)と名づけた.そののち,LOTUSのノックアウトマウスを作製し,このノックアウトマウスの嗅索にはスクリーニングされたモノクローナル抗体は結合しないことも確認した.LOTUSはN末端にシグナルペプチドをもちC末端に膜貫通領域と思われる疎水性領域をもつ膜タンパク質であり,細胞内と予想される領域はほとんど存在しなかった.
LOTUSは膜タンパク質でありその大部分が細胞外に位置すると予想されたので,LOTUSに結合するタンパク質は細胞外にあると考え,そのようなタンパク質の同定を試みた.まず,LOTUSに結合するタンパク質の発現部位を検討した.C末端の膜貫通領域を除いたLOTUSとアルカリホスファターゼとの融合タンパク質を作製し,生理的な条件において終脳と反応させてアルカリホスファターゼの酵素活性を指標に結合部位を検討したところ,アルカリホスファターゼ-LOTUS融合タンパク質は嗅索に結合することが明らかになった.このことは,LOTUSと結合するタンパク質も嗅索に発現する膜タンパク質であることを意味した.そこで,再度,抗原の同定に用いた手法を用いてLOTUSと相互作用するタンパク質の同定を試みた.すなわち,嗅球に由来する発現cDNAライブラリーから,発現させると株細胞にアルカリホスファターゼ-LOTUS融合タンパク質が結合するようなcDNAクローンをスクリーニングした.その結果,LOTUSと結合するタンパク質としてNogo受容体1を同定した.アルカリホスファターゼ-LOTUS融合タンパク質はNogo受容体1ノックアウトマウスの嗅索には結合しないことから,嗅索においてLOTUSと結合するタンパク質はNogo受容体1だけであると考えられた.さらに,LOTUSとNogo受容体1は同じ軸索に発現していることが免疫染色により明らかになった.
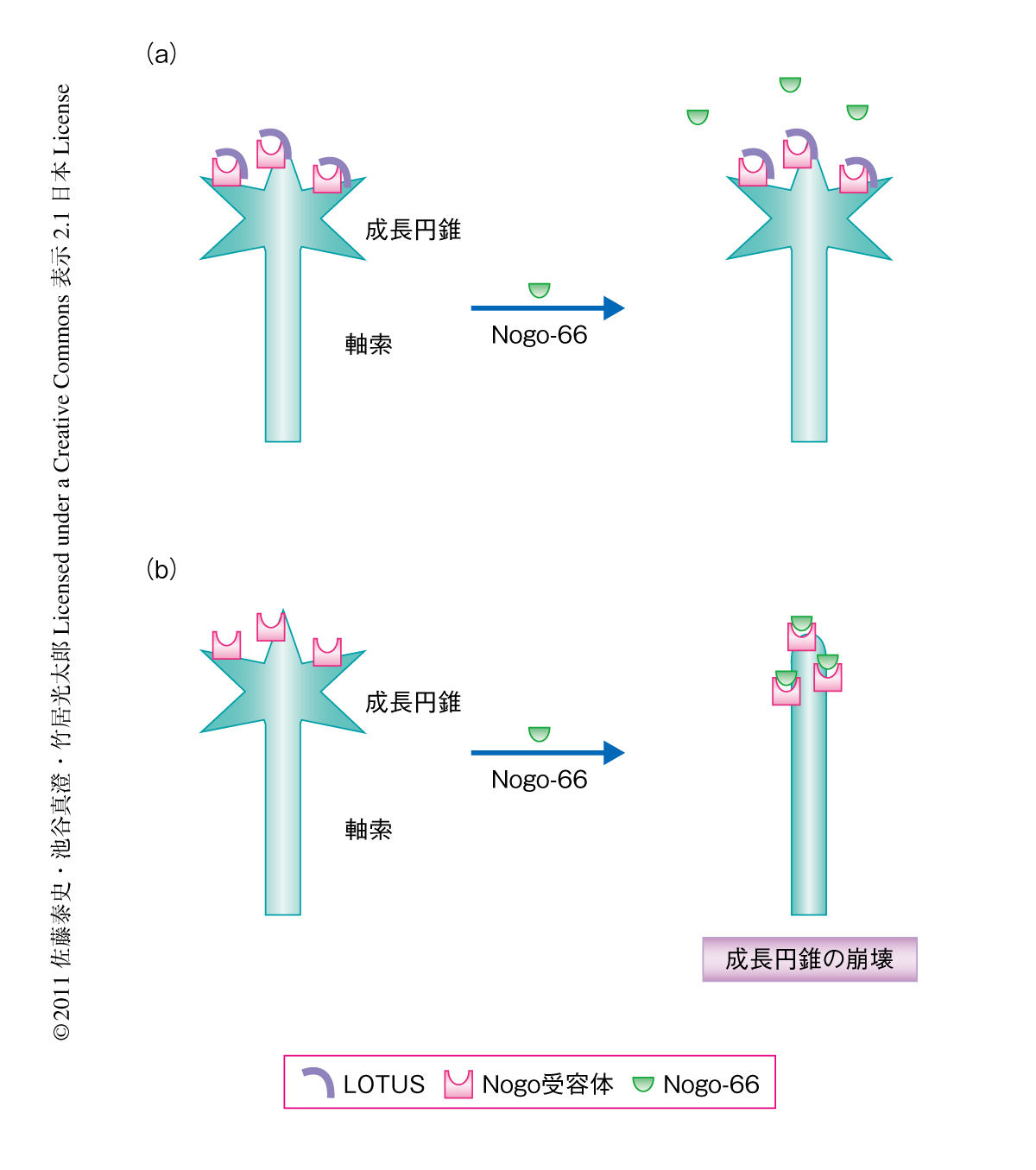
Nogo受容体1は髄鞘に由来する軸索の伸長阻害タンパク質として知られる膜タンパク質Nogoの受容体としてよく知られたタンパク質である.軸索の伸長は先端にある成長円錐とよばれる手のひら状の構造が外界の環境因子などを感受することにより制御されている.Nogo受容体1を介したNogoのシグナルは細胞骨格に作用し成長円錐の構造を崩壊させ(成長円錐の崩壊),軸索の伸長に対し抑制的に作用することが知られている7,8).LOTUSの結合タンパク質として同定されたNogo受容体1が嗅索に発現していたことは驚きであった.その理由は,Nogo受容体1のリガンドであるNogoも嗅索に発現していることが報告されていたからである9).すなわち,軸索の伸長に対し抑制的にはたらくシグナルのリガンド(Nogo)と受容体(Nogo受容体1)が発現しているのに,どうして嗅索を構成する軸索は伸長して嗅索を形成することができるのか,という疑問が生じた.この点を明らかにするため,Nogo,Nogo受容体1,LOTUSの三者の生理的な関係を検討した.その結果,Nogo受容体1のみを発現させた株細胞にはNogo-66(Nogo受容体1を介した軸索の伸長阻害活性をもつNogoの66アミノ酸残基からなる領域)が結合するのに対し,Nogo受容体1とLOTUSを共発現させた株細胞にはNogo-66は結合しないことが判明した.さらに,野生型マウスの嗅球から伸長する軸索の成長円錐はNogo-66に対して応答しないが,LOTUSノックアウトマウスの嗅球から伸長する軸索の成長円錐は退縮した(図1).
さらに,ノックアウトマウスを作製してその表現型を解析した.予想どおり,LOTUSノックアウトマウスの嗅索は脱束化し,軸索が伸長する領域の幅は野生型マウスに比べ広がった.これは,LOTUSノックアウトマウスの任意の軸索はLOTUSの欠損により嗅索においてその周囲の軸索に存在するNogoからの伸長阻害シグナルが入力されるようになったため,周囲の軸索を避ける方向(軸索の束の外側)に伸長して嗅索の幅が広がったものと考えられた(図2).軸索はその伸長阻害タンパク質が周囲に多いと成長円錐が退縮し伸長しないが,伸長阻害タンパク質が局在した場合はそれを避けるように伸長するからである.一方,LOTUSとNogo受容体1のダブルノックアウトマウスの嗅索の幅は広がらなかった.この結果は,受容体としてNogo受容体1も欠損しているのでNogoによる伸長阻害シグナルが入力されなかったためと考えられた.
これらの結果から,LOTUSはNogo受容体1と結合することでNogo受容体1とNogoとの結合を阻害し,結果として,NogoによるNogo受容体1を介した軸索の伸長阻害シグナルを抑制し,嗅索の形成に寄与しているものと考えられた.
この研究では,LOTUSがNogo受容体1の内在性のアンタゴニストであることを明らかにした.軸索の伸長“阻害”タンパク質であるNogoからのシグナルをLOTUSが“阻害”することで,結果として,Nogoが存在してもNogo受容体1とLOTUSをともに発現する軸索は影響されない.シグナルが阻害されるのにもかかわらず,どうしてNogoとNogo受容体1は発現しているのだろうか? たぶん,リガンド(Nogo)もしくは受容体(Nogo受容体1)をそれぞれ抑制するよりも,シグナルを抑制するタンパク質(LOTUS)を制御するほうが複雑な神経回路を構築するうえで有利なのではないかと考えている.一方で,Nogoは脊髄損傷の際の中枢神経における軸索の再生阻害タンパク質のひとつでもあり,そのシグナルをLOTUSが阻害することから,LOTUSの神経再生治療への応用も期待される.
ここで紹介したモノクローナル抗体と光照射分子不活性化法を組み合わせた手法は,マウスのみならず多くの生物への応用が期待できる.くわえて,野生型の動物を利用するので,ノックアウトすると致死となるような遺伝子の致死ステージ以降での役割を解析することも可能である.さらには,スクリーニングのときに得られた抗体による免疫染色も同時に行うことで,興味深い染色像を示す抗体を手がかりに研究を行うこともできる10).この手法は特別に高価な機器を必要とせず簡便に行えるので,さまざまな実験系において有用であるものと思われる.
略歴:2001年 名古屋大学大学院理学研究科 修了,同年 国立遺伝学研究所 研究員,2003年 横浜市立大学大学院医学研究科 研究員,2006年 三菱化学生命科学研究所 特別研究員を経て,2011年より基礎生物学研究所 研究員.
池谷 真澄(Masumi Iketani)
横浜市立大学大学院医学研究科博士課程 在学中.
竹居 光太郎(Kohtaro Takei)
横浜市立大学大学院医学研究科 准教授.
© 2011 佐藤泰史・池谷真澄・竹居光太郎 Licensed under CC 表示 2.1 日本
(横浜市立大学大学院医学研究科 分子薬理神経生物学教室)
email:佐藤泰史,池谷真澄,竹居光太郎
DOI: 10.7875/first.author.2011.136
Cartilage acidic protein-1B (LOTUS), an endogenous Nogo receptor antagonist for axon tract formation.
Yasufumi Sato, Masumi Iketani, Yuji Kurihara, Megumi Yamaguchi, Naoya Yamashita, Fumio Nakamura,Yuko Arie, Takahiko Kawasaki, Tatsumi Hirata, Takaya Abe, Hiroshi Kiyonari, Stephen M. Strittmatter, Yoshio Goshima, Kohtaro Takei
Science, 333, 769-773 (2011)
要 約
神経系が高度な情報処理を行うためには複雑な神経回路が正確に形成されることが重要であるが,その機構にはまだ不明な点が多い.筆者らは,マウスの嗅索とよばれる神経束をモデルにユニークな実験系を用いて,機能を阻害したとき嗅索の形成に異常を起こすタンパク質の探索を試みた.その結果,機能を阻害すると嗅索が脱束化する異常をひき起こすような膜タンパク質を同定しLOTUSと命名した.つづいて,LOTUSと結合するタンパク質として軸索の伸長阻害タンパク質であるNogoの受容体として知られるNogo受容体1を同定した.LOTUS,Nogo受容体1,Nogoの関係を検討し,LOTUSが結合したNogo受容体1にはNogoは結合できないことを明らかにした.これらの結果から,LOTUSはNogo受容体1のアンタゴニストとしてはたらきNogoによる軸索の伸長阻害作用を抑制することを明らかにした.
はじめに
神経回路の形成の分子機構を明らかにするため,筆者らは,マウスの嗅索の形成機構について研究している.マウスの終脳(大脳)の先端に位置する嗅球の神経軸索は,終脳の表層の狭い領域を伸長し嗅索とよばれる軸索の束を形成する.嗅索の形成をモデルとして研究する理由は,嗅索は比較的大きく簡単に可視化しやすいことなどいくつかあるが,その最たるものは,嗅索が形成されるまえの終脳半球を丸ごと器官培養することにより培養下において嗅索を形成させることのできる点にある1).このことから嗅索の形成の際に実験操作を行うことができ,さまざまな解析が可能になる.この利点を生かし,嗅索の形成にかかわる機能タンパク質を探索し同定する目的で,筆者らは,以下のような研究をしてきた.まず,嗅索を抗原として免疫したモノクローナル抗体を作製した.この場合,嗅索に含まれるさまざまなタンパク質に対する抗体を得ることができるものと考えられた.得られたモノクローナル抗体のなかから,培養のとき添加することで嗅索の形成に異常を起こすような抗体をスクリーニングした.この時点では抗原となるタンパク質は不明なので,つづいてスクリーニングされたモノクローナル抗体の抗原を同定した.このようにして,これまでに嗅索の形成にかかわるタンパク質としてM6aを見い出している2).しかしながら,この方法ではスクリーニングの効率が悪いと考えられた.そのため,この研究では抗体のスクリーニングに光照射分子不活性化(fluorophore-assisted light inactivation:FALI)法を導入し,嗅索の形成にかかわるタンパク質を効率よく探索することを試みた.
1.光照射分子不活性化法とモノクローナル抗体を用いた機能タンパク質の同定
フルオレセインイソチオシアネート(FITC)は蛍光色素としてなじみ深いが,励起光を照射すると活性酸素(一重項酸素)を発生する.光照射分子不活性化法は,FITCで標識した抗体を抗原に結合させたのち励起光(波長490 nm)を照射し,FITCより生じた活性酸素により近傍(一重項酸素がその半減期のあいだに拡散する距離は40Å)にある抗原を酸化反応により機能阻害する技術である.すなわち,単に結合するだけでは抗原の機能を阻害しない抗体でも,この方法を用いることで抗原の機能を阻害することができる.くわえて,60 W電球といった比較的弱い光を照射することでも効果のあることが報告されており,簡便な装置で実験が可能である3,4).この研究では,メタルハライドライトを用いた光ファイバー光源装置,FITC用蛍光フィルターと平面ライトガイドを用い,6ウェルプレートに最大2000 luxの波長490 nmの青色光を均一に照射できる装置を作製して用いた.
ある組織を抗原としてモノクローナル抗体を作製すると,原理的には抗原とした組織に含まれるすべてのタンパク質に対する抗体のできる可能性がある.対象とする生命現象が培養下において再現できれば,対象とする組織に対し作製されたモノクローナル抗体をくわえて培養する.このとき,対象とした生命現象に異常が生じれば,くわえた抗体の抗原(細胞表面にある膜タンパク質など)はその現象にかかわる機能タンパク質であることが推測される.このような機能スクリーニングをとおして,まずモノクローナル抗体をスクリーニングし,そののち機能タンパク質である抗原を同定する.しかし,この抗体スクリーニングでは抗原の機能を乱すような抗体が選択され,機能タンパク質に対する抗体であっても抗原の機能を乱さない抗体は選択されない.そのため,この研究では抗体のスクリーニングに光照射分子不活性化法を導入し,抗原の機能を“乱さない”抗体により抗原の機能を“乱す”ことで,効率よく機能タンパク質を探索することを試みた.
2.LOTUSの同定
マウスの嗅索の細胞破砕液を抗原としてアルメニアンハムスターへ免疫しモノクローナル抗体を作製した.作製した抗体のうち生理的な条件において嗅索に結合する抗体を選択した.それらの抗体をFITCで標識したのち培養液にくわえ,波長490 nmの青色光を照射しながら終脳器官培養を行い,形成された嗅索を観察した.その結果,嗅索を構成する軸索が正常よりも広い範囲を伸長し嗅索が脱束化する異常をひき起こすモノクローナル抗体を見い出した.この時点では抗原は不明であったので,まずその同定を試みた.この抗体による免疫染色の結果,抗原は嗅索の軸索に分布していた.そこで,嗅球に由来する発現cDNAライブラリーを作製し,発現させると株細胞に抗体が結合するようなcDNAクローンをライブラリーからスクリーニングすることで抗原遺伝子を同定した5).その結果,このモノクローナル抗体の抗原としてCartilage acidic protein-1Bを同定した.このタンパク質は軟骨のマーカーとしてすでに報告がなされていたが生理機能はまったく不明だったので6),筆者らは,このタンパク質をLOTUS(lateral olfactory tract usher substance)と名づけた.そののち,LOTUSのノックアウトマウスを作製し,このノックアウトマウスの嗅索にはスクリーニングされたモノクローナル抗体は結合しないことも確認した.LOTUSはN末端にシグナルペプチドをもちC末端に膜貫通領域と思われる疎水性領域をもつ膜タンパク質であり,細胞内と予想される領域はほとんど存在しなかった.
3.LOTUSはNogo受容体1に結合する
LOTUSは膜タンパク質でありその大部分が細胞外に位置すると予想されたので,LOTUSに結合するタンパク質は細胞外にあると考え,そのようなタンパク質の同定を試みた.まず,LOTUSに結合するタンパク質の発現部位を検討した.C末端の膜貫通領域を除いたLOTUSとアルカリホスファターゼとの融合タンパク質を作製し,生理的な条件において終脳と反応させてアルカリホスファターゼの酵素活性を指標に結合部位を検討したところ,アルカリホスファターゼ-LOTUS融合タンパク質は嗅索に結合することが明らかになった.このことは,LOTUSと結合するタンパク質も嗅索に発現する膜タンパク質であることを意味した.そこで,再度,抗原の同定に用いた手法を用いてLOTUSと相互作用するタンパク質の同定を試みた.すなわち,嗅球に由来する発現cDNAライブラリーから,発現させると株細胞にアルカリホスファターゼ-LOTUS融合タンパク質が結合するようなcDNAクローンをスクリーニングした.その結果,LOTUSと結合するタンパク質としてNogo受容体1を同定した.アルカリホスファターゼ-LOTUS融合タンパク質はNogo受容体1ノックアウトマウスの嗅索には結合しないことから,嗅索においてLOTUSと結合するタンパク質はNogo受容体1だけであると考えられた.さらに,LOTUSとNogo受容体1は同じ軸索に発現していることが免疫染色により明らかになった.
4.LOTUSはNogo受容体1の内在性のアンタゴニストである
Nogo受容体1は髄鞘に由来する軸索の伸長阻害タンパク質として知られる膜タンパク質Nogoの受容体としてよく知られたタンパク質である.軸索の伸長は先端にある成長円錐とよばれる手のひら状の構造が外界の環境因子などを感受することにより制御されている.Nogo受容体1を介したNogoのシグナルは細胞骨格に作用し成長円錐の構造を崩壊させ(成長円錐の崩壊),軸索の伸長に対し抑制的に作用することが知られている7,8).LOTUSの結合タンパク質として同定されたNogo受容体1が嗅索に発現していたことは驚きであった.その理由は,Nogo受容体1のリガンドであるNogoも嗅索に発現していることが報告されていたからである9).すなわち,軸索の伸長に対し抑制的にはたらくシグナルのリガンド(Nogo)と受容体(Nogo受容体1)が発現しているのに,どうして嗅索を構成する軸索は伸長して嗅索を形成することができるのか,という疑問が生じた.この点を明らかにするため,Nogo,Nogo受容体1,LOTUSの三者の生理的な関係を検討した.その結果,Nogo受容体1のみを発現させた株細胞にはNogo-66(Nogo受容体1を介した軸索の伸長阻害活性をもつNogoの66アミノ酸残基からなる領域)が結合するのに対し,Nogo受容体1とLOTUSを共発現させた株細胞にはNogo-66は結合しないことが判明した.さらに,野生型マウスの嗅球から伸長する軸索の成長円錐はNogo-66に対して応答しないが,LOTUSノックアウトマウスの嗅球から伸長する軸索の成長円錐は退縮した(図1).
さらに,ノックアウトマウスを作製してその表現型を解析した.予想どおり,LOTUSノックアウトマウスの嗅索は脱束化し,軸索が伸長する領域の幅は野生型マウスに比べ広がった.これは,LOTUSノックアウトマウスの任意の軸索はLOTUSの欠損により嗅索においてその周囲の軸索に存在するNogoからの伸長阻害シグナルが入力されるようになったため,周囲の軸索を避ける方向(軸索の束の外側)に伸長して嗅索の幅が広がったものと考えられた(図2).軸索はその伸長阻害タンパク質が周囲に多いと成長円錐が退縮し伸長しないが,伸長阻害タンパク質が局在した場合はそれを避けるように伸長するからである.一方,LOTUSとNogo受容体1のダブルノックアウトマウスの嗅索の幅は広がらなかった.この結果は,受容体としてNogo受容体1も欠損しているのでNogoによる伸長阻害シグナルが入力されなかったためと考えられた.
これらの結果から,LOTUSはNogo受容体1と結合することでNogo受容体1とNogoとの結合を阻害し,結果として,NogoによるNogo受容体1を介した軸索の伸長阻害シグナルを抑制し,嗅索の形成に寄与しているものと考えられた.
おわりに
この研究では,LOTUSがNogo受容体1の内在性のアンタゴニストであることを明らかにした.軸索の伸長“阻害”タンパク質であるNogoからのシグナルをLOTUSが“阻害”することで,結果として,Nogoが存在してもNogo受容体1とLOTUSをともに発現する軸索は影響されない.シグナルが阻害されるのにもかかわらず,どうしてNogoとNogo受容体1は発現しているのだろうか? たぶん,リガンド(Nogo)もしくは受容体(Nogo受容体1)をそれぞれ抑制するよりも,シグナルを抑制するタンパク質(LOTUS)を制御するほうが複雑な神経回路を構築するうえで有利なのではないかと考えている.一方で,Nogoは脊髄損傷の際の中枢神経における軸索の再生阻害タンパク質のひとつでもあり,そのシグナルをLOTUSが阻害することから,LOTUSの神経再生治療への応用も期待される.
ここで紹介したモノクローナル抗体と光照射分子不活性化法を組み合わせた手法は,マウスのみならず多くの生物への応用が期待できる.くわえて,野生型の動物を利用するので,ノックアウトすると致死となるような遺伝子の致死ステージ以降での役割を解析することも可能である.さらには,スクリーニングのときに得られた抗体による免疫染色も同時に行うことで,興味深い染色像を示す抗体を手がかりに研究を行うこともできる10).この手法は特別に高価な機器を必要とせず簡便に行えるので,さまざまな実験系において有用であるものと思われる.
文 献
- Sugisaki, N., Hirata, T., Naruse, I. et al.: Positional cues that are strictly localized in the telencephalon induce preferential growth of mitral cell axons. J. Neurobiol., 29, 127-137 (1996)[PubMed]
- Sato, Y., Mita, S., Fukushima, N. et al.: Induction of axon growth arrest without growth cone collapse through the N-terminal region of four-transmembrane glycoprotein M6a. Dev. Neurobiol., 71, 733-746 (2011)[PubMed]
- Beck, S., Sakurai, T., Eustace, B. K. et al.: Fluorophore-assisted light inactivation: a high-throughput tool for direct target validation of proteins. Proteomics, 2, 247-55 (2002)[PubMed]
- Hoffman-Kim, D., Diefenbach, T. J., Eustace, B. K. et al.: Chromophore-assisted laser inactivation. Methods Cell Biol., 82, 335-354 (2007)[PubMed]
- Kawasaki, T., Takagi, Y., Yamatani, H. et al.: Systematic screening and identification of the antigens recognized by monoclonal antibodies raised against the developing lateral olfactory tract. J. Neurobiol., 62, 330-340 (2005)[PubMed]
- Steck, E., Braun, J., Pelttari, K. et al.: Chondrocyte secreted CRTAC1: a glycosylated extracellular matrix molecule of human articular cartilage. Matrix Biol., 26, 30-41 (2007)[PubMed]
- Chen, M. S., Huber, A. B., van der Haar, M. E. et al.: Nogo-A is a myelin-associated neurite outgrowth inhibitor and an antigen for monoclonal antibody IN-1. Nature, 403, 434-439 (2000)[PubMed]
- Fournier, A. E., GrandPre, T., Strittmatter, S. M.: Identification of a receptor mediating Nogo-66 inhibition of axonal regeneration. Nature, 409, 341-346 (2001)[PubMed]
- Tozaki, H., Kawasaki, T., Takagi, Y. et al.: Expression of Nogo protein by growing axons in the developing nervous system. Brain Res. Mol. Brain Res., 104, 111-119 (2002)[PubMed]
- Sato, Y., Hirata, T., Ogawa, M. et al.: Requirement for early-generated neurons recognized by monoclonal antibody lot1 in the formation of lateral olfactory tract. J. Neurosci., 18, 7800-7810 (1998)[PubMed]
著者プロフィール
略歴:2001年 名古屋大学大学院理学研究科 修了,同年 国立遺伝学研究所 研究員,2003年 横浜市立大学大学院医学研究科 研究員,2006年 三菱化学生命科学研究所 特別研究員を経て,2011年より基礎生物学研究所 研究員.
池谷 真澄(Masumi Iketani)
横浜市立大学大学院医学研究科博士課程 在学中.
竹居 光太郎(Kohtaro Takei)
横浜市立大学大学院医学研究科 准教授.
© 2011 佐藤泰史・池谷真澄・竹居光太郎 Licensed under CC 表示 2.1 日本